手性氮氧化合物参与的不对称催化反应研究进展
周 雷,李 珅
(天津大学理学院,天津 300350)
手性氮氧化合物参与的不对称催化反应研究进展
周 雷,李 珅
(天津大学理学院,天津 300350)
手性氮氧化合物具有良好的亲电、亲核能力,作为有机小分子催化剂备受关注,被广泛应用于各种化学反应,但其在不对称催化反应中的应用还不多见。综述了手性氮氧化合物参与的不对称催化反应研究进展,按照催化剂的种类,分别介绍了手性吡啶/喹啉-N-氧化物和手性叔胺-N-氧化物作为催化剂参与的不对称催化反应。
手性氮氧化合物;有机小分子;不对称催化
在自然界中,很多物质都具有手性。人们设计了很多手性催化剂[1],通过不对称催化反应合成了各种各样的手性化合物。然而,催化剂不是万能的,它很难做到适用于所有的反应底物。因此,针对不同种类的化学反应,我们需要设计不同的催化剂,以取得令人满意的结果。
手性氮氧化合物由于氮-氧偶极具有较强的极性,因而可作为电子的给予体或者接纳体,表现出良好的亲电、亲核能力。近年来,手性氮氧化合物作为有机小分子催化剂备受关注,但其在不对称催化反应中的应用还不多见。随着不对称催化反应研究的深入,寻找新的、有效的手性氮氧化合物催化剂是化学工作者们不断努力的目标之一。作者在此综述了2种手性氮氧化合物(手性吡啶/喹啉-N-氧化物、手性叔胺-N-氧化物)参与的不对称催化反应的研究进展,拟为手性氮氧化合物在不对称催化反应中的应用提供帮助。
1 手性吡啶/喹啉-N-氧化物作为催化剂参与的反应
1997年,Nakajima等[2]成功拆分出具有C2对称2,2′-联二喹啉骨架的手性喹啉-N-氧化物1,并将其用于催化醛的不对称烯丙基化反应[3],以85%的收率、88%的对映选择性合成了手性高烯丙醇2。手性喹啉-N-氧化物催化不对称反应开创了喹啉-N-氧化物在有机合成中的新纪元。手性喹啉-N-氧化物1中的2个氧原子可以与反应物中的硅原子配位,形成稳定的六元环状过渡态3,从而实现了良好的手性控制。如图1所示。
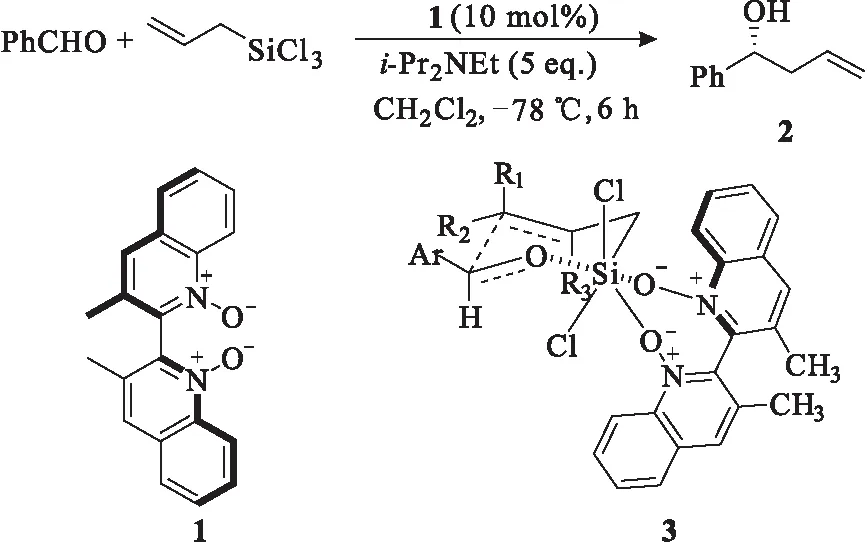
图1 手性喹啉-N-氧化物1催化的不对称烯丙基化反应Fig.1 Asymmetric allylic reaction catalyzedby chiral quinoline-N-oxide 1
Zhao等[4]用一种双氮氧催化剂4对芳香醛进行不对称催化,以11%~67%的收率和15%~65%的对映选择性获得了目标产物(图2)。当苯基上连有供电子基时,目标产物的收率和对映选择性要高于苯基上连有吸电子基时的结果;当苯基的对位连有甲氧基时,产物的对映选择性只有3%。
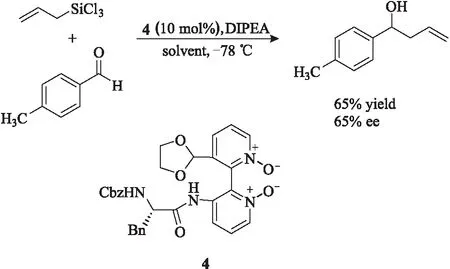
图2 手性吡啶-N-氧化物4催化的不对称烯丙基化反应Fig.2 Asymmetric allylic reaction catalyzedby chiral pyride-N-oxide 4
Kocovsky课题组[5-6]以(+)-诺蒎酮为原料设计合成了一系列手性吡啶-N-氧化物5(图3),并将其用于催化醛的不对称反应。结果发现。底物为芳香醛时所得产物的收率和对映选择性较高;底物为脂肪醛时所得产物的收率和对映选择性较低;底物为不饱和醛时所得产物的对映选择性较底物为同结构的饱和醛所得产物的对映选择性高,表明该催化反应中存在π共轭效应。
2009年,Kocovsky课题组[7]又将催化剂5应用于环氧化合物的开环反应,产物收率高达98%,对映选择性高达90%(图4)。催化剂5对七、八、十二元环有着较好的催化效果,而对六元环的催化效果较差,产物的对映选择性不高。当环上有不饱和基团时,产物的对映选择性下降。
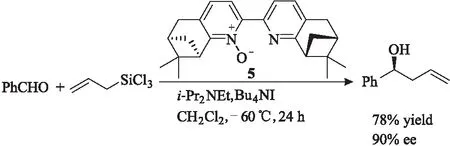
图3 手性吡啶-N-氧化物5催化的不对称烯丙基化反应Fig.3 Asymmetric allylic reaction catalyzed by chiral pyride-N-oxide 5
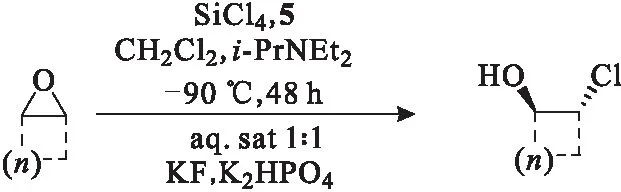
图4 手性吡啶-N-氧化物5催化的不对称开环反应Fig.4 Asymmetric ring-opening reaction catalyzedby chiral pyride-N-oxide 5
Ramanathan课题组[8-9]设计合成了一种双氮氧催化剂6,并将其应用于环氧化合物的开环反应,以65%~96%的收率和22%~93%的对映选择性获得了目标产物(图5)。当催化剂用量由0.5%(摩尔分数)减少到0.1%时,产物的对映选择性变化不大。
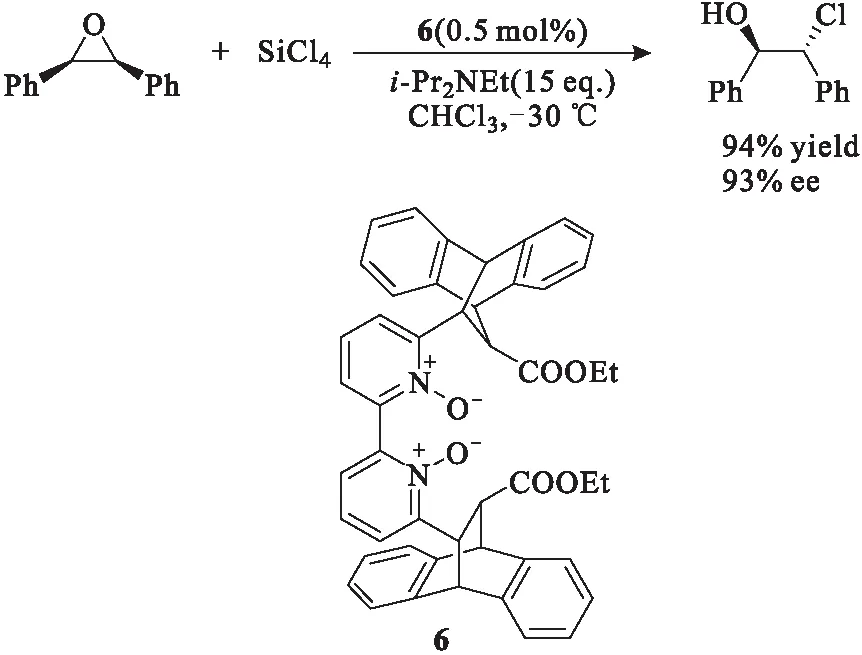
图5 手性吡啶-N-氧化物6催化的不对称开环反应Fig.5 Asymmetric ring-opening reaction catalyzedby chiral pyride-N-oxide 6
2015年,Zhu课题组[10]利用一种较大分子结构的吡啶氮氧催化剂7成功实现了醛的不对称烯丙基化反应(图6),并研究了底物醛的分子结构大小与反应温度对反应的影响。结果表明,当醛的分子结构较小时,升高反应温度,容易形成副产物,导致收率降低。因此,该反应所用底物醛的分子结构均较大。
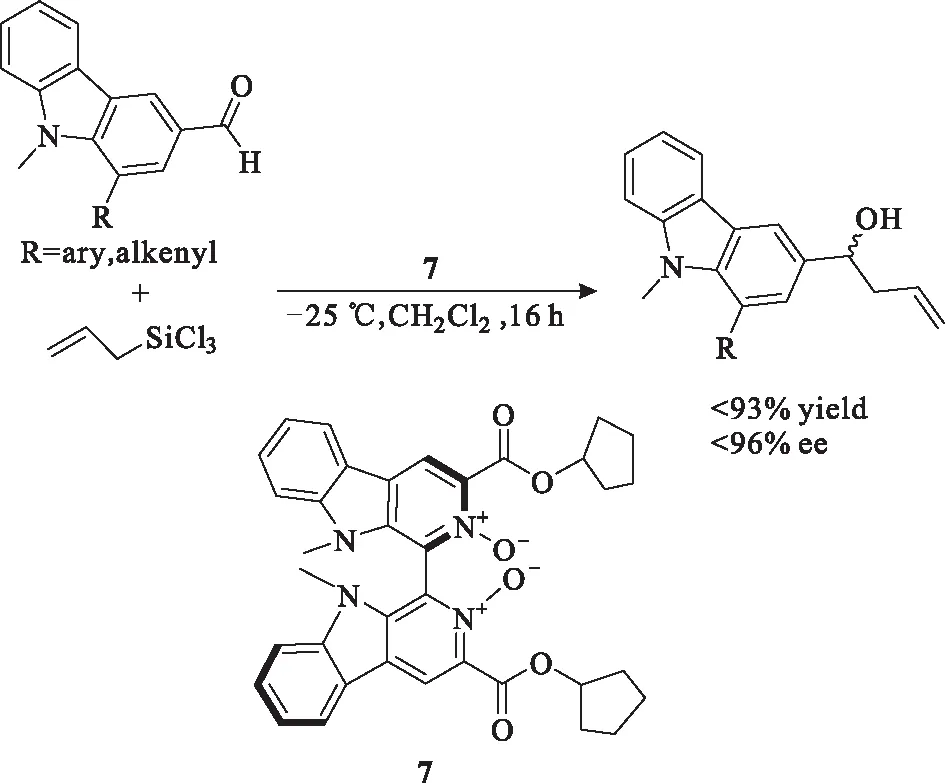
图6 手性吡啶-N-氧化物7催化的不对称烯丙基化反应Fig.6 Asymmetric allylic reaction catalyzed bychiral pyride-N-oxide 7
2016年,Kotora课题组[11]将吡啶氮氧化合物8应用于不饱和醛的不对称烯丙基化反应,产物收率最高达到79%,对映选择性最高达到98%(图7)。手性磷酸催化剂9的催化效果要优于吡啶氮氧化合物8。该反应的相关产物可以应用于一些自然产物的合成过程中,提高了该反应的实用价值。
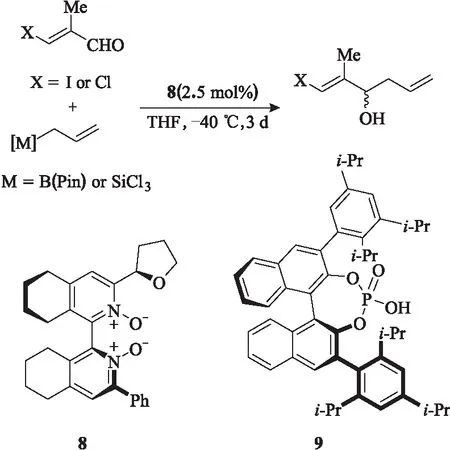
图7 手性吡啶-N-氧化物8催化的不对称烯丙基化反应Fig.7 Asymmetric allylic reaction catalyzed bychiral pyride-N-oxide 8
2 手性叔胺-N-氧化物作为催化剂参与的反应
在胺-N-氧化物中,除氮杂芳环N-氧化物外,叔胺也可以被氧化成叔胺-N-氧化物参与不对称催化反应。2005年,Hoveyda课题组[12]从脯氨酸出发,合成了一系列手性叔胺-N-氧化物10,并将其应用于芳香醛的不对称催化反应中,产物的对映选择性高达71%~92%(图8)。这是烷基胺-N-氧化物作为手性催化剂应用于不对称反应的首例报道。

图8 手性叔胺-N-氧化物10催化的不对称烯丙基化反应Fig.8 Asymmetric allylic reaction catalyzed bychiral tertiary amine-N-oxide 10
Feng课题组[13]从光学活性的氨基酸出发,设计合成了多种具有C2对称的双氮氧偶极化合物11,将其用于催化酮的不对称硅氰化反应,产物收率达到73%~99%、对映选择性达到85%~93%(图9)。当酮上连有供电子基团时,催化效果较差;当酮上连有吸电子基团时,催化效果较好,产物收率和对映选择性都有提升。该反应对空气和湿度并不敏感。
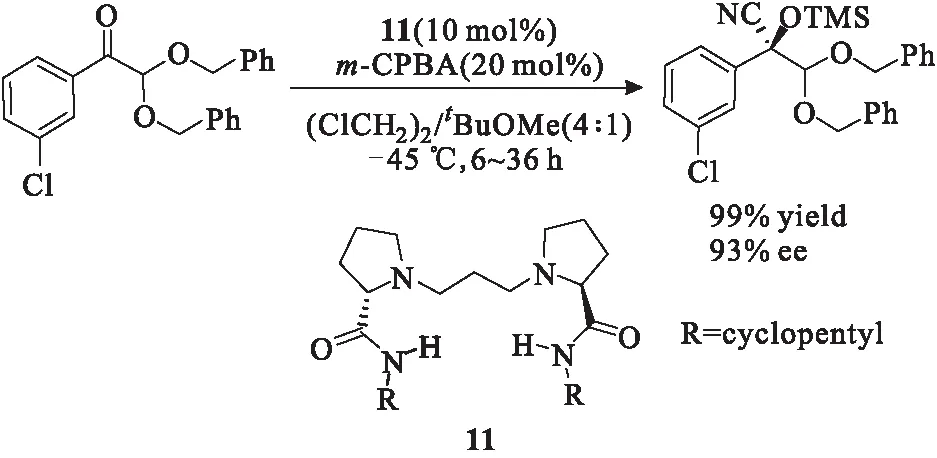
图9 手性叔胺-N-氧化物11催化的不对称硅氰化反应Fig.9 Asymmetric silicon cyanide reaction catalyzed bychiral tertiary amine-N-oxide 11
Feng课题组[14]还设计合成了一种新的手性双氮氧化合物12,并将其用于催化醛、胺和氰基硅烷的三组分Strecker 反应,也以60%~99%的收率和80%~95%的对映选择性取得了令人满意的结果(图10)。该反应通过一锅法完成,且对于芳香族和脂肪族的底物都可得到不错的结果。反应过程中,胺-N-氧化物中的2个氧原子与反应物中的硅原子配位,形成十三元环过渡态13,从而实现了良好的手性控制。
卤代反应是有机化学中一类重要的基础反应,但是不对称卤代反应在近些年才得到发展[15-18]。2010年,Feng课题组[19]利用一种手性双氮氧催化剂14实现了β-酮酸酯的α位氯代反应(图11)。该反应体系简单,不需要加入添加剂,而且对空气和水并不敏感,其产物对映选择性最高达到98%。该催化剂良好的催化效果进一步推动了不对称卤代反应的发展。
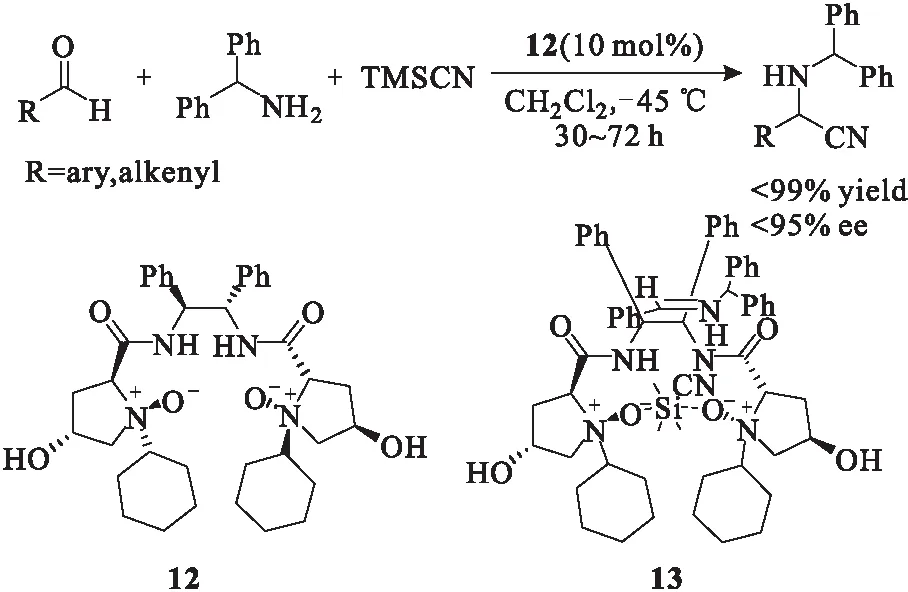
图10 手性叔胺-N-氧化物12催化的三组分不对称Strecker反应Fig.10 Three component asymmetric Strecker reactioncatalyzed by chiral tertiary amine-N-oxide 12
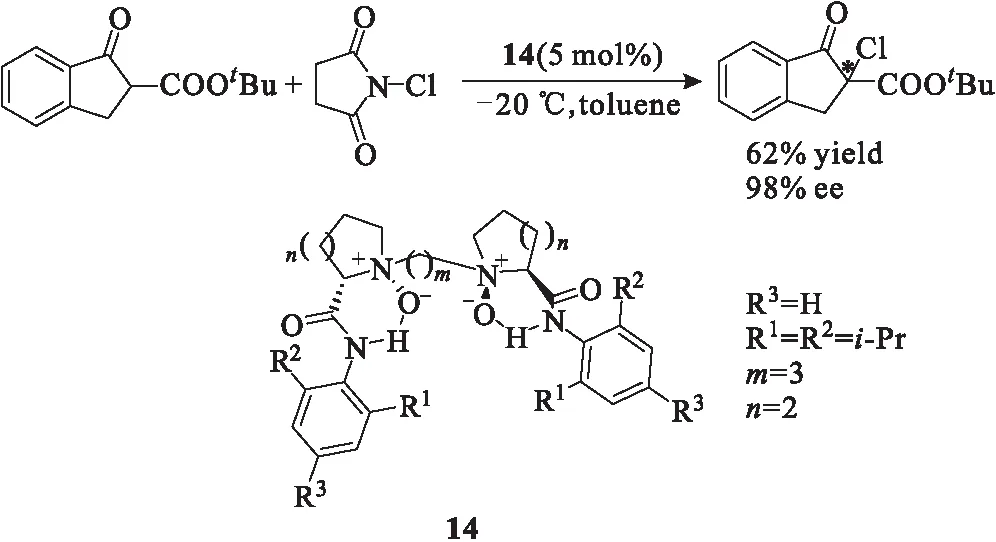
图11 手性叔胺-N-氧化物14催化的不对称卤代反应Fig.11 Asymmetric halogenation reaction catalyzed bychiral tertiary amine-N-oxide 14
二氢吡喃及其衍生物是一类重要的杂环化合物,广泛应用于自然产物的合成,这类化合物还具有生物活性,在相关的抗癌药物合成中占据着重要地位。2013年,Feng等[20]巧妙地利用一种双氮氧手性催化剂15,通过一步法成功合成了一类二氢吡喃化合物,收率和对映选择性最高都达到99%(图12)。该类二氢吡喃化合物的合成也进一步扩展了该类双氮氧手性催化剂的应用范围。
二氢呋喃化合物同样具有生物活性,广泛存在于各类自然产物中。2015年,Feng等[21]又利用双氮氧手性催化剂16,巧妙利用1,3-环己二酮衍生物和溴代硝基苯乙烯衍生物的 Michael烷基化反应一步合成了手性二氢呋喃类化合物(图13)。
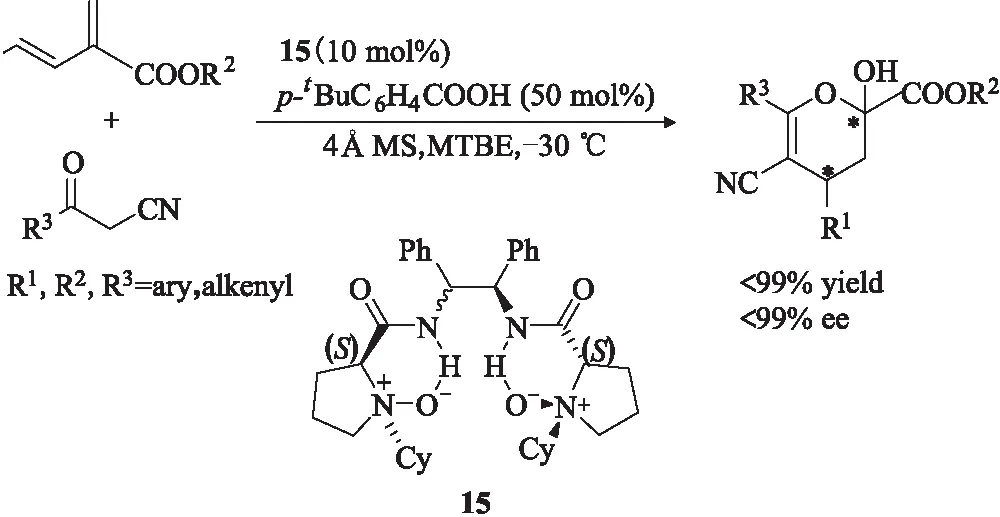
图12 手性叔胺-N-氧化物15催化的不对称Michael加成反应Fig.12 Asymmetric Michael addition reactioncatalyzed by chiral tertiary amine-N-oxide 15
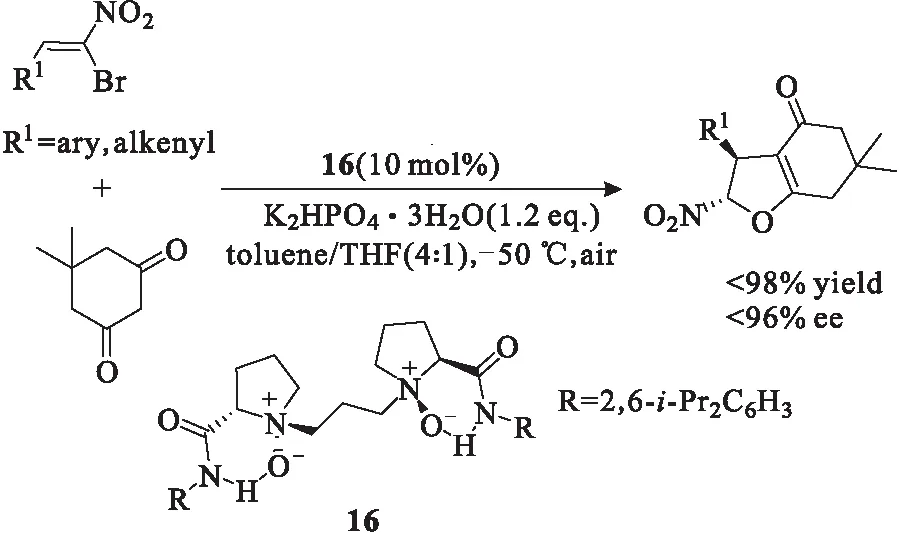
图13 手性叔胺-N-氧化物16催化的不对称Michael烷基化反应Fig.13 Asymmetric Michael alkylation reactioncatalyzed by chiral tertiary amine-N-oxide 16
2016年,Feng等[22]又利用双氮氧手性催化剂17催化溴代硝基苯乙烯衍生物和α取代的氰基酮类衍生物通过Michael烷基化反应一步合成了手性四氢呋喃类化合物,产物的对映选择性最高可以达到93%。
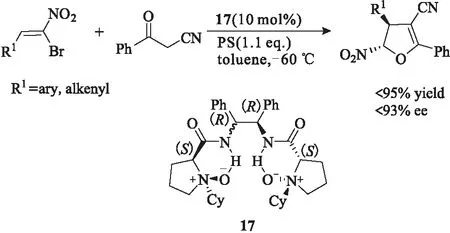
图14 手性叔胺-N-氧化物17催化的不对称Michael烷基化反应Fig.14 Asymmetric Michael alkylation reaction catalyzedby chiral tertiary amine-N-oxide 17
3 结语
综上所述,近年来手性氮氧化合物参与的不对称催化反应取得了长足的进展,但仍有其应用的局限性,它仅在不对称 Sakurai-Hosomi、Strecker、Michael和开环等反应中有较好的应用,还有大量的反应类型有待拓展。因此,设计新的、有效的手性氮氧化合物催化剂具有重要意义。
[1] YOON T P,JACOBSEN E N.Privileged chiral catalysts[J].Science,2003,299(5613):1691-1693.
[2] NAKAJIMA M,SASAKI Y,SHIRO M,et al.A novel axially dissymmetric chiral ligand based on amineN-oxide:(R)- and(S)-3,3′-dimethyl-2,2′-biquinolineN,N′-dioxide[J].Tetrahedron:Asymmetry,1997,8(3):341-344.
[3] NAKAJIMA M,SAITO M,SHIRO M,et al.(S)-3,3′-dimethyl-2,2′-biquinolineN,N′-dioxide as an efficient catalyst for enantioselective addition of allyltrichlorosilanes to aldehydes[J].Journal of the American Chemical Society,1998,120(25):6419-6420.
[4] ZHAO H W,YUE Y Y,LI H L,et al.Asymmetric synthesis of novel axially chiral 2,2′-bipyridineN,N′-dioxides bearing α-amino acid residues and their applications in enantioselective allylation of aromatic aldehydes with allyltrichlorosilane[J].Chinese Journal of Chemistry,2013,31(4):485-493.
[5] MALKOV A V,ORSINI M,PERNAZZA D,et al.Chiral 2,2′-bipyridine-typeN-monoxides as organocatalysts in the enantioselective allylation of aldehydes with allyltrichlorosilane[J].Organic Letters,2002,4(6):1047-1049.
[6] MALKOV A V,BELL M,ORSINI M,et al.New Lewis-basicN-oxides as chiral organocatalysts in asymmetric allylation of aldehydes[J].Journal of Organic Chemistry,2003,68(25):9659-9668.
[8] GNANAMANI E,SOMESHWAR N,RAMANATHAN C R.Conformationally rigid chiral pyridineN-oxides as organocatalyst:asymmetric allylation of aldehydes[J].Advanced Synthesis & Catalysis,2012,354(11/12):2101-2106.
[9] GNANAMANI E,NAGAMALLA S,SAYNJEEVI J,et al.Conformationally rigid chiral bicyclic skeleton-tethered bipyridineN,N′-dioxide as organocatalyst:asymmetric ring opening ofmeso-epoxides[J].Advanced Synthesis & Catalysis,2014,356(10):2219-2223.
[10] LIU L,YANG Q,YU H,et al.Fitness of driving force and catalytic space in chiral catalyst design.application of axial biscarboline N-O chiral catalyst for enantioselective allylation of allyltrichlorosilane to bulky substituted aldehydes[J].Tetrahedron,2015,71(21):3296-3302.
[11] KOUKAL P,ULC J,NECAS D,et al.Enantioselective allylation ofβ-haloacrylaldehydes:formal total syntheses of pteroenone and antillatoxin[J].European Journal of Organic Chemistry,2016,47(12):2110-2114.
[12] TRAVERSE J F,ZHAO Y,HOVEYDA A H,et al.Proline-basedN-oxides as readily available and modular chiral catalysts.enantioselective reactions of allyltrichlorosilane with aldehydes[J].Organic Letters,2005,7(15):3151-3154.
[13] QIN B,LIU X H,SHI J,et al.Enantioselective cyanosilylation ofα,α-dialkoxy ketones catalyzed by proline-derivedin-situ-preparedN-oxide as bifunctional organocatalyst[J].Journal of Organic Chemistry,2007,72(7):2374-2378.
[14] WEN Y H,GAO B,FU Y Z,et al.Asymmetric three-component Strecker reactions catalyzed bytrans-4-hydroxy-L-proline-derivedN,N′-dioxides[J].Chemistry-A European Journal,2008,14(22):6789-6795.
[15] HONG M,ZHAO Y,SU W,et al.A silver(Ⅰ) coordination polymer chain containing nanosized tubes with anionic and solvent molecule guests[J].Angewandte Chemie International Edition,2000,39(14):2468-2470.
[16] HAMASHIMA Y,YAGI K,TAKANO H,et al.An efficient enantioselective fluorination of variousβ-ketoesters catalyzed by chiral palladium complexes[J].Journal of the American Chemical Society,2002,124(49):14530-14531.
[17] MARIGO M,FIELENBACH D,BRAUNTON A,et al.Enantioselective formation of stereogenic carbon-fluorine centers by a simple catalytic method[J].Angewandte Chemie International Edition,2005,44(24):3703-3706.
[18] AMATORE M,BEESON T D,BROWN S P,et al.Enantioselective linchpin catalysis by SOMO catalysis:an approach to the asymmetricα-chlorination of aldehydes and terminal epoxide formation[J].Angewandte Chemie International Edition,2009,48(28):5121-5124.
[19] CAI Y F,WANG W T,SHEN K,et al.Highly enantioselectiveα-chlorination of cyclicβ-ketoesters catalyzed byN,N′-dioxide using NCS as the chlorine source[J].Chemical Communications,2010,46(8):1250-1252.
[20] FENG J H,FU X,CHEN Z L,et al.Efficient enantioselective synthesis of dihydropyrans using a chiralN,N′-dioxide as organocatalyst[J].Organic Letters,2013,15(11):2640-2643.
[21] FENG J H,LIN L L,YU K R,et al.Asymmetric synthesis of dihydrofuransviaorganocatalytic domino Michael-alkylation reaction[J].Advanced Synthesis & Catalysis,2015,357(6):1305-1310.
[22] FENG J H,YUAN X,LUO W W,et al.ChiralN,N′-dioxide-organocatalyzed regio-,diastereo- and enantioselective Michael addition-alkylation reaction[J].Chemistry-A European Journal,2016,22(44):15650-15653.
ResearchProgressinAsymmetricCatalyticReactionsinthePresenceofChiralOxynitride
ZHOU Lei,LI Shen
(SchoolofScience,TianjinUniversity,Tianjin300350,China)
Chiral oxynitrides have good electrophilic ability and nucleophilic ability.As small organocatalysts,chiral oxynitrides are widely used in various chemical reactions,but their applications in asymmetric catalytic reaction are rare.We summarize the research progress of asymmetric catalytic reactions involving chiral oxynitrides.According to the catalyst type,we introduce the asymmetric catalytic reactions catalyzed by chiral pyridine/quinoline-N-oxide and chiral tertiary amine-N-oxide.
chiral oxynitride;small organic molecule;asymmetric catalysis
O621.34
A
1672-5425(2017)10-0006-05
2017-05-15
周雷(1988-),男,河北沧州人,硕士研究生,研究方向:非金属催化,E-mail:zhou7892449@163.com;通讯作者:李珅,副教授,E-mail:shenli@tju.edu.cn。
10.3969/j.issn.1672-5425.2017.10.002
周雷,李珅.手性氮氧化合物参与的不对称催化反应研究进展[J].化学与生物工程,2017,34(10):6-10.

