光照对静脉滴注过程中马来酸桂哌齐特注射液稳定性的影响
张敏
(安徽省阜阳市食品药品检验检测中心,安徽阜阳236015)
光照对静脉滴注过程中马来酸桂哌齐特注射液稳定性的影响
张敏
(安徽省阜阳市食品药品检验检测中心,安徽阜阳236015)
目的考察马来酸桂哌齐特注射液与0.9%氯化钠注射液配伍的稳定性。方法模拟临床用药,观察马来酸桂哌齐特注射液与0.9%氯化钠注射液配伍在室温自然光、遮光、光照条件下配伍液7 h内的外观,并采用紫外分光光度法测定马来酸桂哌齐特的含量。结果配伍液中马来酸桂哌齐特的含量、pH及外观均无明显变化。结论马来酸桂哌齐特注射液与0.9%氯化钠注射液配伍后遮光条件下7 h内稳定。
马来酸桂哌齐特注射液;0.9%氯化钠注射液;配伍;稳定性
马来酸桂哌齐特化学名称为(E)1-[(吡咯烷羰基)甲基]-4-(3,4,5-三甲氧基肉桂酰基)哌嗪顺丁烯二酸盐,商品名为克林澳,由法国Sanofi-Anentis公司开发,并于1974年首先在法国上市,1980年在西班牙上市,2002年在中国上市[1]。其具有钙离子阻滞和腺苷、环磷腺苷(cAMP)增效的双重机制[2],还有抗动脉粥样硬化、保护心肌、减轻心脏负荷、改善微循环、降低心肌氧耗的作用[3],能明显降低全血黏度、血浆黏度及血小板聚集指数,提高红细胞变形指数和柔韧性[4],尤其在治疗心脑血管疾病方面有独特优势。马来酸桂哌齐特制剂均需要避光保存,由于静脉滴注时间较长,有必要考察光照在静脉滴注过程中的影响[5]。本研究中旨在探讨避光条件对静脉滴注马来酸桂哌齐特溶液稳定性的影响。现报道如下。
1 仪器与试药
1.1 仪器
UV-2401PC型紫外-可见分光光度计(日本岛津公司);BS124S型电子分析天平(0.1 mg/0.01 mg,德国赛多利斯)。
1.2 试药
马来酸桂哌齐特对照品(中国食品药品检定研究院,批号为100981-201303);马来酸桂哌齐特注射液(北京四环制药有限公司,批号为15010814);0.9%氯化钠注射液(上海华源安徽锦辉药业有限公司,批号为1505290652)。
2 方法与结果
2.1 测定波长选择
避光条件下,精密量取马来酸桂哌齐特注射液1 mL,置50 mL容量瓶中,加0.9%氯化钠注射液至刻度,摇匀,精密量取1 mL,置50 mL容量瓶中,加0.9%氯化钠注射液至刻度,得质量浓度为16 μg/mL的溶液,以0.9%氯化钠注射液为空白溶液,于220~400 nm波长范围内进行扫描,结果于302.7 nm波长处有最大吸收(见图1)。参照文献[6],选取302.7 nm为测定波长。
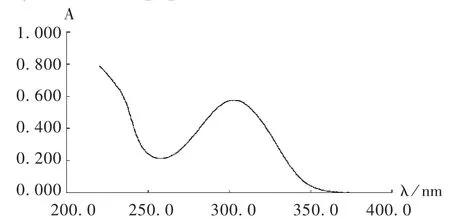
图1 紫外-可见分光光谱图
2.2 溶液制备
避光条件下,称取马来酸桂哌齐特对照品39.89 mg,精密称定,置100 mL容量瓶中,加0.9%氯化钠注射液适量,使溶解并稀释至刻度,摇匀,作为对照品贮备液。精密量取2 mL对照品贮备液,置100 mL容量瓶中,加0.9%氯化钠注射液至刻度,作为对照品溶液。
2.3 方法学考察
标准曲线绘制:避光条件下,分别精密吸取1,2,4,6,8 mL对照品贮备液,置100 mL容量瓶中,加0.9%氯化钠注射液至刻度,得质量浓度为3.989~31.912 μg/mL的溶液,于302.2 nm波长处测得吸光度(A),分别为0.157 2,0.312 6,0.629 8,0.940 3,1.250 2,以质量浓度(C)对A进行线性回归,得线性回归方程A=0.039 2C+0.001 6,r=1.000 0(n=5)。结果表明,马来酸桂哌齐特质量浓度在3.989~31.912 μg/mL范围内与吸光度线性关系良好。
精密度试验:取样品,依法制备供试品溶液1份,按以上标准曲线方法平行操作6次。结果A分别为0.633 7,0.633 8,0.636 3,0.632 2,0.634 5,0.634 8,RSD为0.21%(n=6),表明仪器精密度良好。
稳定性试验:避光操作。取同一供试品溶液,于0,1,2,3,4,5,7 h时依法测定吸光度。结果的RSD为0.31%(n=7),表明供试品溶液在7 h内稳定。
重复性试验:避光操作。取同一批(批号为15010814)马来酸桂哌齐特注射液,按2.2项下方法制备供试品溶液6份,分别测定吸光度。结果马来酸桂哌齐特的平均含量为98.56%,RSD为0.35%(n=6),表明方法重复性好。
加样回收试验:避光操作。取同一批(批号为15010814)马来酸桂哌齐特注射液,按2.2项下方法制备供试品溶液9份,精密量取供试品溶液1 mL,置100 mL容量瓶中,加0.9%氯化钠注射液适量使溶解并稀释至刻度,摇匀,再精密量取2 mL,分别加入2.2项下对照品贮备液0.8,1,1.2 mL,加0.9%氯化钠注射液适量使溶解并稀释至刻度,摇匀,测定吸光度,计算回收率。结果见表1。
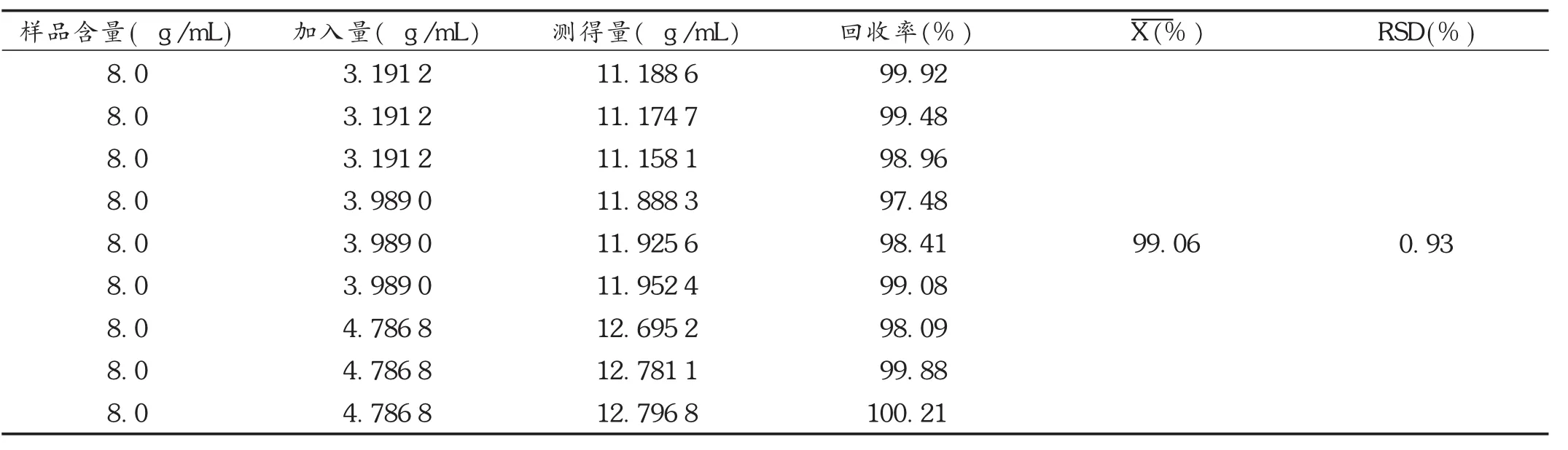
表1 加样回收试验结果(n=9)
2.4 样品稳定性考察
2.4.1 光解产物干扰试验
取新配制的配伍液,于避光及室温(20.0±2.0)℃条件下,0 h于220~400 nm波长范围内进行扫描;然后将配伍液置拟订光照条件下,于1,2,3,7 h时进行扫描,将吸收曲线与0 h进行对比,结果最大吸收峰形及峰位未发生改变,未见有新的吸收峰干扰,最大A值逐渐减小,由此推断,光解产物对该测定吸收波长处A值不产生干扰,表明本测定方法可行。结果见表2。
2.4.2 光稳定性试验
光照条件:遮光;室内自然光;100 W日光灯。
供试液配制:模拟临床习惯用法,将马来酸桂哌齐特注射液240 mg溶于250 mL 0.9%氯化钠注射液中。温度为20~25℃,将供试液置上述光照条件下,于0,1,2,3,7 h时取样考察其含量变化。结果供试品溶液在7 h内澄明,无颜色变化。结果见表2。
3 讨论
马来酸桂哌齐特口服给药后吸收迅速,30~45 min可达最大血药浓度3.6~8.3 g/L,血浆药物半衰期为30 min〚7]。其在体内分布广泛,以肾、肝、甲状腺等脏器含量较高;主要经肝脏代谢,可转化为不同程度的去甲基代谢物;大部分从尿中以原形排泄,故临床以静脉给药为主。
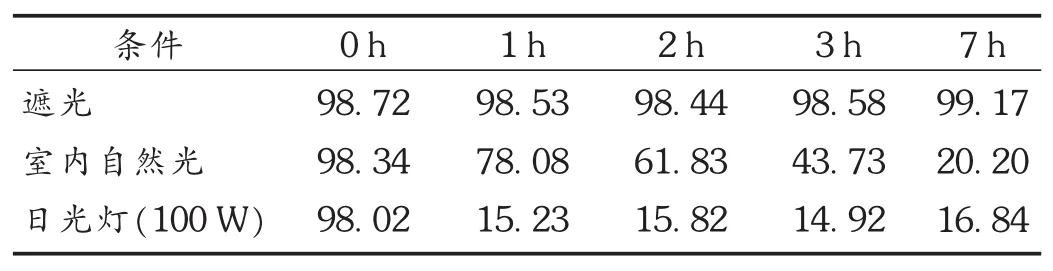
表2 马来酸桂哌齐特在不同光照条件下7 h内含量变化情况
马来酸桂哌齐特可通过抑制腺苷脱氨酶及促进腺苷重吸收提高腺苷浓度,加强腺苷的生物效应[7]。脑内至少有2种腺苷受体(A1受体和A2受体),腺苷与A1受体结合可以使细胞膜超极化,从而使细胞膜的稳定性加强,提高缺血预适应能力[8]。同时,其还可激活丝裂霉素激活蛋白激酶(MAPK)的活性,提高神经元在缺血、缺氧环境下的存活能力,并且促进神经突起的形成。A2受体主要分布在对缺血敏感的海马区的谷氨酸能神经纤维末梢上,腺苷与A2受体结合可抑制谷氨酸能神经纤维末梢对谷氨酸的释放,从而保护神经元免受兴奋性递质的毒害[9-11]。
马来酸桂哌齐特结构中含有不稳定基团,紫外光及蓝光可使其发生降解反应。有研究结果显示,在太阳光照射下,马来酸桂哌齐特含量在短时间内发生急剧变化〚12]。采用紫外分光光度法进行马来酸桂哌齐特与氯化钠注射液配伍后的含量测定[13],操作简便快捷,经济实用。本试验结果表明,马来酸桂哌齐特在氯化钠注射液中稳定性受光影响较大,临床使用时应以遮光为主要手段避免有效成分的分解,并在7 h内使用完为宜。
[1] 冯国龙,王娟,刘亚娟.马来酸桂哌齐特的研究进展[J].河北化工,2011,34(8):23-24.
[2] 汤旭红,刘建红.桂哌齐特的临床应用进展[J].中国现代药物应用,2010,4(9):223-225.
[3] 赵平鸽.心脑血管病新药——马来酸桂哌齐特[J].浙江实用医学,2003,8(5):320-321.
[4] 陈达,王绍久,李莹洁.马来酸桂哌齐特治疗稳定型心绞痛的临床观察[J].山西医药杂志,2007,36(6):556-557.
[5] 邱新锋.马来酸桂哌齐特在不同输液中的配伍稳定性[J].安徽医药,2007,11(3):259-260.
[6] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:附录Ⅳ25.
[7] 杜望春,王萌萌,沈杰.马来酸桂哌齐特注射液在输液中超说明书配伍的稳定性考察[J].中南药学,2013,11(9):661-663.
[8] 许晋星.RP-HPLC法测定马来酸桂哌齐特片中有关物质的含量[J].中国药房,2009,20(1):59-60.
[9] 王惠玲,杨宏图,常翠,等.马来酸桂哌齐特注射液的HPLC法测定[J].中国药师,2010,13(6):892-893.
[10] 王向军,陈一秀.奥美拉唑与马来酸桂哌齐特注射液存在配伍禁忌[J].中国实用护理杂志,2013,29(26):65.
[11] 肖.马来酸桂哌齐特的临床应用与安全性[J].包头医学院学报,2011,27(3):136-137.
[12] 潘代勇,兰小曼.光照对核黄素静脉滴注过程中稳定性的影响[J].中国药物与临床,2010,10(7):779-780.
[13] 沈国荣,王尧,王永,等.马来酸桂哌齐特在输液中配伍的稳定性考察[J].抗感染药学,2012,9(2):129-130.
Effect of Light on the Stability of Cinepazide Maleate Injection in the Process of Intravenous Drip Infusion
Zhang Min
(Fuyang Food and Drug Inspection and Testing Center,Fuyang,Anhui,China236015)
ObjectiveTo investigate the stability of compatibility of Cinepazide Maleate Injection and 0.9%Sodium Chloride Injection.MethodsSimulating the clinical medication,the appearance of compatibility of Cinepazide Maleate Injection and 0.9%Sodium Chloride Injection was observed in 7 h under room temperature with natural light,shading and light conditions,and the content of cinepazide maleate was determined by UV spectrophotometry.ConclusionThe content,pH and appearance of cinepazide maleate in the mixture solution showed no obvious change.ConclusionThe compatibility of Cinepazide Maleate Injection and 0.9%Sodium Chloride Injection is stable under the condition of shading within 7 h.
Cinepazide Maleate Injection;0.9%Sodium Chloride Injection;compatibility;stability
R972+.4;R917
A
1006-4931(2017)21-0010-03
10.3969/j.issn.1006-4931.2017.21.004
张敏,女,大学本科,主管药师,研究方向为药品检验检测,(电话)0558-2563737(电子信箱)2528372559@qq.com。
2017-07-03;
2017-07-17)

