ADC、EADC及其相对值在WHOⅡ级胶质瘤鉴别诊断中的价值*
龚军伟,张 竹,程润田,蒋佩伶,罗天友△,吴少平.重庆医科大学附属第一医院 放射科(重庆 40006);2.成都医学院第一附属医院 放射科(成都 60500)
·论著·
ADC、EADC及其相对值在WHOⅡ级胶质瘤鉴别诊断中的价值*
龚军伟1,张 竹1,程润田1,蒋佩伶1,罗天友1△,吴少平2△
1.重庆医科大学附属第一医院 放射科(重庆 400016);2.成都医学院第一附属医院 放射科(成都 610500)
目的研究表观扩散系数(ADC)、指数表观扩散系数(EADC)及其相对值对不同病理类型脑内WHOⅡ级胶质瘤的鉴别诊断价值。方法回顾性分析术后病理确诊的51例脑内WHOⅡ级胶质瘤,包括30例星形细胞瘤(AC)、15例少突胶质细胞瘤(OD)、6例少突-星形细胞瘤(OA),分别测量其实质区ADC值和EADC值,计算rADC值、rEADC值,比较3组肿瘤各参数的差异,再用受试者工作特征曲线(ROC)确定AC与OD+OA的鉴别诊断截断值、敏感度和特异度。结果ADC值、EADC值、rADC值和rEADC值在AC与OD、AC与OA瘤体实质区的组间差异有统计学意义(P<0.001),在OD与OA组间差异无统计学意义(P>0.05)。ROC曲线分析表明,ADC、EADC、rADC和rEADC曲线下面积均大于0.9,以1.150×10-3mm2/s、0.311、1.512、0.691为截断值时,鉴别AC与OD+OA的诊断灵敏度和特异度均>80%。结论ADC值、EADC值、rADC值和rEADC值对脑内AC与OD、OA的鉴别具有一定的价值,鉴别OD和OA存在一定的局限性,鉴别AC与OD+OA时各参数均有较高且相仿的诊断效能。
磁共振成像;表观扩散系数;指数表观扩散系数;低级别胶质瘤
在沿用多年的2007版WHO中枢神经系统肿瘤分类标准中,Ⅱ级胶质瘤中的星形胶质瘤(AC)、少突胶质细胞瘤(OD)和少突-星形胶质瘤(OA)属于低级别胶质瘤,约占胶质瘤的15%~25%[1],临床上常难以治愈[2]。不同组织病理类型间的生物学行为、治疗方案及预后评估不同[3],因此,其术前的影像学分型研究具有重要的临床意义。借鉴Khayal等[4]应用DTI技术以ADC值、FA值鉴别WHOⅡ级胶质瘤的研究思路,本研究利用扩散加权成像(DWI)技术,测量瘤体实质区ADC值、EADC值及其相对值,探究上述参数鉴别WHOⅡ级胶质瘤的临床应用价值。
1 资料与方法
1.1临床资料
收集2012年10月至2016年6月在重庆医科大学附属第一医院行头颅MRI平扫+增强,且经手术病理证实的WHOⅡ级胶质瘤患者71例,纳入其中有可供测量瘤体实质的研究对象51例,其中男28例,女23例,年龄12~62岁(39.4±12.4岁),按2007版WHO中枢神经系统肿瘤分级方法进行分组,其中含AC 组30例、OD 组15例、OA 组6例,所有患者MRI检查前均未行特殊治疗。主要症状包括:肢体抽搐和(或)伴意识障碍19例,头晕、头痛17例,头痛伴乏力、抽搐、视物模糊6例,肢体乏力、幻听、耳鸣、听力下降6例,言语不利、记忆力减退2例,无症状1例。
1.2仪器与方法
采用 GE Signa HDxt 3.0 T MRI扫描仪,头部专用8通道相控阵线圈。所有患者均行常规MRI扫描,包括平扫和增强扫描,平扫序列及参数如下:轴位T1-FLAIR(TR=1 650 ms,TE=23.7 ms,TI=720.0 ms)、FSE T2WI(TR=2 860 ms,TE=118.9 ms)、T2-FLAIR(TR=6 880 ms、TE=150 ms、TI=1 850 ms)及DWI(b=1 000 s/mm2),层厚5 mm,层间距1.5 mm;T1WI增强扫描各方位参数如下:轴位 TR=1 650 ms、TE=27.3 ms、TI=720.0 ms,矢状位 TR=1 967 ms、TE=24.0 ms、TI=720.0 ms,冠状位 TR=2 405 ms、TE=21.9 ms、TI=750 ms,对比剂采用钆喷替酸葡甲胺(Gd-DTPA,4 mmol/L),用量0.2 mmol/kg,使用专用高压注射器(spectris solaris EP)经肘静脉注射,流率为2~3 mL/s,注射完毕后再用20 mL生理盐水以相同流率注射冲管。
1.3图像分析及后处理
将采集的数据传至GE ADW 4.6工作站Functool软件后处理,获得ADC伪彩图和EADC图。在两名放射科高级职称医生指导下,以ADC伪彩图和EADC图为基础,再结合轴位T1WI增强图及T1WI、T2WI、T2-FLAIR,避开脑沟、脑池、坏死及囊变区域,共同确定测量区。具体方法如下(图1和图2):1)将ADC伪彩图调整为灰阶图(color ramps→gray levels),再从颅顶到颅底逐层浏览ADC图和EADC图;2)若肿瘤无强化,则在肿瘤实质最大层面将ROI置于ADC图呈低灰阶、EADC图呈高灰阶相对应的区域;3)若肿瘤有强化,则将ROI置于强化最明显区域所对应的ADC图和EADC图上;4)获取肿瘤实质区ADC值和EADC值后,再测量镜像正常脑白质区ADC值和EADC值,得到rADC值(瘤体实质区ADC/镜像白质区ADC)和rEADC值(瘤体实质区EADC/镜像白质区EADC)。
1.4统计学方法
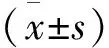

图1 左额叶星形胶质细胞瘤
注:A.T2WI呈混杂稍高信号,伴瘤周小斑片水肿;B.T1WI增强未见明显强化;C.ADC图示肿瘤实质区表现为低灰阶但高于镜像正常脑白质区(ADC=1.253×10-3mm2/s,rADC=1.868);D.EADC图示肿瘤实质区表现为高灰阶但低于镜像正常脑白质区(EADC=0.293,rEADC=0.571)

图2 左额叶少突胶质细胞瘤
注:A.T2WI以高信号为主,伴瘤周小斑片水肿;B.T1WI增强见附壁结节样明显强化;C.ADC图示明显强化区表现为低灰阶但高于镜像正常脑白质区(ADC=1.041×10-3mm2/s,rADC=1.214);D.EADC图示明显强化区表现为高灰阶但低于镜像正常脑白质区(EADC=0.355,rEADC=0.833)
2 结果
2.1基本影像学表现
51例WHOⅡ级胶质瘤各脑叶的分布如下:额叶27例、顶叶2例、颞叶9例、额颞/额顶叶6例、顶枕叶/颞枕叶4例、基底节海马区2例,跨中线累及双侧额叶1例。51例胶质瘤的瘤体直径为(39.37±12.38)mm,肿瘤以长T1WI长T2WI信号为主,实质区呈稍长T1WI、等/稍长T2WI信号,DWI呈等/稍高信号,ADC图表现为低灰阶,EADC图对应为高灰阶;增强扫描未见明显强化21例、不均匀轻度强化16例、附壁结节样强化6例、不均匀明显强化5例、花环样强化3例;多数肿瘤瘤周伴片状水肿信号(42例)。
2.2ADC值、EADC值及其相对值的比较
3组不同病理类型WHOⅡ级胶质瘤的ADC值、EADC值及其相对值组间比较差异有统计学意义(F值/2值分别为28.458、26.794、28.058、30.746,P值均<0.001);进一步两两比较发现,AC组与OD组、AC组与OA组各参数差异均有统计学意义(P<0.001),而OD组与OA组各参数差异无统计学意义(P>0.05)(表1)。

表1 WHOⅡ级胶质瘤ADC、EADC、rADC及rEADC的比较(n=51)
注:ADC值的单位为×10-3mm2/s;ADC和rADC取2值,EADC和rEADC取F值
2.3ROC曲线分析
进一步作AC组与OA+OD组ROC曲线分析,发现ADC、EADC、rADC和rEADC分别以1.150×10-3mm2/s、0.311、1.512、0.691为截断值时,鉴别AC组与OD+OA组的敏感度和特异度较高,且曲线下面积均大于0.9;行4个参数曲线下面积的两两比较发现,差异无统计学意义(P>0.05)(表2)。

表2 AC组和OD+OA组各参数ROC曲线分析
3 讨论
DWI可量化分析活体组织水分子的微观运动情况,能反映组织细胞的空间结构特性[6]。但DWI信号强度受组织T2穿透效应影响,有时并不能真实反映病理情况下活体组织内水分子扩散速度的快慢。ADC图和EADC图能较好的消除T2穿透效应,因此ADC值和EADC值常被视为衡量活体组织水分子扩散速度变化的定量指标[7]。ADC值与DWI信号强度呈负指数函数关系(ADC=-ln(Sb/S0)/b),即ADC值增加,DWI信号降低;EADC值则由DWI信号除以SE EPI T2WI所得(EADC=Sb/S0)。近年来,国内外学者开展了ADC值鉴别颅内肿瘤类型[8-10]、鉴别WHOⅡ级胶质瘤[11]以及ADC值联合EADC值鉴别颅内淋巴瘤与高级别胶质瘤的研究[12],但应用ADC值联合EADC值鉴别WHOⅡ级胶质瘤的研究尚无报道。
作为定量研究,测量误差的控制至关重要。为此,本研究在测量时将ADC伪彩图调整为灰阶图,既便于与EADC图对应,又较伪彩图更清晰显示瘤体实质区的内部结构;在肿瘤实质区ROI个数及面积的选择上,本研究以最大限度涵盖肿瘤实质细胞最密集区为原则,根据肿瘤具体情况,将其个数和面积分别控制在2~5个、10~26 mm ,且测量在两名经验丰富的放射科医师共同指导下完成。同时,为增加不同个体间的可比性[13],本研究在纳入ADC值和EADC值的同时,还增加了rADC和rEADC两个指标。
ADC值与EADC值主要与肿瘤细胞密度、体积及空间结构的排列等因素密切相关[14]。肿瘤细胞排列越紧密、细胞间隙越小、细胞异型性越大、细胞体积越大,则扩散受限越明显,对应的ADC值和rADC值越低,EADC值和rEADC值越高,反之亦然。本组患者中,AC组肿瘤实质成分的ADC值[(1.377±0.213)×10-3mm2/s]和rADC值[1.692(1.543-1.993)]明显高于OD组和OA组,与文献报道[4,11]一致,EADC值(0.264±0.048)和rEADC值(0.574±0.108)明显低于OD组和OA组,且差异均具有统计学意义;但各参数在OD组和OA组比较,差异无统计学意义。众所周知,在WHOⅡ级胶质瘤的组织病理上,AC的肿瘤细胞密度低,细胞核异形性低,核分裂少见,肿瘤实质内异常增殖的血管较少,坏死、钙化少见,但细胞外基质较疏松;OD的细胞密度中等,核异形、核分裂偶见,肿瘤实质内可见较密集的“鸡爪”状血管网,亦可见微小钙化[15];OA则由不同比例星形细胞和少突细胞混合而成,其微环境结构较复杂,但有争议[16]。依据上述AC、OD、OA的组织病理学特点,笔者认为AC与OD、OA组间各参数差异有统计学意义的主要原因在于肿瘤细胞密度和细胞外基质疏松程度不同。而OD和OA组间差异无统计学意义的原因则可能与OA含有AC、OD两种细胞成分但比例不定,导致ADC值和EADC值倾向性不同相关。进一步的AC组与OD+OA组ROC曲线分析可知,ADC、EADC、rADC及rEADC对AC和OD+OA的鉴别均有较高的诊断价值,且诊断效能相仿。
综合本研究的结果,可见肿瘤实质成分ADC值联合EADC值及其相对值的定量分析有助于WHOⅡ级AC与OD、OA及OD+OA的鉴别诊断。至于OD和OA之间鉴别的局限性,一方面可能与本组OA的样本量较小有关,另一方面也可能与OA组织病理学起源尚未明确有关,如果按照2016版WHO中枢神经系统肿瘤分类标准,本研究中6例OA因未行基因检测应归为OA(未定型)类别,鉴于该6例OA与15例OD的ADC、EADC及其相对值差异无统计学意义,可推测OA中少突胶质细胞瘤基因型居多,但具体情况尚待基于基因型检测的WHO Ⅱ级胶质瘤影像学研究来阐述。
[1]Louis D N, Ohgaki H, Wiestler O D,etal. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109.
[2]Duffau H, Taillandier L. New concepts in the management of diffuse low-grade glioma: Proposal of a multistage and individualized therapeutic approach[J]. Neuro-oncology, 2015, 17(3): 332-342.
[3]Babu R, Bagley J H, Park J G,etal. Low-grade astrocytomas: the prognostic value of fibrillary, gemistocytic, and protoplasmic tumor histology[J]. J Neurosurg, 2013, 119(2): 434-441.
[4]Khayal I S, McKnight T R, McGue C,etal. Apparent diffusion coefficient and fractional anisotropy of newly diagnosed grade II gliomas[J]. NMR Biomed, 2009, 22(4): 449-455.
[5]Hajian-Tilaki K. Receiver Operating Characteristic (ROC) Curve Analysis for Medical Diagnostic Test Evaluation[J]. Caspian J Intern Med, 2013, 4(2): 627-635.
[6]Attariwala R, Picker W. Whole body MRI: improved lesion detection and characterization with diffusion weighted techniques[J]. J Magn Reson Imaging, 2013, 38(2): 253-268.
[7]Barajas R F, Rubenstein J L, Chang J S,etal. Diffusion-weighted mr imaging derived apparent diffusion coefficient is predictive of clinical outcome in primary central nervous system lymphoma[J]. American Journal of Neuroradiology, 2009, 31(1): 60-66.
[8]Hu Y C, Yan L F, Sun Q,etal. Comparison between ultra-high and conventional mono b-value DWI for preoperative glioma grading[J]. Oncotarget, 2017, 8(23): 37884-37895.
[9]Cuccarini V, Erbetta A, Farinotti M,etal. Advanced MRI may complement histological diagnosis of lower grade gliomas and help in predicting survival[J]. J Neurooncol, 2016, 126(2): 279-288.
[10] 王健, 钱银锋, 杨奇芳, 等. 多b值DWI鉴别高级别胶质瘤及脑转移瘤[J]. 临床放射学杂志, 2015, 34(10): 1540-1543.
[11] 李晓光, 康厚艺, 张伟国. MR扩散和灌注加权成像在脑WHOⅡ级胶质瘤鉴别诊断中的价值[J]. 临床放射学杂志, 2014, 33(3): 325-329.
[12] 李辉, 陈兵, 龚瑞, 等. 弥散加权成像在颅内淋巴瘤与Ⅲ-Ⅳ级星形细胞瘤鉴别中的应用[J]. 实用放射学杂志, 2013, 29(9): 12-13.
[13] Akter M, Hirai T, Makino K,etal. Diffusion-weighted imaging of primary brain lymphomas: effect of ADC value and signal intensity of T2-weighted imaging[J]. Comput Med Imaging Graph, 2008, 32(7): 539-543.
[14] Kim C K, Park J J, Park B K. Prostate diffusion-weighted imaging at 3T: effect of intravenous gadobutrol administration[J]. Eur Radiol, 2016, 26(5): 1450-1456.
[15] Walker C, Baborie A, Crooks D,etal. Biology, genetics and imaging of glial cell tumours[J]. Br J Radiol, 2011, 84(2): S90-S106.
[16] Sahm F, Reuss D, Koelsche C,etal. Farewell to oligoastrocytoma: in situ molecular genetics favor classification as either oligodendroglioma or astrocytoma[J]. Acta Neuropathol, 2014, 128(4): 551-559.
TheValueofADC,EADCandTheirRelativeValuesintheDifferentialDiagnosisofWHOGradeⅡGlioma
GongJunwei1,ZhangZhu1,ChengRuntian1,JiangPeiling1,LuoTianyou1△,WuShaoping2△.
1.DepartmentofRadiology,TheFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China; 2.DepartmentofRadiology,TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China
ObjectiveTo study the value of apparent diffusion coefficient (ADC), exponential apparent diffusion coefficient (EADC) and their relative values in the differential diagnosis of WHO grade Ⅱ glioma.Methods51 cases with WHO grade II gliomas in brain confirmed pathologically were analyzed retrospectively. The cases consisted of 30 cases of astrocytomas (AC), 15 cases of oligodendrogliomas (OD) and 6 cases of oligoastrocytomas (OA). The values of ADC and EADC were measured and the values of the relative ADC (rADC) and relative EADC (rEADC) were calculated. Then the parameters were compared in order to analyze the differences between the three groups. The receiver operating characteristic curve (ROC) was used to determine the cut-off value, sensitivity and specificity for differential diagnosis between AC and OD+OA.ResultsThe values of ADC, EADC, rADC and rEADC in the parenchyma of the tumors were significantly different (P<0.001) between AC and OD and between AC and OA respectively, while there were no significant differences between OD and OA (P>0.05). The results of the ROC curve analysis showed that the areas under the curves were all greater than 0.9,and the diagnostic sensitivity and specificity were all more than 80% in differentiating AC and OD+OA when the values of 1.150×10-3mm2/s, 0.311, 1.512 and 0.691 were used respectively as the cut-off values for ADC, EADC, rADC and rEADC.ConclusionThe values of ADC, EADC, rADC and rEADC have certain value in differentiating OD or OA from AC, but there are some limitations in the differentiation of OD and OA. Those parameters have higher and similar diagnostic efficacy in the differentiation between AC and OD+OA.
Magnetic resonance imaging; Apparent diffusion coefficient; Exponential apparent diffusion coefficient; Low-grade glioma
http://kns.cnki.net/kcms/detail/51.1705.R.20171016.1110.010.html
10.3969/j.issn.1674-2257.2017.05.009
R739.41
A
国家临床重点专科建设资助项目(No:国卫办医函[2013]544号)
△
罗天友,E-mail: ltychy@sina.com;吴少平,E-mail: 1006820907@qq.com

