乳源生物活性肽研究进展
于洋,祁艳霞,靳艳
1(中国科学院 大连化学物理研究所,中国科学院 分离分析化学重点实验室,辽宁 大连,116023) 2(大连海洋大学 食品科学与工程学院,辽宁 大连,116023)
乳源生物活性肽研究进展
于洋1,2,祁艳霞2,靳艳1*
1(中国科学院 大连化学物理研究所,中国科学院 分离分析化学重点实验室,辽宁 大连,116023) 2(大连海洋大学 食品科学与工程学院,辽宁 大连,116023)
乳蛋白是人类膳食蛋白质的重要来源之一,乳蛋白在蛋白酶的作用下生成具有不同功能的肽,因其对人体生理功能潜在的调节作用得到了广泛的研究和关注。为了更好地了解乳源生物活性肽,文章从生物功能、制备方法以及质谱技术的应用等3个方面对乳源生物活性肽的最新研究进展进行了系统的综述。首先系统分析了目前已报道的具有血管紧张素转换酶抑制活性、免疫调节活性、抗氧化活性、抗菌活性和阿片活性等功能的乳源生物活性肽的功能、来源和构效关系;对乳源生物活性肽的制备方法及其优缺点进行了比较;最后对质谱技术在乳源生物活性肽筛选、磷酸化乳源肽和糖基化乳源肽的鉴定等方面的最新应用进展进行了梳理。
乳蛋白;生物活性肽;质谱技术;生物活性
乳蛋白是食源蛋白质的重要组成部分,不仅可以为人体提供营养物质,还可以产生多种对人体代谢和生理活动具有积极影响的生物活性肽,是当前国际食品界热门的研究课题和极具发展前景的功能因子。乳源生物活性肽活性强、易制备、来源广泛且天然安全,受到人们的普遍关注。在过去的数十年中,利用不同的制备技术和方法,不断从乳蛋白中发现具有新功能的生物活性肽。同时随着组学技术的迅猛发展,基于生物质谱的蛋白质组学技术也逐渐应用于乳源生物活性肽的研究,使得乳源生物活性肽的研究更加深入。本文从乳源生物活性肽的活性、制备以及质谱技术在乳源生物活性肽的鉴定和分析方面的最新研究进展进行综述,以期为后续的研究提供参考。
1 乳源生物活性肽
乳源生物活性肽是以乳蛋白为原料,经过水解及分离纯化后得到的具有特殊生物活性的蛋白水解物,能够产生镇静止痛、调节血压、机体防御与免疫调节以及促进矿物质吸收等促进人体健康的功能[1-5]。文献报道乳源生物活性肽具有血管紧张素转换酶(angiotensin converting enzyme, ACE)抑制活性、免疫调节活性、抗氧化活性、抗菌活性和阿片活性等功能,如表1所示。
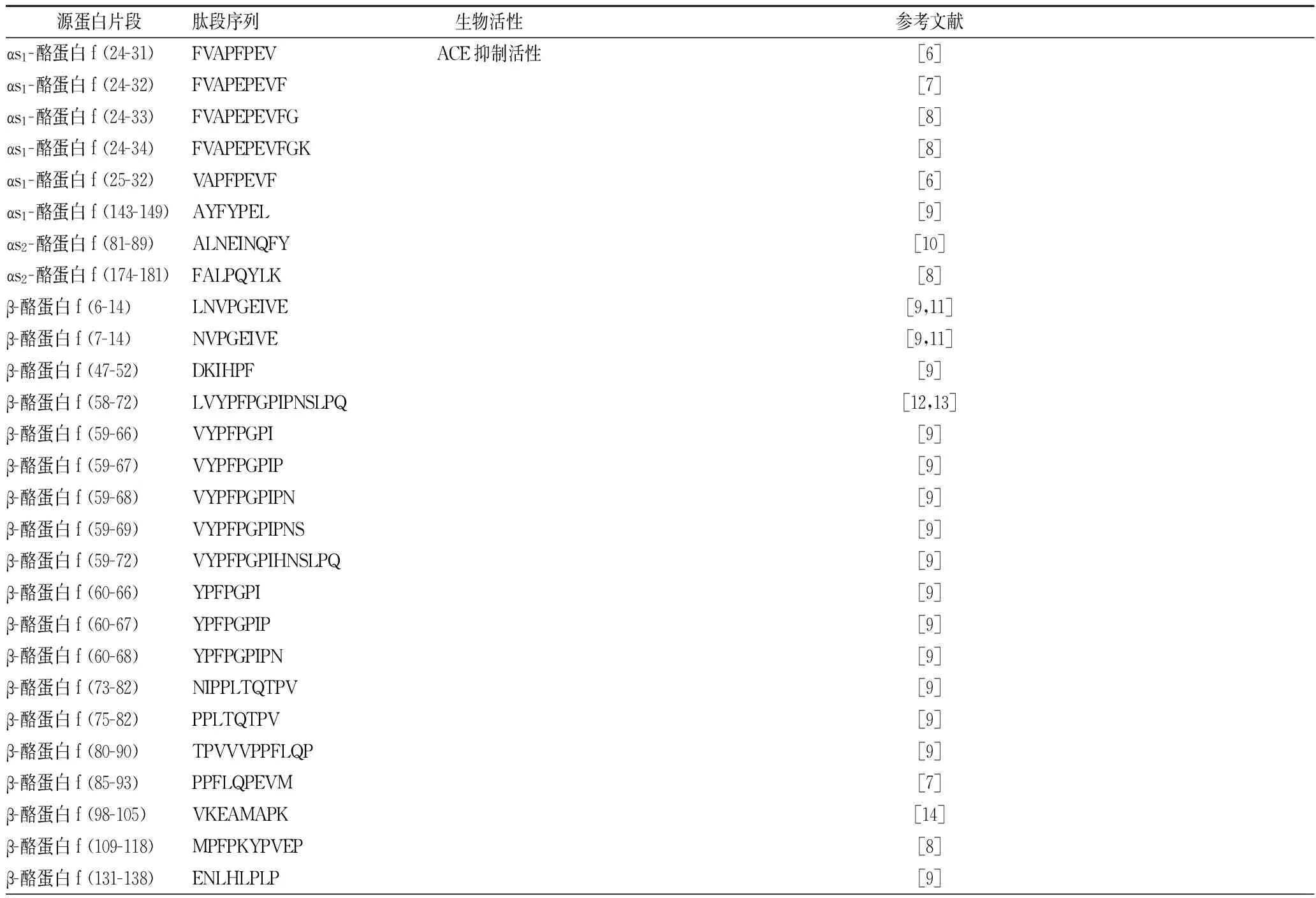
表1 文献报道的具有5种生物功能的乳源生物活性肽
续表1
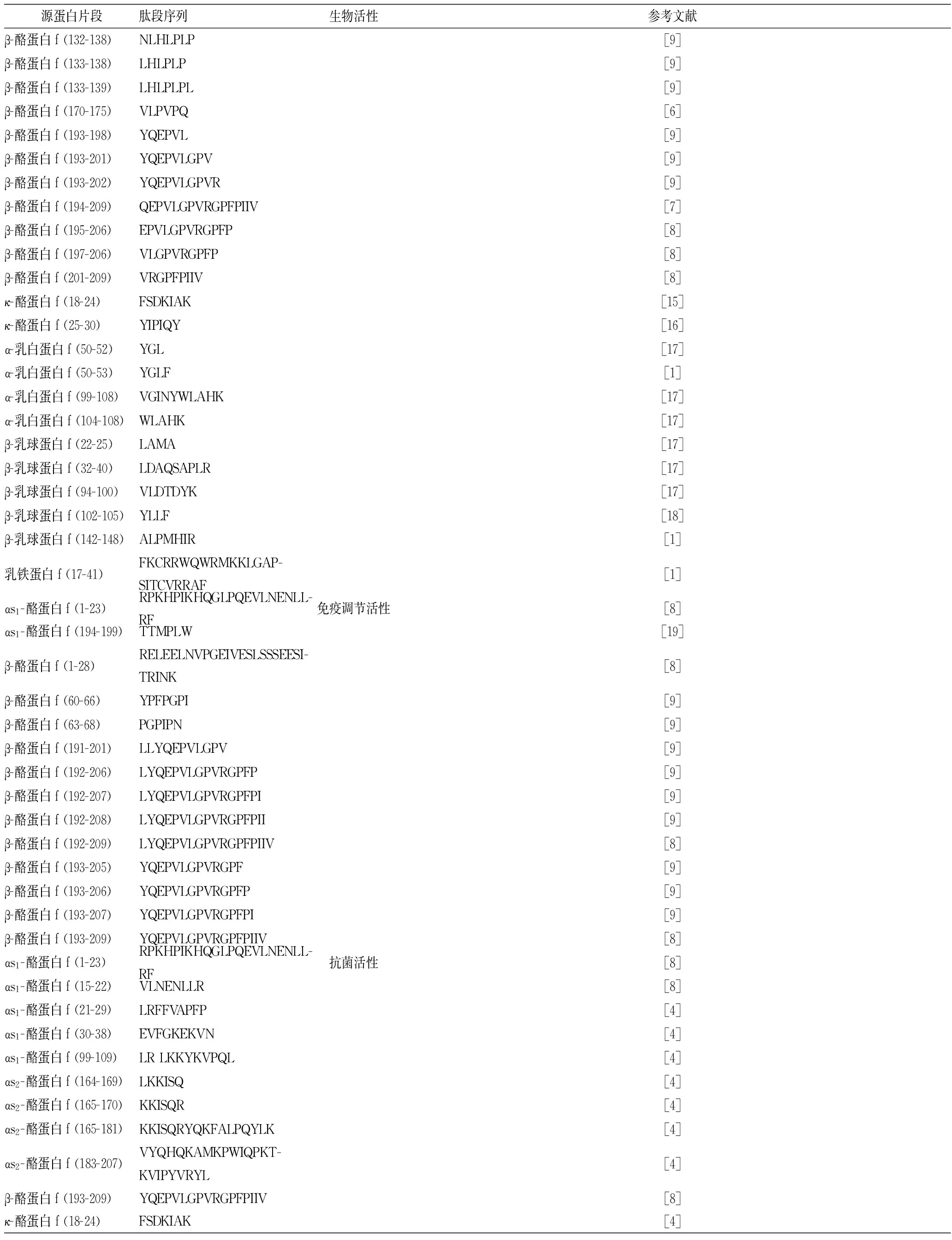
源蛋白片段肽段序列生物活性参考文献β-酪蛋白f(132-138)NLHLPLP[9]β-酪蛋白f(133-138)LHLPLP[9]β-酪蛋白f(133-139)LHLPLPL[9]β-酪蛋白f(170-175)VLPVPQ[6]β-酪蛋白f(193-198)YQEPVL[9]β-酪蛋白f(193-201)YQEPVLGPV[9]β-酪蛋白f(193-202)YQEPVLGPVR[9]β-酪蛋白f(194-209)QEPVLGPVRGPFPIIV[7]β-酪蛋白f(195-206)EPVLGPVRGPFP[8]β-酪蛋白f(197-206)VLGPVRGPFP[8]β-酪蛋白f(201-209)VRGPFPIIV[8]κ-酪蛋白f(18-24)FSDKIAK[15]κ-酪蛋白f(25-30)YIPIQY[16]α-乳白蛋白f(50-52)YGL[17]α-乳白蛋白f(50-53)YGLF[1]α-乳白蛋白f(99-108)VGINYWLAHK[17]α-乳白蛋白f(104-108)WLAHK[17]β-乳球蛋白f(22-25)LAMA[17]β-乳球蛋白f(32-40)LDAQSAPLR[17]β-乳球蛋白f(94-100)VLDTDYK[17]β-乳球蛋白f(102-105)YLLF[18]β-乳球蛋白f(142-148)ALPMHIR[1]乳铁蛋白f(17-41)FKCRRWQWRMKKLGAP-SITCVRRAF[1]αs1-酪蛋白f(1-23)RPKHPIKHQGLPQEVLNENLL-RF免疫调节活性[8]αs1-酪蛋白f(194-199)TTMPLW[19]β-酪蛋白f(1-28)RELEELNVPGEIVESLSSSEESI-TRINK[8]β-酪蛋白f(60-66)YPFPGPI[9]β-酪蛋白f(63-68)PGPIPN[9]β-酪蛋白f(191-201)LLYQEPVLGPV[9]β-酪蛋白f(192-206)LYQEPVLGPVRGPFP[9]β-酪蛋白f(192-207)LYQEPVLGPVRGPFPI[9]β-酪蛋白f(192-208)LYQEPVLGPVRGPFPII[9]β-酪蛋白f(192-209)LYQEPVLGPVRGPFPIIV[8]β-酪蛋白f(193-205)YQEPVLGPVRGPF[9]β-酪蛋白f(193-206)YQEPVLGPVRGPFP[9]β-酪蛋白f(193-207)YQEPVLGPVRGPFPI[9]β-酪蛋白f(193-209)YQEPVLGPVRGPFPIIV[8]αs1-酪蛋白f(1-23)RPKHPIKHQGLPQEVLNENLL-RF抗菌活性[8]αs1-酪蛋白f(15-22)VLNENLLR[8]αs1-酪蛋白f(21-29)LRFFVAPFP[4]αs1-酪蛋白f(30-38)EVFGKEKVN[4]αs1-酪蛋白f(99-109)LRLKKYKVPQL[4]αs2-酪蛋白f(164-169)LKKISQ[4]αs2-酪蛋白f(165-170)KKISQR[4]αs2-酪蛋白f(165-181)KKISQRYQKFALPQYLK[4]αs2-酪蛋白f(183-207)VYQHQKAMKPWIQPKT-KVIPYVRYL[4]β-酪蛋白f(193-209)YQEPVLGPVRGPFPIIV[8]κ-酪蛋白f(18-24)FSDKIAK[4]
续表1

源蛋白片段肽段序列生物活性参考文献κ-酪蛋白f(106-169)MAIPPKKNQDKTEIPTINTIAS-GEPTSTPTTEAVESTVATLEDSPEVIESP-PEINTVQVTSTAV[20]乳铁蛋白f(17-41)FKCRRWQWRMKKLGAP-SITCVRRAF[1]αs1-酪蛋白f(80-90)HIQKEDVPSER抗氧化活性[8]αs1-酪蛋白f(157-164)DAYPSGAW[21,22]αs2-酪蛋白f(174-181)FALPQYLK[8]β-酪蛋白f(170-176)VLPVPQK[9]κ-酪蛋白f(96-106)ARHPHPHLSFM[23]αs1-酪蛋白f(90-96)RYLGYLE阿片活性[1]β-酪蛋白f(60-63)YPFP[9]β-酪蛋白f(60-65)YPFPGP[9]β-酪蛋白f(60-66)YPFPGPI[9]β-酪蛋白f(60-67)YPFPGPIP[9]κ-酪蛋白f(25-34)YIPIQYVLSR[8]
1.1ACE抑制肽
高血压是心血管疾病的一个重要的危险因素,是目前影响人类健康的主要疾病之一。在各种生物活性肽中,抗高血压生物活性肽的研究最为深入和广泛。ACE是一种在血压调节中起关键作用的酶,抑制ACE的活性会降低血压。ACE抑制肽的氨基酸序列结构和肽链长度各不相同,大多含2~14个氨基酸残基,但都具有类似的生理功能[24]。对ACE抑制肽的构效关系研究表明,C末端三肽残基在竞争性结合ACE活性位点中起关键作用。大多数有效的ACE 抑制肽在C末端包含Tyr、Phe、Trp等芳香族氨基酸残基和Pro残基时最有利于其与ACE的结合,而且 Leu可能对增加多肽的ACE 抑制潜力具有显著作用。
1965年,FERREIRA等[25]首次从南美洲蝮蛇的毒液中发现了一种具有抑制血管紧张素转换酶(angiotensin-converting enzyme, ACE) 活性的小肽之后,ACE抑制肽的研究引起了各国科学家们的兴趣。目前在乳制品中已从牛奶、发酵乳和奶酪中分离纯化得到了各种结构、序列及长度大小不一的具有降血压功能的 ACE 抑制肽。由于ACE抑制肽具有降血压的作用,因此通过控制发酵条件来得到含有更高活性 ACE 抑制肽的发酵乳制品已经得到商业应用。例如,日本的一种名为“Calpis”的软饮料,是由乳酸杆菌发酵的脱脂牛奶,其中含有三氨基酸多肽,序列分别为Val-Pro-Pro和Ile-Pro Pro,具有明显的降血压作用[26]。
1.2阿片肽
阿片肽是免疫系统中重要的调节因子,是最早在酪蛋白的酶解产物中被发现的生物活性肽。阿片肽是一类具有吗啡受体配体活性的生物活性肽,能够作为激素和神经递质与体内的μ-、δ-和γ-受体相互作用,具有镇静止痛、调节人体情绪、呼吸、脉搏、体温、延长胃肠蠕动和刺激胃肠激素的释放等生理功能[1-2]。
β-酪啡肽是由β-酪蛋白酶解得到的一类阿片活性肽,其中研究最多的β-酪啡肽 5 (β-casomorphin-5,β-CM5)和β-酪啡肽 7 (β-casomorphin-7,β-CM7) 是来源于β-酪蛋白 60-64 位 (YPFPG) 和60-66 位(YPFPGPI)的2种具有阿片活性的多肽物质。1979年,BRANTL[27]从牛乳β-酪蛋白的酶解物中发现了对豚鼠回肠纵肌神经节具吗啡样活性的物质, 并首次从中分离出β-酪啡肽5 (β-casomorphin-5,β-CM5) Tyr-Pro-Phe-Pro-Gly和β-酪啡肽7 (β-casomorphin-7,β-CM7) Tyr-Pro-Phe-Pro-Gly-Pro-Ile,这是源于食品蛋白活性肽的最早报道,并证实与内源性阿片样肽具有相同的活性。
1.3抗氧化肽
人体内自由基的产生和清除处在动态平衡中,但当人体内自由基的产生过量时,就会发生氧化反应导致机体的损伤进而引起多种疾病。研究发现,通过膳食供应来提高机体的抗氧化能力是降低机体氧化应激水平的一种现实和可行的方法。
FARVIN[28]等在酸奶中鉴定到一系列源于酪蛋白的抗氧化肽,并提出将抗氧化肽作为一种食品添加剂应用于易氧化的鱼油食品中以延缓氧化的可能性。他们之后的一篇报道[29]进一步研究了抗氧化肽的构效关系,发现这些肽几乎都至少含有一个Pro残基,部分鉴定到的肽段N端为疏水性氨基酸(如Val或Leu)并且肽段序列中含有Pro,His 或Tyr,这些被认为是抗氧化肽的特征结构。
1.4抗菌肽
抗菌肽又称为肽类抗生素,是由生物体产生的具有抗菌作用的小分子蛋白质,是宿主先天性非特异性防御系统的重要组分,多数相对分子质量小于10 kDa,由20~60个氨基酸残基组成,是多样性的阳离子型两亲性肽类。这类肽的N末端富含亲水性氨基酸残基,如Lys、Arg等;C末端富含疏水性氨基酸残基,如Ala、Gly,且通常被酰胺化,这是抗菌肽具有抗菌活性的关键因素之一。同时这类活性多肽多数具有两亲性和电正性等特点,与免疫调节肽之间还有互相协同和增效作用[30]。
最早被发现的乳源抗菌肽是用凝乳蛋白酶酶解αs1-酪蛋白获得有抗菌特点的物质。这种物质被命名为Casecidin,并通过实验证明其在体外可抑制葡萄球菌、八叠球菌、枯草杆菌、肺炎双球菌和化脓性链球菌的生长[31]。MALKOSKI等[20]从κ-酪蛋白的水解产物中分离得到具有抗菌活性的肽,经鉴定为κ-酪蛋白106-169序列片段,并将其命名为Kappacin。抗菌肽是近几年来研究较多的一类生物活性肽,对人体特别是新生儿正常生理功能发挥着不可替代的作用,具有广泛的应用前景。
1.5免疫调节肽
免疫调节肽是一类从乳酪蛋白的胰蛋白酶、胰凝乳蛋白酶等酶水解物中分离出来的、具有刺激吞噬功能的肽类,这些免疫活性肽不仅在生物体内起重要的免疫调节作用,而且还刺激机体淋巴细胞的增殖和增强巨噬细胞的吞噬能力,提高机体抗病原物质的感染能力。
GILL等[32]证实了来源于牛乳蛋白的低分子质量肽可以调节人外周血液淋巴细胞的增生。MIGHORE-SAMOUR 等[33]发现酪蛋白酶解后获得了2条具有刺激巨噬细胞活性功能的免疫调节肽,不仅可以在体外实验中刺激小眼吞噬细胞的活性,在人体内也可刺激巨噬细胞的吞噬活性。其他一些活性肽(如抗高血压肽、阿片肽等)也具有一定的免疫调节活性,在机体的免疫调节中发挥着重要作用。还有研究表明免疫调节肽能够抑制艾滋病早期感染的发展和肿瘤生长。尽管如此,目前对于免疫刺激肽如何发挥其功能的生理机制还不清楚,有待于进一步深入研究。
1.6促进矿物质吸收
酪蛋白是牛奶、酸奶以及奶酪等乳制品中主要的磷酸化蛋白,由酪蛋白水解得到的磷酸化片段称为酪蛋白磷酸肽(caseinophosphopeptides,CPPs)。CPPs的经典制备方式是用胰蛋白酶、碱性蛋白酶、中性蛋白酶等适宜pH值为7.0~8.0的酶进行酶解,将pH值调至4.6沉淀蛋白,上清液调至7.0后加入CaCl2振荡,使用冰乙醇沉淀得到CPPs[34]。许多CPPs具有一种3个磷酸丝氨酸残基后接2个谷氨酸残基的特征结构,即Ser(P)-Ser(P)-Ser(P)-Glu-Glu,这种结构使CPPs具有较强的结合二价金属离子(如钙、铁、锌)的功能[3]。CPPs与钙离子结合可防止钙离子在小肠内生成磷酸钙沉淀,提高钙离子的溶解度,促进钙离子的吸收和利用。多项研究表明CPPs还具有预防龋齿的作用[35-36]。
可以看出酪蛋白(casein)和乳清蛋白(whey protein)均可释放生物活性肽,而在4种酪蛋白(αs1-、αs2-、β-和κ-酪蛋白)中,β-酪蛋白产生最多的活性肽,其次是αs1-酪蛋白、κ-酪蛋白和αs2-酪蛋白[37]。
2 乳源生物活性肽的制备方法
乳源生物活性肽被编码在对应蛋白一级结构中,只有在水解后从蛋白中释放出来时才会被激活从而具备生物活性[3]。酶解法和微生物发酵法对乳蛋白进行水解是常用的制备乳源生物活性肽的方法。
2.1酶解法制备生物活性肽
酶法制备乳源生物活性肽以其成本低,安全性高,条件温和,水解进程易于控制,可特异性生产特定的肽等优势,一直以来都是活性肽的主要制备方法。常用的蛋白水解酶有三类:动物蛋白酶如胃蛋白酶、胰蛋白酶及胰凝乳蛋白酶等;植物蛋白酶如木瓜蛋白酶及菠萝蛋白酶等;微生物蛋白酶如细菌胶原酶、嗜热菌蛋白酶等[38]。由于酶的专一性,蛋白酶的水解位点存在差异,当2种或2种以上蛋白酶同时作用于底物时,往往具有协同增效作用,因此采用复合酶水解蛋白的方法可提高酶解效率。酶解产物一般是各种活性肽的混合物,活性效果也往往是多种肽段活性协作的结果。
酶膜反应器是一种高效制备生物活性肽的反应器,系统可以持续稳定反应达8 h 以上,大大提高了原料和蛋白酶的利用率[39]。超声波、微波等方法也可提高酶解效率、缩短酶解时间,作为一种辅助手段越来越多地应用到了蛋白质酶解工艺中[40]。
酶法制备活性肽具有效率高、特异性强、反应时间短的优点,因此是目前最常用的方法。但是由于酶的品种有限,利用该方法制备活性肽具有一定的局限性。
2.2微生物发酵法制备生物活性肽
微生物发酵是一个古老的制备生物活性肽的方法。微生物酶解蛋白释放乳源生物活性肽主要发生于酸奶、酸奶油、干酪和乳酒的制作中。酸奶中的肽主要是由乳酸菌发酵得到的,常用的乳酸菌有嗜热链球菌、保加利亚乳杆菌、嗜酸乳杆菌和乳双歧杆菌等。在酸奶发酵过程中,有20%左右的蛋白质在乳酸菌的作用下被分解,产生对人体健康有重要影响的活性肽等物质。开菲尔粒(Kefir grains)是一个复杂的微生物共生体系,主要由酸菌,酵母菌和醋酸菌的某些属种组成。JENNIFER等[37]使用开菲尔粒制作俄罗斯传统发酵乳Kefir,然后对其中的活性肽进行分析,共鉴定到有16条活性肽具有ACE抑制活性、阿片活性、抗氧化、抗菌、抗血栓形成和矿物质结合等不同活性。PAN等[41]使用瑞士乳杆菌LB10发酵牛奶并检测了产物的ACE抑制活性,ACE抑制率为75.46%,并从β-乳球蛋白中筛选出了一个新的肽段RLSFNP,其对ACE的半抑制浓度(hemi-inhibitory concentration,IC50)为177.39 mmol/L。
微生物发酵法是最传统的活性肽的制备方法,在食品中已经得到广泛应用。发酵所使用的微生物具有特殊的蛋白酶体系,而且还可使用多种微生物组合进行发酵,因此所制备的活性肽的功能更丰富。但是与酶法相比较,发酵所用微生物的蛋白酶体系效率较低,发酵并不能使乳蛋白完全降解,一般只有20%左右的乳蛋白被降解。
3 质谱技术在乳源生物活性肽中的应用
得益于质谱技术的快速发展,蛋白质组学的研究步入快速发展轨道,蛋白质组学技术的应用也从生物医学拓展到食品领域,形成食物蛋白质组学(food proteomics)。基于生物质谱的食物蛋白质组学在乳蛋白中的主要应用有:乳蛋白消化组学、乳源生物活性肽的筛选、磷酸化乳源肽及糖基化乳源肽的研究。
3.1乳蛋白质消化组学
乳蛋白消化组学是食源蛋白质消化组学的重要组成部分,主要是利用以质谱技术为核心的蛋白质组学方法分析乳蛋白质经过人体胃肠道消化后的去向以及蛋白质降解产物对人体健康的影响,是目前国际上一个活跃的研究领域。
对人体胃肠道消化的研究可分为体内消化和体外消化2种模式。体外消化是在生物体外模拟人体胃肠道的消化环境,研究各种食物或药物成分的消化和代谢情况。由于对蛋白质消化酶及消化条件有比较好的研究基础,因此针对蛋白质尤其是乳蛋白质体外消化模型的研究较多。PICARIELLO等[42]建立体外模拟胃肠道消化体系研究了牛奶蛋白的消化过程,模拟消化体系主要为胃蛋白酶、由胰蛋白酶、胰凝乳蛋白酶、弹性蛋白酶和羧肽酶组成的胰酶、以及人体小肠BBM酶,分别在模拟胃液(pH 2.0)、模拟胰液(pH 7.0)和模拟肠液中反应1 h,研究了经过模拟消化后牛奶肽的存在情况。结果显示β-乳球蛋白的特定区域(f 125-135)具有耐酶解的特点。本实验室[7]利用基于质谱的蛋白质组学技术研究了酸奶的蛋白消化组学,在酸奶、酸奶胃酶解和酸奶胰酶解样品通过质谱检测分别鉴定到250、434和466条酪蛋白肽,并对消化过程中ACE和DPP-IV抑制活性进行研究,结果表明酸奶的ACE和DPP-IV抑制活性均随着消化程度的加深而增加。STUKNYTE等[43]使用混合四极静态轨道阱质谱Q Exactive研究了12种不同的奶酪样品经过模拟胃肠道消化的主要的ACE抑制肽并主要研究了其中的8条:VPP、IPP、RYLG、RYLGY、AYFYPE、HLPLP、AYFYPEL和LHLPLP。不同的奶酪样品经消化后产生ACE抑制肽的数量和种类均会发生变化,但VPP和IPP几乎存在于所有的样品中。SANCHEZ-RIVERA等[44]以西班牙蓝纹奶酪为样品进行模拟胃肠道消化。在十二指肠消化时,除了胰蛋白酶、胰凝乳蛋白酶之外,还使用了胰脂肪酶(pancreatic lipase)和辅脂肪酶(colipase)对乳蛋白进行进一步的消化。结果显示经过模拟胃肠道消化之后,包括ACE抑制肽、抗氧化肽、阿片肽和抗菌肽等活性肽的数量显著增加。
乳蛋白的消化研究在人体或动物体内能最准确地反映实际情况,但是体内实验往往存在研究周期长、动物个体间的差异、结果重现性差、费用高、伦理等问题,而体外消化模型则凭借其简单方便、便宜、可再生的优点逐渐得到了广泛的认可和应用。随着研究发展,体外消化模型的模拟条件逐渐细化和精确,越来越向体内真实的状态靠拢,大大提高了使用体外模型得到研究结果的可信度。
3.2基于蛋白质组学的乳源生物活性肽筛选
传统活性肽制备方法需经过分离纯化,得到单一组分后通过结构解析获得活性肽的信息,这种传统的方法效率低下,往往获得一个肽需要耗费大量的时间和化学试剂。本实验室将蛋白质组学技术与构效关系相拟合,建立了基于蛋白质组学技术的生物活性肽快速筛选方法[45-46],该技术可通过质谱分析获得大量的肽序列信息,结合活性肽的构效分析可实现快速筛选生物活性肽。
利用该技术使用RPLC串联质谱LTQ-Orbitrap XL对市面上4种酸奶进行研究,通过质谱检测分别鉴定到152、125、364和274条肽段。以对ACE的抑制能力为指标对鉴定到的肽活性进行检测,发现在相同浓度2 mg/L时,4种酸奶 ACE 抑制率分别为 46.84%、42.75%、77.41%和 63.84%。另外还利用这种高效、快速筛选活性肽的方法,在酸奶中获得FVAPFPEVF、PPFLQPEVM和QEPVLGPVRGPFPIIV 3个新的活性肽,其中FVAPFPEVF和PPFLQPEVM对ACE和DPP-IV均具有抑制作用,FVAPFPEVF对ACE和DPP-IV的IC50分别为35.76 μmol/L和2.52 μmol/L;PPFLQPEVM对ACE和DPP-IV的IC50分别为34.63 μmol/L和0.44 μmol/L;QEPVLGPVRGPFPIIV只对ACE有抑制作用,IC50为160.76 μmol/L[7]。
3.3基于蛋白质组学的磷酸化肽和糖基化肽的研究
利用质谱技术鉴定蛋白磷酸化和糖基化是蛋白质组学技术中的主要研究方向之一,该技术也应用于乳蛋白中的酪蛋白磷酸化以及糖基化肽的研究中。乳蛋白磷酸化的研究主要集中在具有促进钙吸收的酪蛋白磷酸肽的研究中。由于乳蛋白肽中发生磷酸化修饰和糖基化修饰的肽段丰度较低,非修饰肽会抑制修饰肽的信号,降低质谱检测的灵敏度,因此通常需要进行富集来取得更好的鉴定效果。CRUZ-HUERTA等[47]使用UPLC连接Esquire-LC四极离子阱质谱分析酪蛋白副产物中的CPPs,共鉴定到37条CPPs,其中源于αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白的分别有13条、8条、16条和2条,显示酪蛋白副产物可以成为CPPs的来源。ADT等[48]使用RPLC连接纳升级电喷雾电离串联质谱研究波弗特奶酪以及酶解产物中的CPPs。72条波弗特奶酪中水溶性的CPPs大部分源于β-酪蛋白,而酶解产物中的79条CPPs则主要来源于αs1-酪蛋白。大部分鉴定到CPPs是单磷酸化的,只有17条含有CPPs的特征结构Ser(P)-Ser(P)-Ser(P)-Glu-Glu。乳蛋白的糖基化与哺乳期密切相关,相关的研究并不太多。CHEN等[49]研究了牛乳中叶酸结合蛋白中的糖基化肽。叶酸结合蛋白的酶解物富集后使用PNGase F 酶去除糖基化肽上的糖链,使用MALDI-TOF-MS鉴定到NACCSVNTSIEAHK和GWNWTSGYNQCPVK两条肽段。结果表明牛乳中的叶酸结合蛋白的49位和141位天冬氨酸残基会发生N-糖基化,其发生的概率分别为96%和74%。
4 总结与展望
随着人们健康意识的日益增强以及对强化食品、膳食补充剂和保健功能食品需求的增长,活性强、天然安全、资源丰富且易于进行大规模的工业化生产的乳源生物活性肽将具有强大的发展趋势。同时高分辨率的分离技术与功能强大的生物质谱技术的迅猛发展,使乳源生物活性肽的研究水平发生了质的飞跃,其具备的各种生物活性对寻找疾病的治疗条件以及研究药物的先导化合物等具有重要意义,因此利用新技术新方法研究开发乳源生物活性肽具有十分优越的应用前景。
[1] CLARE D A,SWAISGOOD H E.Bioactive milk peptides a prospectus[J].Journal of Dairy Science,2000,83 (6):1 187-1 195.
[2] PIHLANTO-LEPPLA.Bioactive peptides derived from bovine whey proteins opioid and ace-inhibitory peptides[J].Trends in Food Science & Technology,2001,11 (9/10):347-356.
[3] PHELAN M,AHERNE A,FITZGERALD R J,et al.Casein-derived bioactive peptides:Biological effects,industrial uses,safety aspects and regulatory status[J].International Dairy Journal,2009,19 (11):643-654.
[5] NONGONIERMA A B,FITZGERALD R J.Bioactive properties of milk proteins in humans:a review[J].Peptides,2015,73:20-34.
[6] CONTRERAS M d M,SANCHEZ D,SEVILLA M,et al.Resistance of casein-derived bioactive peptides to simulated gastrointestinal digestion[J].International Dairy Journal,2013,32 (2):71-78.
[7] JIN Yan,YU Yang,QI Yan-xia,et al.Peptide profiling and the bioactivity character of yogurt in the simulated gastrointestinal digestion[J].Journal of Proteomics,2016,(141):24-46.
[8] BAUM F,FEDOROVA M,EBNER J,et al.Analysis of the endogenous peptide profile of milk:identification of 248 mainly casein-derived peptides[J].Journal of Proteome Research,2013,12 (12):5 447-5 462.
[9] NONGONIERMA A B,FITZGERALD R J.Strategies for the discovery,identification and validation of milk protein-derived bioactive peptides[J].Trends in Food Science & Technology,2016,50:26-43.
[10] MURRAY B A,FITZGERALD R J.Angiotensin converting enzyme inhibitory peptides derived from food proteins:biochemistry,bioactivity and production[J].Current Pharmaceutical Design,2007,13 (8):773-791.
[11] GOBBETTI M,STEPANIAK L,ANGELIS M D,et al.Latent bioactive peptides in milk proteins:Proteolytic activation and significance in dairy processing[J].Critical Reviews in Food Science and Nutrition,2002,42 (3):223-239.
[12] OTTE J,SHALABY S M A,ZAKORA M,et al.Fractionation and identification of ACE-inhibitory peptides from alpha-lactalbumin and beta-casein produced by thermolysin-catalysed hydrolysis[J].International Dairy Journal,2007,17 (12):1 460-1 472.
[13] KORHONEN H,PIHLANTO A.Food-derived bioactive peptides-opportunities for designing future foods[J].Current Pharmaceutical Design,2003,9 (16):1 297-1 308.
[14] KORHONEN H,PIHLANTO A,Technological options for the production of health-promoting proteins and peptides derived from milk and colostrum[J].Current Pharmaceutical Design,2007,13 (8):829-843.
[15] LOPEZ-EXPOSITO I,MINERVINI F,AMIGO L,et al.Identification of antibacterial peptides from bovine kappa-casein[J].Journal of Food Protection,2006,69 (12):2 992-2 997.
[16] JIANG Zhan-mei,TIAN Bo,BRODKORB A,et al.Production,analysis and in vivo evaluation of novel angiotensin-I-converting enzyme inhibitory peptides from bovine casein[J].Food Chemistry,2010,123 (3):779-786.
[17] PIHLANTO-LEPPLA,KOSKINEN P,PIILOLA K,et al.Angiotensin I-converting enzyme inhibitory properties of whey protein digests:concentration and characterization of active peptides[J].Journal of Dairy Research,2000,67 (1):53-64.
[18] MULLALLY M M,MEISEL H,FITZGERALD R J.Synthetic peptides corresponding to alpha-lactalbumin and beta-lactoglobulin sequences with angiotensin-I-converting enzyme inhibitory activity[J].Biological Chemistry Hoppe-Seyler,1996,377 (4):259-260.
[19] MEISEL H,FITZGERALD R J.Biofunctional peptides from milk proteins mineral binding and cytomodulatory effects[J].Current Pharmaceutical Design,2003,9 (16):1 289-1 295.
[20] MALKOSKI M,DASHPER S G,O'BRIEN-SIMPSON N M,et al.Kappacin,a novel antibacterial peptide from bovine milk[J].Antimicrobial Agents and Chemotherapy,2001,45 (8):2 309-2 315.
[22] SUETSUNA K,CHEN Jiun-rong.Isolation and characterization of peptides with antioxidant activity derived from wheat gluten[J].Food Science and Technology Research,2002,8 (3):227-230.
[23] KUDOH Y,MATSUDA S,IGOSHI K,et al.Antioxidative peptide from milk fermented with Lactobacillus delbrueckii subsp bulgaricus IFO13953[J].Journal of the Japanese Society for Food Science and Technology-Nippon Shokuhin Kagaku Kogaku Kaishi,2001,48 (1):44-50.
[24] LEE S H,QIAN Z J,KIM S K.A novel angiotensin I converting enzyme inhibitory peptide from tuna frame protein hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J].Food Chemistry,2010,118 (1):96-102.
[25] FERREIRA L G.Deformation potentials of lead telluride[J].Physical Review,1965,137 (5A):A1 601-A1 609.
[26] 杨铭,胡志和.乳源ACE抑制肽的开发与应用[J].食品科学,2010,31 (19):461-464.
[27] BRANTL V,TESCHEMACHER H,HENSCHEN A,et al.Novel opioid peptides derived from casein (beta-casomorphins).I.Isolation from bovine casein peptone[J].Hoppe-Seyler's Zeitschrift für physiologische Chemie,1979,360 (9):1 211-1 216.
[28] FARVIN K H S,BARON C P,NIELSEN N S,et al.Antioxidant activity of yoghurt peptides:Part 1-in vitro assays and evaluation in ω-3 enriched milk[J].Food Chemistry,2010,123 (4):1 081-1 089.
[29] FARVIN K H S,BARON C P,NIELSEN N S,et al.Antioxidant activity of yoghurt peptides:Part 2-Characterisation of peptide fractions[J].Food Chemistry,2010,123 (4):1 090-1 097.
[30] MOHANTY D,JENA R,CHOUDHURY P K,et al.Milk derived antimicrobial bioactive peptides:a review[J].International Journal of Food Properties,2015,19 (4):837-846.
[31] KATZIRKATCHALSKY A,LAHAV E,SODE-MORGENSEN M T.Polypeptidic antibiotic substances derived from casein.US 3764670A[P].1973.
[32] GILL H S,DOULL F,RUTHERFURD K J,et al.Immunoregulatory peptides in bovine milk[J].British Journal of Nutrition,2000,84 (suppl 1):S111-S117.
[33] TSURUKI T,YOSHIKAWA M.Anti-alopecia effect of gly-leu-phe,an immunostimulating peptide derived from α-lactalbumin[J].Bioscience Biotechnology and Biochemistry,2005,69 (8):1 633-1 635.
[34] SAINI P,MANN B,KUMAR R,et al.Process optimisation for preparation of caseinophosphopeptides from buffalo milk casein and their characterisation[J].Journal of Dairy Research,2014,81 (3):364-371.
[35] WANG Yan-li,YUAN Lu-lu,YAO Chen-jie,et al.Caseinophosphopeptides cytoprotect human gastric epithelium cells against the injury induced by zinc oxide nanoparticles[J].Rsc Advances,2014,4 (79):1-12.
[36] ZIDANE F,MATEOS A,CAKIR-KIEFER C,et al.Binding of divalent metal ions to 1-25 beta-caseinophosphopeptide:an isothermal titration calorimetry study[J].Food Chemistry,2012,132 (1):391-398.
[37] EBNER J,ARSLAN A A,FEDOROVA M,et al.Peptide profiling of bovine kefir reveals 236 unique peptides released from caseins during its production by starter culture or kefir grains[J].Journal of Proteomics,2015,(117):41-57.
[38] 李建杰,叶磊,荣瑞芬.生物活性肽的酶法制备及分离鉴定研究进展[J].食品研究与开发,2012,33 (2):195-199.
[39] 张赛赛,李恒星,沙莎,等.酶膜反应器水解酪蛋白连续制备ACE抑制肽的研究[J].中国食品学报,2009,9 (6):41-47.
[40] 李菊芳,董绪燕,魏芳,等.微波/超声波及固定化酶技术在食品蛋白质高效水解中的应用研究进展[J].中国农业科技导报,2009,11 (6):86-92.
[41] PAN Dao-dong,GUO Yu-xing.Optimization of sour milk fermentation for the production of ACE-inhibitory peptides and purification of a novel peptide from whey protein hydrolysate[J].International Dairy Journal,2010,20 (7):472-479.
[42] PICARIELLO G,FERRANTI P,FIERRO O,et al.Peptides surviving the simulated gastrointestinal digestion of milk proteins:biological and toxicological implications[J].Journal of Chromatography.B,Analytical Technologies in the Biomedical and Life Sciences,2010,878 (3/4):295-308.
[43] STUKNYTE M,CATTANEO S,MASOTTI F,et al.Occurrence and fate of ACE-inhibitor peptides in cheeses and in their digestates followinginvitrostatic gastrointestinal digestion[J].Food Chemistry,2015,168:27-33.
[45] JIN Yan,YAN Jia-ze,YU Yang,et al.Screening and identification of DPP-IV inhibitory peptides from deer skin hydrolysates by an integrated approach of LC-MS/MS and in silico analysis[J].Journal of Functional Foods,2015,18 (1):344-357.
[46] LIU Xiao-yan,SONG Chun-xia,CHEN Rui,et al.Identification of angiotensin I-converting enzyme inhibitors in peptides mixture of hydrolyzed red deer plasma with proteomics approach[J].Chinese Journal of Chemistry,2010,28 (9):1 665-1 672.
[47] CRUZ-HUERTA E,GARCA-NEBOT M J,MIRALLES B,et al.Caseinophosphopeptides released after tryptic hydrolysis versus simulated gastrointestinal digestion of a casein-derived by-product[J].Food Chemistry,2015,168:648-655.
[48] ADT I,DUPAS C,BOUTROU R,et al.Identification of caseinophosphopeptides generated through in vitro gastro-intestinal digestion of Beaufort cheese[J].International Dairy Journal,2011,21(3):129-134.
[49] CHEN Wei-bin,LEE P J,STAPELS M,et al.The use of mass spectrometry to determine location and extent of N-glycosylation on folate binding protein from bovine milk[J].Rapid Communications in Mass Spectrometry,2006,20 (2):313-316.
Milk-derivedbioactivepeptides:Areview
YU Yang1,2,QI Yan-xia2,JIN Yan1*
1(Key Laboratory of Separation Science for Analytical Chemistry,Dalian Institute of Chemical and Physics, Chinese Academy of Sciences,Dalian 116023,China) 2(College of Food Science and Engineering College,Dalian Ocean University,Dalian 116023,China)
Milk protein is a kind of significant high-value and digestible protein, which could be hydrolyzed by proteases and release various functional bioactive peptides. Milk-derived bioactive peptides has
wide interests and extensive research for their regulating effects on human body. The biological function, preparation and mass spectrometry application on milk-derived bioactive peptides were systematically summarized. Milk-derived bioactive peptides’ have angiotensin converting enzyme inhibitory activities, immunoregulatory, antioxidant, antibacterial and opioid bioactivities. The biological functions, sources and structure-function relationship of milk-derived bioactive peptides were analyzed. The enzymatic hydrolysis and fermentation are two main preparation methods of milk-derived bioactive peptides. The advantages and disadvantages of two techniques were compared. Finally, the application of mass spectrometry technology on the screening and identifying of milk-derived bioactive peptides, including phosphopeptides and glycopeptides were reviewed.
milk protein; bioactive peptides; mass spectrometry technology; bioactivity
硕士研究生(靳艳研究员为通讯作者,E-mail:yanjin@dicp.ac.cn)。
国家自然科学基金(31601538);中国科学院分离分析化学重点实验室开放基金(KL-1602)
2017-01-16,改回日期:2017-02-14
10.13995/j.cnki.11-1802/ts.013847

