紫茎泽兰乙醇提取物对小鼠肝脏ATPase活力的影响
农向+赵乐乐+旷欢

摘 要:紫茎泽兰是菊科泽兰属的一种有毒植物,是我国外来入侵物种中危害最为严重的植物之一。紫茎泽兰提取物对于组织器官中ATPase的活力是否有影响是本试验的目的。利用不同浓度的紫茎泽兰提取液灌胃小白鼠以及溶解了避孕药的菜籽油作对照,每隔5天取上一次灌胃的小鼠解剖取其肝脏制成组织匀浆,使用ATPase活力测定试剂盒和紫外-可见光分光光度计测得其吸光值,并由公式计算出其对应的活力值,然后利用差异顯著性分析,得出F>f0.01,在正态分布图中P<0.01,即紫茎泽兰提取液对小鼠肝脏的ATPase活性是有极显著的影响。
关键词:紫茎泽兰提取物 ;ATPase活力; 紫外-可见光分光光度计
紫茎泽兰(Eupatorium adenophorum)属于双子叶植物,菊目菊科泽兰属多年生草本或成半灌木状植物。原产中美洲墨西哥和哥斯达黎加,是一种有毒的、侵占性很强的恶性杂草。目前,对紫茎泽兰的毒性及中毒机理的研究虽然有一定进展,但报道结论不够一致。有研究表明紫茎泽兰对棉铃虫的生长发育有不利影响;鲜紫茎泽兰水提液对小鼠也有毒性。也有人认为紫茎泽兰乙醇提取物对小鼠没有毒性。本试验从生物天然药物的角度,探索紫茎泽兰乙醇提取物对小鼠肝中ATPase活力是否有影响。
ATPase是细胞中利用ATP水解产生的能量产生结构变化从而促进离子进行主动跨膜运输的一种酶,也称为泵。其在小鼠肝脏中的主要作用是提供能量给器官进行解毒。ATPase的变化说明了其催化ATP水解产生能量的能力的变化,然而测定ATPase通常不能用重量和体积衡量,而是用酶活力大小来表示(即酶催化反应的能力)。酶的活力越大,肝脏的解毒能力越强,反之,解毒能力越弱。近年来,在实验性高血压动物以及临床高血压患者的血清中观察到了一种称为利钠激素(natriuretic hormone)的Na+K+泵抑制性液体因子。冯北元等研究得出乙醇对大鼠突触体的两类ATPase(Na+K+-ATPase和Mg2+-ATPase)均有抑制作用。目前国内已经应用cDNA信息库从动物中获得了Na+K+-ATPase亚基的克隆,所缺少的是新合成的亚基氨基端的信号肽。本次试验目的在于通过小鼠肝脏中ATPase活性的变化,来探究所灌胃药物是否对小鼠脏器功能产生了影响,以及影响的程度。
一、材料与方法
1.试验材料
(1)紫茎泽兰、左炔诺孕酮。紫茎泽兰植株采于四川省西昌市,取树阴下长势旺盛的紫茎泽兰地上部分,烘干后粉碎并用乙醇制作提取液备用。植物形态学的鉴定按相关的鉴定文献进行。
左炔诺孕酮(正规药店直接购买华润紫竹药业公司产品左炔诺孕酮炔雌醚)。
(2)小白鼠。从小鼠养殖场购买成年健康小白鼠60只,分成4组,每组10只母鼠,5只公鼠。公母鼠分开喂养。
2.试验方法
(1)紫茎泽兰提取液的制备。取粉碎的紫茎泽兰100g,加入500ml,95%的乙醇在旋转蒸发仪上提取1h,过滤,萃取,浓缩,最后酒精蒸发完用丙三醇溶出残渣,定容。
(2)给药方法。将紫茎泽兰提取液分成两组。第一组原始浓度灌胃,第二组加入相同体积超纯水配成50%浓度的溶液灌胃,第三组灌胃相同体积的超纯水作为对照,第四组灌胃菜籽油溶解的避孕药(10ml)。体重称量 小鼠体重均为50g左右(±2.5g)给药浓度为0.1ml/10g体重·5d-1,每只小鼠使用灌胃针给药0.5ml。第一次测定三组每组一只作为空白对照的吸光值,当天灌胃第一次,以后每隔5天灌胃一次,灌胃之前取出三组每组一只测定吸光值。连续灌胃3次,测定数据5次(外加一次恢复试验)。
(3)样品制备。每组取一只小鼠,在无菌环境下解剖,快速取其肝脏,用人工研磨方法,在冰块上充分研磨,并按照1:9比例加入超纯水混匀,各取2ml组织匀浆于EP管内, 2500r/min离心10min。取上清液先测定组织蛋白含量,然后测定肝脏ATPase的吸光值。
(4)数据处理。测得每组吸光值根据公式计算出对应的组织蛋白含量和ATPase活力。并利用生物统计学知识方差分析:可重复双因素分析在office中确定差异的显著性。
二、结果与分析
1.三组药物影响肝脏ATPase活力显著性分析
表1中,不同药物对肝脏的影响数据中,df1=2,dfe=6,f0.05=5.14,f0.01=10.92,F1>f0.01,则P<0.01,表明同一时间段内不同药物对肝的影响差异极显著;不同持续时间段内对肝的影响数据中,df1=3,dfe=6,f0.05=4.76,f0.01=9.78,F2>f0.01,则P<0.01,表明不同持续时间段内同一药物对肝的影响差异极显著。
综合来说,根据上表F值,并查表对比,F值远大于标准表值,即在正态分布图上P<0.01,概率为99.9%,差异极显著。
2.得到的结论
(1)对于同一种ATPase的活性,在灌胃持续期间,每一次相对于之前一次的活性都具有显著性差异,即每次喂药都有99.9%的概率使其对应的ATPase活性产生变化;
(2)对于同一次灌胃的三种药物之间,同一灌胃时间其活力值相对于另一种药物的活力值也都具有显著性的差异,即每一次喂药,灌胃三种药物的器官活性都会有99.9%的概率产生变化。
3.每组小鼠器官中四种ATPase离子泵的活力变化曲线图建立
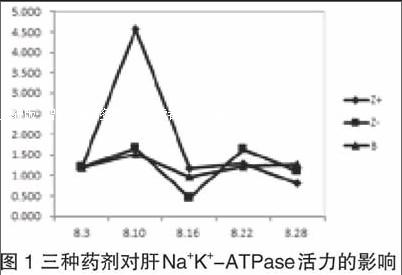
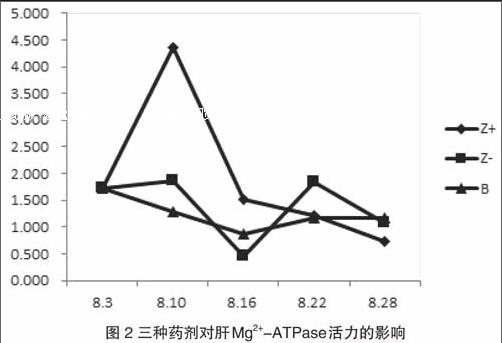
(横坐标:日期,纵坐标:活力值)(Z+代表紫茎泽兰提取液原始浓度;Z-代表紫茎泽兰原始提取液稀释一倍的度;B代表避孕药的菜籽油溶液)
根据图1中曲线图走向,可知肝脏中Na+K+-ATPase对Z+的应激反应特别强烈,其活性突然增大,但在第二次灌胃以后便降低到正常水平,之后活力也基本没有变化,稳定在正常水平。Z-和B的趋势大概都是灌胃后ATPase活力增强与减弱互相交替中进行,且变化幅度相比于Z+的影响不大,直至最后一次恢复试验都回到正常水平附近。endprint
根据图2曲线图走势可以看出,Z+在第一次灌胃后对肝脏Mg2+-ATPase活力的影响与图五相同,但第二次及以后直到恢复性试验,Mg2+-ATPase活力都在缓慢下降,降到了正常水平之下,并且没有恢复正常活力。Z-与图1中Z-的影响趋势相同。但是B对Mg2+-ATPase的影响却是先逐渐下降而后缓慢上升,变化水平很小,贴近正常水平。
图3中三种药物对肝脏Ca2+-ATPase的影响趋势基本与图五中Na+K+-ATPase的影响趋势相同。不过Z+的影响使得Ca2+-ATPase的活力在第二次灌胃后依旧处于缓慢下降,并且降到了正常水平之下。
图4中Z+对肝脏中Ca2+Mg2+-ATPase活力的整体影响依旧使其下降到了正常水平之下,而Z-和B在第一次灌胃后对ATPase基本没产生影响,但在第二次灌胃后其活性都突然下降,幅度很大,之后却一直在上升,并且恢复到了正常的活力水平附近。
综上,可得出,三种药物中,Z+对肝脏中四种ATPase的活力影响最为明显,而且可以持续的使其活力明显下降,而Z-及B对其活性的影响不稳定,并且停止灌胃后都可以恢复到正常活力水平。
根据表中方差交互值和图表分析结论可得,紫茎泽兰提取物对小鼠肝中ATPase活力产生了影响,并且每种药物的影响程度不同。有人得出女贞子提取物对小鼠Na+K+-ATPase活力产生了促进作用,延长其活力持续时间,并且药效时间结束后,其活性显著降低到正常水平以下。而研究表明垂盆草及竹叶提取物也有相同提高脏器ATPase活力的功效。在实验中,小鼠脏器ATPase活性也产生了同样的影响,因此可以得出灌胃的紫茎泽兰提取物对小鼠脏器ATPase活力有影响,并且不同的浓度影响不同。根据董强等人的紫茎泽兰全草小鼠毒性的研究中得出的紫茎泽兰全草提取物中含有多种致毒有效成分,并且互相作用,因此在本实验中可知,对于肝脏紫荆泽兰提取物原始浓度对其影响效果强,对于肾脏,避孕药菜籽油溶液对其影响效果较强。但是紫茎泽兰提取物并不能永久有效的使肝、肾脏中ATPase产生变化,起影响作用只是在持续给药期间,中断给药,则会恢复到正常状态。
三、讨论
对于肝脏的四种ATPase的活性,Z+所引起的应激反应是最为强烈的,而且后续灌胃之后,其能够持续的影响肝脏内ATPase的活性,从而达到长期影响的效果,但缺点是必须坚持给药,一旦中断灌胃,那么肝脏的ATPase活性就会立即回复到正常的水平。
4张图表从三种药物对小鼠不同的器官及同一器官内不同的ATPase的活性影响趋势进行分析,数据为ATPase的吸光值,可用来表示其活性的大小,更加直观的体现出不同药物的影响变化,从感官方面佐证了我们的结论,并且为接下来进行数据统计学分析做出了铺垫。
在解剖小鼠进行组织匀浆的制备过程中,我们还进行了病理组织学检查。初次解剖(8.3日)的小鼠肝脏肾脏外观良好,无异常肿胀、萎缩或者病变。然而在第二次解剖时(8.10日)及之后到第四次(8.22日)解剖,小鼠的肝脏肾脏外观明显有变化,肝脏肿胀,并且有黄色脂肪块覆盖,肾脏逐渐萎缩,颜色变暗淡,并且弹性下降。
参考文献:
[1]董强,赵宝玉,顾强,等.紫茎泽兰全草对小鼠毒性试验[J].西北大学学报(自然科学版),2011,(6).
[2]董欣悦,王见.紫茎泽兰提取物国内研究进展[J]绿色科技,2013,(12).
[3]马云慧.女贞子提取物对大鼠不同组织Na+K+-ATPase活性的影响[J].西北林学院学报,2011,26(1):143-146.
[4]程丽坤,刘小侠,张青文,等.紫茎泽兰乙醇提取物对棉铃虫生长发育和繁殖力的影响[J].昆虫学报,2007,50(3):304-308.
[5]王一丁,高平,郑勇,等.紫茎泽兰提取物对棉蚜的毒力及其灭蚜机理研究[J].植物保护学报,2002(12).
[6]李宝成,郭科明,王新军,等.葛根总黄酮对大强度耐力训练大鼠不同组织Na+K+-ATPase活性的影响[J].北京体育大学学报,2006(10).
[7]赵文玺,金梅花,李天,等.草苁蓉水萃取物对四氯化碳致肝损伤小鼠肝脏氧化应激的干预作用[J].中国中药杂志,2013,15(3).
[8]李超,李厚勇,張振玲,等.紫茎泽兰提取物对小鼠免疫毒性的研究[J].毒理学杂志,2015,25(6).
[9]侯敏,李岩.桦树皮提取物对H22、S180荷瘤小鼠肿瘤细胞膜Ca2+,Mg2+-ATPase活性的影响[M]. 2010年中国药学大会暨第十届中国药师周论文集,2010,1(11).
[10]程丽坤.紫茎泽兰次生物质对几种害虫生物活性研究[M].中国农业大学出版社,2007.
[11]李宏.ATPase的研究进展[J].生物学杂志,1996.
[12]包维民,郭永章,唐映梅,等.大鼠肝脏冷/热缺血再灌注损伤钠钾ATP酶、钙ATP酶及镁ATP酶与干细胞死亡方式的研究[J].中国现代普通外科进展,2004.
[13]范立鹏.紫茎泽兰提取物对美国白蛾生物活性及解毒酶的影响.河北农业大学,2010.
[14]刘利江,熊正英.竹叶提取物对大强度耐力训练大鼠不同组织ATPase活性的影响[J].南方农业学报,2013(10).
[15]苏振阳.垂盆草对训练大鼠不同组织ATPase活性的影响[J].北京体育大学学报,2006(11).
[16] Yougui ZHA,Yongqing LI,Liming FAN,et al. Herbicidal Activities of Eupatorium adenophorum Extracts by 3 Extraction Methods[J]. Plant Diseases and Pests 2012,3(2):57-59.endprint

