原花青素类成分在防治2型糖尿病作用机制方面的研究进展
王雪萍 李医明 王钊 贾琦 陈凯先

[摘要]糖尿病是一种以升高血糖为主要特点的慢性疾病,长期高血糖会引发多种并发症。原花青素是一类广泛存在于植物中的多酚化合物,在降血糖、改善胰岛素抵抗、保护胰岛β细胞方面具有良好的作用,对于2型糖尿病的预防及治疗显示出较好的效果。该文对原花青素类成分调控2型糖尿病在促进葡萄糖吸收、保护胰岛β细胞、改善肠道微环境、调节糖尿病并发症等方面的研究进展进行综述,为该类成分进一步研究提供参考。
[关键词]原花青素; 2型糖尿病; 作用机制
[Abstract]Diabetes mellitus, a chronic disease, is characterized by high blood glucose that could induce various complications Procyanidin, a kind of polyphenol compounds existing in many plants, have shown to be effective in preventing and treating type 2 diabetes mellitus as they may lower blood glucose, moderate insulin resistance and protect islet β cells This review focused on the research advances on the preventive and therapeutic application of procyanidin in promoting glucose absorption, protecting islet β cells, modulating intestinal microbiota and regulating diabetic complications of type 2 diabetes mellitus, which should provide useful reference for subsequent studies.
[Key words]procyanidin; type 2 diabetes mellitus; mechanism
糖尿病是一種因胰岛素分泌不足和/或胰岛素作用障碍所致的以高血糖为主要特征的代谢紊乱综合征,长期慢性高血糖导致多种组织损害、器官功能障碍,使患者生活质量降低、寿命缩短、病死率增高。根据发病机制的不同,糖尿病分为以胰岛素分泌不足为主的1型糖尿病及以胰岛素抵抗为主要特征的2型糖尿病,其中糖尿病患者以2型为主,占比超过90%[1]。目前临床上治疗2型糖尿病的药物,存在低血糖反应、变态反应、消化道不适等一系列的不良反应[2],研发安全有效的降糖药物是当前药物研发的重要任务,而天然药物是新药发现与研究的重要来源。
原花青素是一类以黄烷3醇为单体的聚合多酚类物质,常根据参与聚合的单体数目进行分类 (原花青素分类见表1及图1),其广泛存在于各种植物的核、皮或种子中,如葡萄籽、蓝莓、肉桂、桑椹、野苹果等植物中均含有较为丰富的原花青素类成分[3]。研究表明原花青素具有降血糖、降血脂、抗氧化、抗炎等药理活性,其降血糖的效果越来越受到人们的关注。虽然已有文献对原花青素降糖降脂作用进行了综述[45],但未见原花青素降糖机制方面的系统综述。本文对原花青素改善2型糖尿的作用机制进行较为系统的综述,为后续深入研究原花青素用于2型糖尿病的防治提供参考。
1促进外周细胞葡萄糖吸收
高血糖是糖尿病的一个典型特点,机体细胞对于葡萄糖的吸收利用主要存在于肝脏、肌肉、脂肪等外周组织中,促进外周细胞葡萄糖的吸收是降低血糖的一个重要途径。药理实验表明,原花青素可以促进葡萄糖的吸收,其作用机制包括以下几点。
11促进细胞膜外葡萄糖转运葡萄糖吸收入血后,依赖葡萄糖转运体(GLUTs)进入细胞。葡萄糖转运体包括13个亚型,GLUT2主要在肾小管细胞、肝脏细胞及胰岛β细胞中表达,GLUT4主要表达于胰岛素敏感的骨骼肌、脂肪细胞和心肌中。AMPK,Akt磷酸化促进葡萄糖转运体由胞质转移到胞膜,从而促进葡萄糖吸收。在胰岛素敏感的外周组织中,原花青素增加糖转运水平。在高脂诱导的肥胖型糖尿病小鼠中,可可酒原花青素提取物提高骨骼肌、棕色脂肪组织及白色脂肪组织中GLUT4表达和AMPKα磷酸化[6]。在KKAy糖尿病小鼠中,黑豆皮原花青素提取物提高肝脏及骨骼肌AMPK活性[7]。STZ诱导的糖尿病模型小鼠中,槟榔果中原花青素提取物增加肝脏AMPK活性[8]。在过表达人胰岛素受体的中国仓鼠卵巢细胞(CHOIR)中,葡萄籽原花青素提取物(GSPE)增加了Akt磷酸化水平[9];在3T3L1脂肪细胞中,海岸松树皮原花青素提取物提高Akt磷酸化水平[10]。此外,可可类黄酮表儿茶素通过增加HepG2细胞胰岛素受体(IR)、胰岛素受体底物1(IRS1)、胰岛素受体底物2(IRS2)磷酸化水平,激活PI3K/Akt,AMPK信号通路,增加GLUT2转运水平。但是部分研究显示,原花青素降低葡萄糖转运体mRNA的表达。在胰岛素诱导的胰岛素抵抗的3T3L1脂肪细胞中,GSPE下调Pparg2,GLUT4 及IRS1 mRNA水平,但不影响其促进葡萄糖吸收作用[11]。这提示原花青素可以通过改善胰岛素信号通路或激活AMPK,Akt引起GLUT4或/和GLUT2转移到细胞膜,调节葡萄糖吸收[12]。
12促进糖原合成及糖酵解,抑制糖异生过程糖原合成是血糖代谢的一个重要途径,肝脏和骨骼肌是合成糖原的主要场所,对调节血糖代谢有着至关重要的作用。糖原是葡萄糖在体内储存的主要形式,胰岛素可调节其合成与分解。有报道指出,胰岛素抵抗患者体内的糖原含量会显著降低[13]。PI3K/Akt信号通路是调节糖原合成的一个重要通路[14]。可可豆原花青素能够非胰岛素依赖性的刺激人原代骨骼肌细胞糖原合成、葡萄糖吸收;这种作用在低聚原花青素和多聚原花青素中都有体现,而且多聚原花青素效果更加显著[15]。在3T3L1脂肪细胞中,GSPE具有一定促进糖原合成的能力[16]。endprint
糖酵解途径是体内葡萄糖代谢最主要的途径之一,也是糖、脂肪和氨基酸代谢相联系的途径。肝脏糖异生紊乱导致肝糖输出增多是机体肝脏胰岛素抵抗发生的重要诱因[17]。在STZ诱导的糖尿病小鼠中,莲蓬低聚原花青素提高肝脏丙酮酸激酶(PK)、磷酸果糖激酶(PFK) mRNA的表达促进糖酵解过程[18]。苹果原花青素给予ob/ob小鼠8周,在丙酮酸耐受实验中,15,30 min苹果原花青素给药组显著降低血糖,抑制糖异生[19]。此外,GSPE促进糖原合成作用弱于胰岛素,但将葡萄糖合成脂质方面强于胰岛素,大多数葡萄糖直接合成甘油,但并不影响甘油三酯的总量[16]。
13调节与葡萄糖代谢相关酶的活性原花青素调节与葡萄糖输入或输出相关酶的活性。原花青素能够提高葡萄糖激酶、己糖激酶、糖原合成酶活性,降低葡萄糖6磷酸酶(G6Pase)、磷酸烯醇丙酮酸羧激酶(PEPCK)、果糖1,6二磷酸酶活性,减少葡萄糖生成[2023]。
原花青素下调与糖酵解通路相关的酶。糖酵解过程的关键酶葡萄糖激酶(GK),PK,PFK的活性直接影响着糖酵解过程[2425]。GSPE 25 mg·kg-1给药45 d,在大鼠胰岛上检测葡萄糖激酶基因表达水平显著降低[26]。另外,原花青素對丙酮酸激酶同工酶M1/M2(PKM2)、甘油醛3磷酸脱氢酶、ATP5B均有调节作用[27]。原花青素通过下调胰腺组织中与糖酵解通路相关酶的mRNA的表达或影响酶的活性降低葡萄糖的含量,从而改善2型糖尿病。
2保护胰岛β细胞
在2型糖尿病中,机体处于胰岛素抵抗状态,为了维持正常血糖水平,机体自我调节机制使胰岛β细胞分泌更多的胰岛素,加重胰岛β细胞功能受损状态,从而产生高胰岛素血症。研究表明,原花青素对胰岛素分泌和产生具有一定作用,也可影响β细胞的凋亡和增殖。
21调节胰岛素的合成和分泌正常情况下,葡萄糖的转运和利用主要在胰岛素等激素的刺激下,通过胰岛素转导途径,引起一系列激酶的激活、葡萄糖转运体易位等,最终促进靶组织吸收葡萄糖。胰岛素信号转导途径任一环节异常都会导致胰岛素抵抗。原花青素能增强机体对胰岛素的敏感性,调节胰岛素合成和分泌。在db/db糖尿病小鼠中,200 mg·kg-1柴桂原花青素提取物给药4周,小鼠血清及胰腺中胰岛素含量增加,葡萄糖耐受及胰岛素敏感性增加[28]。棕榈酸诱导的胰岛β细胞损伤模型中,原花青素三聚体提高葡萄糖刺激的胰岛素分泌水平[2930]。蛋白组学研究显示,原花青素通过调节羧肽酶蛋白(将前胰岛素转化为胰岛素)水平从而控制胰岛素合成[26]。但是,部分研究结果显示,高脂饮食诱导的糖尿病鼠中,给予GSPE,胰岛素基因表达有降低的趋势[27,31]。此外,原花青素促进胰岛β细胞增殖,其原因可能与胰岛素含量较高有关[25]。INS1E(β细胞系)经GSPE处理后,在高糖刺激下,GSPE增加β细胞对葡萄糖的吸收;改善葡萄糖诱导线粒体超极化的损伤、三磷酸腺苷合成的降低、改变细胞膜电位;改变GLUT2、葡萄糖激酶、UCP2基因表达及肝脏胰岛素降解酶的表达,进而改变胰岛素的降解;即原花青素在病理条件下通过调节胰岛素合成、分泌和降解来改变β细胞作用[32]。
原花青素调节胰岛素的分泌另外一个机制与miRNA改变相关。健康大鼠GSPE 25 mg·kg-1给药45 d,miR1249,miR483及miR30c1*下调,miR3544上调[33]。这些miRNA控制与胰岛素分泌过程相关的离子转运、刺激条件下激素和有机物质应答相关基因的表达,进而影响胰岛素的分泌[4]。
22改善胰岛β细胞功能及缓解炎症状态葡萄籽原花青素提取物能够降低高血糖、提高β细胞功能、保护胰岛β细胞[34]。其机制可能为:①通过调节β细胞的增殖[26]和凋亡[35]来调节细胞的功能。在人胰腺癌MIA PaCa2细胞中,给予10~100 mg·L-1的GSPE长期孵育,给药组减少胰岛β细胞增殖,增加β细胞凋亡,其原因可能是下调抗凋亡蛋白Bcl2和线粒体膜去极化[31]。在高脂诱导的2型糖尿病晚期鼠模型中,500 mg·kg-1给予GSPE 16周,β细胞功能及胰岛素表达增加,其原因是改善内质网应激和减少胰岛β细胞凋亡[36]。②INS1E细胞经油酸诱导3 d,GSPE处理后,上调CPT1a(增加β氧化),下调与脂质合成相关基因(FASn,SREBF1),减少β细胞中脂质堆积[31]。③改善炎症状态。Yin等[37]研究葡萄籽原花青素B2对db/db鼠胰腺的作用,发现与炎症相关的MFGE8,IL1β及NLRP3水平降低,且得出MFGE8可能是原花青素B2缓解db/db鼠胰腺炎症状态,从而发挥保护db/db鼠胰岛细胞作用的一个重要靶点的结论。
3改善肠道微环境
目前研究已揭示了肠道菌群与宿主代谢之间的复杂联系,肠道菌群可以通过影响葡萄糖和脂质代谢发挥对能量平衡的调节[38]。原花青素可以通过调节肠道菌群平衡及肠道微环境维持机体稳态。
31调节肠道菌群平衡研究表明,原花青素增加肠道中有益菌含量及种类,降低有害菌含量,优化肠道菌群多样性及优势性。宋雪琳等[39]发现GSPE能够有效降低营养肥胖型大鼠肠道菌群中厚壁菌门Firmicutes的量,增加拟杆菌门Bacteroidetes的量,降低F/B比值,改善肥胖模型大鼠肠道菌群结构。RTPCR定量研究也发现,GSPE可以促进有益的拟杆菌增殖,抑制有害的柔嫩梭菌增殖,对优势菌群具有显著的调节作用。傅颖等[40]给予高脂饲料喂养的SD大鼠不同剂量原花青素,发现各剂量组肠道优势菌群多样性明显增加,随着原花青素的干预剂量加大,中、高剂量组肠道菌群多样性明显减少,肠道优势菌群结构明显恢复。另外,原花青素能促进人类粪便培养液中双歧杆菌等益生菌的生长,增加短链脂肪酸的含量,抑制大肠杆菌、鼠李糖乳杆菌、鼠伤感沙门氏菌等有害菌的生长,减少厚壁菌门和拟杆菌门的比例[4143];酚类物质可通过破坏特定菌细胞膜的正常功能、改变微生物代谢酶构成和活性等途径来影响肠道菌群结构,但尚不清楚引起这些变化的由于酚类物质本身还是酚类物质的代谢产物[44]。endprint
32改善肠壁通透性及肠道蛋白功能慢性炎症和氧化应激反应都可能引起胰岛β细胞的凋亡,而胰岛素抵抗将最终引起2型糖尿病的发生[45]。研究显示,由高脂膳食诱导的大鼠2型糖尿病,其肠道中的细菌可蔓延到能引起炎症反应的肠壁周围的脂肪组织和血液中,提升细菌对于黏膜的黏附作用,从而导致炎症的发生[46]。原花青素对肠道环境的改善具有积极作用。在高脂饲料喂养Wistar大鼠建立的营养肥胖模型中,肖俊松等[47]发现GSPE可以显著恢复肠壁通透性。高脂膳食可诱导肠壁通透性异常升高,而肠壁通透性增加导致肠道内大量有毒物质经过静脉进入肝脏进而导致肝脏解毒负担,GSPE可减轻肝脏负担。
二肽基肽酶4 (DPP4)为一种糖膜蛋白,能使胰高血糖素样肽(GLP1)和抑胃肽(GIP) 快速降解,DPP4通过影响这2种肽类激素促进胰岛β细胞分泌胰岛素的功能,进而影响2型糖尿病患者血糖水平。原花青素可通过抑制肠道中DPP4的活性及/或基因的表达,来调节血糖水平。Gonzálezabuín等[48]发现GSPE长期处理人源Caco2细胞,DPP4的活性及基因的表达降低;在健康大鼠中,GSPE 25 mg·kg-1给药45 d,其肠道中DPP4的活性及基因表达相对未给予GSPE大鼠明显降低;饮食诱导的肥胖型大鼠中,经GSPE干预DPP4基因表达下调;可可黄酮通过抑制小肠上皮细胞中α淀粉酶、α葡萄糖苷酶、DPP4活性,抑制SGLT1及GLUT2糖转运体向胞浆转运,提高GLP1分泌影响碳水化合物的吸收[49]。
4调节与糖尿病相关的并发症
慢性高血糖可能会引起糖尿病肾病、糖尿病微血管病变等多种并发症的发生。目前研究结果表明糖尿病并发症发生与氧化应激、多元醇通路、蛋白质非酶糖激化、蛋白激酶C等相关[50]。在这些通路中可能存在控制糖尿病并发症发生的潜在靶点,以发病机制为靶点的治疗可能会给控制糖尿病慢性并发症发生及发展带来新的希望。
41调节血脂在脂肪组织、肝脏、肌肉组织中脂质过度积累将会导致肥胖,而肥胖也是引起2型糖尿病、心血管疾病等的一个危险因素。由高脂饮食诱导的糖尿病大鼠模型中,短期GSPE处理降低血清中甘油三酯、低密度脂蛋白含量,降低肝脏中SREBP1,MTP,DGAT2的表达[51]。
原花青素调节脂质的机制可能是:①降低肝脏PPARα、脂肪组织PPARγ水平,使ACO,CPT1,ABCA1等上调,提高脂肪酸氧化和降低胆固醇的形成;使FAS,SREBP1/2,DGAT2等下调,降低脂质合成和TAG储存[5255]。GSPE干预db/db鼠8周,可降低血尿素氮、血肌酐、尿白蛋白的水平,抑制肾小管上皮细胞内脂滴形成及脂肪酸合成,促进脂肪酸β氧化[56]。GSPE处理3T3L1脂肪细胞,调节PPARγ及miR4835p,抑制脂质生成[57]。②降低激素敏感性脂肪酶(HSL)等酶活性,减少脂解[5859]。在3T3L1细胞中,GSPE在其诱导分化的第4天,可明显降低HSL的mRNA表达[59]。但是,也有研究显示不同的结果。高脂诱导的仓鼠经GSPE处理,与合成代谢相关基因(ACC1,GPAT)、分解代谢相关基因(PPARα,ATGL,HSL)的mRNA水平提高,其糖脂/脂肪酸循环受到影响[60]。
42改善氧化应激及炎症状态肥胖条件下,脂肪酸和葡萄糖代谢增加将导致线粒体氧化应激,同時激活部分炎症信号通路[6162]。在胰岛素抵抗的动物模型上,原花青素降低与产生毒性物质相关酶的活性,如Cu,ZnSOD,谷胱甘肽过氧化物酶(GPx),过氧化氢酶 [6364];降低NFκB,COX2,CRP,IL6,TNFα等细胞因子在肝脏、脂肪及肌肉组织中基因表达[6568],促进脂肪组织脂联素含量的增加,缓解炎症状态[69]。糖尿病小鼠胰岛β细胞上显示出相似作用[70]。研究人员通过研究黑豆皮花青素对2型糖尿病大鼠氧化应激信号传导通路DAGPKC的影响,发现黑豆皮花青素可明显降低糖尿病大鼠血糖,对糖基化终产物(AGEs)的形成具有明显的抑制作用,肾小球PKC活性和肾小球总DAG的含量比糖尿病模型组明显下降,改善2型糖尿病大鼠的抗氧化能力[71] 。肖俊松等[47]发现GSPE可显著降低高脂诱导的肥胖大鼠血清中丙二醛水平,升高超氧化物歧化酶和过氧化氢酶水平,改善肥胖大鼠氧化应激状态;降低白介素1的水平,改善炎症状态。
5结语和展望
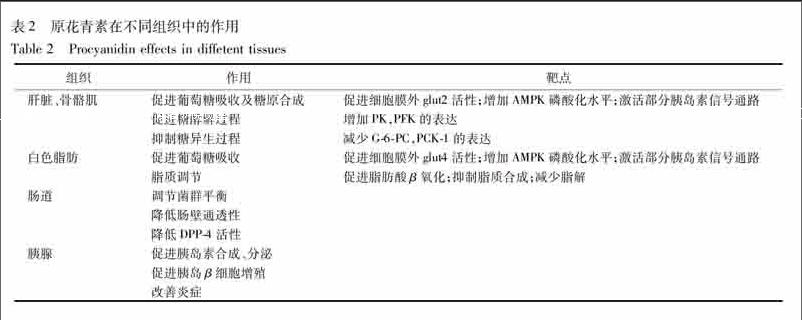
2型糖尿病是一种长期慢性疾病,病理过程涉及多个器官病变。研究发现原花青素具有多组分、多靶点、多功能作用,其在不同组织中的作用概括见表2。原花青素类成分可能通过促进葡萄糖吸收,减轻高糖毒性;抑制脂质分解,减轻脂毒性;调节胰岛素的合成和分泌;调节β细胞的增殖和凋亡等方面调控糖尿病。因此,原花青素类成分对2型糖尿病的防治具有较大优势。
美国食品和药品监督管理局(FDA)批准的第一个植物药——绿茶中的提取物Veregen,此植物药的主要成分为表没食子儿茶素没食子酸酯(EGCG)及其他儿茶素衍生物。原花青素类成分与EGCG在结构上有诸多相似之处,且毒副作用较小,这提示原花青素类成分在保健品及药品方面具有潜在的价值。但是,目前原花青素类成分的研究仍存在一些问题,如:①原花青素具有多个酚羟基,导致其不稳定,容易被氧化成其他成分;②目前对于单体原花青素发挥降糖活性的机制研究尚不彻底;③如何改善原花青素多聚体生物利用度低的问题尚不明确。因此,原花青素类成分对于改善2型糖尿病的研究还有很长的一段路要走。
[参考文献]
[1]American Diabetes Association Diagnosis and classification of diabetes mellitus [J]. Diabetes Care, 2013, 36(Suppl 1):S67.
[2]王艳梅,王根杰,张树林,等. 临床常用降糖药物的不良反应及防治策略[J]. 中国医院药学杂志, 2015, 35(24):2233.endprint
[3]張小军,夏春镗,吴建铭原花青素的资源研究[J]. 中药材, 2009, 32(7):1154.
[4]Gonzalezabuin N, Pinent M, Casanovamarti A, et al Procyanidins and their healthy protective effects against type 2 diabetes [J]. Curr Med Chem, 2015, 22(1):39.
[5]Bladé C, Arola L, Salvadó M J Hypolipidemic effects of proanthocyanidins and their underlying biochemical and molecular mechanisms[J]. Mol Nutr Food Res, 2010,54: 37.
[6]Yamashita Y, Okabe M, Natsume M, et al Prevention mechanisms of glucose intolerance and obesity by cacao liquor procyanidin extract in highfat dietfed C57BL/6 mice[J]. Arch Biochem Biophys, 2012, 527(2):95.
[7]Kurimoto Y, Shibayama Y, Inoue S, et al Black soybean seed coat extract ameliorates hyperglycemia and insulin sensitivity via the activation of AMPactivated protein kinase in diabetic mice [J]. J Agric Food Chem, 2013, 61(23):5558.
[8]Huang P L, Chi C W, Liu T Y Areca nut procyanidins ameliorate streptozocininduced hyperglycemia by regulating gluconeogenesis [J]. Food Chem Toxicol, 2013, 55(3):137.
[9]Montagut G, Onnockx S, Vaqué M, et al Oligomers of grapeseed procyanidin extract activate the insulin receptor and key targets of the insulin signaling pathway differently from insulin[J]. J Nutr Biochem, 2010, 21(6):476.
[10]Lee H H, Kim K J, Lee O H, et al Effect of pycnogenol on glucose transport in mature 3T3L1 adipocytes [J]. Phytother Res, 2010, 24(8):1242.
[11]Montagut G, Bladé C, Blay M, et al Effects of a grapeseed procyanidin extract (GSPE) on insulin resistance [J]. J Nutr Biochem, 2010, 21(10):961.
[12]Corderoherrera I, Martín M á, Goya L, et al Cocoa flavonoids attenuate high glucoseinduced insulin signalling blockade and modulate glucose uptake and production in human HepG2 cells [J]. Food Chem Toxicol, 2014, 64(2):10.
[13]Krssak M, Brehm A, Bernroider E, et al Alterations in postprandial hepatic glycogen metabolism in type 2 diabetes [J]. Diabetes, 2004, 53(12):3048.
[14]Youl C J, Jongsun P Contribution of natural inhibitors to the understanding of the PI3K/PDK1/PKB pathway in the insulinmediated intracellular signaling cascade [J]. Int J Mol Sci, 2008, 9(11):2217.
[15]Bowser S M, Moore W T, Mcmillan R P, et al Highmolecularweight cocoa procyanidins possess enhanced insulinenhancing and insulin mimetic activities in human primary skeletal muscle cells compared to smaller procyanidins [J]. J Nutr Biochem, 2017, 39:48.
[16]Pinent M, Bladé M C, Salvadó M J, et al Metabolic fate of glucose on 3T3L1 adipocytes treated with grape seedderived procyanidin extract (GSPE) Comparison with the effects of insulin[J]. J Agric Food Chem, 2005, 53(15):5932.endprint
[17]黃卫东,刘毅,辛超,等. Irisin对2型糖尿病小鼠血糖的影响及机制[J]. 心脏杂志, 2014(4):408.
[18]Li X, Sui Y, Wu Q, et al Attenuated mTOR signaling and enhanced glucose homeostasis by dietary supplementation with lotus seedpod oligomeric procyanidins in streptozotocin (STZ)induced diabetic mice[J]. J Agric Food Chem, 2017,65(19):3801.
[19]Ogura K, Ogura M, Shoji T, et al Oral administration of apple procyanidins ameliorates insulin resistance via suppression of proinflammatory cytokines expression in liver of diabetic ob/ob mice[J]. J Agric Food Chem, 2016, 64(46):8857.
[20]Zhang H J, Ji B P, Chen G, et al A combination of grape seedderived procyanidins and gypenosides alleviates insulin resistance in mice and HepG2 cells [J]. J Food Sci, 2009, 74(1):H1.
[21]Sundaram R, Naresh R, Shanthi P, et al Modulatory effect of green tea extract on hepatic key enzymes of glucose metabolism in streptozotocin and high fat diet induced diabetic rats [J]. Phytomedicine, 2013, 20(7):577.
[22]FernandezLarrea J, Montagut G, Bladé M C, et al GSPE has the same effects as insulin on the mRNA levels of the main genes of glucose disposal in the liver of STZdiabetic animals [J]. Diab Vasc Dis Res, 2007(1): S186.
[23]Gandhi G R, Ignacimuthu S, Paulraj M G Solanum torvum Swartz fruit containing phenolic compounds shows antidiabetic and antioxidant effects in streptozotocin induced diabetic rats [J]. Food Chem Toxicol, 2011, 49(11):2725.
[24]Lenzen S A fresh view of glycolysis and glucokinase regulation: history and current status [J]. J Biol Chem, 2014, 289(18):12189.
[25]Arden C, Petrie J L, Tudhope S J, et al Elevated glucose represses liver glucokinase and induces its regulatory protein to safeguard hepatic phosphate homeostasis [J]. Diabetes, 2011, 60(12):3110.
[26]CastellAuví A, Cedó L, Pallarès V, et al Procyanidins modify insulinemia by affecting insulin production and degradation [J]. J Nutr Biochem, 2012, 23(12):1565.
[27]Cedó L, CastellAuví A, Pallarès V, et al Pancreatic islet proteome profile in Zucker fatty rats chronically treated with a grape seed procyanidin extract [J]. Food Chem, 2012, 135(3):1948.
[28]Chen L, Sun P, Wang T, et alDiverse mechanisms of antidiabetic effects of the different procyanidin oligomer types of two different cinnamon species on db/db mice [J]. J Agric Food Chem, 2012, 60(36):9144.
[29]Sun P, Wang T, Chen L, et al Trimer procyanidin oligomers contribute to the protective effects of cinnamon extracts on pancreatic βcells in vitro [J]. Acta Pharm Sin, 2016, 37(8):1083.endprint
[30]Wang T, Sun P, Chen L, et al Cinnamtannin D1 protects pancreatic βcells from palmitic acidinduced apoptosis by attenuating oxidative stress [J]. J Agric Food Chem, 2014, 62(22):5038.
[31]Castellauví A, Cedó L, Pallarès V, et al Grape seed procyanidins improve βcell functionality under lipotoxic conditions due to their lipidlowering effect [J]. J Nutr Biochem, 2013, 24(6):948.
[32]Hutton J C Insulin secretory granule biogenesis and the proinsulinprocessing endopeptidases [J]. Diabetologia, 1994, 37(2):S48.
[33]CastellAuví A, Cedó L, Movassat J, et al Procyanidins modulate microRNA expression in pancreatic islets [J]. J Nutr Biochem, 2013, 61(2):355.
[34]Zunino S Type 2 diabetes and glycemic response to grapes or grape products [J]. J Nutr, 2009, 139(9):1794S.
[35]Mantena S K, Baliga M S, Katiyar S K Grape seed proanthocyanidins induce apoptosis and inhibit metastasis of highly metastatic breast carcinoma cells [J]. Carcinogenesis, 2006, 27(8):1682.
[36]Ding Y, Zhang Z, Dai X, et al Grape seed proanthocyanidins ameliorate pancreatic betacell dysfunction and death in lowdose streptozotocinand highcarbohydrate/highfat dietinduced diabetic rats partially by regulating endoplasmic reticulum stress [J]. Nutr Metab, 2013, 10(1):51.
[37]Yin W, Li B, Li X, et al Antiinflammatory effects of grape seed procyanidin B2 on a diabetic pancreas [J]. Food Funct, 2015, 6(9):3065.
[38]Ley R E, Peterson D A, Gordon A J I Ecological and evolutionary forces shaping microbial diversity in the human intestine [J]. Cell, 2006, 124(4):837.
[39]宋雪琳,李雅梅,肖俊松,等. 葡萄籽原花青素對营养肥胖模型大鼠肠道菌群的影响[J]. 食品科学技术学报, 2015, 33(5):39.
[40]傅颖,梅松,刘冬英,等. 原花青素经肠道微生态途径对脂质代谢的调节[J]. 中国生物制品学杂志, 2013, 26(2):225.
[41]Parkar S G, Trower T M, Stevenson D E Fecal microbial metabolism of polyphenols and its effects on human gut microbiota [J]. Anaerobe, 2013, 23:12.
[42]Lee H C, Jenner A M, Low C S, et al Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota [J]. Res Microbiol, 2006, 157(9):876.
[43]Parkar S G, Stevenson D E, Skinner M A The potential influence of fruit polyphenols on colonic microflora and human gut health [J]. Int J Food Microbiol, 2008, 124(3):295.
[44]龚凌霄,曹文燕,王静,等. 全谷物调节代谢性疾病机制研究的新视角——肠道微生物[J]. 食品工业科技, 2017, 38(2):364.
[45]Donath M Y, Bnischnetzler M, Ellingsgaard H, et al Islet inflammation impairs the pancreatic betacell in type 2 diabetes [J]. Physiology, 2009, 24(6):325.endprint
[46]Amar J, Serino M, Lange C, et al Involvement of tissue bacteria in the onset of diabetes in humans: evidence for a concept [J]. Diabetologia, 2011, 54(12):3055.
[47]肖俊松,王莹,宋雪琳,等. 原花青素对营养肥胖模型大鼠氧化应激的影响[J]. 食品科学, 2014, 35(3):183.
[48]Gonzálezabuín N, Martínezmicaelo N, Blay M, et al Grape seedderived procyanidins decrease dipeptidylpeptidase 4 activity and expression [J]. J Agric Food Chem, 2012, 60(36):9055.
[49]Strat K M, Smithson A T, Tessem J S, et al Mechanisms by which cocoa flavanols improve metabolic syndrome and related disorders [J]. J Nutr Biochem, 2016, 35:1.
[50]郑玲,刘秋爽,金晶,等. 糖尿病并发症治疗靶点的研究进展[J]. 海峡药学, 2014, 26(1):13.
[51]Quesada H, Bas J M D, Pajuelo D, et al Grape seed proanthocyanidins correct dyslipidemia associated with a highfat diet in rats and repress genes controlling lipogenesis and VLDL assembling in liver [J]. Int J Obes, 2009, 33(9):1007.
[52]Serra A Procyanidins target mesenteric adipose tissue in Wistar lean rats and subcutaneous adipose tissue in Zucker obese rat [J].Food Chem, 2013, 141(1):160.
[53]Lee Y A, Cho E J, Yokozawa T Effects of proanthocyanidin preparations on hyperlipidemia and other biomarkers in mouse model of type 2 diabetes [J]. J Agric Food Chem, 2008, 56(17):7781.
[54]Shimada T, Tokuhara D, Tsubata M, et al Flavangenol (pine bark extract) and its major component procyanidin B1 enhance fatty acid oxidation in fatloaded models [J]. Eur J Pharmacol, 2012, 677(677):147.
[55]Baselgaescudero L, Bladé C, Ribaslatre A, et al Grape seed proanthocyanidins repress the hepatic lipid regulators miR33 and miR122 in rats [J]. Mol Nutr Food Res, 2012, 56(11):1636.
[56]杜春陽,姚芳,任韫卓,等. 葡萄籽原花青素对db/db小鼠肾组织脂质沉积的影响[J]. 中国细胞生物学学报, 2017, 39(3):288.
[57]Zhang J, Huang Y Z, Shao H Y, et al Grape seed procyanidin B2 inhibits adipogenesis of 3T3L1 cells by targeting peroxisome proliferatoractivated receptorγ with miR4835p involved mechanism [J]. Biomed Pharmacother, 2017, 86:292.
[58]Caimari A, Bas J M D, Crescenti A, et al Low doses of grape seed procyanidins reduce adiposity and improve the plasma lipid profile in hamsters [J]. Int J Obes, 2013, 37(4):576.
[59]Pinent M, Bladé M C, Salvadó M J, et al Grapeseed derived procyanidins interfere with adipogenesis of 3T3L1 cells at the onset of differentiation [J]. Int J Obes, 2005, 29(8):934.
[60]Caimari A, Crescenti A, Puiggròs F, et al The intake of a highfat diet and grape seed procyanidins induces gene expression changes in peripheral blood mononuclear cells of hamsters: capturing alterations in lipid and cholesterol metabolisms [J]. Genes Nutr, 2015, 10(1):438.endprint
[61]Kolb H, MandrupPoulsen T An immune origin of type 2 diabetes[J]. Diabetologia, 2005, 48(6):1038.
[62]Houstis N, Rosen E D, Lander E S Reactive oxygen species have a causal role in multiple forms of insulin resistance [J]. Nature, 2006, 440(7086):944.
[63]Pajuelo D, Fernándeziglesias A, Díaz S, et al Improvement of mitochondrial function in muscle of genetically obese rats after chronic supplementation with proanthocyanidins [J]. J Agric Food Chem, 2011, 59(15):8491.
[64]Castrillejo V M, Romero M M, Esteve M, et al Antioxidant effects of a grapeseed procyanidin extract and oleoylestrone in obese Zucker rats [J]. Nutrition, 2011, 27(11/12):1172.
[65]Yokozawa T, Kim H J, Cho E J Gravinol ameliorates highfructoseinduced metabolic syndrome through regulation of lipid metabolism and proinflammatory state in rats [J]. J Agric Food Chem, 2008, 56(13):5026.
[66]Terra X, Montagut G, Bustos M, et al Grapeseed procyanidins prevent lowgrade inflammation by modulating cytokine expression in rats fed a highfat diet [J]. J Nutr Biochem, 2009, 20(3):210.
[67]Kanamoto Y, Yamashita Y, Nanba F, et al A black soybean seed coat extract prevents obesity and glucose intolerance by upregulating uncoupling proteins and downregulating inflammatory cytokines in highfat dietfed mice [J]. J Agric Food Chem, 2011, 59(16):8985.
[68]Chacón M R, CeperueloMallafré V, MaymóMasip E, et al Grapeseed procyanidins modulate inflammation on human differentiated adipocytes in vitro [J]. Cytokine, 2009, 47(2):137.
[69]Terra X, Pallarés V, Ardèvol A, et al Modulatory effect of grapeseed procyanidins on local and systemic inflammation in dietinduced obesity rats [J]. J Nutr Biochem, 2011, 22(4):380.
[70]Li R, Liang T, Xu L, et al Protective effect of cinnamon polyphenols against STZdiabetic mice fed highsugar, highfat diet and its underlying mechanism [J]. Food Chem Toxicol, 2013, 51(1):419.
[71]趙艳威,孙静,李玲,等. 黑豆皮花青素对2型糖尿病大鼠氧化应激信号传导通路DAGPKC的影响[J]. 中药药理与临床, 2012(6):27
[责任编辑张宁宁]endprint

