不同栽培措施对党参药材中游离态糖类成分的影响
曹婷婷 刘久石 高石曼 孙恬 覃婕媛 景浩 齐耀东 张本刚 刘海涛 肖培根


[摘要]采用HPLCELSD建立了党参药材中具有“甜味”的3种游离态糖类成分的含量测定方法,为补充和完善党参药材的质量控制提供科学依据。方法学考察结果显示蔗糖、葡萄糖、果糖分别在2312 5~18500 0,1500 0~12000 0, 2000 0~16000 0 μg呈良好的线性关系,平均加样回收率分别为9631%,1004%,1018%。该方法操作简便,稳定可靠,结果准确,适合党参药材中蔗糖、葡萄糖、果糖3种游离态糖类成分的同时检测。应用建立的分析方法对甘肃省岷县党参药材规范化种植基地不同栽培措施种植的党参药材样品进行分析,发现不同栽培措施对党参药材中3种游离态糖类成分具有一定的影响,其中,按照蔗糖含量的高低顺序为:施用壮根灵>不施用壮根灵,不打尖、搭架>不打尖、不搭架>打尖、不搭架>打尖、搭架;按照葡萄糖、果糖含量的高低顺序为:不施用壮根灵>施用壮根灵,打尖、搭架>不打尖、不搭架>不打尖、搭架>打尖、不搭架。因不同游离态糖类成分甜度和含量均具有差异性,因此可考虑将游离态糖类成分的含量作为党参药材的评价指标。
[关键词]党参; 栽培措施; 游离态糖; 含量测定
[Abstract]To provide a scientific evidence for the quality control of Codonopsis Radix, a method was established for determining the content of three free carbohydrates of Codonopsis Radix The developed method showed good linearity The calibration curves were linear within the range of 2312 518500 0 μg for sucrose, 1500 012000 0 μg for glucose, and 2000 016000 0 μg for fructose, resgectwely The recoveries varied between 9631%1018% The method is simple, accurate and reproducible, and can be used for determining the content of sucrose, glucose and fructose of Codonopsis Radix The results showed that different cultivation measures had an effect on the content of three free carbohydrates of Codonopsis Radix According to the content of sucrose, using Zhuanggenling>not using Zhuanggenling While, not pinching, shelving>not pinching, not shelving>pinching, not shelving>pinching, shelving According to the content of glucose and fructose, not using Zhuanggenling>using Zhuanggenling While, pinching, shelving>not pinching, not shelving>not pinching, shelving>pinching, not shelving In consideration of the differences of sweetness and content of the three free carbohydrates in Codonopsis Radix, we recommend that the content of free carbohydrates could be considered as the marker to evaluate the quality of Codonopsis Radix.
[Key words]Codonopsis Radix; cultivation measures; free carbohydrates; quantitative analysis
黨参为桔梗科植物党参Codonopsis pilosula (Franch) Nannf、素花党参C pilosula Nannf var modesta (Nannf) L T Shen或川党参C tangshen Oliv的干燥根,具有健脾益肺,养血生津等功效,主要用于治疗脾肺气虚,食少倦怠,咳嗽虚喘,气血不足等症[1],其化学成分主要有三萜、糖类、甾类、木脂素、倍半萜、黄酮等[23]。现代药理研究表明,党参可以显著提高机体免疫力,具有促进造血机能、清除自由基、增强机体免疫力、延缓衰老、抗肿瘤、调节胃收缩及抗溃疡等多种作用[45]。
自古以来,“味甜者佳”就是鉴别党参药材品质的一项重要感官指标,老药工或老中医常使用这一感官指标对党参药材的品质进行判断,至今仍在使用,但却缺乏相应的科学阐述。《中国药典》(2015年版)中尚未规定党参药材的指标成分,因此,急需找到科学、合理的指标用于评价党参药材的品质。多糖是党参药材发挥免疫调节、增强造血功能的主要活性成分,同时影响着党参药材的口感。目前的研究多采用紫外分光光度法测定总多糖含量作为党参药材品质评价的指标,然而总多糖缺乏专属性特征,限制了这一指标在实际过程中的应用[6]。关于多糖的组成及化学结构等方面的研究相对较少,在多糖的研究中,游离态糖类成分的分析是研究其性质、结构及构效关系的重要内容[713]。因此,以游离态糖类成分为突破口,科学阐述党参药材的“甜味”品质,对于提升党参药材的质量评价具有重要的意义。endprint
目前,游离态糖类成分的检测多采用比色法或HPLCRID法,前者只能测定游离态糖类成分总量,后者采用的RID法灵敏度低,受温度影响大,系统平衡时间长。本研究以Agilent HiPlex Ca为色谱柱,采用HPLCELSD法测定党参药材中蔗糖、葡萄糖、果糖3种游离态糖类成分,基线稳定、分离效果好,重复性好,且以纯水作为流动相,减少了有机溶剂对环境的危害,体现了强大的环保和安全优势,是一种值得推广应用的糖类检测方法。前期在对党参药材主产区的资源调查中发现,施用壮根灵、打尖、搭架等栽培措施会对党参药材的产量及质量产生一定的影响。因此通过测定不同栽培措施的党参药材中3种游离态糖类成分的含量,研究不同栽培措施对党参药材中游离态糖类成分的影响。
1材料
Agilent 1260 高效液相色谱仪(美国),Agilent Technologies 380ELSD蒸发光散射检测器,ChemStation工作站,AL204电子分析天平(METTLER TOLEDO);水浴锅HH8(常州国华电器有限公司);MilliporQ超纯水机(美国Millipore公司)。
蔗糖(中国食品药品检定研究院,纯度>99%,批号111507201303)、D无水葡萄糖(中国食品药品检定研究院,纯度>99%,批号110833201506)、果糖对照品(中国食品药品检定研究院,纯度>99%,批号100231201305),水为超纯水(Millipore,Billerica,MA,USA)。
在甘肃省定西市岷县十里镇十里村党参药材规范化种植基地(34°29′ N,103°57′ E,2340 m),设计施用壮根灵、打尖、搭架等不同栽培措施实验区6个,每个小区设3个重复,每个小区面积66 m2,并设置中间保护行1 m。样品采集于2015年10月,共计18份,样品采集信息见表1,经中国医学科学院药用植物研究所张本刚研究员鉴定为桔梗科植物党参C pilosula,凭证标本保存于中国医学科学院药用植物研究所药用植物资源研究中心。
2方法与结果
21色谱条件Agilent HiPlex Ca(77 mm×300 mm)色谱柱,流动相为超纯水,流速05 mL·min-1,柱温80 ℃。ELSD条件:漂移管温度30 ℃,蒸发管温度60 ℃,载气流速14 L·min-1,增益1。
22对照品溶液精密称取经五氧化二磷干燥过的蔗糖、葡萄糖、果糖对照品适量,精密称定,加水分别制得每1 mL含37,24,32 mg的对照品混合溶液,并將对照品混合溶液稀释2,4,6,8倍保存在4 ℃冰箱中,备用。
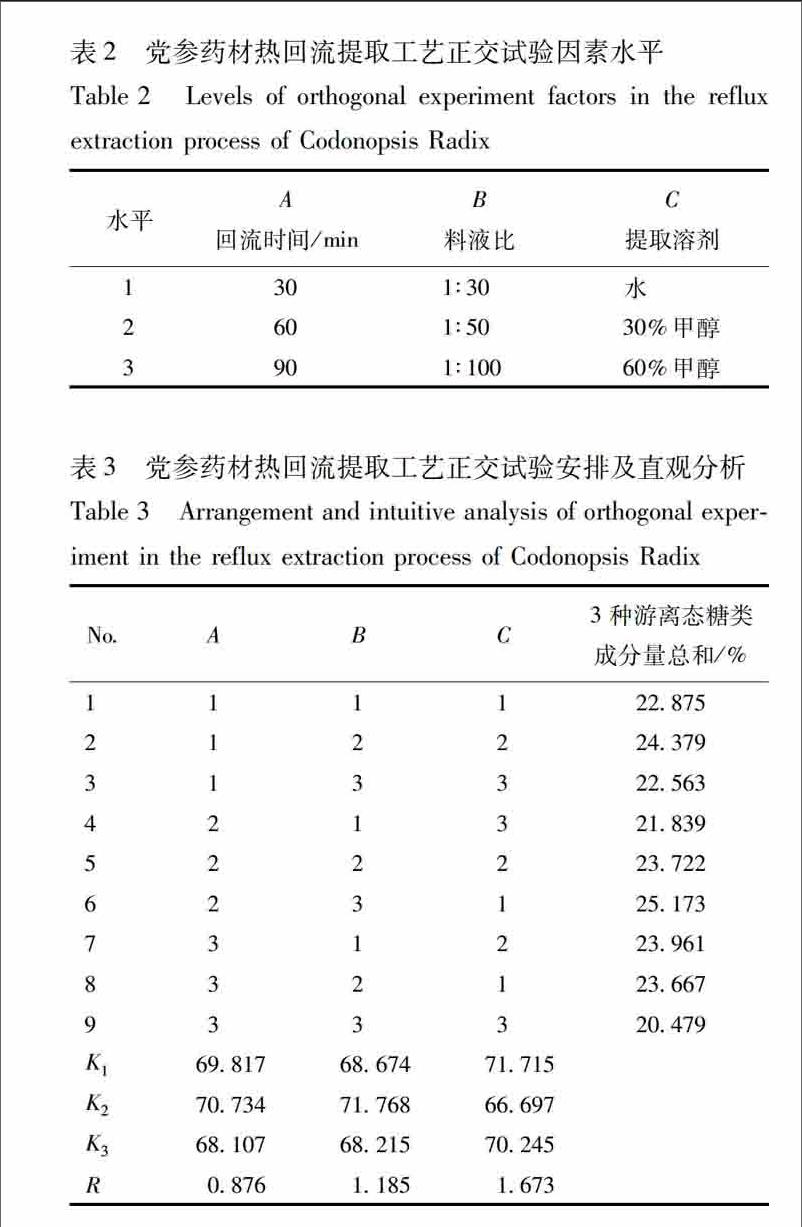
23提取工艺优选在预试验的基础上,选择提取溶剂、料液比、回流时间为考察因素,以游离态糖类成分总提取量为指标,按L9(33)正交表安排试验,确定供试品溶液制备条件。因素水平见表2,试验安排及结果见表3。
以所测得3种游离态糖类成分的含量总和为考察指标,结果显示,对于党参游离态糖类成分总量的提取各因素作用主次为提取溶剂>料液比>回流时间。最终确定党参药材中3种游离态糖类成分最佳提取工艺方案为A2B2C1,即使用纯水作为提取溶剂,料液比为1∶50,加热回流提取1 h。
24供试品溶液制备取党参药材样品粉末(过4号筛)约1 g,精密称定,置于100 mL具塞三角瓶中,精密加入水50 mL,称重,加热回流提取1 h,放冷,再称重,用水补足失重,放冷,摇匀后,经022 μm微孔滤膜滤过,滤液作为供试品溶液。
25线性范围考察及定量限和检测限测定分别精密吸取5种不同浓度的蔗糖、葡萄糖、果糖混合对照品溶液5 μL,按21项色谱条件测定含量,记录色谱峰面积,以峰面积的自然对数值(Y)为纵坐标,以进样量的自然对数值(X)为横坐标,制作线性回归方程,结果见表4,标准游离态糖类成分HPLC图见图1A。用混合对照品溶液逐级稀释,按上述色谱条件进样测定,定量限(S/N=10)和检测限(S/N=3)测定结果见表4。
26精密度试验精密吸取同一份党参药材供试品溶液5 μL,连续进样6次,测得蔗糖、葡萄糖、果糖含量的RSD分别为14%,092%,049%,表明仪器的精密度良好。
27重复性试验取同一份党参药材样品,共取6份,精密称定,分别按照24项方法制备供试品溶液,分别进样5 μL,测得蔗糖、葡萄糖、果糖含量的RSD分别为28%,059%,099%,表明该方法重复性良好。
28稳定性试验取党参药材供试品溶液5 μL,分别在0,4,8,12,24 h各进样1次,进样量为5 μL,测得蔗糖、葡萄糖、果糖含量的RSD分别为29%,18%,15%,结果表明党参药材供试品溶液在室温下24 h内稳定。
29加样回收率试验称取已知含量的党参药材样品粉末1 g,精密称定,共取9份,分别加入高、中、低3种不同质量的蔗糖,葡萄糖,果糖对照品,按照24项方法制备加样回收率供试液,分别进样5 μL,记录峰面积,计算回收率。得蔗糖、葡萄糖、果糖的平均回收率分别为9631%,1004%,1018%。(RSD 012%~050%,RSD 12%~22%,RSD 12%~19%),见表5。
210样品测定取不同产地的党参药材样品1 g,按上述色谱条件24项制备党参药材样品供试品溶液,分别吸取5 μL进样,根据线性回归方程计算党参药材样品中蔗糖、葡萄糖、果糖含量。党参药材样品信息见表1,3种游离态糖类成分含量测定结果见表6,党参药材样品中3种游离态糖类成分HPLC图见图1B。
211数据分析将18份党参药材样品中蔗糖,葡萄糖,果糖的含量数据导入SPSS 21软件进行分析,得到不同栽培措施的党参药材样品中蔗糖,葡萄糖,果糖的含量的均值及变异程度,见图2。方差分析结果表明,不同栽培措施的党参药材样品中蔗糖,葡萄糖,果糖的含量有显著性差异(P<005)。按照endprint
蔗糖含量的高低顺序为:施用壮根灵>不施用壮根灵,不打尖、搭架>不打尖、不搭架>打尖、不搭架>打尖、搭架;按照葡萄糖含量的高低顺序为:不施用壮根灵>施用壮根灵,打尖、搭架>不打尖、不搭架>不打尖、搭架>打尖、不搭架。按照果糖含量的高低顺序为:不施用壮根灵>施用壮根灵,打尖、搭架>不打尖、不搭架>不打尖、搭架>打尖、不搭架。
3讨论
糖类成分作为党参药材的主要活性成分,具有
1不施壮根灵;2施壮根灵;3不打尖、不搭架;4不打尖、搭架; 5 打尖、不搭架;6 打尖、搭架; 不同小写字母表示在α=005水平上具有显著差异。
图2不同栽培措施党参药材样品中3种游离态糖类成分的含量(±s,n=3)
Fig2Content of three free carbohydrates of Codonopsis Radix samples cultivated by different cultivation measures (±s,n=3)
抗衰老,抗肿瘤,促进胃肠消化功能等生理活性,在药品、食品和保健食品开发等方面具有广阔的市场空间。本研究首次采用HPLCELSD法测定了党参药材中3种游离态糖类成分的含量,相比目前测定游离态糖类成分常采用的比色法和HPLCRID法,该方法具有受温度的影响较小,基线不易发生漂移,重复性与可靠性好等优势。
实验比较了Agilent HiPlex Ca,Agilent ZORBAX Carbohydrate和Agilent Zorbax NH23种色谱柱,结果表明Agilent Zorbax NH2和Agilent ZORBAX Carbohydrate穩定性差,固定相易流失,导致蒸发光检测器所检测得到的基线不稳,而Agilent HiPlex Ca色谱柱对党参药材中3种游离态糖类成分的分析效果较好,且基线平稳,满足定量检测的要求。同时Agilent HiPlex Ca(77 mm×300 mm)色谱柱的流动相为纯水,没有有机溶剂的使用,减少了有机试剂对环境的危害,且主要通过调节色谱柱的温度和流速进行游离态糖类成分的分离,操作简便,分离效果良好,准确度较高,适用于党参药材中游离态糖类成分的含量测定。同时,考察了漂移管温度(30,35,40 ℃),雾化器温度(50,60,70 ℃),雾化气体流量(12,14,16 L·min -1)对分离效果的影响,结果表明漂移管温度30 ℃,蒸发管温度60 ℃,载气流速14 L·min -1对党参药材中游离态糖类成分的分离效果较好。
另外,通过正交试验优化了党参药材中游离态糖类成分的提取条件,以3种游离态糖类成分的含量总和为考察指标进行分析,结果表明,各因素的影响排序为提取溶剂>料液比>回流时间。确定最佳提取工艺为纯水作为提取溶剂,料液比为1∶50,加热回流提取1 h。
综上,建立了党参药材中蔗糖、葡萄糖、果糖3种游离态糖类成分的HPLCELSD检测方法,该方法操作简便,稳定可靠,结果准确,为科学、合理地开展党参药材品质评价提供了参考。
应用建立的方法对不同栽培措施党参药材样品中3种游离态糖类成分的含量进行测定,结果发现,不同栽培措施的党参药材样品中蔗糖、葡萄糖、果糖3种游离态糖类成分的含量差异具有显著性,按照蔗糖含量的高低顺序为:施用壮根灵>不施用壮根灵,不打尖、搭架>不打尖、不搭架>打尖、不搭架>打尖、搭架;按照葡萄糖含量的高低顺序为:不施用壮根灵>施用壮根灵,打尖、搭架>不打尖、不搭架>不打尖、搭架>打尖、不搭架。按照果糖含量的高低顺序为:不施用壮根灵>施用壮根灵,打尖、搭架>不打尖、不搭架>不打尖、搭架>打尖、不搭架。由此可见,不同栽培措施对党参药材中葡萄糖和果糖含量的影响具有一致性,对蔗糖含量的影响与前两者不同,有研究表明,在植物发育早期,植物中主要糖类成分是果糖和葡萄糖,在发育后期,主要糖类成分是蔗糖,如在桃果实发育早期,果糖和葡萄糖含量较高,蔗糖含量较低,而在发育后期果糖和葡萄糖含量下降,蔗糖迅速积累[1416],因此,造成不同栽培措施对党参药材中3种游离态糖类成分影响不一致的原因可能是不同栽培措施对党参药材不同发育时期的影响不同,其具体影响机制有待于进一步研究。
另外,由于不同的游离态糖类成分在甜度上存在差异,如果以蔗糖的甜度作为 1,果糖和葡萄糖的甜度则分别为 175 和 075[1718],因此,党参药材在以“甜味”作为衡量其内在品质的标准时,不仅要取决于各离态糖类成分的含量,还取决于各游离态糖类成分的甜度差异,因此可考虑将游离态糖类成分的含量作为党参药材的评价指标。
[参考文献]
[1]中国药典一部 [S]. 2015.
[2]He Qing,Zhu Enyuan, Wang Zhengtao, et al Flavones isolated from Codonopsis xundianensis[J]. Chin Pharm Sci, 2004, 13(3): 212.
[3]孙政华, 邵晶, 郭玫 党参化学成分及药理作用研究进展[J]. 安徽农业科学, 2015, 43(33): 174.
[4]王洁, 邓长泉, 石磊, 等. 党参的现代研究进展[J]. 中国医药指南, 2011, 9(31): 279.
[5]张晓君, 祝晨, 胡黎, 等. 党参多糖对小鼠免疫和造血功能的影响[J]. 中药新药与临床药理, 2003, 14(3): 174.
[6]陈克克, 王喆之 党参多糖的研究进展[J]. 现代生物医学进展, 2007, 7(4): 635.
[7]Kuang H X, Xia Y G, Yang B Y, et al Screening and comparison of the immunosuppressive activities of polysaccharides from the stems of Ephedra sinica Stapf [J]. Carbohydr Polym, 2011, 83(2): 787.endprint
[8]Andersen K E, Bjergegaard C, Mller P, et al High performance capillary electrophoresis with indirect UV detection for determination of αgalactosides in leguminosae and brassicaceae [J]. J Agric Food Chem, 2003, 51 (22): 6391.
[9]Xia Y G, Wang Q H, Liang J, et al Development and application of a rapid and efficient CZE method coupled with correction factors for determination of monosaccharide composition of acidic heteropolysaccharides from Ephedra sinica [J]. Phytochem Anal, 2011, 22(2): 103.
[10]Xu D J, Xia Q, Wang J J, et al Molecular weight andmonosaccharide composition of Astragalus polysaccharides[J]. Molecules, 2008, 13(10): 2408.
[11]徐继华, 刘文英, 屠旦来 吴茱萸多糖的分离和组成研究[J]. 中草药, 2009, 40(4): 573.
[12]Fan Y J, He X J, Zhou S D, et al Composition analysis and antioxidant activity of polysaccharide from Dendrobium denneanum [J]. Int J Biol Macromol, 2009, 45(2): 169.
[13]Yang Y F, Feng J Q, Xu H Y, et al Influence of different extraction and purification methods on astragalus polysaccharides and pharmacological evaluation[J]. Chin Herb Med, 2010, 2(1): 54.
[14]Sandhu S S, Dhillon B S, Randhawa J S Chromatographic estimation of sugars from the components of developing fruits of early and latematuring peach cultivars [J]. J Hortic Sci, 1983, 58(2):197.
[15]Moriguchi T, Ishizawa Y, Sanada T Differences in sugar composition in Prunus persica fruit and the classification by the principal component analysis[J]. Engei Gakkai Zasshi, 1990, 59(2):307.
[16]Robertson J A, Horvat R J, Lyon B G, et al Comparison of quality characteristics of selected yellowand whitefleshed peach cultivars[J]. J Food Sci, 2010, 55(5):1308.
[17]Pangborn R M Relative taste intensities of selected sugars and organic acids [J]. J Food Sci, 2010, 28(6):726.
[18]Doty T E Fructose sweetness: a new dimension [J]. Cereal Food World, 1976,21:62
[責任编辑丁广治]endprint

