活性白土催化乙醇脱水制备乙烯的实验探究
杨玉峰
摘要:针对浓硫酸催化乙醇脱水反应制备乙烯的实验存在副反应多、耗时长等问题,对其反应机理进行分析。通过浓硫酸和分子筛催化乙醇脱水反应两种机理的比较,得出后者制备乙烯可获得较佳的效果。试验以廉价、易得的活性白土-石棉代替分子筛作催化剂催化乙醇脱水制备乙烯。结果表明,方法可行、操作方便、反应速率快、绿色环保、催化剂可循环使用,在适当的实验条件下,乙烯的转化率达93%。
关键词:乙烯制备;固体催化剂;活性白土;高温气相脱水;实验探究
文章编号:1005–6629(2017)10–0066–04 中图分类号:G633.8 文献标识码:B
人教版高中化学第五章第三节[实验5-3]“乙烯制备实验”[1]采用浓硫酸催化乙醇脱水,实验存在碳化现象严重、副反应多、有污染、实验耗时长、实验现象不明显等问题。为此,许多化学工作者提出了改进措施。尹志刚用一定比例的乙醇、浓硫酸溶液,加入大理石[2];张建夫等人采用油浴加热,活性炭作“沸石”,浓硫酸和磷酸混合液作催化剂[3];张斌调整乙醇和浓硫酸的比例,并加入一定量的生石灰[4];任有国等在反应混合物中加入少量的氧化铁和氧化锌的混合物[5]。这些改进虽取得了一定的效果,但仍没有脱离以浓硫酸为基础的催化体系,传统方法的弊端没有被完全消除。彭俊等人采用乙烯利制备乙烯[6],克服了传统方法的弊端,实验现象明显,但所用原料为乙烯利,以乙烯利制备乙烯实验的原理与教材以乙醇脱水的消除反应的机理不相符。我们受工业上分子筛催化乙醇蒸气高温脱水反应的启发[7],依据其原理,经过反复实验,设计了一种适用实验室制备乙烯的可行方案。采用廉价、易得的活性白土-石棉作催化剂,催化乙醇高温气相脱水制备乙烯,装置简单、操作容易、实验效果好。该方法有助于培养学生的实验兴趣、激发学生探索实验的欲望。
1 原理分析
实验室用浓硫酸催化乙醇脱水制备乙烯的反应属β-消除反应,失水反应是按E1历程进行的。反应分两步进行:第一步是羟基质子化,促使羟基离去产生碳正离子。离去基团的碱性越弱越易离去,而羟基具有强碱性,所以不易离去。只有在酸性条件下生成盐,降低碱性,方易离去。第二步是碳正离子脱去一个β-氢原子生成乙烯。其脱水反应机理如下: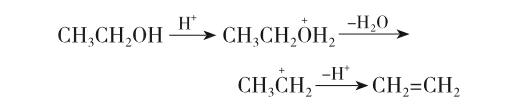
由乙醇在浓硫酸催化下的液相脱水的机理可知:在溶液中碳正离子既可以发生脱去一个β-氢原子生成乙烯的消除反应,又可与溶液中大量的乙醇分子和其他亲核试剂发生亲核取代反应生成副产物。
工业上分子筛催化乙醇蒸气高温脱水反應的部分机理如图1。乙醇以分子形式吸附在固体催化剂上,达到一定的温度后,形成三种可互变的中间产物形式:乙基-甲硅烷基醚、烯碳正离子和通过氢键与催化剂中活性基团-OH结合的乙醇分子(图1)。在这3种形态中,乙基-甲硅烷基醚占多数,并且它能够很快转化为烯碳正离子,然后释放出乙烯[8]。历程中乙醇转化为烯碳正离子后,因周围环境无其他亲核试剂,故烯碳正离子仅发生消除反应生成乙烯,无副反应。消除反应的活化能较高(较亲核取代),反应在较高的温度下(一般在250℃以上)进行,有利于消除反应的进行。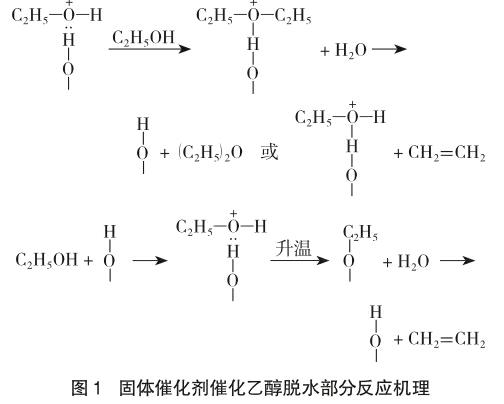
从上述浓硫酸和分子筛催化乙醇脱水制乙烯的反应两种历程,不难看出,分子筛催化乙醇脱水反应具有更高的选择性和转化率。有报道称,在适宜的实验条件下,反应的选择性和转化率都可高达99%[9]。我们联想到工业级活性白土廉价、易得,常用作柴油、煤油、润滑油、润滑脂等石油加工的脱色精炼及化工行业中的催化剂、吸附剂等。于是,以工业级活性白土代替分子筛作催化剂进行乙醇脱水制备乙烯的实验。
2 实验
2.1 仪器及药品
仪器:恒压滴液漏斗、圆底烧瓶、酒精灯、蒸发皿、烧瓶、冷凝管、硬质玻璃管、具支试管、橡胶塞、玻璃丝等
药品:95%乙醇(分析纯)、活性白土(工业级)、石棉绳、1%溴的四氯化碳溶液等
2.2 催化剂的制备
将活性白土放入蒸发皿中,用酒精灯加热,在130~150℃下焙炒半个小时,冷却至室温。将石棉绳剪成小段做载体,放入活性白土中,使活性白土均匀地附着在石棉绳上,即得活性白土-石棉催化剂[10]。
2.3 实验方法
将原料乙醇在气化装置中加热气化,乙醇蒸气进入装有活性白土-石棉催化剂的反应装置中反应,反应后的混合蒸气经冷凝,气液分离,对分离出的气体进行检验和收集。
2.4 实验装置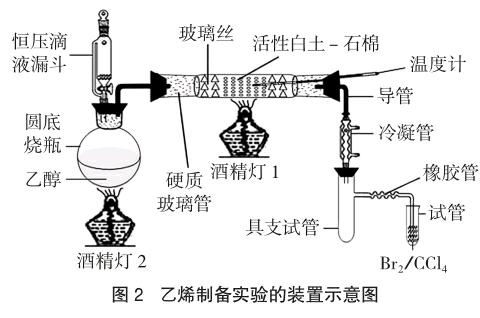
改进后的制备乙烯的实验装置如图2所示,由气化部分、反应部分、分离及检验部分组成。气化部分由恒压滴液漏斗、圆底烧瓶、酒精灯2构成,调节酒精灯2火焰大小与滴加乙醇的速度相匹配,保持圆底烧瓶中乙醇的液面高度不变(实际操作是乙醇沸腾后,调节滴加乙醇的速度到可使乙醇液始终处于微沸状态),则乙醇的滴加速度与气化速度相等。若控制连续、恒定的速度滴加乙醇,就可实现连续、稳定地制备乙烯,同现行工业上的操作相似。若不连续或制备少量乙烯,就可不用恒压滴液漏斗,甚至用试管代替圆底烧瓶;反应部分由酒精灯1、温度计、耐高温的玻璃管构成,玻璃管中放催化剂,用酒精灯1对玻璃管中的催化剂加热,再对经过的乙醇蒸气进行二次加热,加热至约250℃左右,乙醇蒸气在高温、催化下发生脱水反应;分离部分由冷凝管、具支试管构成,从反应室中出来的混合蒸气的成分为:少量的未反应的乙醇蒸气、反应生成的水蒸气及乙烯。经冷凝管冷凝,乙醇和水蒸气凝结成液体进入具支试管,乙烯在常温、常压下为不凝性气体,从具支试管支管导出,用冷凝管冷凝可大大去除乙醇蒸气混入的乙烯;检验部分由玻璃导管及试管组成,内装溴的四氯化碳溶液,因乙烯相对于水在四氯化碳溶液中溶解性更好,故褪色更快。另外,此处也可进行乙烯的收集或做乙烯的燃烧实验等。endprint
2.5 实验步骤及现象
(1)在圆底烧瓶中加入一定量的乙醇,并放入2~3粒沸石,硬质玻璃管中部加入活性白土-石棉催化剂,两端放入玻璃丝。
(2)连接好装置,检查气密性。
(3)点燃酒精灯1,让酒精灯火焰沿整个硬质试管来回移动几次,待整个硬质试管受热均匀后,对准催化剂部位大火加热。
(4)用酒精灯1大火加热催化剂部位2分钟后,点燃酒精灯2,加热圆底烧瓶中的乙醇,使乙醇沸腾、气化,控制乙醇滴加速度,保持微沸状态。
(5)乙醇蒸气进入装有催化剂的硬质玻璃管中,在加热的催化剂的作用下反应。
(6)反应产生的混合蒸气进入冷凝管冷凝,进行气液分离。
(7)气液分离出的气体通入到溴的四氯化碳溶液中,液体则进入到具支试管中。
(8)观察试管中溴的四氯化碳溶液颜色变化及液体流入到具支试管速度大小情况。
2.6 实验结果
实验中冷凝器流出端有少量的液体流入具支试管,单位时间内流入具支试管的液体的量,远低于乙醇气化的量。我们在保持乙醇的气化速度与滴加速度相同的情况下,4分钟滴加4.6克乙醇到气化装置中,而流入到具支试管里液体约2克。具支试管里液体为未反应的乙醇和反应生成的水,依据质量守恒定律产生气体乙烯量应为2.6克,可推算出产生水的量是约1.7克、未反应的乙醇是约0.3克,反应的乙醇量是4.3克,乙醇的转化率达93%以上,说明乙醇绝大部分发生了脱水反应生成了乙烯和水。
2.7 实验的优点
2.7.1 实验耗时短
改进后的实验,乙醇蒸气被二次加热到250℃左右发生脱水反应,脱水反应的温度远高于液相法的170℃,故气相法较液相法反应速度快得多。气相法从实验开始到溴的四氯化碳溶液红棕色褪去,整个过程用时不到5分钟,而传统法则耗时较多。改进后的实验大大缩短了实验时间,节约了课时,可谓快捷、高效。
2.7.2 反应平稳、易控制
改进后的实验只需控制乙醇滴加速度与乙醇气化速度相等,也就控制了经过催化剂反应物的量,从而控制了乙醇脱水的反应速率。若停止加热,就停止了乙醇的气化,也就停止了反应。
2.7.3 乙烯转化率高
改进后的实验方法,避免了传统方法浓硫酸对乙醇的氧化反应以及与消除反应相竞争的亲核取代等副反应,因而,乙醇脱水生成乙烯反应的选择性高。同时,高温气相法反应温度较传统法高,乙醇脱水反应的进行程度更高。传统方法乙烯的转化率约在70%,改进后的实验乙烯的转化率为93%。在原料乙醇一定的情况下,后者得到乙烯的量更多,从而使实验现象更加明显。
2.7.4 催化剂可重复使用
活性白土-石棉催化剂催化乙醇脱水反应,不仅原料常见、廉价易得、无污染、实验的危险程度低、催化剂的选择性强、活性高,而且可以连续多次循环使用。
2.8 实验注意事项
2.8.1 先加热催化剂,再通入乙醇蒸气
实验开始时,应先将固体催化剂加热到反应温度(约在250℃以上),再通入乙醇蒸气,这是改进实验成功与否的关键。若对催化剂加热温度不够或先通入乙醇蒸气,再加热催化剂,易造成乙醇蒸气在催化剂表面凝结成液体,不仅难以发生乙醇的消去反应,而且易造成堵塞,存在安全隐患。
2.8.2 控制乙醇的气化速度
若乙醇的气化速度过快,乙烯的转化率有所降低。这是因为乙醇的气化速度过快,乙醇分子在催化剂表面的停留时间过短,少部分乙醇还来不及被吸附、活化、反应即被带出催化剂层,从而导致转化率降低;若气化速度过慢,会造成反应物在高温催化剂的活性中心上停留时间过长,生成的乙烯可能会进一步发生聚合反应。实验条件下乙醇的气化速度1~2mL/min为宜。
2.8.3 白土的附着量要适宜
活性白土-石棉催化剂是将活性白土均匀地附着在作载体的石棉上,附着率在70%~80%为宜。该催化剂的活性中心是活性白土,石棉绳有透气的作用。石棉绳上附着的活性白土越多,催化剂的量越大,催化的反应物分子越多,生成的产物越多,反应速率越快。但若石棉绳上附着的活性白土太多时,易产生堵塞现象,不利于乙烯气体的逸出,反应便不能顺利进行。
3 小结
实验室以活性白土-石棉作催化剂,催化乙醇高温气相脱水,反应速率快,乙烯的转化率达到93%,选择性高达95%,具有较高的实用性、安全性、可操作性和科学性。本改进实验实现了实验室与工业上制备方法原理的统一,富有鲜明的实验特色。
参考文献:
[1]人民教育出版社化学室.普通高中课程标准实验教科书·化学(必修加选修)(第二册)[M].北京:人民教育出版社, 2006:122.
[2]尹志刚.实验室制备乙烯实验的研究和改进[J].科技信息(学术研究),2008,(9):238~239.
[3]張建夫,张彩文,陈红伟.实验室制备乙烯条件的改进[J].周口师范学院学报,2008,25(2):84~86.
[4]张斌.乙醇脱水制备乙烯实验方法的改进[J].宁波高等专科学校学报,2006,14(2):48~50.
[5]任有良,张国春,陈凤英.乙烯的制备及性质实验的改进[J].商洛学院学报,2011,25(6):34~36.
[6]彭梭,刘廷婷,陈肖宇等.乙烯的实验室制备及性质检验的实验改进[J].化学教育,2016,37(13):50~51.
[7] Schulz J, Bandermann F. Conversion of Ethanol over Zeolite HZSM-5 [J]. Chemical Engineering&Technology,1994,17(3):179~186.
[8][9]张跃,侯廷建,严生虎等. HZSM-5型分子筛催化乙醇溶液脱水制备乙烯的工艺[J].南京工业大学学报,2007,29(3):67~70.
[10]彭清生.用黄土作催化剂改进乙烯的实验室制法[J].湘潭师范学院学报,1990,11(6):95~96.endprint

