不同昼夜节律高血压患者心率减速力检测的临床意义
周丽++王兴德+申淑荣++程培++陈彬+陈忠

[摘要] 目的 探討不同昼夜节律高血压患者心率减速力(DC)改变的临床意义。 方法 选择2014年1月~2016年12月在上海交通大学附属第六人民医院(以下简称“我院”)诊治的原发性高血压患者184例,给予动态血压监测,根据其夜间血压下降率结果分为两组:<10%为非杓型高血压组(NDPH组,118例),≥10%为杓型高血压组(DPH组,66例)。选择我院同期健康体检者50名为对照组。应用24 h Holter检测并比较三组入选者的DC、心率加速力(AC)及心率变异性(HRV)水平,并分析其相关性。 结果 DPH组及NDPH组DC和正常窦性RR间期的标准差(SDNN)值均明显低于对照组,AC值明显高于对照组(均P < 0.01);NDPH组全程相邻正常R-R间期之差的均方根值(RMSSD)、24 h内差值>50 ms的连续正常的R-R间期数所占的百分数(PNN50)值也明显低于对照组(P < 0.05)。同时与DPH组比较,NDPH组DC、SDNN也明显降低,AC明显增高(P < 0.05)。NDPH组患者DC与SDNN、RMSSD呈明显正相关(P < 0.01、P < 0.05),与AC呈明显负相关(P < 0.01)。 结论 不同昼夜节律高血压患者均存在自主神经功能损害,其中NDPH组较DPH组自主神经功能失衡更加明显,在临床工作中不仅要关心高血压患者的血压控制,还应注意其自主神经功能的变化和血压昼夜节律的改变。
[关键词] 自主神经系统;昼夜节律;高血压;心率减速力
[中图分类号] R544.1 [文献标识码] A [文章编号] 1673-7210(2017)10(b)-0061-04
Clinical significance of detection of deceleration capacity of rate in patients with primary hypertension of different circadian rhythm
ZHOU Li WANG Xingde SHEN Shurong CHENG Pei CHEN Bin CHEN Zhong
Department of Cardiology, the Sixth People′s Hospital Affiliated to Shanghai Jiao Tong University, Shanghai 201306, China
[Abstract] Objective To investigate the clinical significance of the changes of deceleration capacity of rate (DC) in patients with primary hypertension of different circadian rhythm. Methods One hundred and eighty-four patients with primary hypertension treated in the Sixth People′s Hospital Affiliated to Shanghai Jiao Tong University (“our hospital” for short) from January 2014 to December 2016 were selected and given ambulatory blood pressure monitoring. According to the descent rate of nighttime blood pressure, they were divided into two groups: the patients with descent rate of <10% were taken as non-dipper pattern hypertension group (NDPH group, 118 cases), the patients with descent rate of ≥10% were taken as dipper pattern hypertension group (DPH group, 66 cases). 50 healthy subjects taken physical examination in our hospital at the same time were taken as control group. 24 h Holter was used to detect and compare the levels of DC, acceleration capacity of rate (AC), heart rate variability (HRV) among the three groups, and their relevance was analyzed. Results The DC and standard deviation of normal sinus RR intervals (SDNN) in NDPH group and DPH group were significantly lower than that of control group, and AC was significantly higher than that of control group (all P < 0.01); the root mean square of standard deviations of differences between adjacent normal RR intervals (RMSSD) and the proportion derived by dividing NN50 by the total number of NN intervals (PNN50) in NDPH group were significantly lower than that of control group (P < 0.05). DC and SDNN in NDPH group were significantly lower than that of DPH group, and AC was significantly higher than that of DPH group (P < 0.05). In NDPH group, DC was significantly positively correlated with SDNN, RMSSD (P < 0.01, P < 0.05) and negatively correlated with AC (P < 0.01). Conclusion The patients with primary hypertension of different circadian rhythm have impaired autonomic nerve function, and its imbalance in NDPH group is more obvious than that in DPH group. In clinical practice, physicians should not only care for the blood pressure control, but also pay attention to the changes of autonomic function and circadian blood pressure rhythm in the diagnosis and treatment of hypertension.endprint
[Key words] Autonomic nervous system; Circadian rhythm; Hypertension; Deceleration capacity of rate
正常生理状态下,人体24 h的血压变化呈明显的昼夜节律,表现为“双峰一谷”节律改变[1-2]。根据夜间血压下降是否超过白天平均血压的10%,可以将高血压患者分为两类:≥10%定义为杓型高血压(dipper pattern hypertension,DPH),而<10%定义为非杓型高血压(non-dipper pattern hypertension,NDPH)[3-6]。有研究表明,NDPH患者可发生更严重的心、脑、肾等靶器官损害和心血管事件[7-8],可能跟迷走神经活动受损和交感神经兴奋有关[9-10]。心率减速力(deceleration capacity of rate,DC)检测能定量评估受检者迷走和交感神经张力的高低,可作为其自主神经功能异常的检测指标[11-12]。本研究旨在观察不同昼夜节律高血压患者心率减速力的变化,探讨其在心脏自主神经功能损害中的作用,为临床诊断和治疗提供帮助。
1 资料与方法
1.1 一般资料
选择2014年1月~2016年12月在上海交通大学附属第六人民医院(以下简称“我院”)诊治的高血压患者184例(男126例,女58例)作为高血压组,均符合中国高血压防治指南修订委员会[13]所制订的高血压诊断标准。排除标准:急性心肌梗死、严重肝肾功能不全、肿瘤患者;心力衰竭以及合并糖尿病、甲状腺功能亢进者;继发性高血压患者;服用可能影响心率变异性(HRV)的药物者;非窦性心律(如心房颤动、心房扑动);心脏起搏器植入患者。根据昼夜节律将高血压组分为DPH组(66例)和NDPH组(118例)。选择我院同期健康体检者50名作为对照组,经心电图、X线胸片、生化检查、葡萄糖耐量试验及超声心动图等,排除高血压等相关疾病,无长期饮酒和吸烟史,年龄39~73岁。本研究经医院伦理委员会批准,且经过入选者知情同意。
1.2 方法
1.2.1 动态血压监测 所有入选者均给予动态血压检查,选择美国伟伦ABPM 6100动态血压监测仪,血压测量采用压力示波震荡法,袖带缚于受试者左上臂,白昼(6:00~22:00)每隔20 min,夜间(22:00~6:00)每隔30 min自动测压1次,并记录24 h所有测量结果。血压昼夜节律计算方法:夜间血压下降率=(白天平均血压-夜间平均血压)/白昼平均血压×100%。正常血压下降10%~20%,呈杓型;如下降<10%,为非杓型。如有效血压监测次数不到应获得次数的80%,则需要隔日重新测量。收缩压与舒张压不一致时,以收缩压为准。
1.2.2 动态心电图检查 入选者1周内均接受DMS Holter检查,然后应用动态心电图分析系统,将数据回放,通过人机对话去除各种干扰和伪差,经分析系统自动计算出DC值和心率加速力(acceleration capacity of rate,AC)值。佩戴者和数据分析者均不了解三组的分组情况。DC和AC的分析方法:将Holter数据经数字化处理系统自动筛选出减速周期和加速周期,并将心率段设定为20个周期,入选比前1个心动周期延长或缩短者的减速或加速点为中心点,进行不同心率段的有序排列,经位相整序后,分别计算对应周期的平均值:①X(0):系所有中心点的RR间期的平均值;②X(1):中心点右侧紧邻的第1个心动周期的平均值;③X(-1):中心点左侧紧邻的第1个心动周期的平均值;④X(-2):中心点左侧相邻的第2个心动周期的平均值。分别计算X(0)、X(1)、X(-1)、X(-2)的均值,并代人公式DC(ms)=[X(0)+X(1)-X(-1)-X(-2)]1/4,得到DC值。用同样的方法和流程筛选出加速周期,代入上述公式可计算出受检者的AC值。
1.2.3 HRV检测 HRV分析选用的时域分析指标为24 h正常窦性RR间期的标准差(SDNN)、全程相邻正常R-R间期之差的均方根值(RMSSD)和24 h内差值>50 ms的连续正常的R-R间期数所占的百分数(PNN50,%),其数值可通过DMS分析软件自动计算获得。
1.2.4 左心室射血分数检测 入选者1周内均接受超声心动图(UCG)检查,采用Philips IE33型彩色多普勒超声心动图诊断仪测量。
1.3 统计学方法
相关数据处理应用IBM SPSS 22.0统计软件进行,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较应用Post hoc检验;分类资料数据的组间比较采用χ2检验;变量间的相关分析采用Spearman分析;以P < 0.05为差异有统计学意义。
2 结果
2.1 三组一般资料比较
三组年龄、性别构成及其他一般临床资料比较差异无统计学意义(P > 0.05),具有可比性。见表1。
2.2 三组自主神经功能相关指标的比较
DPH组及NDPH组DC和SDNN均明显低于对照组,AC值明显高于对照组(均P < 0.01);NDPH组HRV其他时域指标RMSSD、PNN50也明显低于对照组(P < 0.05);同时与DPH组比较,NDPH组DC、SDNN也明显降低,AC明显增高(P < 0.05)。见表2。
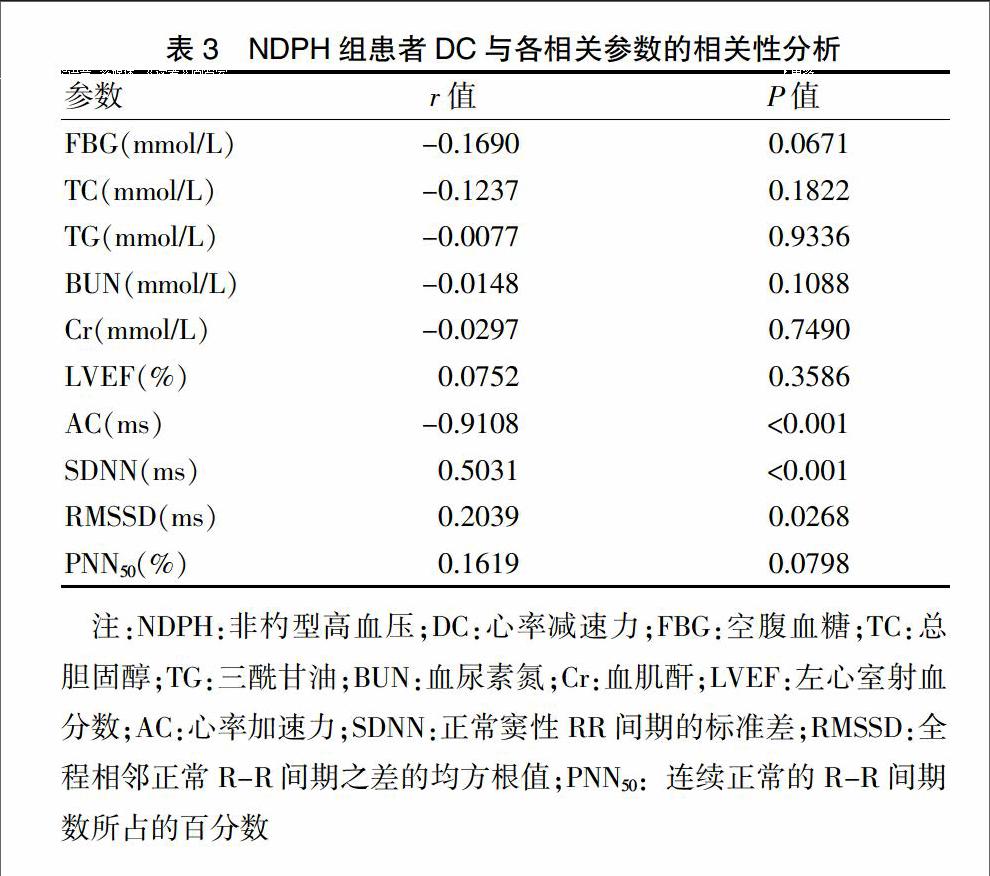
2.3 NDPH组患者DC与各参数的相关性分析
NDPH组患者DC与SDNN、RMSSD呈明显正相关(P < 0.01、P < 0.05),与AC呈明显负相关(P < 0.01)。见表3。
注:NDPH:非杓型高血壓;DC:心率减速力;FBG:空腹血糖;TC:总胆固醇;TG:三酰甘油;BUN:血尿素氮;Cr:血肌酐;LVEF:左心室射血分数;AC:心率加速力;SDNN:正常窦性RR间期的标准差;RMSSD:全程相邻正常R-R间期之差的均方根值;PNN50:连续正常的R-R间期数所占的百分数endprint
3 讨论
自主神经系统在高血压病的发生发展、血压调控及病情评价和估量中具有重要作用和价值[14],血压昼夜节律变化和自主神经功能失调有着非常密切的关系,自主神经特别是交感神经功能紊乱,贯穿于高血压的发生、发展过程中,并影响其预后[15]。而DC和AC检测采用位相整序信号平均技术,通过24 h心率的整体趋向性分析和减速能力的测定,可定量检测受检者迷走和交感神经张力的大小,因而能进一步筛选出猝死高危患者[7],对高血压昼夜节律改变患者有重要临床价值。
本研究结果显示,DPH组及NDPH组DC和SDNN均明显低于对照组,AC值明显高于对照组,说明高血压患者较正常对照组迷走神经张力明显降低,交感神经张力则明显升高,自主神经功能平衡失调,与闫永红等[16]及沈安娜等[17]的研究结果相似。另外,与DPH组比较,NDPH组DC、SDNN也明显降低,AC明显增高,说明昼夜节律消失的高血压患者心脏ANS功能损害较节律正常者更为明显。
目前关于高血压昼夜节律改变患者的生理学和病理学机制尚不完全明了,神经内分泌机制是其最主要的决定因素,其中自主神经系统起着重要调节作用[1]。高血压病患者血液中可出现肾素-血管紧张素系统激活及儿茶酚胺水平升高,去甲肾上腺素、肾上腺素和多巴胺水平增加,使交感神经张力增高,长期高血压也可导致α和β-肾上腺素受体敏感性降低,压力感受器功能受损,迷走神经张力减低;另一方面,交感神经兴奋性随着高血压患者左心室肥厚增加而增加,同时左心室肥厚本身也同夜间血浆醛固酮和胰岛素水平升高密切相关,而后二者则常常与夜间血压升高有关。上述相关因素相互作用导致了自主神经系统功能的紊乱,致使交感和迷走神经功能失衡,加剧了高血压患者昼夜节律的改变。
HRV是指逐次窦性心搏RR间期之間的差异,可评估心脏交感和迷走神经的张力、两者的均衡性及其对心血管系统的影响,是目前自主神经功能无创评估主要方法之一,HRV降低表明患者心脏自主神经功能受损,猝死危险性增加。本研究显示NDPH组患者的SDNN、RMSSD和PNN50均低于对照组,差异有显著性,说明NDPH患者心脏自主神经功能受损明显,与既往研究结果一致[18];另外NDPH组DC值与SDNN、RMSSD呈正相关,这表明DC和过去常用的一些自主神经功能检测指标也有良好的相关性。HRV和DC分别用不同的方法展现心率的变化,DC是否是HRV的另一种变化形式尚需进一步研究。
有研究表明,血压的波动和昼夜节律变化与心血管系统病变有着密切的关系[19],高血压患者随着病情的进展,自主神经功能失调进行性加重,夜间血压下降减少或消失,心率逐渐加快,使心、脑、肾等靶器官的负荷相应增加,损害加重,加速动脉粥样硬化和左心室肥厚形成,而这些靶器官的损害又促使自主神经调节功能进一步减低,二者相互作用,互为因果,血压昼夜节律改变与自主神经功能失调密切相关[20]。高血压患者从杓型血压发展为非杓型血压的过程就是自主神经调节功能进一步衰弱减退的过程,因此,在临床工作中我们不仅要关心高血压患者血压是否达标,还应注意其自主神经功能的变化和血压昼夜节律的改变,尽可能恢复其血压的正常节律,从而减少靶器官的损害。根据不同昼夜节律血压波动的特点,可为采用时间治疗学方法防治高血压提供科学的依据。
[参考文献]
[1] Fabbian F,Smolensky MH,Tiseo R,et al. Dipper and non-dipper blood pressure 24-hour patterns:circadian rhythm-dependent physiologic and pathophysiologic mechanisms [J]. Chronobiol Int,2013,30(1/2):17-30.
[2] Biaggioni I. Circadian clocks,autonomic rhythms,and blood pressure dipping [J]. Hypertension,2008,52(5):797-798.
[3] O'Brien E. Dipping comes of age:The importance of nocturnal blood pressure [J]. Hypertension,2009,53(3):446-447.
[4] Fukutomi M,Matsui Y,Shimada K. Dipper and non- dipper [J]. Nippon Rinsho,2006,64(Suppl 6):33-38.
[5] Salwa P,Gorczyca-Michta I,Kluk M,et al. Variability of circadian blood pressure profile during 24-hour ambulatory blood pressure monitoring in hypertensive patients [J]. Kardiol Pol,2014,72(5):432-437.
[6] 吐尔逊娜依·艾海提.血压变异性进展及展望[J].心血管病防治知识,2014(12):153-154.
[7] Cuspidi C,Meani S,Salerno M,et al. Cardiovascular target organ damage in essential hypertensives with or without reproducible nocturnal fall in blood pressure [J]. J Hypertens,2004,22(2):273-280.
[8] Izzedine H,Launay-Vacher V,Deray G. Abnormal blood pressurecircadian rhythm:a target organ damage? [J]. Int J Cardiol,2006,107(3):343-349.endprint
[9] Dauphinot V,Gosse P,Kossovsky MP,et al. Autonomic nervous system activity is independently associated with the risk of shift in the non-dipper blood pressure pattern [J]. Hypertens Res,2010,33(10):1032-1037.
[10] Sahiner L,Okutucu S,Karakulak UN,et al. Assessment of the relationship between non-dipping phenomenon and heart rate turbulence [J]. Cardiol J,2012,19(2):140-145.
[11] 郭繼鸿.心率减速力检测[J].临床心电学杂志,2009,18(1):59-68.
[12] Wang X,Jiang Z,Chen B,et al. Cardiac autonomic function in patients with acute exacerbation of chronic obstructive pulmonary disease with and without ventricular tachycardia [J]. BMC Pulm Med,2016,16(1):124.
[13] 中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华高血压杂志,2011,19(8):701-743.
[14] Carthy ER. Autonomic dysfunction in essential hypertension:A systematic review [J]. Ann Med Surg(Lond),2013,3(1):2-7.
[15] Mancia G,Grassi G. The autonomic nervous system and hypertension [J]. Circ Res,2014,114(11):1804-1814.
[16] 闫永红,张超,徐俊蛟,等.原发性高血压患者动态脉压与心率减速力的关系[J].心脑血管病防治,2015,15(2):94-95.
[17] 沈安娜,郑德仲,胡兆霆.原发性高血压患者昼夜节律与自主神经功能及心肌能量消耗的相关性[J].南方医科大学学报,2014,34(5):713-717.
[18] 隗希有,陈玉英,张善同,等.杓型与非杓型高血压患者自主神经功能紊乱的比较[J].泰山医学院学报,2001, 22(2):88-91.
[19] 焦坤,冯玉宝,苏平.血压变异性与心血管疾病的研究进展[J].中国循环杂志,2016,31(5):518-520.
[20] Okutucu S,Karakulak UN,Kabakci G. Circadian blood pressure pattern and cardiac autonomic functions:different aspects of same pathophysiology [J]. Anadolu Kardiyol Derg,2011,11(2):168-173.
(收稿日期:2017-06-07 本文编辑:张瑜杰)endprint

