鱼腥草多糖提取工艺及抑菌活性研究
雒江菡,于瑞洪,阎 红
(1.哈尔滨商业大学药学院 细胞与分子生物学研究所,黑龙江 哈尔滨150001;2.黑龙江生物科技职业学院,黑龙江 哈尔滨 150025)
鱼腥草多糖提取工艺及抑菌活性研究
雒江菡1,于瑞洪2,阎 红1
(1.哈尔滨商业大学药学院 细胞与分子生物学研究所,黑龙江 哈尔滨150001;2.黑龙江生物科技职业学院,黑龙江 哈尔滨 150025)
以鱼腥草为原料,采用单因素实验和正交实验优化了鱼腥草多糖的提取工艺,并对其抑菌活性进行了研究。确定最优提取工艺条件为:提取温度80 ℃、料液比1∶40(g∶mL)、提取时间6 h,在此条件下,提取率为9.74%。鱼腥草多糖对大肠杆菌和金黄色葡萄球菌均有明显的抑菌作用,而对枯草芽孢杆菌无明显的抑菌作用。该研究对鱼腥草在食品和药品等方面的进一步开发和应用奠定了基础。
鱼腥草多糖;提取工艺;抑菌活性
鱼腥草(HouttuyniacordataThunb.),又名折耳根、猪鼻孔、颤儿根、臭根草、鱼鳞草等,在我国长江以南的各个地区分布较广,尤其以湖南、贵州、湖北、四川等省居多。鱼腥草活性成分较多,除含有挥发性成分外,还含有酚类物质、黄酮类、生物碱、有机酸和多糖等物质[1]。具有利尿通淋、清热解毒、消肿排脓等作用。鱼腥草是药食两用的植物资源,极具开发潜力,受到人们的广泛关注。多糖是一类重要的具有生物活性的大分子物质,具有抗氧化、抗肿瘤、抗炎、抗病毒、抗辐射、调节免疫力以及降血糖等功效[2]。目前,国内外关于多糖提取工艺的研究较多,但以鱼腥草为原料进行多糖提取的工艺研究甚少。作者以鱼腥草为原料提取鱼腥草多糖,对提取工艺条件进行优化,为进一步开发鱼腥草的药用价值提供理论依据。
1 实验
1.1 材料、试剂与仪器
鱼腥草,北京同仁堂。
葡萄糖(分析纯),天津天力化学试剂有限公司;无水乙醇,天津基准化学试剂有公司;营养琼脂,北京奥博星生物技术有限责任公司。
枯草芽孢杆菌(Bacillussubtilis)、大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus),中科院微生物研究所。
紫外可见分光光度计,北京普析通用仪器有限公司;DZTW型调温电热套,北京永光明医疗仪器有限公司;BSA223S-CW型精密电子分析天平,赛多利斯科学仪器有限公司。
1.2 方法
1.2.1 多糖的提取
准确称取干燥、剪碎的鱼腥草样品2 g,将其置于回流装置中,加入一定量的水,在一定温度下水浴加热提取一定时间;滤去残渣,收集滤液,离心得上清液,浓缩至10 mL,加入浓缩液5倍量的95%乙醇进行醇析;第2 d,除去上清液,将醇析物蒸干得鱼腥草多糖提取物;加入蒸馏水溶解,定容至10 mL,再将多糖水溶液转至离心管中,加入等体积的Sevage试剂混合振荡20 min,离心,取上清液,重复3次;合并得到鱼腥草多糖粗品,定容至100 mL,进行多糖含量测定[3]。
1.2.2 标准曲线的绘制及多糖含量的测定
多糖含量的测定采用苯酚-硫酸比色法[4]。精密称取干燥至恒重的葡萄糖0.010 g,加水定容至100 mL,得到质量浓度为100 μg·mL-1的葡萄糖标准溶液。精确吸取0.00 mL、0.10 mL、0.20 mL、0.30 mL、0.40 mL、0.50 mL标准溶液,分别置于10 mL 具塞比色管中,补加蒸馏水至2 mL,精密加入5%苯酚1 mL,混合均匀后快速加入浓硫酸5 mL,摇匀后置于沸水浴中保温15 min,取出,室温放置15 min,在紫外可见分光光度计的495 nm 波长处,以蒸馏水调零,测定各组的吸光值,并绘制标准曲线。拟合标准曲线回归方程为:A=0.6207x+0.0079(A为吸光值;x为葡萄糖浓度,mg·mL-1),R2=0.9992。
多糖提取率的测定:将鱼腥草多糖粗品利用旋转蒸发仪浓缩,用水定容到100 mL,取1 mL进行含量测定。鱼腥草多糖提取率按下式计算:
式中:c为从标准曲线查得的多糖含量,mg·mL-1;N为稀释倍数;V为多糖样品的测定体积,mL;m为鱼腥草质量,mg。
1.2.3 抑菌实验
采用滤纸片法测定鱼腥草多糖的抑菌活性。将吸水性强的定性滤纸用打孔器制作成直径为6 mm 的圆形滤纸片,高压蒸汽灭菌。将已灭菌的细菌培养基冷却至60 ℃左右,倒平板;凝固后取0.1 mL供试菌进行涂布,将蘸有鱼腥草多糖的滤纸片放在涂布后的平板上,每种菌种做3个平行;然后将带有滤纸片的培养皿正置于37 ℃的恒温箱中培养18~24 h,取出,测量抑菌圈直径,取其平均值[5]。
2 结果与讨论
2.1 单因素实验
2.1.1 提取时间对多糖提取率的影响
在80 ℃下,采用80 mL水对鱼腥草样品进行提取,考察提取时间(3 h、4 h、5 h、6 h、7 h)对多糖提取率的影响,结果如图1所示。

图1 提取时间对多糖提取率的影响Fig.1 The effect of extraction time on thepolysaccharides extraction rate
由图1可知,多糖提取率随提取时间的延长而升高,提取5 h后,多糖提取率上升缓慢。加入提取溶剂水后,水通过渗透作用进入到细胞内部,鱼腥草内部结构变得松软,有利于多糖有效成分的浸出。浸提初期,鱼腥草内有效成分开始浸出,并逐渐形成浓度差,使有效成分浸出量逐渐增多,随着提取时间的延长,浓度差减小并逐渐趋于平衡。因此,水提法鱼腥草多糖提取时间选择5 h。
2.1.2 提取温度对多糖提取率的影响
采用80 mL水对鱼腥草样品提取5 h,考察提取温度(60 ℃、70 ℃、80 ℃、90 ℃、100 ℃)对多糖提取率的影响,结果如图2所示。
由图2可知,随着提取温度的升高,多糖提取率逐渐升高;但当提取温度升高到80 ℃以后,多糖提取率略有降低。这可能是因为,提取温度升高,多糖分子运动能力增强,易于从鱼腥草中转移到浸提液中,但较高的提取温度使多糖分子降解。因此,水提法鱼腥草多糖提取温度选择80 ℃。
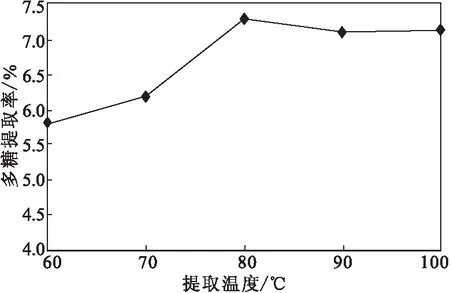
图2 提取温度对多糖提取率的影响Fig.2 The effect of extraction temperature on thepolysaccharides extraction rate
2.1.3 料液比对多糖提取率的影响
在80 ℃下,分别采用20 mL、40 mL、60 mL、80 mL、100 mL水对鱼腥草样品提取5 h,考察料液比(1∶10、1∶20、1∶30、1∶40、1∶50,g∶mL,下同)对多糖提取率的影响,结果如图3所示。
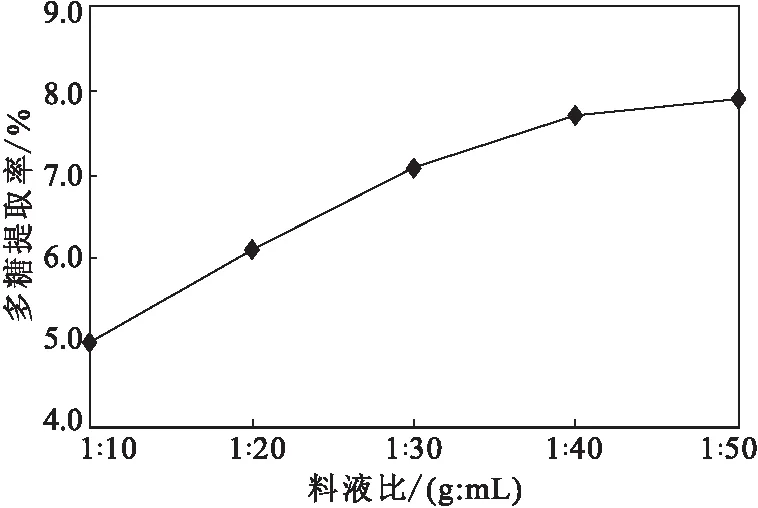
图3 料液比对多糖提取率的影响Fig.3 The effect of solid-liquid ratio on thepolysaccharides extraction rate
由图3可知,多糖提取率随着提取溶剂量的增加逐渐升高。这主要是由于,当提取溶剂量较少时,溶剂中的多糖分子达到饱和,从而抑制鱼腥草中多糖分子的溶出,因此,随着提取溶剂量的增加,多糖提取率升高;当料液比为1∶40后,多糖提取率变化不大,这或许是鱼腥草中多糖成分已基本溶出。另外,提取溶剂不宜过多,因为过多的溶剂增加了提纯和浓缩的工作量。因此,水提法鱼腥草多糖提取的料液比选择1∶40。
通过单因素实验可知,鱼腥草多糖提取最佳工艺条件为:提取时间5 h,提取温度80 ℃,料液比1∶40。
2.2 正交实验
为了进一步优化提取工艺条件,在单因素实验基础上进行L9(33)正交实验。正交实验的因素与水平见表1,结果与分析见表2。
表1正交实验的因素与水平
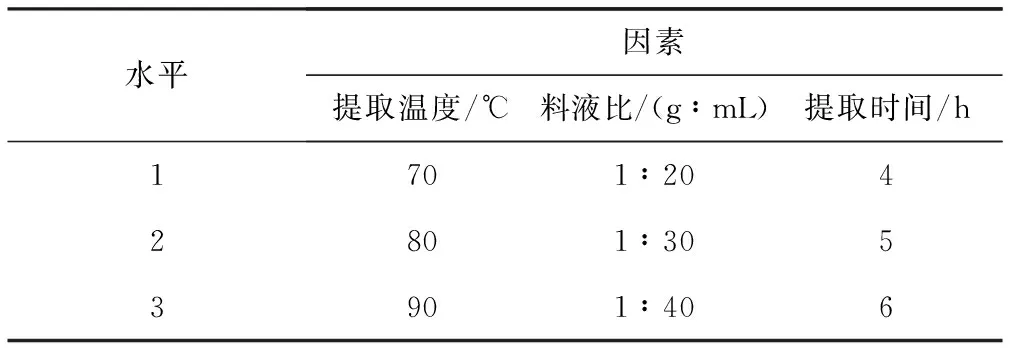
Tab.1Factors and levels of orthogonal experiment
表2正交实验的结果与分析
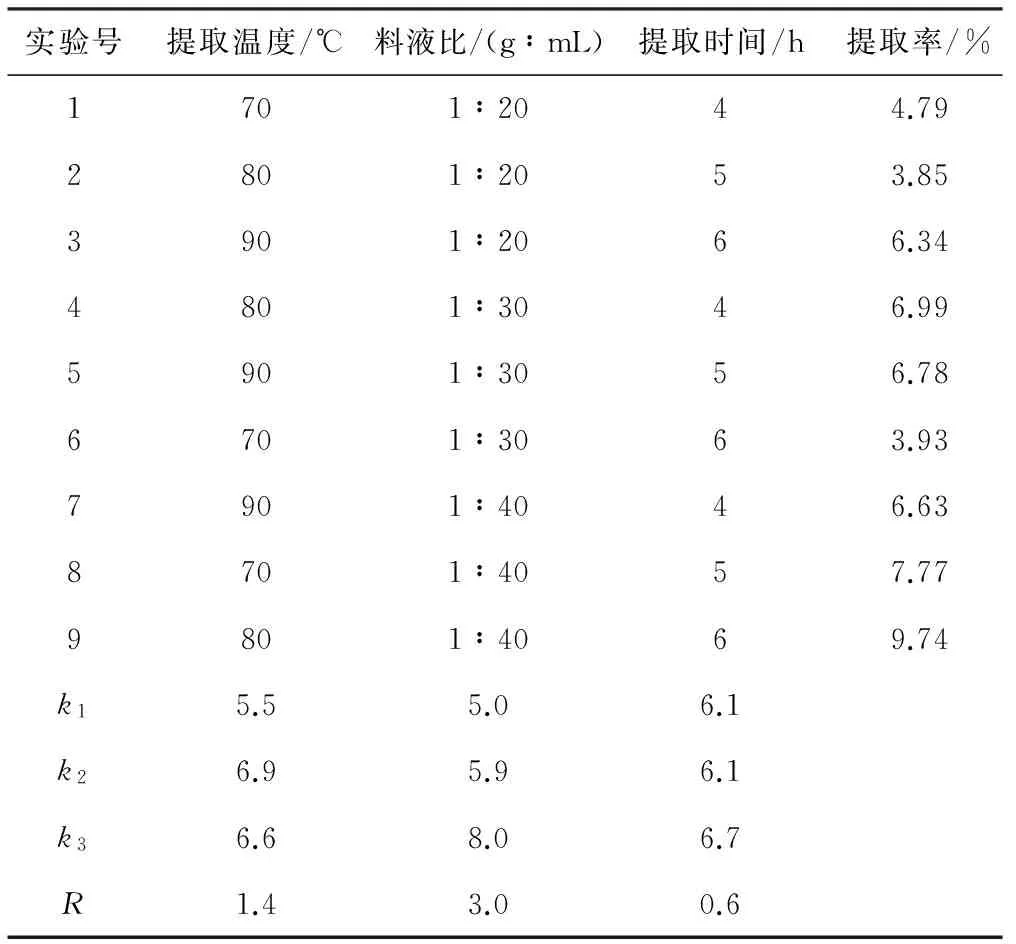
Tab.2Results and analysis of orthogonal experiment
由表2可知,最优水平组合为:提取温度80 ℃、料液比1∶40、提取时间6 h,提取率为9.74%,此时鱼腥草多糖浓度为5.19 mg·mL-1。极差分析结果表明,在3个因素中,影响鱼腥草多糖提取的主次顺序为:料液比gt;提取温度gt;提取时间。其中料液比对鱼腥草多糖提取的影响最大,提取时间的影响最小,优化后的工艺条件跟单因素实验结果相类似。
2.3 抑菌活性研究
采用最佳工艺条件(提取温度80 ℃、料液比1∶40、提取时间6 h)下提取的鱼腥草多糖进行枯草芽孢杆菌、大肠杆菌和金黄色葡萄球菌抑菌活性研究,结果见表3。
由表3可知,鱼腥草多糖对大肠杆菌和金黄色葡萄球菌均有明显的抑菌作用,其中对金黄色葡萄球菌的抑菌作用更强,而对枯草芽孢杆菌抑菌作用并不明显。
表3鱼腥草多糖抑菌效果比较

Tab.3Bacteriostasis comparison ofpolysaccharides from Houttuynia cordata Thunb.
3 结论
以鱼腥草为原料,采用水提法提取鱼腥草多糖。通过单因素实验和正交实验分析可知,影响鱼腥草多糖提取因素的主次顺序为:料液比gt;提取温度gt;提取时间,最优工艺条件为:提取温度80 ℃、料液比1∶40(g∶mL)、提取时间6 h,在此条件下,提取率为9.74%,此时鱼腥草多糖浓度为5.19 mg·mL-1。
鱼腥草多糖对大肠杆菌和金黄色葡萄球菌均有明显的抑菌作用,对金黄色葡萄球菌的抑菌作用更强,而对枯草芽孢杆菌无明显的抑菌作用。鱼腥草中多糖含量较高,并且具有一定的抑菌作用,具有广阔的研发前景。
[1] 伍贤进,李胜华,卢红梅,等.鱼腥草不同部位挥发油组分分析及其抗菌活性研究[J].中国抗生素杂志,2014,39(9):1001-1003.
[2] 苏杰,李娜,惠伯棣,等.鱼腥草作为保健食品原料潜力的概述[J].食品工业科技,2017,38(6):391-396.
[3] 王宏军,蒋红,周铁忠,等.蒽酮-硫酸比色法检测多糖条件的优化[J].中国饲料,2011(4):39-41.
[4] LUO A X,HE X J,ZHOU S D,et al.Purification,composition analysis and antioxidant activity of the polysaccharides fromDendrobiumnobileLindl.[J].Carbohydrate Polymers,2010,79:1014-1019.
[5] NIE S P,XIE M Y.A review on the isolation and structure of tea polysaccharides and their bioactivities[J].Food Hydrocolloids,2011,25:144-149.
ExtractionProcessandBacteriostasisofPolysaccharidesfromHouttuyniacordataThunb.
LUO Jiang-han1,YU Rui-hong2,YAN Hong1
(1.InstituteofCellandMolecularBiology,CollegeofPharmaceuticalSciences,
HarbinUniversityofCommerce,Harbin150001,China;2.HeilongjiangVocationalCollegeofBiologyScienceandTechnology,Harbin150025,China)
UsingHouttuyniacordataThunb. as a raw material,we investigated the extraction process of polysaccharides fromHouttuyniacordataThunb. by a single-factor experiment and an orthogonal experiment,and studied bacteriostasis of polysaccharides.The optimum extraction conditions were determined as follows:extraction temperature was 80 ℃,solid-liquid ratio was 1∶40(g∶mL),and extraction time was 6 h.Under above conditions,the extraction rate was 9.74%.Polysaccharides fromHouttuyniacordataThunb.strongly inhibited the growth ofEscherichiacoliandStaphylococcusaureus,and weakly inhibited the growth ofBacillussubtilis.This study lays the foundation for further development and application ofHouttuyniacordataThunb.in food and drug fields.
polysaccharides fromHouttuyniacordataThunb.;extraction process;bacteriostasis
大学生创新创业训练计划项目(201610240007)
2017-06-20
雒江菡(1980-),女,山东宁津人,博士,讲师,研究方向:中药学,E-mail:649993192@qq.com。
10.3969/j.issn.1672-5425.2017.11.007
雒江菡,于瑞洪,阎红.鱼腥草多糖提取工艺及抑菌活性研究[J].化学与生物工程,2017,34(11):27-29,43.
TQ461
A
1672-5425(2017)11-0027-03

