铜绿微囊藻对轮虫生命表参数和表型特征的影响
梁 叶 欧阳凯 许欢欢 杨家新
(南京师范大学生命科学学院, 南京 210023)
铜绿微囊藻对轮虫生命表参数和表型特征的影响
梁 叶 欧阳凯 许欢欢 杨家新
(南京师范大学生命科学学院, 南京 210023)
为评价铜绿微囊藻的有毒(Microcystin-producingMicrocystis aeruginosa)、无毒(Microcystin-freeM.aeruginosa)品系对轮虫种群增长和表型特征的影响, 研究探讨了萼花臂尾轮虫(Brachionus calyciflorus)在不同微囊藻溶液中的生活史参数及形态变化。实验中各处理组单位体积总含碳量为(20.61±0.15) g C/mL, 以使轮虫获得等碳量的食物供应。实验组轮虫分别用蛋白核小球藻(Chlorella pyrenoidosa)、斜生栅藻(Scenedesmus obliquus)、有毒和无毒微囊藻溶液单独投喂, 并用有毒、无毒蓝藻菌分别与不同绿藻的混合液投喂。生命表实验结果表明, 不同微囊藻混合液投喂的轮虫净生殖率R0(F=102.71,df=32,P<0.001)、世代时间T(F=17.05,df=32,P<0.001)和内禀增长率rm(F=18.89,df=32,P<0.001)与对照组相比降低1.36%—210.34%。侧棘刺长(F=28.18,df=65,P<0.001)和游泳速度(F=181.69,df=65,P<0.001)下降2.63%—39.07%, 轮虫体长(F=690.04,df=65,P<0.001)变化显著。与绿藻投喂的轮虫参数值相比, 轮虫的生命表参数和表型特征变化规律随微囊藻溶液浓度改变。萼花臂尾轮虫受到铜绿微囊藻胁迫时, 生长繁殖受到抑制并通过改变自身形态以抵御不利的生存环境。
铜绿微囊藻; 萼花臂尾轮虫; 净生殖率; 世代时间; 内禀增长率; 表型特征
铜绿微囊藻(Microcystis aeruginosa)是最为常见的水华蓝藻[1]。有毒(Microcystin-producingM.aeruginosa)和无毒微囊藻(Microcystin-freeM. aeruginosa)共存于天然水域生态系统中[2]。有毒微囊藻产生的内源性毒素可引起鱼类、鸟类和无脊椎动物中毒死亡[3]。已有关于蓝藻及其毒素的描述中,铜绿微囊藻产生的微囊藻毒素(Microcystin)对水体环境和浮游动物种群增长的危害备受关注[4]。
轮虫是淡水浮游动物组成的主要类群, 在食物链中起至关重要的作用[5]。臂尾轮虫常被选为水生态毒理学研究的受试动物[6]。部分轮虫的形态在自然水环境中, 随理化因子、捕食者释放的化学信息素、食物组分等的变化而发生变化, 具有表型可塑性[7]。表型可塑性使得轮虫可根据环境的特点调整自身的适应方式, 最大限度地提高自身的适合度[7]。
国内外利用轮虫生活史特征进行毒理学研究的报道较多, 但大多数研究局限在食物种类、丰度和污染因子对轮虫生活史、繁殖策略和休眠卵孵化等方面[8—11]。本文在研究微囊藻对臂尾轮虫生活史特性影响的基础上, 将有毒和无毒铜绿微囊藻分别与不同绿藻混合, 以淡水萼花臂尾轮虫(Brachionus calyciflorus)为受试动物, 研究单一有毒、无毒微囊藻及不同微囊藻混合液对轮虫种群增长参数和表型特征的影响, 以期为臂尾轮虫属的生态毒理学参数研究提供基础数据资料。
1 材料与方法
1.1 轮虫的来源与培养
实验选用美国乔治亚理工学院Snall教授馈赠本实验室克隆培养多年以上的萼花臂尾轮虫品系为实验对象。利用休眠卵刚孵出的幼体作为起始测试动物。轮虫于(25±1)℃的恒温光照培养箱中进行群体培养。光照强度为2500 lx, 周期为12 L∶12 D。轮虫培养基为改良后的EPA (CaSO4·2H2O 60 mg/L;NaHCO396 mg/L; MgSO4·7H2O 123 mg/L; KCl 4 mg/L, pH 7.5), 其配制方法同杨家新[12]。
1.2 藻种来源与培养
实验用绿藻为蛋白核小球藻(Chlorella pyrenoidosaFACHB10)和斜生栅藻(Scenedesmus obliquusFACHB12); 蓝藻为有毒铜绿微囊藻(Microcystin-producingM. aeruginosaPCC7806)和无毒铜绿微囊藻(Microcystin-freeM. aeruginosaFACHB927)。实验藻种由中国科学院水生生物研究所淡水藻种库提供。绿藻培养基为BBM, 蓝藻培养基为BG11[13]。置于(25±1)℃的恒温光照培养箱中进行充气培养。选取进入指数增长期的蓝藻和绿藻进行离心(6000×g, 15min, 4℃)并用EPA稀释到所需浓度(3×106cells/mL)。
1.3 实验设计
食物组分包括: (1)单一藻液[含碳量: (20.61±0.15) μg C/mL]: 100%蛋白核小球藻(C), 100%斜生栅藻(S), 100%有毒铜绿微囊藻(M1), 100%无毒铜绿微囊藻(M2); (2)两种藻的混合液[总含碳量:(20.61±0.15) μg C/mL]: 50%小球藻+50%栅藻(CS),50%小球藻+50%有毒微囊藻(CM1), 50%小球藻+50%无毒微囊藻(CM2), 50%栅藻+50%有毒微囊藻(SM1), 50%栅藻+50%无毒微囊藻(SM2); (3)三种藻的混合液[总含碳量: (20.61±0.15) μg C/mL]:33.3%小球藻+33.3%栅藻+33.3%有毒微囊藻(CSM1), 33.3%小球藻+33.3%栅藻+33.3% 无毒微囊藻(CSM2) (图1)。当配制藻溶液时, 每种藻溶液而非每种藻细胞使用碳平衡原理。实验中各处理组单位体积总含碳量保持为(20.61±0.15) g C/mL, 以使轮虫获得等碳量的食物供应。本实验以单独投喂蛋白核小球藻的轮虫参数值为对照组。
生命表实验将每组10只刚孵出的非混交轮虫幼体(<2h)分别放入6孔板中用藻类溶液投喂。每组设置6个重复实验(n=6)。每隔12h记录存活母体数和新生幼体数并投喂, 同时将新生幼体从培养体系中移除, 每24h更换培养基, 实验至初始投入的轮虫母体全部死亡。轮虫的体长、侧棘刺长于倒置光学显微镜40倍镜下用Cellsens Standard 1.9软件(Olympus Optical Co., Ltd., Tokyo, Japan)拍照后测定。记录10s内轮虫的运动轨迹, 根据轨迹的斜率计算轮虫的游泳速度。
1.4 生命表计算方法
依据生命表实验数据计算萼花臂尾轮虫主要生活史参数[14]:
净生殖率(R0): 种群经过一个世代后的净增长率
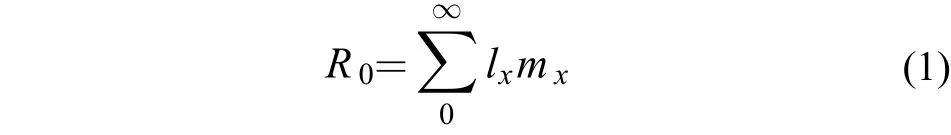
世代时间(T): 亲代出生到子代出生所经历的时间
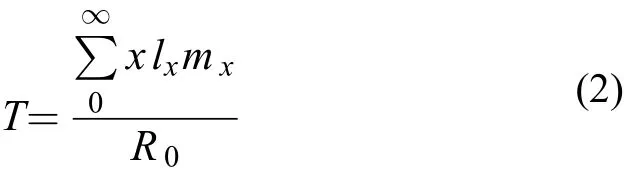

图1 实验流程Fig. 1 Schematic diagram of the experiment
内禀增长率(rm): 种群特定实验条件下的最大增长率
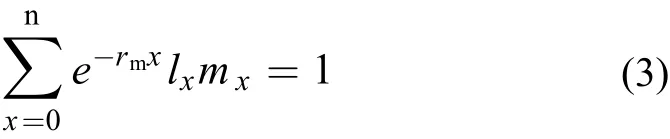
式中:x为轮虫年龄;lx为x年龄组存活个体百分数;mx为x年龄组平均每个雌体所产雌性后代数。
1.5 统计分析
本实验数据经Kolmogorov-Smirnov检测符合正态分布, 各参数值使用数据统计软件SPSS 19.0进行单因子方差分析(One-Way ANOVA), 最小显著差法(LSD)进行比较, 差异显著程度设置为P<0.05。所有处理组之间两两比较的结果用字母标注法标出。生命表各参数图使用绘图软件SigmaPlot 12.5进行制作。
2 结果
2.1 有毒、无毒铜绿微囊藻对萼花臂尾轮虫生命表参数的影响
不同微囊藻溶液中轮虫净生殖率变化由图2可看出, 不同微囊藻混合液投喂时, 轮虫净生殖率(R0)显著下降(F=102.71,df=32,P<0.001)。100%有毒微囊藻溶液(M1)、50%有毒微囊藻混合液(CM1、SM1) 或33.3%有毒微囊藻混合液(CSM1)投喂时, 轮虫不产子代(0<R0<1)。R0值在有毒微囊藻混合液中降低95.8%—98.1%。50%无毒微囊藻与50%栅藻混合液(SM2)投喂的轮虫净生殖率也受到抑制, 轮虫不产子代(0<R0<1); 50%无毒微囊藻与50%小球藻混合液(CM2)投喂的轮虫虽产生子代(R0>1), 但R0值仍低于对照组。33.3%无毒微囊藻混合液(CSM2)投喂的轮虫所产子代数显著多于其余微囊藻处理组和栅藻处理组(P<0.001)。轮虫用100%微囊藻溶液、50%微囊藻混合液或33.3%有毒微囊藻混合液投喂时,R0值均显著低于C, CS,CSM2组(P<0.001)。绿藻的混合液对轮虫净生殖率的影响不显著(P=0.102>0.05), 小球藻与栅藻混合液(CS)投喂的轮虫R0值(12.54±1.24) ind.则接近对照组。
不同微囊藻溶液中轮虫世代时间变化单因子方差分析结果表明微囊藻与不同绿藻混合时,其对轮虫世代时间(T)产生显著影响(F=17.05,df=32,P<0.001) (图3)。微囊藻的加入降低了轮虫的世代时间, 而小球藻和栅藻混合液投喂则可显著延长轮虫的世代时间。与栅藻投喂的轮虫世代时间相比, 50%和100%有毒微囊藻投喂的轮虫世代时间降低, 而33.3%无毒微囊藻投喂的轮虫T值则显著增加。与对照组相比, 轮虫世代时间在M2, SM2组降低27.9%—30.9%。33.3%有毒微囊藻投喂的轮虫世代时间降低15.3% (P=0.04<0.05)。50%有毒微囊藻投喂的轮虫T值则显著降低38.5%—46.2%(P<0.001)。在100%有毒微囊藻溶液中, 轮虫世代时间显著降低54.8%至最小值(40.35±14.49)h(P<0.001), 表明单一有毒微囊藻溶液对萼花臂尾轮虫世代时间的抑制作用最大。
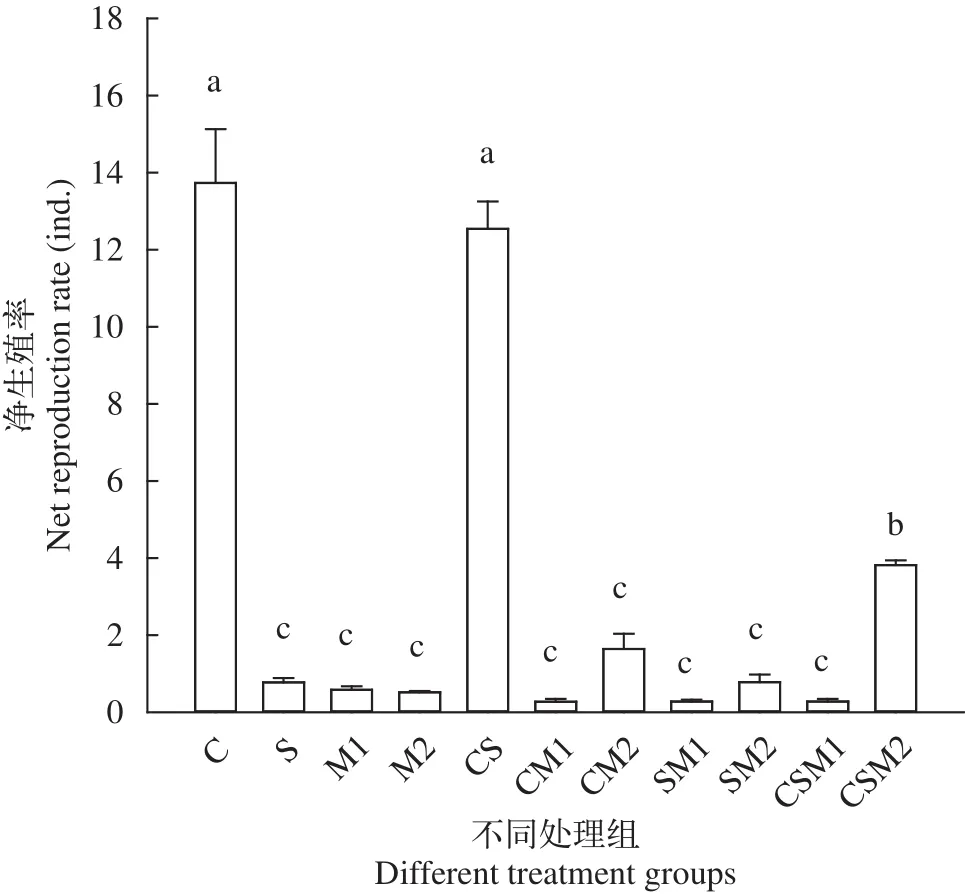
图2 不同处理组中萼花臂尾轮虫净生殖率变化Fig. 2 Changes of net reproduction rate of B. calyciflorus in different treatments

图3 不同处理组中萼花臂尾轮虫世代时间变化Fig. 3 Changes of generation time of B. calyciflorus in different treatments
不同微囊藻溶液中轮虫内禀增长率变化不同微囊藻混合液投喂的轮虫内禀增长率(rm)显著降低(F=18.89,df=32,P<0.001) (图4)。50%有毒微囊藻投喂的轮虫内禀增长率显著低于栅藻处理组的rm值(P<0.001)。33.3%无毒微囊藻投喂的轮虫rm显著高于100%栅藻投喂的参数值(P=0.004<0.01)。与对照组相比, 33.3%无毒微囊藻投喂的轮虫rm值降低48.3% (P=0.03<0.05)。100%微囊藻, 50%微囊藻和33.3%有毒微囊藻投喂的轮虫rm值降低82.8%—182.8% (P<0.001)。rm在M1、M2、CM1、SM1、SM2和CSM1组出现负值(–1<rm<0)。50%有毒微囊藻投喂的轮虫rm值显著降低 162.1%—210.3%。rm最小值(–0.03±0.02/d)出现在CM1处理组。这些结果证实有毒微囊藻对轮虫内禀增长率的负面影响更大, 轮虫种群增长受到抑制。
2.2 有毒、无毒铜绿微囊藻对萼花臂尾轮虫表型特征的影响
表1给出了萼花臂尾轮虫侧棘刺长、体长以及游泳速度数据。不同微囊藻混合液显著影响轮虫的表型特征(F=28.18,df=65,P<0.001)。100%有毒微囊藻溶液可促使轮虫侧棘刺长增加(P=0.01<0.05), 而100%无毒微囊藻溶液、50%微囊藻混合液和33.3%微囊藻混合液则抑制轮虫的棘刺生长(P<0.001)。与栅藻投喂的轮虫侧棘刺长相比,100%或33.3%有毒微囊藻混合液投喂的轮虫侧棘刺长显著增加, 而50%有毒微囊藻混合液投喂的轮虫侧棘刺长则减小。
轮虫体长在不同浓度的微囊藻混合液中变化显著(F=690.04,df=65,P<0.001)。与单一绿藻投喂的轮虫体长相比, 33.3%微囊藻混合液以及50%栅藻与50%微囊藻的混合液对轮虫体长增加有促进作用, 轮虫体长在SM1、SM2、CSM1和CSM2组显著增加(P<0.001)。100%微囊藻溶液以及50%小球藻与50%微囊藻的混合液对轮虫体长则有负面影响, 轮虫体长在M1、M2、CM1和CM2组则显著减少(P<0.001)。
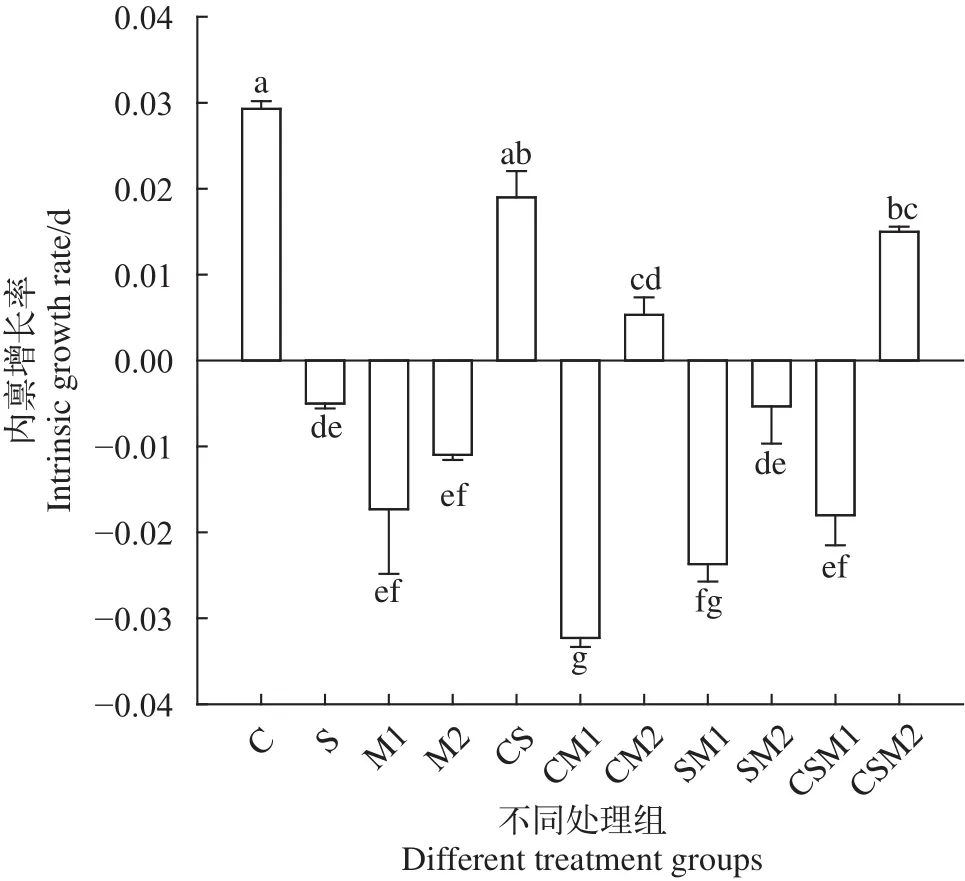
图4 不同处理组中萼花臂尾轮虫内禀增长率变化Fig. 4 Changes of intrinsic growth rate of B. calyciflorus in different treatments
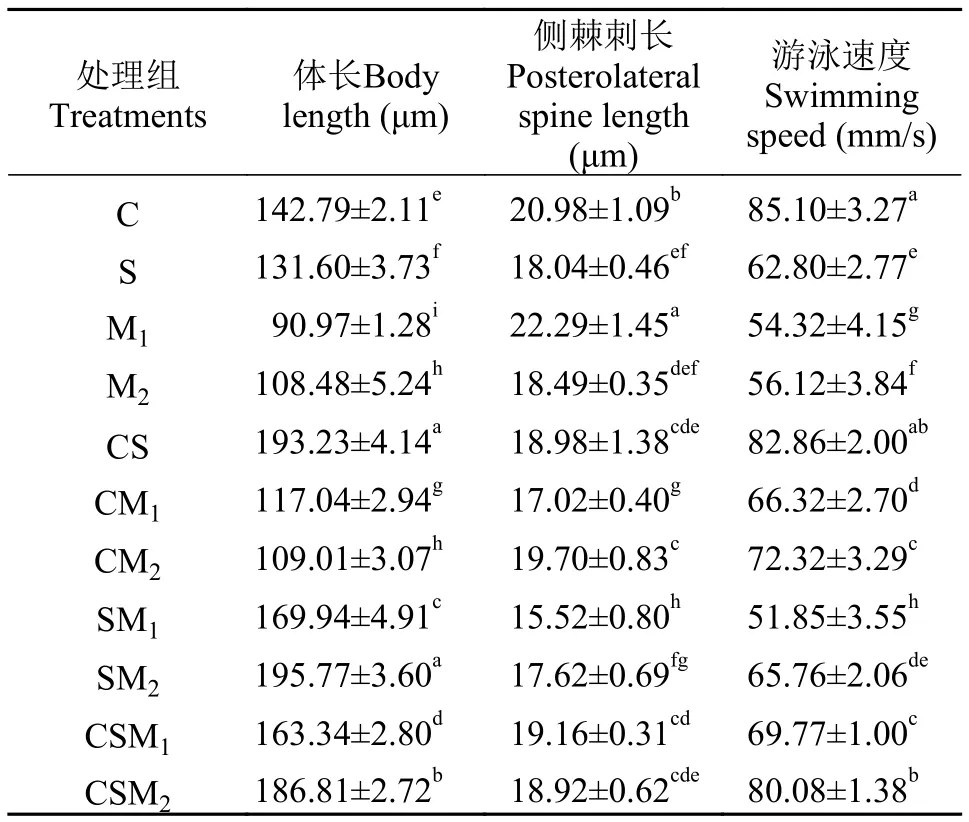
表1 萼花臂尾轮虫体长、侧棘刺长和游泳速度变化Tab. 1 Changes of body length, posterolateral spine length andswimming speed of B. calyciflorus
微囊藻对轮虫游泳速度具有显著负面影响(F=181.69,df=65,P<0.001)。与对照组相比, 轮虫游泳速度在33.3%、50%和100%有毒微囊藻混合液中降低18.0%—39.1%, 而在无毒微囊藻混合液中降低5.9%—22.7%(P<0.001)。与栅藻投喂的轮虫游泳速度相比, 轮虫游泳速度在100%微囊藻溶液以及50%栅藻和50%有毒微囊藻混合液中下降, 而在33.3%微囊藻混合液以及50%小球藻和50%微囊藻的混合液中则显著增加(P<0.001)。
3 讨论
不同微囊藻混合液投喂的萼花臂尾轮虫生命表参数值较低, 种群密度下降。以33.3%、50%和100%浓度的有毒微囊藻投喂的轮虫净生殖率R0,世代时间T和内禀增长率rm均低于小球藻投喂的轮虫参数值, 表明有毒微囊藻含有的微囊藻毒素对轮虫的生长繁殖有负面的影响[3]。无毒微囊藻与栅藻混合液投喂的轮虫净生殖率受到抑制, 轮虫不产子代。轮虫净生殖率下降的原因是栅藻内的有毒物质抑制了轮虫的生长繁殖[15]。此外, 无毒微囊藻缺乏脂肪酸及其他脂类物质, 轮虫因体内缺乏营养而生殖能力下降[16]。33.3%的较低浓度无毒微囊藻混合液投喂比栅藻投喂的轮虫R0、T和rm值大, 证实无毒微囊藻与小球藻和栅藻的混合液对轮虫生长繁殖的影响比栅藻溶液对其影响小。以上结论验证了铜绿微囊藻对轮虫的种群生长不利, 与Liang等[17]发现微囊藻对萼花臂尾轮虫的生活策略和摄食强度有负面影响, 轮虫生命表参数值下降的结论一致。
轮虫用不同浓度的微囊藻溶液投喂时通过改变自身侧棘刺长、体长和游泳速度来抵御不利的生存环境。在微囊藻混合液中, 轮虫侧棘刺长和游泳速度降低而其体长变化规律随溶液浓度改变。50%微囊藻和50%小球藻混合液投喂时, 轮虫体长变短; 33.3%微囊藻或50%微囊藻和50%栅藻混合液投喂时, 轮虫体长增加。在单一微囊藻溶液中,轮虫体长和游泳速度降低而其侧棘刺长变化规律随微囊藻品系改变。100%无毒微囊藻投喂时, 轮虫侧棘刺长变短; 100%有毒微囊藻投喂时, 轮虫侧棘刺长增加。轮虫在单一和混合微囊藻溶液中游泳速度下降的原因是微囊藻毒性物质可抑制轮虫的行为表型。轮虫体长在单一微囊藻溶液中下降证实微囊藻对轮虫生长不利从而体长减短。不同绿藻和微囊藻混合液投喂的轮虫体长变化显著, 表明绿藻对轮虫生长的影响差异较大, 进而使其体长对微囊藻混合液产生不同的响应。轮虫侧棘刺长在微囊藻混合液和单一无毒微囊藻溶液中下降, 表明微囊藻对轮虫的棘刺生长不利。萼花臂尾轮虫在单一有毒微囊藻胁迫下, 其侧棘刺长增加。棘刺的增长将会消耗轮虫自身较多能量, 从而导致用于生殖的能量减少, 二者表现出一种负偶联的关系[18]。这些结果证实臂尾轮虫在受到环境胁迫后会产生防御性的表型[6]。殷旭旺等指出臂尾轮虫遇到捕食压力或环境因素的胁迫时也会通过刺激棘刺的生长来改变自身的表型特征[7]。
铜绿微囊藻对轮虫生命表参数和表型特征的影响与微囊藻的品系有关。实验室培养的微囊藻主要是单细胞或成对的细胞, 这排除了来自微囊藻其他生长形式的干扰[19]。Downing等[20]证实有毒微囊藻PCC7806能产生microcystin-LR。通过高效液相色谱法(HPLC)测定单个有毒微囊藻细胞的microcystin-LR含量为3.6 pg/cell[21]。不同浓度的有毒微囊藻PCC7806被摄食后, 轮虫体内含有microcystin-LR[17]。有毒微囊藻和绿藻的混合液改变了轮虫体长并抑制其棘刺生长和游泳速度。轮虫种群生长会受到其牧食的有毒微囊藻所释放的藻毒素的抑制。Geng和Xie[22]指出微囊藻PCC7820能抑制轮虫的种群生长和繁殖。轮虫牧食无毒微囊藻FACHB927后, 体内缺乏营养物质, 使其生长受到抑制。这一现象验证了无毒微囊藻FACHB927缺乏omega-3脂肪酸及其他对轮虫种群生长十分重要的脂类物质的报道[16,23]。与绿藻溶液投喂的轮虫参数值相比, 有毒或无毒微囊藻混合液使萼花臂尾轮虫的生长繁殖参数和表型特征产生不同的响应。Zhao等[24]发现将有毒微囊藻PCC7806与栅藻混合投喂时, 轮虫种群密度急剧下降, 而将无毒微囊藻FACHB927与栅藻混合投喂时, 轮虫对无毒微囊藻混合液表现出较大的耐受性。
Li等[25]提出随着绿藻浓度的增加, 浮游动物获取的食物中有毒微囊藻所占的比例相对下降, 毒害作用减弱。耿红等[26]认为微囊藻中加入绿藻后, 微囊藻毒素的性质部分被绿藻细胞内的化合物所改变, 从而降低毒性。然而在本研究中, 食物中加入绿藻对微囊藻毒害作用的减弱在萼花臂尾轮虫中并没有明显体现, 表明这种减弱作用随轮虫种类的不同而具有特异性。Geng等[22]也发现用有毒微囊藻PCC7820投喂萼花臂尾轮虫和红臂尾轮虫(Brachionus rubens)后, 两品系轮虫对有毒微囊藻表现出不同的耐受性。
综上所述, 有毒、无毒铜绿微囊藻能显著抑制萼花臂尾轮虫生命表参数。轮虫在不同微囊藻溶液中能产生防御性的表型以响应微囊藻的胁迫。鉴于蓝藻水华暴发时水体中理化因子(如: 温度、pH、盐度等)发生变化, 进而影响轮虫种群的结构[27—28]。研究者认为温度的升高会加剧微囊藻对轮虫种群的抑制作用[29]。温度及其他可食性绿藻对轮虫和微囊藻的相互作用起到协同或拮抗作用, 从而影响食物链中高营养级的其他生物种类[24,29,30]。因此, 深入开展2种及以上环境因子同时作用的研究将进一步揭示铜绿微囊藻和蓝藻混合物对轮虫种群的影响。
[1]Mowe M A D, Mitrovic S M, Lim R P,et al. Tropical cyanobacterial blooms: a review of prevalence, problem taxa, toxins and influencing environmental factors [J].Journal of Limnology, 2015, 74(2): 205—224
[2]Ferrão-Filho A D S, Kozlowsky-Suzuki B. Cyanotoxins:bioaccumulation and effects on aquatic animals [J].Marine Drugs, 2011, 9(12): 2729—2772
[3]Jiang J L, Song R, Ren J H,et al. Advances in pollution of cyanobacterial blooms-producing microcystins and their ecotoxicological effects on aquatic organisms [J].Progress in Chemistry, 2011, 23(1): 246—253 [姜锦林,宋睿, 任静华, 等. 蓝藻水华衍生的微囊藻毒素污染及其对水生生物的生态毒理学研究. 化学进展, 2011,23(1): 246—253]
[4]Singh N K, Dhar D W. Cyanotoxins, related health hazards on animals and their management: a review [J].Indian Journal of Animal Sciences, 2013, 83(11): 1111—1127
[5]Dahms H U, Hagiwara A, Lee J S. Ecotoxicology, ecophysiology, and mechanistic studies with rotifers [J].Aquatic Toxicology, 2011, 101(1): 1—12
[6]Guo R, Snell T, Yang J. Studies of the effect of environmental factors on the rotifer predator-prey system in freshwater [J].Hydrobiologia, 2010, 655(1): 49—60
[7]Yin X W, Zhao W, Bi J H,et al. RotiferAsplanchna brightwelliiinduced morphological plasticity in fourBrachionusrotifer species [J].Journal of Dalian Fisheries University, 2009, 24(6): 493—496 [殷旭旺, 赵文, 毕进红, 等. 卜氏晶囊轮虫对4种臂尾轮虫形态可塑性的影响. 大连海洋大学学报, 2009, 24(6): 493—496]
[8]Moreira R A, Mansano A D S, Rocha O,et al. The use of rotifers as test species in the aquatic effect assessment of pesticides in the tropics [J].Hydrobiologia, 2016, 773(1):1—9
[9]Sulehria A Q K, Abrar J, Shah A H,et al. Effect of algae and other food types on population growth of rotifers [J].Biologia, 2015, 61(2): 263—270
[10]Espinosa-Rodriguez C A, Parra R D L, Sarma S S S,et al.Effect of food density ofPseudokirchneriella subcapitataandChlorella vulgarison the population growth rates of four brachionid rotifers [J].Inland Waters, 2014, 4(3):271—278
[11]Huang L, Xi Y, Xu X,et al. Responses in population growth and reproduction of the freshwater rotiferBrachionus calyciflorusto microcystin-LR at different temperatures [J].Annales de Limnologie - International Journal of Limnology, 2012, 48(4): 383—390
[12]Yang J X, Huang X F. Effects of density and temperature on the egg and mictic female produced byBrachionus calyciflorus[J].Journal of Lake Sciences, 1996, 8(4):367—372 [杨家新, 黄祥飞. 密度和温度对萼花臂尾轮虫产卵量和混交雌体的影响. 湖泊科学, 1996, 8(4):367—372]
[13]Rippka R, Deruelles J, Waterbury J B,et al. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria [J].Journal of General Microbiology,1979, 111(2): 1—61
[14]Krebs C J. Ecology: the experimental analysis of distribution and abundance [J].Research, 1973, 48(1): 133—148
[15]Wagner K H, Siddiqi I. Toxic substances of the microalgeaScenedesmus obliquus[J].Naturwissenschaften,1973, 60(2): 109—110
[16]Elert E V, Wolffrom T. Supplementation of cyanobacterial food with polyunsaturated fatty acids does not improve growth ofDaphnia[J].Limnology and Oceanography, 2001, 46(6): 1552—1558
[17]Liang Y, Ouyang K, Chen X,et al. Life strategy and grazing intensity responses ofBrachionus calyciflorusfed on different concentrations of microcystin-producing and microcystin-freeMicrocystis aeruginosa[J].Scientific Reports, 2017, 7(1): 43127
[18]Gilbert J J, McPeek M A. Maternal age and spine development in a rotifer: ecological implications and evolution ecology [J].Ecology, 2013, 94(10): 2166—2172
[19]Ferrão-Filho A D S, Azevedo S M F O. Effects of unicellular and colonial forms of toxicMicrocystis aeruginosafrom laboratory cultures and natural populations on tropical cladocerans [J].Aquatic Ecology, 2003, 37(1): 23—35
[20]Downing T G, Sember C S, Gehringer M M,et al. Medium N:P ratios and specific growth rate comodulate microcystin and protein content inMicrocystis aeruginosaPCC7806 andM. aeruginosaUV027 [J].Microbial Ecology, 2005, 49(3): 468—473
[21]Shamsollahi H R, Alimohammadi M, Nabizadeh R,et al.Measurement of microcystin-LR in water samples using improved HPLC method [J].Global Journal of Health Science, 2015, 7(2): 66—70
[22]Geng H, Xie P. Experimental studies on the effects of toxicMicrocystis aeruginosaPCC7820 on the survival and reproduction of two freshwater rotifersBrachionus calyciflorusandBrachionus rubens[J].Ecotoxicology,2008, 17(8): 709—715
[23]Xie Q M, Luo H D, Wei S,et al. Effects ofMicrocysisaeruginosaon the population growth ofBrachionus plicatilis[J].Journal of Anhui Agricultural Sciences,2016, 44(35): 11—13 [谢钦铭, 骆和东, 魏施, 等. 铜绿微囊藻对皱褶臂尾轮虫种群生长的影响. 安徽农业科学,2016, 44(35): 11—13]
[24]Zhao S, Wang Y, Li D. Effects of toxic and non-toxicMicrocystis aeruginosain different mixtures withScenedesmus obliquuson growth ofBrachionus calyciflorus[J].Journal of Freshwater Ecology, 2014, 29(3): 377—386
[25]Li F, Deng D, Zhang X,et al. Combined effects of fourMicrocystis aeruginosastrains andScenedesmus obliquusconcentrations on population dynamics and resting egg formation of twoDaphniaspecies [J].Limnology,2014, 15(3): 271—279
[26]Geng H, Meng X, He M. Effect ofMicrocystis aeruginosaon the rotifer life history at different concentrations of green algae [J].Journal of South-Central University for Nationalities(Nat. Sci. Edition), 2016, 35(1):44—49 [耿红, 孟希, 贺萌. 不同绿藻浓度下铜绿微囊藻对轮虫生活史的影响. 中南民族大学学报: 自然科学版,2016, 35(1): 44—49]
[27]Viayeh R M, Mohammadi H, Shafiei A B. Population growth of six IranianBrachionusrotifer strains in response to salinity and food type [J].International Review of Hydrobiology, 2010, 95(6): 461—470
[28]Xu H L, Ma Z H, Guo L,et al. Effects of light, pH and salinity on growth in rotiferBrachionus plicatilis[J].Fisheries Science, 2013, 32(2): 85—88 [徐海龙, 马志华,郭立, 等. 光照、pH及盐度对皱褶臂尾轮虫培养效果的影响. 水产科学, 2013, 32(2): 85—88]
[29]Zhang X, Geng H. Effect ofMicrocystis aeruginosaon the rotiferBrachionus calyciflorusat different temperatures [J].Bulletin of Environmental Contamination and Toxicology, 2012, 88(1): 20—24
[30]Kozlowsky-Suzuki B, Wilson A E, Ferrão-Filho A D S.Biomagnification or biodilution of microcystins in aquatic foodwebs? Meta-analyses of laboratory and field studies [J].Harmful Algae, 2012, 18(6): 47—55
EFFECTS OF MICROCYSTIS AERUGINOSA ON THE LIFE-TABLE PARAMETERS AND PHENOTYPIC TRAITS OF ROTIFERS
LIANG Ye, OUYANG Kai, XU Huan-Huan and YANG Jia-Xin
(Nanjing Normal University, Nanjing 210023, China)
To evaluate the effects of microcystin-producing and microcystin-freeMicrocystis aeruginosaon the population growth and phenotypic traits of rotifers, we discussed the responses of life history parameters and morphology ofBrachionus calyciflorusto differentM. aeruginosasolutions. In order to ensure that rotifers obtained food supply from same carbon content, the total carbon content was maintained at a level of (20.61±0.15) μg C/mL per unit volume in every treatment group. Rotifers were fed onChlorella pyrenoidosa,Scenedesmus obliquus, microcystin-producing and microcystin-freeM. aeruginosa, and mixtures of green algae with toxic and nontoxic cyanobacteria, respectively. Compared with the control group, the life-table experimental results showed that net reproduction rateR0(F=102.71,df=32,P<0.001), generation timeT(F=17.05,df=32,P<0.001) and intrinsic growth raterm(F=18.89,df=32,P<0.001) of rotifers decreased 1.36%—210.34% in the groups fed with differentM. aeruginosamixtures. Posterolateral spine length(F=28.18,df=65,P<0.001) and swimming speed (F=181.69,df=65,P<0.001) ofB.calyciflorusdeclined 2.63%—39.07%, and the rotifer body length (F=690.04,df=65,P<0.001) changed significantly. The life table parameters and phenotypic traits of rotifers changed with concentrations ofMicrocystissolutions compared with those in groups fed with green algae. Under the stress ofM. aeruginosa, the growth and reproduction ofB.calycifloruswere inhibited, and its morphology changed to defend adverse living environment.
Microcystis aeruginosa;Brachionus calyciflorus; Net reproduction rate; Generation time; Intrinsic growth rate; Phenotypic traits
Q178.1
A
1000-3207(2017)06-1362-07
2016-12-22;
2017-04-26
国家自然科学基金(31772458和31272388); 江苏省水产三新工程项目(Y2017-35)资助 [Supported by the National Natural Science Foundation of China (31772458, 31272388); Three Term Project of Aquiculture of Jiangsu Province, China (Y2017-35)]
梁叶(1984—), 女, 江苏淮安人; 博士; 主要从事浮游动物生态学研究。E-mail: liangye_8888@126.com
通信作者: 杨家新(1964—), 男, 河南信阳人; 教授, 博士生导师; 主要从事动物学和浮游动物生态学研究。E-mail: yangjx@njnu.edu.cn
10.7541/2017.168

