自然发酵的葡萄醋中醋酸菌的分离鉴定
孙一帆,梁新红*,高莹莹
(河南科技学院 食品学院,河南 新乡 453003)
自然发酵的葡萄醋中醋酸菌的分离鉴定
孙一帆,梁新红*,高莹莹
(河南科技学院 食品学院,河南 新乡 453003)
为了了解自然发酵葡萄醋中醋酸杆菌的生长特性,采用分离纯化培养、定性试验等方法,从葡萄醋中筛选出优势菌株SP001,通过菌落和细胞形态、生理生化试验以及16S rRNA序列分析等方法对菌株进行鉴定,结果表明,菌株SP001被鉴定为巴氏醋杆菌(Acetobacter pasteurianus),其最大产酸量为2.31 g/100 mL,酒精转化率为73.29%。
醋酸菌;分离纯化;生长特性;鉴定
随着人们生活水平的不断提高,果醋的营养保健功能也越来越受到人们的重视。与食醋相比,果醋的营养成分更为丰富,含有十多种有机酸和人体必需的多种氨基酸、维生素、无机盐、碳水化合物、微量元素等[1],其中果醋发酵菌种是影响果醋品质的关键因素。当前我国用于液体醋生产的醋酸菌菌种主要有AS1.41和沪酿1.01醋酸杆菌,该菌种应用于果醋生产不仅产酸能力低、耐酒精能力有待提高,而且形成的风味也不佳。因此,为了提高果醋产量,改善产品风味,当前的研究工作主要集中于从自然界分离培养高效专一菌种和对现有菌种进行诱变选育。周帼萍等[2]以大米糖化汁培养基为筛选培养基,从市售的醋酸菌粉和武汉锦春调味品厂的醋醅中分离得到了8株产酸快,转化率高的醋酸菌,并以其中的3株试制木瓜果醋取得了良好的效果。陈洋等[3]从工业醋醅中分离出5株耐乙醇、耐高温的产醋酸菌株,利用生理生化试验和16S rDNA同源序列分析,初步认定其为巴氏醋杆菌(Acetobacter pasteurianus),通过对其耐乙醇、耐高温发酵特性的研究,发现菌株FY4具有高耐受性,可产生大量的醋酸,在工业生产中具有潜在应用价值。吴越等[4]从杏皮渣汁自然发酵液、固态发酵醋醅和杏园的土壤中分离醋酸菌,对分离菌株进行产酸曲线的测定及生理生化鉴定,对产酸量高的菌株进行16SrDNA序列测定,在杏皮渣汁自然发酵液中分离得到的菌株Ac02为醋杆菌属(Acetobacter)的Acetobacter pomorumLMG 18848,是一株在杏皮渣醋生产中有应用潜力的醋酸菌。
本试验以自然发酵的葡萄醋为样品,采用分离纯化培养、定性试验等方法,从中筛选出醋酸菌菌种,再通过革兰氏染色、菌种的形态特征、生理生化等特征以及16S rRNA对其进行鉴定[5-7],并测定醋酸菌产酸量、醋酸菌生长曲线,对该菌种的生长特性进行研究,为该菌种今后在生产上的广泛应用打下理论基础。
1 材料与方法
1.1 材料与试剂
自然发酵的葡萄醋:实验室自制;葡萄糖、酵母膏、KH2PO4、MgSO4、无水乙醇、琼脂、蒸馏水、酚酞指示剂、溴甲酚紫、FeCl3、NaOH、结晶紫染色液、碘液、体积分数为95%的乙醇、番红染液、二甲苯、香柏油:天津市科密欧化学试剂开发中心;凝胶回收试剂盒、15 000+2 000 bp DNA Maker:上海生工生物有限公司;细菌基因组DNA提取试剂盒:北京Solarbio公司;pUCm-T载体试剂盒、脱氧核苷三磷酸(deoxyribonucleoside triphosphate,dNTP):宝生物工程(大连)有限公司;10×PCR buffer、TAE buffer、TaqDNA聚合酶:欧瑞卡(北京)科技有限公司。
增殖培养基:1%酵母膏、2%葡萄糖、0.3%K2HPO4、0.2%MgSO4·7H2O,在电炉上加热搅拌至完全溶解后在121℃、0.1 MPa高压灭菌锅中灭菌25 min,待冷却至70℃以下加6%vol的无水乙醇。
平板分离培养基:1%酵母膏、2%葡萄糖、0.3%K2HPO4、0.2%MgSO4·7H2O、2%琼脂,121℃、在电炉上加热搅拌至完全溶解后在121℃、0.1 MPa高压灭菌锅中灭菌25 min,待冷却至70℃以下加3%vol的无水乙醇,pH值自然。
斜面保藏培养基:同分离培养基。
基础发酵培养基:1%酵母膏、2%葡萄糖,pH自然,121℃灭菌25 min,冷却至70℃加入3%vol无水乙醇。
1.2 仪器与设备
SH-250P生化培养箱:上海精宏实验仪器公司;HZP-250全温振荡培养箱:上海精宏实验仪器公司;BS223S电子天平:赛多利斯(上海)贸易有限公司;WFJ7200分光光度计:尤尼柯(上海)仪器有限公司;CX21FS1C生物显微镜:奥林巴斯(广州)工业有限公司;DYY-6C恒流恒压电泳仪:北京市六一仪器厂;D-37520型高速冷冻离心机:德国Sigma公司;HH·W21·600-S电热恒温水温箱:上海跃进医疗器械厂;T-GradientPCR仪:德国Biometra公司;BIO-BEST 140E型凝胶图像分析系统:美国西盟公司。
1.3 实验方法
1.3.1 产酸菌株的筛选
(1)初筛:采用平板涂布分离法[8],取1 mL果醋,制成10-3至10-5稀释度的样品稀释液,分别取0.3 mL稀释液涂布到加有溴甲酚紫指示剂的平板上,每个稀释度制2个平板,在30℃恒温培养箱中倒置培养3 d左右,然后挑取其中菌落长势良好,分布均匀,透明圈大而清晰,且个数适中的1个平板中的全部单菌落进行复筛。
(2)复筛:采用划线分离法进行复筛[9],分别挑1环活化好的初筛菌株转接于分离培养基中,在30℃恒温培养箱中倒置培养3 d左右,然后挑取其中菌落长势良好的菌种接种于斜面固体培养基上进行斜面保存。
(3)产酸定性试验:各挑取1环复筛后的菌株,分别接种于含3%vol乙醇的100 mL基础发酵培养基中,30℃恒温静置培养72h。离心后取5 mL除去菌体的培养液于小烧杯中,用0.1 mol/L NaOH溶液中和至pH 7.0,煮沸后加入5%FeCl3溶液5~6滴,观察现象,如形成红褐色沉淀则为产醋酸细菌[10]。
(4)耐酒精能力测定:将发酵起始酒精度加水稀释,分别调整为2%vol、4%vol、6%vol、8%vol、10%vol,发酵温度设为30℃,接种量10%,培养基pH为自然,发酵时间为10 d,测定醋酸含量。
1.3.2 菌种生长曲线测定
将保存的已鉴定菌株在斜面培养基上活化2次,然后各取1环接种于4个分别装有100 mL增殖培养基的三角瓶中,标号1#~4#,1#瓶作为对照放入冰箱保存。另3个三角瓶置于30℃、100 r/min摇床中培养,用分光光度计在610 nm波长条件下每隔3 h测一次吸光度值,直至浊度不变为止。以细菌菌悬液的吸光度值为纵坐标,培养时间为横坐标,绘制其生长曲线[11]。
1.3.3 产酸量的测定
将菌种连续活化2次后,接种于增值培养基中,于(30±0.5)℃、100 r/min摇床培养8 d,采用碱式滴定法(以醋酸计)[12]。每隔24 h测定一次产酸量。测定其最大产酸量及出现时间,并计算酒精转化率。产酸量、醋酸转化率计算公式如下[13]:
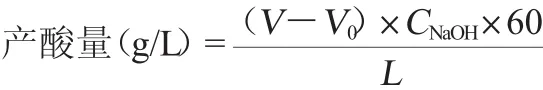
式中:V为NaOH滴定样品的末读数,mL;V0为NaOH滴定样品的初读数,mL;CNaOH为标准NaOH溶液的浓度,mol/L;L为样品体积,mL;60为醋酸相对分子质量。

1.3.4 产酸菌株的形态特征
将复筛得到的产酸最高的一株菌,接种于平板培养基中30℃恒温培养2 d后,观察单菌落形态,取单菌落,涂片并用革兰氏染色法[14]在油镜下观察该菌株菌体形态。
1.3.5 生理生化试验
主要包括乙醇氧化、乙酸氧化、接触酶、乳酸氧化、产葡萄糖酸检验、甘油生酮实验、产纤维素实验等[15-17]。
1.3.6 菌株的分子生物学鉴定
(1)PCR引物
16SrRNA正向引物:5'-AGG AAG CGG AAGAAT G-3'
16SrRNA反向引物:5'-TAGCCT TGCCCT CAA T-3'
(2)醋酸菌活化培养
将保存于-80℃冰箱的实验室前期分离、纯化获得的醋酸菌转接至装有已高压灭菌处理后的液体培养基中(接种量按1∶50进行活化培养)。活化8 h后用,采用划线培养的方式分离单菌落。挑取单菌落转接于高压灭菌的液体培养基中(100 mL三角瓶中含有25 mL液体培养基)进行扩大培养。培养条件为37℃、180 r/min振荡培养18 h。
(3)醋酸菌基因组的提取
取1 mL上述培养好的醋酸菌菌液放入1.5 mL的Eppendorf管中,室温、5 000 r/min条件下离心2 min,弃上清;沉淀用1.0 mL含量为0.85%的NaCl溶液进行重悬,4℃、13000r/min离心5min,弃上清;沉淀物用520μLTE缓冲液进行重悬,向菌液中加入17μL的溶菌酶裂解细菌,裂解条件为:37℃水浴30min;向反应溶液中加蛋白酶K(20 mg/mL)
至终质量浓度为100 ng/mL,充分混匀裂解蛋白,裂解条件为:30℃水浴30 min;加30 μL10%十二烷基硫酸钠(sodium dodecylsulfate,SDS)使蛋白进一步变性,反应条件为:30℃水浴30 min;继续加入100 μL 5 mol/L NaCl溶液,务必充分混匀;加80 μL十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)/NaCl溶液混匀,并继续反应,反应条件为:保持65℃水浴10 min;加等体积的苯酚∶氯仿∶异戊醇(25∶24∶1,V/V)混匀,抽提细菌DNA;4 ℃、13 000 r/min,离心10 min,去除蛋白质等杂质;用移液器缓慢吸取上清液至1.5 mL离心管中,加等体积氯仿∶异戊醇(24∶1)进一步抽提细菌DNA,混匀、离心;用移液器缓慢吸取1.5 mL上清液至新离心管,加0.6倍体积异丙醇混匀,沉淀DNA,反应条件为:室温,静置60 min;离心,弃上清,加500 μL体积分数为70%的乙醇混匀,洗涤DNA;离心、重新悬浮、重复3次,充分洗涤抽提的DNA;洗涤结束后,倒置离心管,干燥DNA沉淀20min;最后,将通过该方法抽提获得的DNA溶于60μL TE缓冲液,-20℃条件下保存备用[18]。
(4)16S rRNA PCR扩增及PCR产物检测
以上述方法制备的醋酸菌菌种基因组DNA为PCR扩增模板,采用总反应体系为50.0 μL的反应体系进行PCR扩增。试验中所采用的PCR反应程序为:先于98℃保持5 min进行预变性,然后于98℃保持10 s使模版变性,然后将温度降到56℃保持15 s使引物与模版充分退火,在72℃保持2 min使引物在模版上延伸,该反应程序循环次数为28次,PCR产物与10℃保存。
PCR反应体系(50 μL):5×Prime STAR Buffer(反应缓冲液)10.0 μL,dNTP Mixture(原料)4.0 μL,上、下游引物各1.0 μL,Primer STAR HS DNA Polymerase(聚合酶)0.5 μL,ddH2O 32.5 μL,基因组DNA 1 μL。将PCR反应体系分成3组,2个为试验组,另一组为阴性对照组(模板用ddH2O替代)。
电泳胶体制备:取200 mg的琼脂糖加入20 mL电泳缓冲液中(1×TAE),利用微波炉加热溶解琼脂糖(要求溶液透明、无颗粒状物),将试验溶液冷却至55℃左右,使用移液器滴加1 μL的EB试剂,充分混匀,并将其倒入制胶板中。等待凝胶凝固,放入电泳槽中,缓冲液液面需高于胶体,检查电泳电极放置情况,加样孔务必位于电泳槽的负极。取5 μL PCR产物与1 μL 6×Loading Buffer上样缓冲液均匀混合,然后用移液器缓慢加入到胶体加样孔中进行电泳分析,电泳条件为:电压220 V,电流300 mA,电泳液为1×TAE,时间为20 min。如果PCR扩增成功,将胶体放入凝胶成像系统后,可获取1 670 bp的条带图像。
(5)16S rRNA基因片段的测序及分析
将获得的PCR产物与pUCm-T载体按照试剂盒说明书上的操作要求就行连接,转化感受态细胞并验证为阳性的重组质粒,通过相关公司进行基因序列片段测序。测序结果数据输入到GenBank数据库中,利用网站中提供的在线BLAST功能组件对本试验测序获得的基因序列与数据库中已经上传的序列进行同源性比较。
2 结果与分析
2.1 菌株筛选结果
2.1.1 产酸醋酸菌初筛结果
从自然发酵的葡萄醋中选取样品,利用平板涂布法,分离得到单菌落醋酸菌菌株,涂布法培养后平板内出现大而清晰的透明圈,随着醋酸菌的生长,醋酸菌产生的酸不断增多,形成的透明圈也不断变大。如图1所示,在相同的时间内,由于产酸量的不同,菌落周围透明圈的大小也有明显的差别。挑取其中菌落长势良好,透明圈大而清晰,菌落分布均匀的菌种继续分离培养。
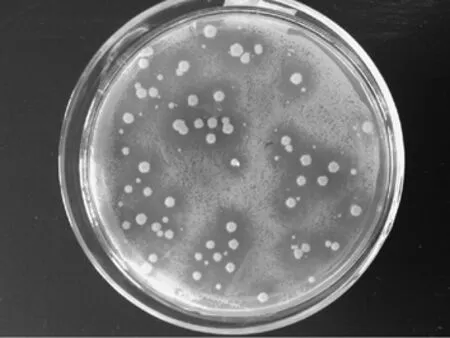
图1 醋酸菌初筛后的透明圈示意图Fig.1 Sketch map of transparent circle of acetic acid bacteria after preliminary screening
2.1.2 产酸醋酸菌复筛结果
采用划线分离法将所挑选的初筛菌种进行转接培养后得到大小一致、长势良好的醋酸菌菌落。该醋酸菌菌落以乳白色为主,呈圆形,突起,表面较光滑,然后挑取其中一株菌落长势良好的菌种做产酸定性实验和镜检,将其命名为SP001。
2.1.3 菌株产酸定性结果
取5 mL除去菌体的发酵液,用0.1 mol/L NaOH溶液中和至中性,煮沸后用5%三氯化铁溶液滴定,部分发酵瓶内的菌液产生砖红色沉淀,说明该发酵液中有醋酸产生,证明此菌株为产醋酸菌株;未出现砖红色沉淀,则说明该发酵液中没有醋酸产生,证明此菌株不产醋酸或活性太低。
2.2 菌株产酸能力测定
将菌株连续活化2次后,接种于增值培养基中,于30℃、100 r/min摇床培养7 d,采用碱式滴定法(以醋酸计)每隔24 h测定一次产酸量,对该菌株的产酸特性进行研究,结果见图2。
由图2可知,醋酸菌SP001产酸量在第7天达到最大,最大产酸量为2.31 g/100 mL,此时酒精转化率为73.29%。
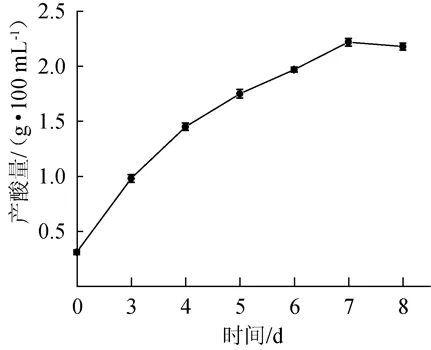
图2 醋酸菌SP001产酸曲线Fig.2 Acid production curve of acetic acid bacteria SP001
2.3 菌株耐酒精能力测定
将发酵起始酒精度分别设定为2%vol、4%vol、6%vol、8%vol、10%vol,发酵温度设为30℃,接种量10%,培养基pH为自然,发酵时间为10 d。结果见图3。
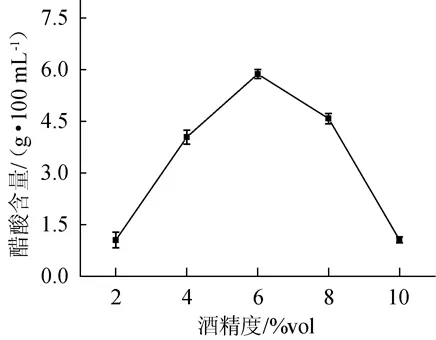
图3 醋酸菌SP001耐酒精能力Fig.3 Ethanol tolerance of acetic acid bacteria SP001
由图3可知,当酒精度为6%vol时,醋酸含量达到最大值为(5.86±0.11)g/100 mL。在酒精度>6%vol时,醋酸含量出现下降趋势,在酒精度为10%vol时,醋酸含量下降至(1.43±0.09)g/100 mL。由此推断,醋酸菌SP001的最佳耐受酒精度为6%vol。
2.4 菌株鉴定结果
2.4.1 形态观察结果
经过筛选得到的醋酸杆菌在琼脂平板上的菌落形态及革兰氏染色结果见图4。
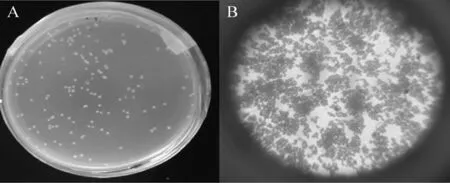
图4 醋酸菌SP001的菌落(A)及细胞(B)形态Fig.4 Morphology of colonial(A)and cell(B)of acetic acid bacteria SP001
由图4A可知,醋酸菌SP001菌落以乳白色为主,呈圆形、突起,表面较光滑,然后挑取其中菌落长势良好的菌株做镜检。由图4B可知,该醋酸杆菌革兰氏染色为阳性,细胞为短杆状或椭圆状,单生或成对或成链生长;同时也可看出该菌种活性较强,显微镜下菌种数目为多不可计。
2.4.2 生理生化试验
对已分离的醋酸菌SP001进行生理生化试验,测定结果见表1。由表1可知,所分离的菌株SP001的乙醇氧化、乙酸氧化及乳酸氧化试验、接触酶、产葡萄糖酸、甘油生酮、产5-酮葡萄糖酸试验结果呈阳性;产纤维素、葡萄糖发酵、氧化酶、淀粉水解、产γ-吡喃酮试验结果呈阴性,符合醋酸菌所具备的生化特征。
2.4.3 分子生物学鉴定
醋酸菌SP001的16S rRNA基因片段的PCR扩增结果见图5。由图5可知,在15000bp处得到了一条清晰且无弥散的条带,说明扩增成功,可以进行16S rRNA基因序列测定。
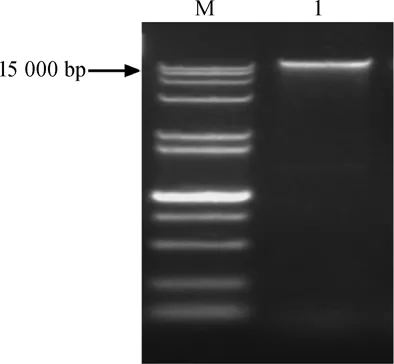
图5 醋酸菌SP001的PCR扩增产物琼脂糖电泳图Fig.5 Agarose electrophoresis of PCR amplification products of acetic acid bacteria SP001

图6 醋酸菌SP001系统发育树Fig.6 Phylogenetic tree of acetic acid bacteria SP001
由图6可知,将扩增产物序列测定后,结果在数据库中利用BLAST软件进行分析[19-21],可以得出分离菌株SP001和NBRC14818是同属菌株。根据鉴定结果,分离醋酸杆菌SP001为巴氏醋杆菌(Acetobacter pasteurianus)。
3 结论
筛选出的醋酸菌确定为革兰氏阳性菌,无芽孢。对其16S rRNA片段克隆与序列分析鉴定及前期对醋酸菌生物学特征的研究结果发现,该菌株与网上公布的醋酸菌菌株NBRC14818有97%的序列同源性,因此可以判断这两种菌是同属菌种属于同一个属,但是因其序列相似性未达到99%以上,且16S rRNA序列种间变化很大,因此极有可能非同一个种,鉴定获得的醋酸菌为巴氏醋杆菌(Acetobacter pasteurianus)SP001,该菌株培养前12 h为延滞期,12~36 h为该菌株的生长对数期。以自然发酵的葡萄醋为样品,经过多次分离纯化,最终筛选出纯化醋酸菌,其醋酸产量为2.31g/100mL,酒精转化率为73.29%。由于试验所采用的样品是自然发酵的果醋,所以筛选出的醋酸菌株产酸能力不高,因此还需进一步诱变育种,以提高发酵中醋酸的产量。
[1]牛蕾,杨幼慧.健康食品——果醋[J].中国酿造,2004,23(2):9-11.
[2]周帼萍,汪芳安,高 冰.醋酸菌筛选培养基的优化和优良醋酸菌分离的研究[J].中国酿造,2004,23(6):20-21.
[3]陈 洋,汪 超,高 冰,等.高耐受性醋酸菌的筛选及发酵特性研究[J].中国酿造,2015,34(12):34-39.
[4]吴 越,张富县,艾乃吐拉·马合木提,等.杏皮渣醋酸发酵醋酸菌的分离筛选和鉴定[J].新疆农业科学,2013,50(7):1297-1303.
[5]TZORTZAKIS N,CHRYSARGYRIS A,SIVAKUMAR D,et al.Vapour or dipping applications of methyl jasmonate,vinegar and sage oil for pepper fruit sanitation towards grey mould[J].Postharvest Biol Tech,2016,118(4):120-127.
[6]ESCALANTE A,RODRÍGUEZ M E,MARTÍNEZ A,et al.Characterization of bacterial diversity in Pulque,a traditional Mexican alcoholic fermented beverage,as determined by 16S rDNA analysis[J].FEMS Microbiol Lett,2004,235(2):273-279.
[7]LOONGSK,KHORCS,JAFARFL,et al.Utilityof16SrDNAsequencing for identification of rare pathogenic bacteria[J].J Clin Lab Anal,2016,30(6):1056-1060.
[8]威 晋,刘凤霞,李永祥,等.高产醋酸菌的分离选育[J].中国酿造,1999,18(5):20-22.
[9]张 赞,梁关霞,席 超,等.优势醋酸菌株QA-9号选育及其初步鉴定[J].中国酿造,2010,29(3):46-48.
[10]宫 强,关道明,王耀兵,等.大肠杆菌总DNA快速提取方法的比较研究[J].海洋环境科学,2005,24(4):63-66.
[11]姜晓芝,李志西.产酸菌株的分离及初步鉴定[J].中国酿造,2008,27(23):53-56.
[12]刘 芸,曹 宜,刘 波.开菲尔粒中醋酸菌的分离鉴定[J].福建农业学报,2012,27(5):544-549.
[13]张忠明.高产醋酸菌的筛选及其形态生化特征研究[J].甘肃农业大学学报,2006,41(1):83-86.
[14]何文兵,刘雪莲,马冬雪.自然发酵的葡萄皮醋中醋酸菌的分离鉴定[J].中国酿造,2012,31(4):79-81.
[15]张纪忠.微生物分类学[M].上海:复旦大学出版社,1990:12.
[16]宋勇强,胡先望,沙 芮,等.一株高产酸醋酸菌的分离与鉴定[J].中国微生态学杂志,2015,27(9):997-1003.
[17]张霁红,李明泽,曾朝珍,等.优势醋酸菌株的筛选鉴定及乙醇脱氢酶活性研究[J].中国酿造,2017,36(5):100-104.
[18]李元召,孙俊良,李冬霄,等.一株产淀粉酶枯草芽孢杆菌16SrDNA的克隆及序列分析[J].河南科技学院学报:自然科学版,2013,41(3):3-4.
[19]苏 波,康建平,黄 静.16S rDNA序列分析鉴定一株芽孢杆菌[J].食品与发酵科技,2010,46(5):1-3.
[20]黄继翔.产碱性蛋白酶芽孢菌株的鉴定[J].微生物通报,2011,38(2):157-163.
[21]陈相达,戴慧慧,刘 燕.一株高产淀粉酶枯草芽孢杆菌的筛选、鉴定及产酶条件的优化[J].温州医学院学报,2011,41(1):40-47.

SUN Yifan,LIANG Xinhong*,GAO Yingying
(School of Food Science,Henan Institute of Science and Technology,Xinxiang 453003,China)
TS26
0254-5071(2017)11-0028-05
10.11882/j.issn.0254-5071.2017.11.007
2017-06-20
国家自然基金面上项目(31771941);河南省高校科技创新团队支持计划项目(16IRTSTHN007)
孙一帆(1989-),女,助教,硕士,研究方向为发酵食品酿造和安全控制。
*通讯作者:梁新红(1971-),女,副教授,博士,研究方向为蛋白质分离纯化、功能性物质和发酵食品酿造和安全控制。

