利用分段函数方法解析元素化合物图象问题
黑龙江 刘成宝
利用分段函数方法解析元素化合物图象问题

分段函数是指对于自变量x的不同的取值范围,有着不同的对应法则。在以元素化合物为背景信息的化学图象问题中,能够充分体现在不同自变量的取值范围内所对应的不同化学反应原理。因此可以借助分段函数的解析方法解决以元素化合物为背景信息的化学图象问题。
一、例题解析
例1把一块镁铝合金投入到1 mol·L-1HCl溶液里,待合金完全溶解后,再往溶液里加入1 mol·L-1NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示。下列说法中错误的是
( )
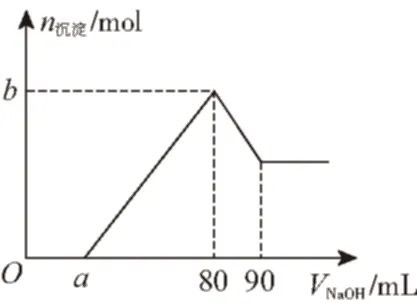
A.盐酸溶液的体积为80 mL
B.a的取值范围为0≤alt;50
C.若a=30时,b值为0.01
D.若a=10时,n(Mg)∶n(Al)=2∶1
解析:由图象和自变量V(NaOH)的变化范围将图象分为0~amL、a~80 mL、80~90 mL、大于90 mL四个阶段,所对应的反应过程分别为:
①0~amL:加入NaOH溶液无沉淀生成,说明和合金反应时盐酸过量,该阶段的反应为H++OH-H2O;
②a~80 mL:NaOH与Mg2+、Al3+反应生成沉淀,Mg2++2OH-Mg(OH)2↓、Al3++3OH-Al(OH)3↓;当加入NaOH溶液80mL时,溶液中的溶质只有NaCl;
③80~90 mL:NaOH与Al(OH)3反应Al(OH)3+OH-AlO-2+H2O;
④V(NaOH)gt;90 mL:NaOH过量。
由原子守恒关系可知n[Al(OH)3]=n(Al3+)=n(Al)=(90-80)×10-3L×1 mol·L-1=0.01 mol,则n(Mg)=[(80-a)×10-3L×1 mol·L-1-0.01 mol×3]/2=(0.025-0.000 5a) mol。则a的取值范围为0≤alt;50;若a=30时,b=n[Al(OH)3]+n[Mg(OH)2]=n(Al)+n(Mg)=0.02;若a=10时,n(Mg)∶n(Al)=2∶1;当加入NaOH溶液80 mL时,溶液中的溶质只有NaCl,由n(HCl)=n(NaCl)=n(NaOH)可计算出盐酸溶液的体积为80 mL。正确答案为C。
例2在200 mL含Mg2+、Al3+、NH+4、H+、Cl-的溶液中,逐滴加入5 mol·L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是
( )
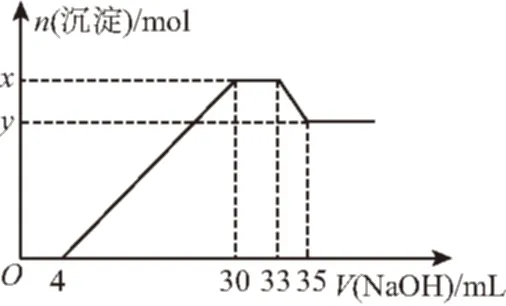
A.x-y=0.01mol
B.原溶液中c(NH+4)=0.75 mol·L-1
C.原溶液中c(Cl-)=0.825 mol·L-1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶1
解析:图象中的四个阶段发生的化学反应及存在的定量关系分别为:
①0~4 mL:H++OH-H2O,n(H+)=4×10-3L×5 mol·L-1=0.02 mol;
②4~30 mL:与Mg2+、Al3+反应生成沉淀,Mg2++2OH-Mg(OH)2↓、Al3++3OH-Al(OH)3↓;
③30~33 mL:沉淀的量未发生变化,为NH+4与OH-的反应,NH+4+OH-NH3·H2O;n(NH+4)=(33-30)×10-3L×5 mol·L-1=0.015 mol,c(NH+4)=0.075 mol·L-1;
④33~35 mL:与Al(OH)3反应,Al(OH)3+OH-AlO-2+H2O,因此n[Al(OH)3]=n(Al3+)=(35-33)×10-3L×5mol·L-1=0.01 mol;则n(Mg2+)=[(30-4)×10-3L×5 mol·L-1-0.01 mol×3]/2=0.05 mol,n(Mg2+)∶n(Al3+)=5∶1;x-y=n[Al(OH)3]=0.01 mol。
由电荷守恒关系可知n(Cl-)=3n(Al3+)+2n(Mg2+)+n(NH+4)+n(H+)=0.165 mol,c(Cl-)=0.825 mol·L-1,正确答案为B。
例3把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有1.16 g白色沉淀析出,向所得的浊液里,逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
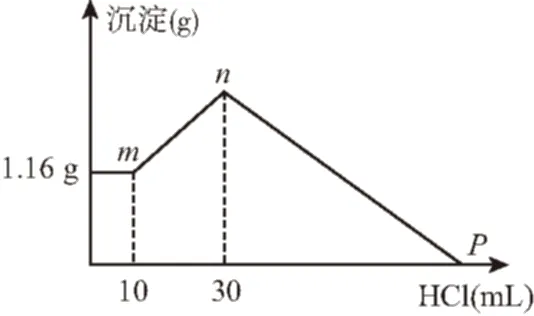
(1)写出m~n段反应的离子方程式:
。
(2)混合物中NaOH的物质的量是________,AlCl3的物质的量是________,MgCl2的物质的量是________,P点所表示的加入盐酸的体积是________mL。
解析:图象中的三个阶段发生的化学反应及存在的定量关系分别为:
①0~10 mL:加入盐酸后沉淀量不变,说明NaOH有剩余,发生的反应为OH-+H+H2O,剩余NaOH的物质的量为n1=10×10-3L×0.5 mol·L-1=0.005 mol,此时AlCl3完全转化为NaAlO2,沉淀为Mg(OH)2,其物质的量为n[Mg(OH)2]=n(MgCl2)=1.16 g58 g/mol=0.02 mol,溶液中NaCl的物质的量为n(NaCl)=3n(AlCl3)+2n(MgCl2);
②10~30 mL:沉淀的量增加,发生的反应为AlO-2+H++H2OAl(OH)3↓,则n(NaAlO2)=n(AlCl3)=(30-10)×10-3L×0.5 mol· L-1=0.01 mol,因此NaCl的物质的量为n(NaCl)=3×0.01 mol+2×0.02 mol=0.07 mol,由Na原子守恒关系可知原混合物中的NaOH的物质的量为n(NaOH)=n1+n(NaCl)+n(NaAlO2)=0.005 mol+0.07 mol+0.01 mol=0.085 mol。
③30 mL~P:沉淀溶解过程,发生的反应为Mg(OH)2+2H+Mg2++2H2O、Al(OH)3+3H+Al3++3H2O,P点时溶液由NaCl、AlCl3、MgCl2三种物质组成。因此加入的盐酸与原混合物中的NaOH的物质的量相等,均为 0.085 mol,P点时所加盐酸溶液的体积为170 mL。
二、方法总结
化学图象在数学图象的基础上融入了化学信息,解题时需将图象信息与化学知识进行有效整合。首先将图象的整体变化、分段变化及图象中特殊点(起点、拐点、最高点、最低点、终点)与物质的性质相结合,对反应过程进行全面细致的定性分析,明确在不同自变量的取值范围内所对应的化学反应,然后再进行定量计算。即先进行定性分析而后进行定量计算。
1.对图象的整体变化及分段变化进行分析,明确反应过程
图象中纵轴量变的实质是横轴内不同变量范围内所对应的不同化学反应,并且是物质反应顺序的体现。结合物质的性质和图象的整体变化、分段变化情况,明确图象变化过程中物质的反应顺序。
如例2中,通过图象中沉淀量在四个阶段的由无到有、增大、不变、减小的变化情况可知,加入NaOH后与NaOH反应的先后顺序依次为:H+→Mg2+、Al3+→NH+4→Al(OH)3,其过程表示如下:
Mg2+
Al3+
NH+4
H+NaOHMg2+
Al3+
NH+4
H2ONaOHMg(OH)2↓
Al(OH)3↓
NH+4
H2ONaOHMg(OH)2↓
Al(OH)3↓
NH3·H2O
H2ONaOHMg(OH)2↓
NaAlO2
NH3·H2O
H2O
又如例3的图象中,加入盐酸后,沉淀的量先不变而后增加,且导致沉淀量增加的反应只有AlO-2+H++H2OAl(OH)3↓,说明NaOH、AlCl3、MgCl2加水混合后,NaOH有剩余,AlCl3完全转化为NaAlO2,沉淀中只有 Mg(OH)2。由图象变化可知,加入盐酸后反应的先后顺序依次为:NaOH→NaAlO2→Mg(OH)2、Al(OH)3,其反应过程表示如下:
MgCl2
AlCl3
NaOHH2OMg(OH)2↓
NaAlO2
NaOH
NaClHClMg(OH)2↓
NaAlO2
NaClHClMg(OH)2↓
Al(OH)3↓
NaClHClMgCl2
AlCl3
NaCl
2.突破特殊点分析,运用守恒关系解题
分段函数图象中的特殊点在纵轴上体现的是量的多少,在横轴上则是某一物质反应的开始或某一物质恰好完全反应的体现。通过横轴每一分段的变化量计算某种物质的量的多少的同时,还要考虑特殊点时所对应的溶液或沉淀的变化情况,然后利用原子守恒、电荷守恒、电子守恒关系进行判断或计算,从而简化计算过程,提高解题效率。
如例1中,当加入的NaOH溶液为80 mL,沉淀量达到最大值,此时溶液中的溶质只有NaCl,由原子守恒关系可知n(HCl)=n(NaCl)=n(NaOH),从而计算出所加盐酸的体积为80 mL。

黑龙江省宾县第一中学)

