盐酸恩诺沙星对杂交鲟幼鱼肝脏抗氧化酶活性的影响
熊铧龙,蒋左玉,张儒学,冯亚楠,姚俊杰,梁 琍
( 1.贵州省瓮安县农村工作局,贵州 瓮安 550400; 2.北京好未来教育摩比事业部,北京 100000;3.贵州大学 动物科学学院 水产科学系,贵州 贵阳 550025;4.铜仁学院 生物与农林工程学院,贵州 铜仁 554300 )
盐酸恩诺沙星对杂交鲟幼鱼肝脏抗氧化酶活性的影响
熊铧龙1,蒋左玉1,张儒学1,冯亚楠2,姚俊杰3,梁 琍4
( 1.贵州省瓮安县农村工作局,贵州 瓮安 550400; 2.北京好未来教育摩比事业部,北京 100000;3.贵州大学 动物科学学院 水产科学系,贵州 贵阳 550025;4.铜仁学院 生物与农林工程学院,贵州 铜仁 554300 )
在水温(17.5±0.5) ℃和盐酸恩诺沙星质量浓度1.56、6.25、25.00 mg/L和100.00 mg/L 下,采用生化和半静态亚急性毒性方法研究了盐酸恩诺沙星对体质量(10.26±2.37) g杂交鲟(施氏鲟♀×西伯利亚鲟♂)幼鱼肝脏中超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性的影响。试验结果显示,盐酸恩诺沙星对杂交鲟幼鱼96 h半致死质量浓度>100.00 mg/L,属于低毒。各试验剂量盐酸恩诺沙星均显著影响杂交鲟幼鱼肝脏超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性(P<0.05),且随时间的延长超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性均呈先升后降变化,即先诱导后抑制,但3种抗氧化酶活性被诱导的程度在时间上具有差异性。低质量浓度组(1.56、6.25 mg/L)酶活性峰值出现较晚,高质量浓度组(25.00、100.00 mg/L)酶活性峰值出现较早,表明高质量浓度下鱼体首先出现氧化应激反应,盐酸恩诺沙星引起的酶活性变化与暴露质量浓度和时间有一定相关性。
盐酸恩诺沙星;杂交鲟幼鱼;肝脏;抗氧化酶
盐酸恩诺沙星又名乙基环丙沙星、恩氟沙星,是第三代氟喹诺酮类动物专用药,具有高效、广谱、副作用小、不易产生耐药性等特点,其代谢产物环丙沙星对疾病防治也具有很好的效果,目前已广泛应用于鱼、虾、蟹等疾病防治中。但作为常用渔药,它对水生生物的生态效应和生态环境的潜在影响尚未有明确的认识和评价[1]。而抗氧化酶活性是鱼类氧化胁迫的生物标志物,在一定程度上能评价水体污染度、药物安全性和机体氧化损伤度[2]。因此,研究渔药对鱼类抗氧化功能的影响具有一定生态和生理意义。
研究证实,喹诺酮类药物能影响水生生物体内抗氧化酶的活性,在体内代谢过程中会产生一些有亲电子活力的中间产物,影响生物体内抗氧化酶活性的变化[3]。Vaccaro等[4-5]研究表明,恩诺沙星对鲈鱼(Dicentrarchuslabrax)、小体鲟(Acipenserruthenus)和施氏鲟(A.schrenckii)多功能氧化还原酶细胞色素P450酶系的活性有一定的抑制作用,且随给药量的增加酶活性逐渐降低。李绍戊等[6]研究表明,在不同恩诺沙星给药量下,小体鲟与施氏鲟血浆和肌肉中超氧化物歧化酶活性先升后降,40 mg/kg剂量组活性最高。卢彤岩等[7-8]发现,达氟沙星能不同程度地诱导施氏鲟肝脏、红细胞抗氧化酶活性,高剂量组超氧化物歧化酶和过氧化氢酶活性最强,在100 mg/kg时,达氟沙星对红细胞中谷胱甘肽过氧化物酶产生一定的诱导作用,说明高剂量组首先表现出诱导现象和氧化应激反应。张喆等[9]研究诺氟沙星对中国明对虾(Fenneropenaeuschinensis)肌肉和鳃中超氧化物歧化酶、过氧化氢酶活性影响的研究时也表明,高剂量组促进了两种酶的活性。类似的结果在诺氟沙星对小体鲟和施氏鲟血浆和肝脏中超氧化物歧化酶活性影响,氧氟沙星对锦鲤(Cyprinuscarpio)超氧化物歧化酶、谷胱甘肽巯基转移酶活性和丙二醛含量的影响等研究中也得到证实[10-11]。
鲟鱼是一种很古老的软骨硬鳞鱼类,衍生出很多重要的经济杂交鲟。研究证实,杂交鲟生长快,抗病性强,经济效益高[12-13],广泛在我国养殖。本试验研究了盐酸恩诺沙星对杂交鲟[施氏鲟♀×西伯利亚鲟(A.baeri)♂]幼鱼肝脏中超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性的影响,以期评价该渔药对杂交鲟幼鱼的安全性,为该药在水产动物疾病治疗中的应用提供一些基础数据。
1 材料与方法
1.1 材料
试验用鱼为贵州省毕节地区金沙县鲟鱼苗种场培育的人工繁殖杂交鲟(施氏鲟♀×西伯利亚鲟♂)幼鱼,平均体长(12.35±0.94) cm,平均体质量(10.26±2.37) g。挑选无病体质健壮的个体用于试验,试验前在水族箱中暂养2 d,试验前1 d不投饵。
1.2 方法
1.2.1 预试验
预试验按静水毒性法在50 L水族箱中进行,设4个质量浓度梯度组(5.0、25.0、250.0、2500.0 mg/L),每一梯度组设置3个平行,每组放入30尾鱼,第0、24、48、72 h和96 h观察、记录鱼存活。按Karber法计算96 h半致死质量浓度。
在96 h预试验中,各质量浓度组均未见试验鱼异常及死亡,说明盐酸恩诺沙星对杂交鲟幼鱼半致死质量浓度>100 mg/L。根据鱼类急性毒性试验的极限试验[14],可确定盐酸恩诺沙星对杂交鲟幼鱼为低毒物质,不需要再进行急性毒性试验。
1.2.2 亚急性毒性试验
根据极限试验规定,以100 mg/L为最大质量浓度组,按等对数间距设置4个质量浓度梯度组和1个空白对照组:0、1.56、6.25、25、100 mg/L。将已驯养的试验鱼随机放入50 L水箱内进行15 d亚急性毒性试验,每组3个平行,每个质量浓度组30尾。试验中连续充气,保持溶解氧>6.0 mg/L,水温为(17.5±0.5) ℃,每8 h更换一次药液。
1.2.3 取样方法
试验开始后24、96、168、240 h和312 h时自各质量浓度水箱中随机取3尾鱼,置于冰盘内解剖。将取出的肝脏组织用预冷的生理盐水清洗,滤纸吸干水分后置于5 mL离心管中,于冰箱中-80 ℃保存待测。
1.3 酶液制备
取不同时期的样品,加入样品质量10倍体积的预冷重蒸水,在玻璃匀浆器中冰浴匀浆,9000~10 000 r/min冷冻离心30 min,上层为油层,下层为沉淀,小心取中间层,3000 r/min再次离心后取上清液测定消化酶活力。酶液置于冰箱4 ℃保存备用,在24 h内分析完毕。
1.4 抗氧化酶活性的测定
采用考马斯亮蓝法测定酶液蛋白含量。超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活性均采用南京建成生物技术有限公司试剂盒测定。
1.5 数据处理
试验数据用平均值±标准差(n=9)表示,用SPSS 13.0统计软件进行单因素方差分析,用Duncan′s法对均值进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 盐酸恩诺沙星对杂交鲟幼鱼肝脏超氧化物歧化酶活性的影响
不同剂量盐酸恩诺沙星对杂交鲟幼鱼肝脏超氧化物歧化酶活性的影响见图1。由图1可知,在24、96 h和168 h各质量浓度组超氧化物歧化酶活性均显著或极显著高于对照组(P<0.05或P<0.01),在240 h时1.56、6.25 mg/L质量浓度组超氧化物歧化酶活性极显著高于对照组(P<0.01),100.00 mg/L质量浓度组超氧化物歧化酶活性极显著低于对照组(P<0.01),312 h时1.56 mg/L质量浓度组超氧化物歧化酶活性极显著高于对照组(P<0.01),6.25、25.00 mg/L质量浓度组超氧化物歧化酶活性稍高于对照组,差异不显著(P>0.05),100.00 mg/L质量浓度组超氧化物歧化酶活性极显著低于对照组(P<0.05)。在各质量浓度组中,随着暴露时间的延长超氧化物歧化酶活性先升后降,1.56 mg/L质量浓度组在240 h时活性最高,其余3个质量浓度组均在168 h时活性最大。
2.2 盐酸恩诺沙星对杂交鲟幼鱼肝脏过氧化氢酶活性的影响
不同剂量盐酸恩诺沙星对杂交鲟幼鱼肝脏过氧化氢酶的影响见图2。由图2可知,在各试验剂量下肝脏过氧化氢酶活性随暴露时间的延长均呈先升后降的变化趋势,1.56 mg/L质量浓度组在240 h时活性最高,6.25、25.00 mg/L质量浓度组在168 h时活性最高,100.00 mg/L在96 h时活性达到最大值。在168 h内各质量浓度组酶活性均显著或极显著高于对照组(P<0.05或P<0.01);暴露至240 h时,仅1.56 mg/L质量浓度组酶活性极显著高于对照组(P<0.05),100.00 mg/L高质量浓度组酶活性显著低于对照组(P<0.05);暴露至312 h时,除1.56 mg/L质量浓度组酶活性显著高于对照组外(P<0.05),其余3个组酶活性均低于对照组,且25.00 mg/L和100.00 mg/L两组极显著低于对照组(P<0.01)。
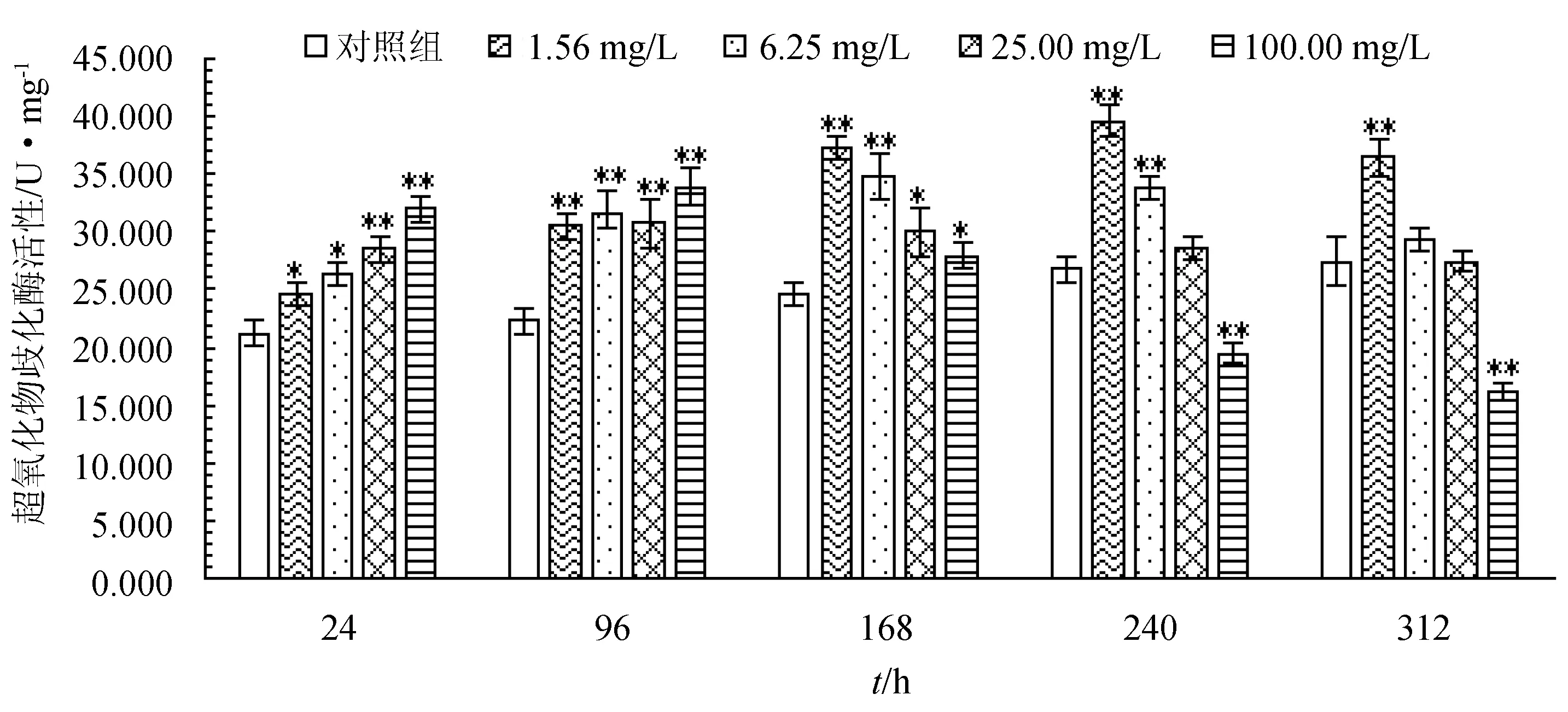
图1 盐酸恩诺沙星对杂交鲟幼鱼肝脏超氧化物歧化酶活性的影响
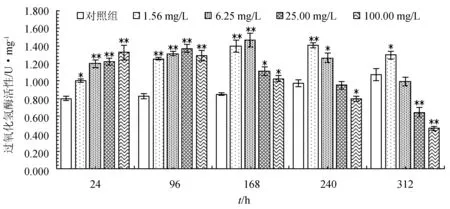
图2 盐酸恩诺沙星对杂交鲟幼鱼肝脏过氧化氢酶活性的影响
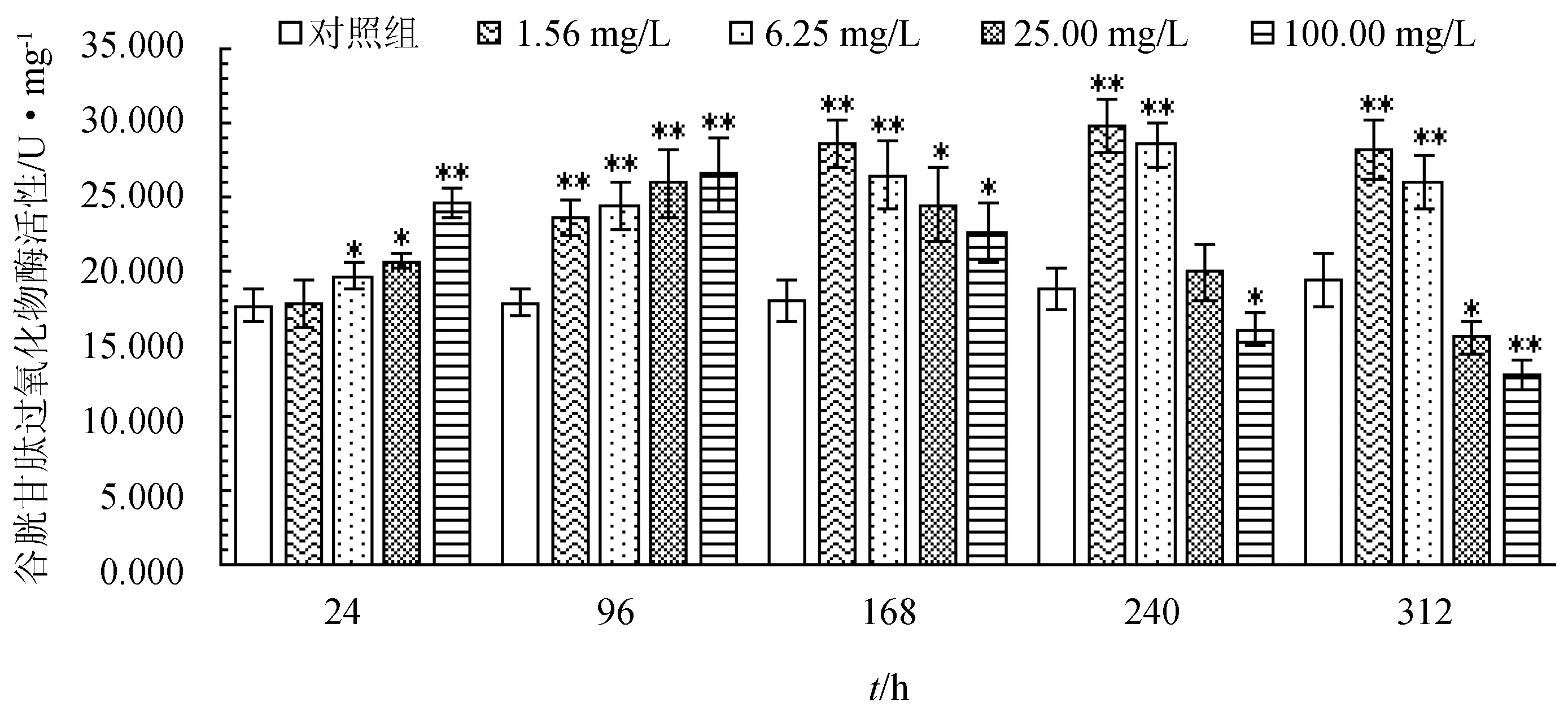
图3 盐酸恩诺沙星对杂交鲟幼鱼肝脏谷胱甘肽过氧化物酶活性的影响
2.3 盐酸恩诺沙对杂交鲟幼鱼肝脏谷胱甘肽过氧化物酶活性的影响
不同剂量盐酸恩诺沙星对杂交鲟幼鱼肝脏谷胱甘肽过氧化物酶的影响见图3。由图3可知,随暴露时间的延长,各质量浓度组肝脏谷胱甘肽过氧化物酶活性呈先升后降趋势,暴露至240 h时,1.56、6.25 mg/L两组活性达到最大值,而25.00、100.00 mg/L质量浓度组在暴露96 h时达到最大值。暴露至168 h内的各质量浓度组酶活性均显著或极显著高于对照组(P<0.05或P<0.01),至312 h时,1.56、6.25 mg/L活性极显著高于对照组(P<0.01),100.00 mg/L组极显著低于对照组(P<0.01)。
3 讨 论
活性氧是机体新陈代谢、杀伤异源物质、抗应激时产生的一类重要物质,包括氧自由基、羟自由基和过氧化氢等。如不及时清除这些物质就会对机体产生氧化损伤。清除这些物质需要抗氧化酶的参与,抗氧化酶存在于所有生物组织。超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶作为生物体内3种重要的抗氧化酶,对阻断羟自由基起关键作用。超氧化物歧化酶是机体内唯一一种清除氧自由基的酶,可使氧自由基歧化生成过氧化氢和氧气,而过氧化氢在过氧化氢酶或谷胱甘肽过氧化物酶的作用下生成水和氧气,消除氧自由基对机体的氧化损伤[15]。
盐酸恩诺沙星对杂交鲟幼鱼半致死质量浓度>100 mg/L,属低毒物质,但其作为一种外来物质进入鱼体,可使鱼体产生过多活性氧,导致活性氧代谢失衡。相关研究表明,恩诺沙星、诺氟沙星、达氟沙星、盐酸环丙沙星等喹诺酮类渔药对鱼类抗氧化酶,如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性或脂类氧化损伤指标丙二醛含量等的影响均表现为先诱导后抑制效应,随时间的延长主要表现为抑制效应,且高质量浓度下首先表现出诱导现象[5-11]。本试验表明,在同一盐酸恩诺沙星质量浓度下,随暴露时间的延长,超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性均呈先升后降的变化趋势,但3种抗氧化酶活性被诱导的程度在时间上具有差异性。在低质量浓度(1.56 mg/L和6.25 mg/L)下,超氧化物歧化酶和谷胱甘肽过氧化物酶随暴露时间的延长,其活性被显著诱导,但表现出一定时间的滞后性,在240 h时超氧化物歧化酶和谷胱甘肽过氧化物酶活性达到最高,显著高于24 h和96 h超氧化物歧化酶和谷胱甘肽过氧化物酶活性。而过氧化氢酶在24 h时各试验剂量处理组之间差异较小,随暴露时间的延长,过氧化氢酶活性显著增强,在168 h时活性达到最大值,随后开始下降。而在高质量浓度(25.00 mg/L和100.00 mg/L)下,滞后性提前,3种酶均在96 h时活性达到峰值。这与相关的研究结果相类似[16-17]。
肝脏作为鱼体重要的解毒器官,对外来药物的应激反应比较迅速。本试验发现,高质量浓度组(100.00 mg/L)盐酸恩诺沙星对杂交鲟肝脏中超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性出现诱导的时间比低质量浓度组(1.56 mg/L)要早, 但在低质量浓度组中活性被诱导的时间比高质量浓度组长,说明高质量浓度下鱼体首先出现氧化应激反应,但此过程持续时间短。其可能原因为,在低质量浓度下,杂交鲟幼鱼对盐酸恩诺沙星具有一定的适应反应过程,促使3种酶活性随暴露时间的延长而升高,以增强机体对氧自由基、羟自由基和过氧化氢等物质的清除能力。但由于药物在机体内代谢都有富集效应,随暴露时间延长鱼体内药物含量增大,氧自由基增多,超过鱼体的适应能力,且抗氧化酶蛋白分子关键性氨基酸残基被大量活性氧中间体攻击,造成鱼体和抗氧化酶受到损伤,抗氧化酶活性降低,清除氧自由基能力降低[18]。在高质量浓度条件下,短暴露时间内,超氧化物歧化酶表现出代偿性增强,以清除药物代谢时产生的过量氧自由基,而此期间过氧化氢酶和谷胱甘肽过氧化物酶活性的显著增强有利于两种酶发挥协同作用,清除羟自由基和过氧化氢等氧化损伤物质[15]。但随暴露时间延长,高剂量药物诱导产生的大量活性氧开始攻击鱼体和抗氧化酶,氧自由基诱导的抗氧化酶活性增加已不足以抵抗其对抗氧化酶的严重损伤,从而导致酶活性逐渐降低[6]。
[1] Costanzo S D, Murby J, Bates J. Ecosystem response to antibiotics entering the aquatic environment [J]. Marine Pollution Bulletin, 2005, 51(1/4):218-223.
[2] Ayllon F, Garcia-Vazquez E. Induction of micronuclei and other nuclear abnormalities in European minnowPhoxinusphoxinus, and molliePoecilialatipinna:an assessment of the fish micronucleus test [J]. Mutation Research, 2000, 467(2):1771-86.
[3] 聂湘平,鹿金雁,李潇,等. 诺氟沙星(Norfloxacin)对蛋白核小球藻(Chlorellapyrenoidosa)生长及抗氧化酶活性的影响[J]. 生态毒理学报, 2007, 2(3):327-332.
[4] Vaccaro E, Giorgi M, Longo V, et al. Inhibition of cytochrome P450 enzymes by enrofloxacin in the sea bass (Dicentrarchuslabrax)[J]. Aquatic Toxicology, 2003, 62(1):27-33.
[5] 卢彤岩,陈琛,李绍戊,等.恩诺沙星对2种鲟细胞色素P450活性影响的比较研究[J]. 中国农学通报, 2011, 27(20):87-91.
[6] 李绍戊,王荻,马涛,等. 恩诺沙星对小体鲟和史氏鲟体内SOD活力影响的比较研究[J]. 水产学杂志, 2011, 24(2):37-40.
[7] 卢彤岩,徐连伟,刘红柏,等.达氟沙星对施氏鲟肝脏抗氧化功能和转氨酶活性的影响[J]. 中国水产科学, 2005, 12(3):288-293.
[8] 卢彤岩,徐连伟,刘红柏,等.达氟沙星对史氏鲟红细胞抗氧化功能及微核形成的影响[J]. 水产学报, 2006, 30(5):591-596.
[9] 张喆,李健,冯伟,等.不同浓度诺氟沙星对中国对虾非特异性免疫酶活的影响[J]. 渔业科学进展, 2011, 32(2):53-59.
[10] 王荻,李绍戊,马涛,等.诺氟沙星对两种鲟体内SOD活力影响的比较研究[J]. 中国畜牧兽医, 2011, 38(7):34-37.
[11] 沈洪艳,王冰,赵月,等.氧氟沙星对锦鲤抗氧化系统和DNA损伤的影响[J]. 环境科学与技术, 2015 (12):59-66.
[12] Billard R, Lecointre G. Biology and conservation of sturgeon and paddle fish[J]. Rev Fish Biol Fisher, 2001, 10(4):355-392.
[13] 石振广,王云山,李文龙.鲟鱼与鲟鱼养殖[M]. 哈尔滨:黑龙江科学技术出版社,2000:82-98.
[14] 国家环境保护总局. 水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2002:715-721.
[15] 唐功. 活性氧·抗氧化酶及抗氧化剂之间关系的探讨[J]. 安徽农业科学, 2010, 38(33):18619-18621.
[16] 聂湘平,王翔,李凯彬,等. 抗生素药物环丙沙星对剑尾鱼的毒性效应[J]. 中山大学学报:自然科学版, 2007, 46(5):70-73.
[17] 聂湘平,陈菊芳,王翔,等. 环丙沙星在异育银鲫(Allogynogenetic crucian)体内的积累分布及其毒性效应[J]. 生态学报, 2008, 28(1):246-252.
[18] 张彬彬.草甘膦对鲫鱼肝脏内膜系统和超氧化物歧化酶的影响[J]. 湖北农业科学, 2010, 49(7):1681-1683.
EffectsofEnrofloxacinHydrochlorideonActivitiesofSuperoxideDismutase,CatalaseandGlutathionePeroxidaseinLiverofJuvenileHybridSturgeon
XIONG Hualong1, JIANG Zuoyu1, ZHANG Ruxue1,FENG Yanan2, YAO Junjie3, LIANG Li4
( 1.Rural Work Bureau of Weng′an County, Guizhou Province, Weng′an 550400, China; 2.TAL Education Group in the Mobby Business Division of Beijing, Beijing 100000, China; 3.Department of Fisheries Science, College of Animal Sciences, Guizhou University, Guiyang 550025, China; 4.College of Biology and Agro-forestry Engineering, Tongren University, Tongren 554300, China )
The effects of enrofloxacin hydrochloride on activities of superoxide dismutase, catalase and glutathione peroxidase were studied in liver of juvenile hybrid sturgeon(Acipenserschrenckii♀×A.baeri♂)with body weight of (10.26±2.37) g exposed to enrofloxacin hydrochloride concentration of 1.56 mg/L, 6.25 mg/L, 25.00 mg/L and 100.00 mg/L at water temperature of(17.5±0.5) ℃ by biochemical and subacute toxicity methods. The results showed that the 96 h LC50of enrofloxacin hydrochloride to juvenile hybrid sturgeon was found to be higher than 100 mg/L, indicating that enrofloxacin hydrochloride was low-toxic to hybrid sturgeon juveniles. The activities of superoxide dismutase, catalase and glutathione peroxidase were significantly affected by concentrations of enrofloxacin hydrochloride and exposure period(P<0.05), with the trend of “ first increase and then decrease” with exposure period. The enzyme activity peak was observed later in low concentration groups(1.56 mg/L and 6.25 mg/L)than in high concentration groups. The findings indicated that oxidative stress reaction first appeared in fish in the high concentration group(25.00 mg/L and 100.00 mg/L), and the enzyme activities were involved in enrofloxacin concentrations and the exposure period.
enrofloxacin hydrochloride; hybrid sturgeon juvenile; liver; antioxidant enzyme
10.16378/j.cnki.1003-1111.2017.05.010
2016-09-05;
2016-12-08.
贵州省科学技术基金资助项目[黔科合LH字(2014)7486].
熊铧龙(1988-),男,水产工程师,硕士;研究方向:水产动物繁殖与发育生物学. E-mail:hualongx67@163.com. 通讯作者:姚俊杰(1968-),男,教授,硕士生导师,博士;研究方向:水产动物繁殖与发育生物学. E-mail:junjieyao@163.com.
S948
A
1003-1111(2017)05-0601-05

