不同类型冠心病患者股动脉斑块超声特征
刘 璐,赵 萍,伍凌鹄,陈慧贞,杨义春
(1.深圳大学总医院超声科,广东 深圳 518055;2.广州中医药大学第一附属医院超声科,广东 广州 510405;3.深圳市人民医院超声科,广东 深圳 518020)
不同类型冠心病患者股动脉斑块超声特征
刘 璐1,赵 萍2*,伍凌鹄3,陈慧贞2,杨义春2
(1.深圳大学总医院超声科,广东 深圳 518055;2.广州中医药大学第一附属医院超声科,广东 广州 510405;3.深圳市人民医院超声科,广东 深圳 518020)
目的探讨股动脉斑块声像特征诊断非ST段抬高型急性冠状动脉综合征(NSTE-ACS)的价值。方法选取冠心病伴颈动脉及股动脉斑块患者72例,分为NSTE-ACS组(n=42)和慢性心肌缺血综合征(CIS)组(n=30),行CEUS、三维超声及灰阶强度定量分析,检测斑块造影增强强度(EI)、斑块体积、形态特征及回声灰阶强度(EL)等参数并进行对比分析。结果NSTE-ACS组斑块EI、形态不规则斑块比例高于CIS组,EL低于CIS组(P均<0.05)。颈动脉和股动脉斑块EI、EL和形态分类均与NSTE-ACS具有相关性(P均<0.05)。股动脉斑块EI、EL为NSTE-ACS的危险因素(OR=1.222、1.177,P<0.05)。颈动脉斑块EI、EL诊断NSTE-ACS的曲线下面积(AUC)分别为0.801、0.757(P均<0.001),股动脉斑块EI、EL的AUC分别为0.814、0.774(P均<0.001)。结论股动脉斑块内新生血管、形态特征和内部回声均与NSTE-ACS存在相关性,且较颈动脉更强;多种超声技术联合评价股动脉斑块声像图特征有望成为预测冠状动脉斑块稳定性、筛查冠心病高危患者的参考指标。
冠状动脉疾病;股动脉;斑块,粥样硬化;造影剂;超声检查
动脉粥样硬化(atherosclerosis, AS)是冠状动脉粥样硬化性心脏病(冠心病)重要的病理学基础,冠状动脉不稳定斑块是导致非ST段抬高型急性冠状动脉综合征(non-ST-elevation acute coronary syndrome, NSTE-ACS)的主要原因。AS是全身性、系统性病变,股动脉与冠状动脉粥样硬化存在共同的发病机制,故股动脉可作为了解冠状动脉病变程度的窗口。超声技术可客观、准确地检测斑块内新生血管,斑块体积、形态特征及内部回声,有助于有效评估斑块的稳定性。本研究联合采用CEUS、三维超声及灰阶强度定量分析技术,探讨股动脉斑块声像图特征与NSTE-ACS的相关性。
1 资料与方法
1.1 一般资料 选取2015年8月—2016年12月在我院因胸痛住院、诊断为冠心病伴颈动脉及股动脉斑块的患者,均予以血清肌钙蛋白(cTnT)、心电图检测和经皮选择性冠状动脉造影。根据卫生部2010年制定的《冠状动脉粥样硬化性心脏病诊断标准》和美国心脏病学院(ACC)/美国心脏协会(AHA)发布的2014版《非ST段抬高型急性冠状动脉综合征(NSTE-ACS)管理指南》[1]的诊断标准,确诊NSTE-ACS患者42例(NSTE-ACS组),其中男24例,女18例,年龄55~75岁,平均(63.9±4.3)岁;确诊慢性心肌缺血综合征(chronic ischemic syndrome, CIS)患者30例(CIS组),其中男17例,女13例,年龄52~73岁,平均(63.8±4.7)岁。如患者颈动脉或股动脉有多个斑块,仅将体积最大者作为研究对象。患者临床资料见表1。排除标准:①CEUS禁忌证,包括ST段抬高急性心肌梗死(ST-elevation myocardial infarction, STEMI);②心功能(NYHA分级)≥3级;③慢性肝、肾功能不全;④自身免疫性疾病;⑤不同意签署知情同意书者。
1.2 仪器与方法 采用GE Logiq E9 超声诊断仪,配备编码相位反转(coded phase inversion, CPI)技术,高频线阵探头ML6-15,频率9~15 MHz;线阵探头9L-D,频率3~9 MHz,支持CEUS;三维容积探头RSP6-16-D,频率4~15 MHz。
1.2.1 二维超声检查 颈动脉:患者取仰卧位,将头转向对侧,尽量放松颈部肌肉,采用线阵探头分别扫查两侧颈动脉,嘱患者屏气并避免吞咽动作,自下向上依次扫查颈总动脉、颈内动脉及颈外动脉。股动脉:患者取仰卧位,被检肢体略外展、外旋,采用线阵探头分别扫查患者两侧股动脉,自上而下依次扫查股总动脉、股浅动脉及股深动脉。对体积最大的靶斑块进行横切及纵切扫查,显示其最佳长轴切面,测量斑块面积,观察斑块内部回声及形态特征。
1.2.2 灰阶强度定量分析技术 显示斑块最佳长轴切面后启动Intensity键,手动勾画斑块边界,于相同深度条件下测量斑块的灰阶强度(echo level, EL),每个斑块测量3次,取平均值。
1.2.3 三维超声成像 采用容积探头,清晰显示斑块长轴切面后启动3D/4D键进行三维成像。随后启动VOCAL技术,选择采用手动描记斑块的方法,每30°旋转一次,共获取12个切面。每个切面手动勾画斑块边界,生成斑块的三维立体图像,观察斑块形态是否规则,并计算斑块体积。
1.2.4 CEUS 清晰显示斑块长轴切面二维图像后切换至CEUS模式,机械指数0.15。经肘静脉快速注入造影剂SonoVue 2.4 ml,跟注2 ml生理盐水。连续观察并采集2 min动态图像,采用时间-强度曲线(time-intensity curve, TIC)软件分析图像,手工勾画斑块边界,尽量避开管腔和斑块周围组织,并将另一与斑块大小相同的ROI置于附近的动脉腔内作为对照,系统自动生成TIC。采用Gamma拟合曲线进行量化分析,获得最大强度(A)、基础强度(B)、造影增强强度(enhanced intensity, EI;EI=A-B)。其中NSTE-ACS组3例颈动脉斑块和2例股动脉斑块、CIS组5例颈动脉斑块和3例股动脉斑块因回声强且后方伴明显声影,造影剂无法显影,难以测量EI,均不纳入造影研究范围。
1.3 统计学分析 采用SPSS 17.0统计分析软件,计量资料以±s表示,各项指标均经正态分布及Levene方差齐性检验,两组各参数比较采用独立样本t检验(方差不齐采用t'检验);两组计数资料间比较采用2检验。动脉斑块声像特征与NSTE-ACS的相关性采用Spearman秩相关分析。筛选具有临床意义的因素纳入非条件Logistic回归模型,定量描述各因素与结局变量间的联系。采用ROC曲线评价有意义的参数的诊断价值。P<0.05为差异有统计学意义。
2 结果
NSTE-ACS组低密度脂蛋白(low-density lipoprotein, LDL)高于CIS组(P<0.05);两组患者年龄、性别、高血压、糖尿病及吸烟情况差异均无统计学意义(P均>0.05),见表1。
两组患者颈动脉和股动脉斑块最大面积、体积差异均无统计学意义(P均>0.05);NSTE-ACS组斑块的EI高于CIS组,EL低于CIS组(P均<0.05);NSTE-ACS组颈动脉[64.29%(27/42)]和股动脉[64.29%(27/42)]不规则斑块的比例均高于CIS组[颈动脉和股动脉均为 36.67%(11/30);2=5.356,P=0.011)],见表2、3和图1~4。
颈动脉斑块EI与NSTE-ACS呈正相关(r=0.363,P=0.042),EL与NSTE-ACS呈负相关(r=-0.342,P=0.046),斑块形态分类与NSTE-ACS呈正相关(r=0.235,P=0.037);股动脉斑块EI与NSTE-ACS呈正相关(r=0.369,P=0.001),EL与NSTE-ACS呈负相关(r=-0.351,P=0.001),斑块形态分类与NSTE-ACS呈正相关(r=0.258,P=0.013)。
筛选的NSTE-ACS危险因素有LDL、股动脉斑块EI、EL及斑块形态分类,建立二分类Logistic回归模型,EI、EL及斑块形态分类进入回归模型。EI、EL为NSTE-ACS的独立危险因素(P<0.05),见表4。

表1 两组患者临床资料比较
表2 两组患者颈动脉斑块声像特征比较(±s)
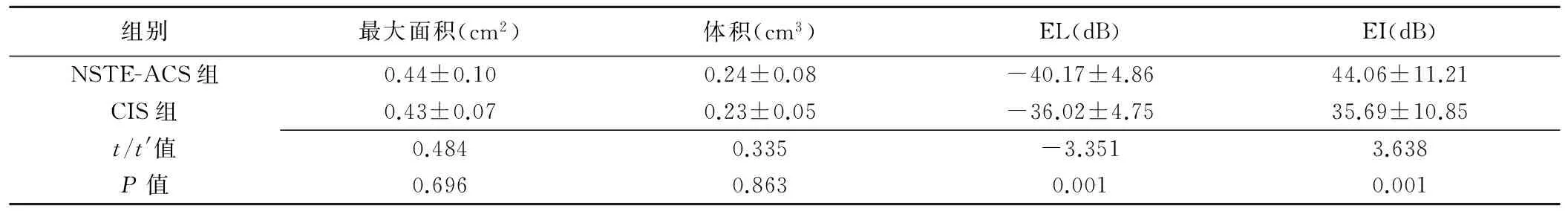
表2 两组患者颈动脉斑块声像特征比较(±s)
组别最大面积(cm2)体积(cm3)EL(dB)EI(dB)NSTE-ACS组0.44±0.100.24±0.08-40.17±4.8644.06±11.21CIS组0.43±0.070.23±0.05-36.02±4.7535.69±10.85t/t'值0.4840.335-3.3513.638P值0.6960.8630.0010.001
注:部分强回声斑块未纳入造影研究,故造影时NSTE-ACS组39例,CIS组25例
表3 两组患者股动脉斑块声像特征比较 (±s)

表3 两组患者股动脉斑块声像特征比较 (±s)
组别最大面积(cm2)体积(cm3)EL(dB)EI(dB)NSTE-ACS组0.45±0.110.24±0.08-42.75±5.4345.82±10.38CIS组0.43±0.090.23±0.07-37.15±4.5637.23±11.40t/t'值0.4870.336-3.3443.609P值0.6510.7380.0010.001
注:部分强回声斑块未纳入造影研究,故造影时NSTE-ACS组40例,CIS组27例
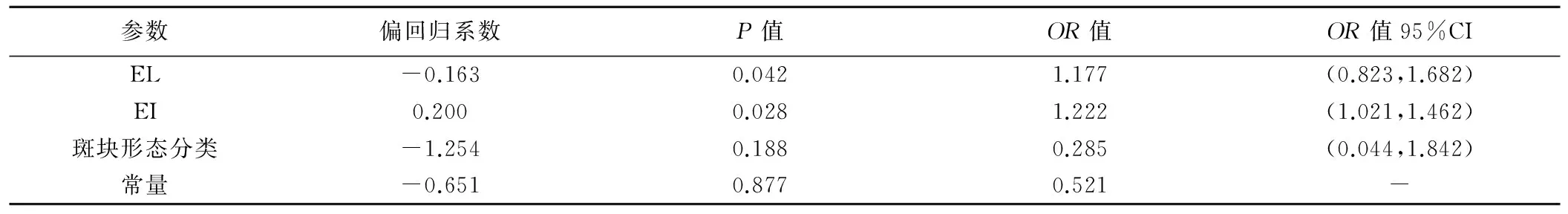
表4 NSTE-ACS患者股动脉斑块危险因素的Logistic回归模型
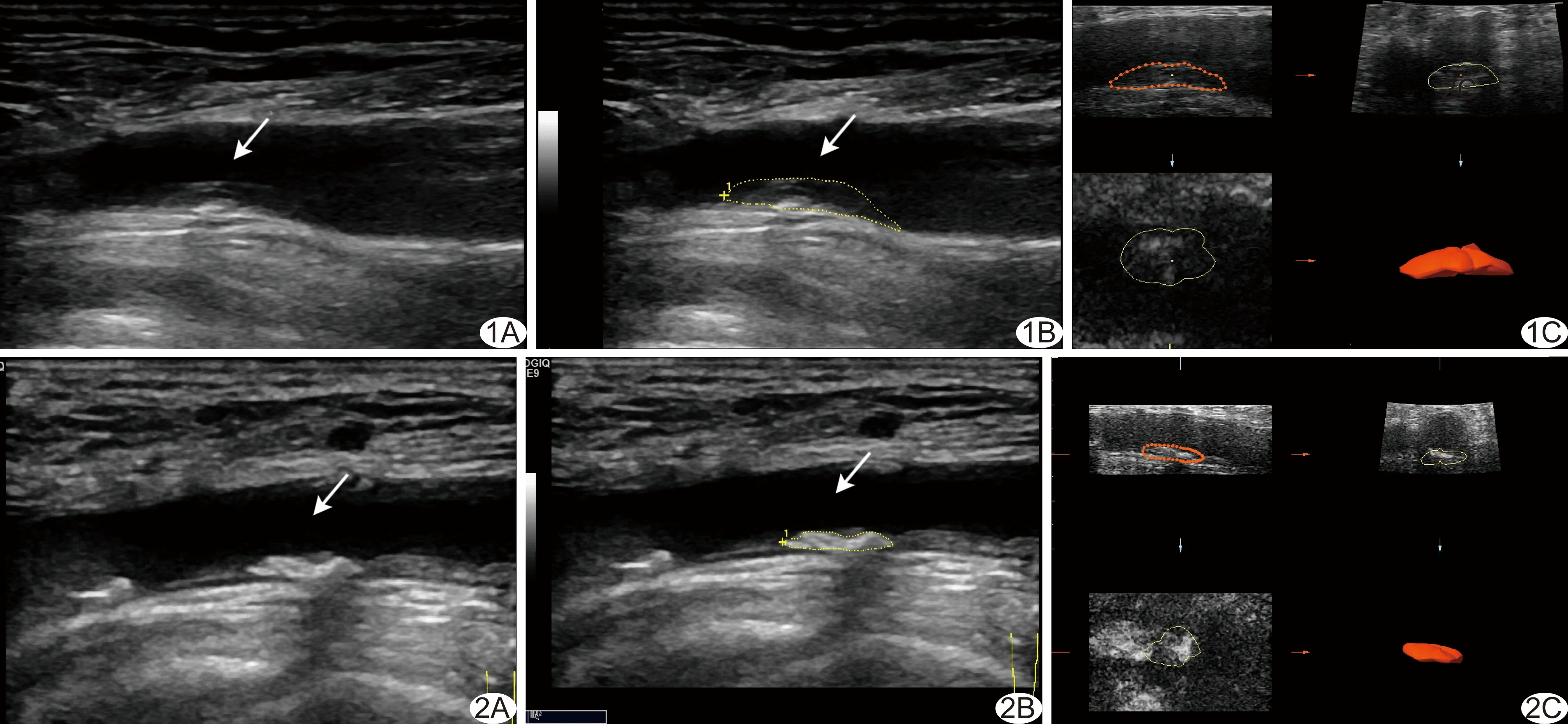
图1 患者女,72岁,NSTE-ACS A.常规二维超声图像示右侧股总动脉低回声斑块(箭); B.灰阶强度定量分析技术示斑块(箭)EL为-51.0 dB; C.三维超声成像示斑块体积为0.2 cm3,形态不规则 图2 患者男,63岁,CIS A.常规二维超声图像示左侧股总动脉强回声斑块(箭); B.灰阶强度定量分析技术示斑块(箭)EL为-34.3 dB; C.三维超声成像示斑块体积为0.2 cm3,形态较规则
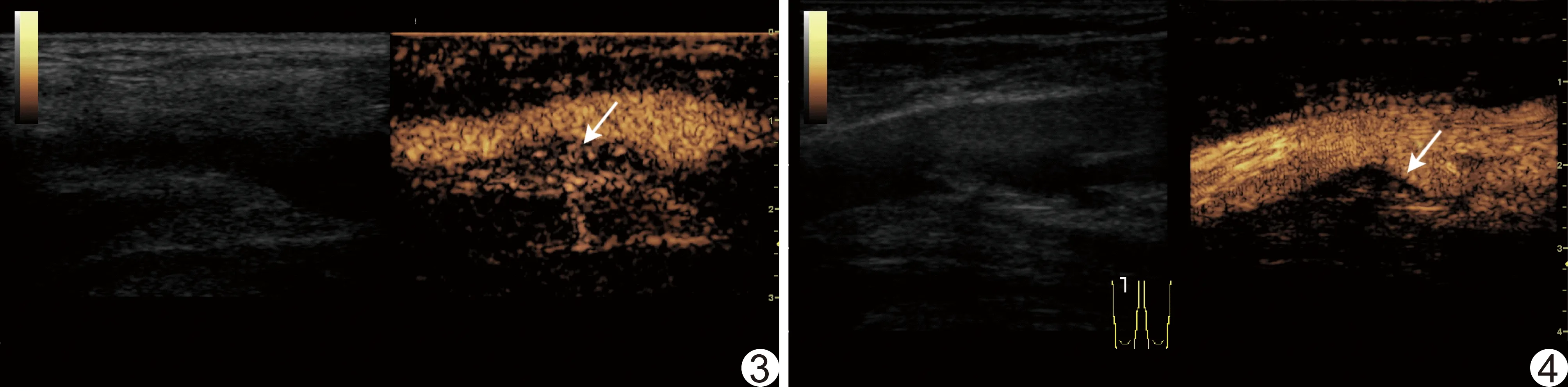
图3 患者男,69岁,NSTE-ACS 右侧股总动脉低回声斑块,CEUS示斑块内造影剂密度较高,分布均匀,斑块基底部、肩部及内部均有分布,呈网状增强(箭) 图4 患者男,61岁,CIS 左侧股总动脉混合回声斑块,斑块内造影剂密度较低,分布欠均匀,主要集中在斑块基底部,呈星点状增强(箭)
颈动脉斑块EI诊断NSTE-ACS的曲线下面积(area under curve, AUC)为0.801[95% CI (0.705,0.924),P<0.001];EL诊断NSTE-ACS的AUC为0.757[95%CI (0.616,0.854),P<0.001]。股动脉斑块EI诊断NSTE-ACS的AUC为0.814[95%CI (0.720,0.908),P<0.001];EL诊断NSTE-ACS的AUC为0.774[95%CI (0.677,0.870),P<0.001]。
3 讨论
AS不稳定性斑块具有较薄的纤维帽、较大的脂质核心、新生血管形成、炎症细胞浸润、继发血栓形成等特点[2],斑块回声越低,其稳定性越差[3-4]。目前超声检查多为定性评估,主观性较强。本研究采用Intensity技术将超声图像灰阶亮度以具体数值的形式表达,不受增益调节的影响,可客观、定量评价回声强弱。EL值越小,回声越低。斑块内新生血管是不稳定性斑块的重要病理特征,易破裂、出血及血栓形成,导致血管腔急剧狭窄甚至完全阻塞[5]。CEUS可有效评估斑块的稳定性[6]。常规超声只能观察斑块的二维切面,无法观察其整体形态[7]。研究[8]发现斑块的体积可更早、更敏感地反映斑块实际大小的变化。本研究采用三维超声成像技术获取斑块的立体图像,定量检测斑块体积,可客观、全面分析斑块的形态特征,减少误差。
根据发病特点和治疗原则的不同冠心病分为两大类:一类是CIS,包括稳定型心绞痛和无症状性心肌缺血;另一类是ACS,包括NSTE-ACS、ST段抬高急性心肌梗死和心脏性猝死。CIS的病理特点是冠状动脉内斑块大小不一,但性质稳定,不易破损,不易激惹血小板急剧聚集,管腔狭窄程度不变。ACS的发病机制为冠状动脉不稳定性斑块破裂、糜烂或出血,继发血小板聚集或血栓形成,导致管腔狭窄程度急剧加重,心肌供氧减少[9]。AS是一种系统性、全身性的退行性炎症病变,冠状动脉与外周动脉粥样硬化存在相同的发病机制和病理变化,外周动脉病变程度可间接反映冠状动脉粥样硬化病变程度[10]。本研究通过超声多种技术联合评价外周动脉斑块稳定性,结果显示,NSTE-ACS组患者颈动脉及股动脉斑块的EI高于CIS组,EL低于CIS组,颈动脉形态不规则斑块比例高于CIS组(P均<0.05);斑块的EI、EL及形态分类均与NSTE-ACS具有相关性;Logistic回归分析显示股动脉斑块EI、EL均为NSTE-ACS的危险因素;ROC曲线显示斑块EI、EL对NSTE-ACS的诊断均有一定价值。提示NSTE-ACS患者股动脉斑块具有回声较低、斑块内新生血管丰富、形态较不规则的特点,即为不稳定性斑块。外周动脉斑块较不稳定者,冠状动脉斑块也更倾向于不稳定性斑块,临床表现为NSTE-ACS,通过超声检测外周动脉病变情况,有助于了解冠状动脉的病变程度。本研究两组斑块的最大面积和体积无明显差异,间接提示斑块的不稳定性是引发急性心脑血管事件的主要原因,而非斑块大小及血管阻塞程度,与既往研究[11]观点一致。
既往研究[12]多以颈动脉为靶血管,近年来研究[13-14]提示,股动脉与冠状动脉粥样硬化病变程度的相关性更强,股动脉预测冠心病的敏感度和准确率均高于颈动脉,股动脉发生AS可能早于颈动脉且病变程度更重。Laclaustra等[15]对入选西班牙阿拉贡工人健康研究、年龄40~59岁的1 423名男性进行颈动脉、股动脉超声检查,并行冠状动脉钙化评分,发现与颈动脉斑块相比,股动脉斑块与高血脂、吸烟和高血压等相关性更强,且股动脉斑块对冠状动脉钙化阳性结果的预测能力强于颈动脉斑块。Lekakis等[16]发现,股动脉内中膜厚度与冠状动脉粥样硬化范围和程度的关系较颈动脉内中膜厚度更密切。Smedby等[17]发现股动脉较颈动脉更早发生AS,可能因股动脉的几何形态更接近冠状动脉,走行均较弯曲,更易导致湍流。本研究结果显示,与颈动脉相比,股动脉斑块与NSTE-ACS发生的相关性更强,ROC曲线显示股动脉斑块EI、EL诊断NSTE-ACS的AUC也更大。股动脉具有搏动性小,操作空间大,更便于超声检测等优点,以股动脉作为靶血管研究冠状动脉粥样硬化早期病变可能较颈动脉更有临床意义。
综上所述,通过CEUS、三维超声成像及灰阶强度定量分析技术等多方面评价股动脉斑块的稳定性,有助于预测冠状动脉病变程度,并有望成为早期识别冠状动脉不稳定性斑块、筛查冠心病高危患者的参考性影像学指标。
[1] Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC guideline for the managementof patients with non-ST-elevation acute coronary syndrome: Executive summary:A report of the American college of cardiology/ American heart association task force on practice guidelines. J Am Coll Cardiol, 2014,64(24):e139-e228.
[2] 陈慧贞,赵萍.超声诊断颈动脉粥样硬化斑块的研究进展.临床超声医学杂志,2014,16(11):763-765.
[3] Schulte-Altedorneburg G, Droste DW, Haas N, et al. Preoperative B-mode ultrasound plaque appearance compared with carotid endarterectomy specimen histology. Acta Neurol Scand, 2000,101(3):188-194.
[4] Hingwala D, Kesavadas C, Sylaja PN, et al. Multimodality imaging of carotid atherosclerotic plaque: Going beyond stenosis. Indian J Radiol Imaging, 2013,23(1):26-34.
[5] ZhouY, Xing Y, Li Y, et al. An assessment of the vulnerability of carotid plaques: A comparative study between intraplaque neovascularization and plaque echogenicity. BMC Med Imaging, 2013,13(13):1471-1476.
[6] Shah F, Balan P, Weinberg M, et al. Contrast-enhanced ultrasound imaging kf atherosclerotic carotid plaque neovascularization: A new surrogate marker of atherosclerosis. Vasc Med, 2007,12(4):291-297.
[7] 陈慧贞,赵萍,贾节,等.三维超声测量斑块体积的临床应用价值.中国超声医学杂志,2015,32(2):110-112.
[8] Spence JD, Parraga G. Three-dimensional ultrasound of carotid plaque. Neuroimaging Clin N Am, 2016,26(1):69-80.
[9] 陶贵周,姚书霞.2010年我国急性ST段抬高型心肌梗死诊断与治疗指南解读评析.医学与哲学(临床决策论坛版),2011,32(12):22-25.
[10] 陆宇,宋予苹,马先林.超声检测外周动脉预测冠状动脉病变的相关性研究.中国预防医学杂志,2012,13(4):292-294.
[11] 何文.重视颈动脉斑块稳定性研究.中国医学影像技术,2015,31(5):643-646.
[12] 高跃华,陈东风,王少春,等.颈动脉硬化斑块超声表现与冠状动脉粥样硬化临床分析.临床超声医学杂志,2013,5(6):7-9.
[13] 薛海萍,张云山,邱璇,等.颈总动脉和股动脉内中膜厚度ROC曲线对冠心病的预测价值分析.海军医学杂志,2014,35(3):205-207.
[14] 孙建群,刘颖.超声检测股动脉、腹主动脉及颈动脉粥样硬化与冠状动脉粥样硬化的相关性.心脏杂志,2012,24(4):464-467.
[15] Laclaustra M, Casasnovas JA, Fernández-Ortiz A, et al. Femoral and carotid subclinical atherosclerosis association with risk factors and coronary calcium: The AWHS study. J Am CollCardiol, 2016,67(11):1263-1274.
[16] Lekakis JP, Papmaiehael CM, CimPoneriu AT, et al. Atherosclerotic changes of extracoronary arteries are associated with the extent of coronary atherosclerosis. Am J Cardiol, 2000,85(8):949-952.
[17] Smedby O. Geometrieal risk factors for atherosclerosis in the femoral artery in longitudinal angiographic study. Ann Biomed Eng, 1998,26(16):391-397.
Ultrasoniccharacteristicsoffemoralarteryatheroscleroticplaquesinpatientswithdifferenttypesofcoronaryheartdisease
LIULu1,ZHAOPing2*,WULinghu3,CHENHuizhen2,YANGYichun2
(1.DepartmentofUltrasound,ShenzhenUniversityGeneralHospital,Shenzhen518055,China;2.DepartmentofUltrasound,theFirstAffiliatedHospitalofGuangzhouUniversityofChineseMedicine,Guangzhou510405,China; 3.DepartmentofUltrasound,ShenzhenPeople'sHospital,Shenzhen518020,China)
ObjectiveTo explore correlation between ultrasonic characteristics of femoral artery atherosclerotic plaques and non-ST-elevation acute coronary syndrome (NSTE-ACS).MethodsSeventy-two patients with coronary heart disease (CHD) coexisting carotid artery and femoral artery plaques were divided into NSTE-ACS group (n=42) and chronic ischemic syndrome (CIS) group (n=30). The enhanced intensity (EI), volume, shape and internal echo level (EL) of plaques were detected with contrast-enhanced ultrasonic imaging and three-dimensional ultrasound combined with ultrasonic grey-scale intensity quantitative analysis, and all parameters were analyzed between the two groups.ResultsEI and the proportion of irregular artery plaques were higher, and EL was lower in NSTE-ACS group than those in CIS group (allP<0.05). EI, EL and shape of carotid artery and femoral artery plaques were correlated with NSTE-ACS (allP<0.05). EI and EL of femoral artery plaques were risk factors for NSTE-ACS (OR=1.222, 1.177,P<0.05). Areas under ROC curve of EI and EL of carotid artery plaques were 0.801 and 0.757 (bothP<0.001), and those of femoral artery plaques were 0.814 and 0.774, respectively (bothP<0.001).ConclusionNeovascularization, shape and internal echo are correlated with NSTE-ACS, and the correlation of femoral artery plaques with NSTE-ACS is more significant than that of carotid artery plaques. Detecting ultrasonic characteristics of femoral artery atherosclerotic plaque can provide references to early identify unstable plaque and screening high-risk patients with CHD.
Coronary disease; Femoral artery; Plaque, atherosclerotic; Contrast media; Ultrasonography
R541; R445.1
A
1003-3289(2017)12-1824-06
广东省省级科技计划项目(2016A020215140)。
刘璐(1987—),女,广西柳州人,博士,医师。研究方向:血管超声诊断。E-mail: raulbest3@163.com
赵萍,广州中医药大学第一附属医院超声科,510405。E-mail: zhaosiping@126.com
2017-04-01
2017-10-22
10.13929/j.1003-3289.201704002

