常压甘油有机溶剂预处理甘蔗渣的浓醪酶解
洪嘉鹏,岳春,赵晓琴,Marie Rose Mukasekuru ,李祥,孙付保*,孙海彦
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)2(南阳理工学院 生物与化学工程学院,河南 南阳,473004)3(中国热带农业科学院 热带生物技术研究所,海南 海口,571101)
常压甘油有机溶剂预处理甘蔗渣的浓醪酶解
洪嘉鹏1,岳春2,赵晓琴1,Marie Rose Mukasekuru1,李祥1,孙付保1*,孙海彦3
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)2(南阳理工学院 生物与化学工程学院,河南 南阳,473004)3(中国热带农业科学院 热带生物技术研究所,海南 海口,571101)
为了实现木质纤维素浓醪酶解在低酶载量时的“三高”(高浓度、高转化率和高转化效率),通过利用常压甘油有机溶剂预处理甘蔗渣为底物,筛选合适的基质质量浓度(150 g/L)、纤维素酶添加量(6 FPU/g基质)和添加剂(吐温80, 30 mg/g基质)。接着采用分批补料策略使基质质量浓度达到350 g/L,考察了不同加酶方式对分批补料浓醪酶解的影响。酶解72 h酶解液葡萄糖质量浓度达到132 g/L,葡萄糖转化率达到了理论值的60%。结果表明,常压甘油有机溶剂预处理基质具有较好的可酶解性,添加吐温80可以显著提高酶解效率。常压甘油有机溶剂预处理甘蔗渣的分批补料浓醪酶解推动了纤维素乙醇浓醪发酵工业化进程。
常压甘油有机溶剂预处理;甘蔗渣;浓醪酶解;分批补料;表面活性剂
目前,纤维素乙醇的生产技术路线已经打通,但是过高的生产成本严重阻碍了商业化进程。WINGREN等人研究发现,当基质质量浓度从50 g/L提高到80 g/L时,相应的操作成本会降低19%。而当基质质量浓度从200 g/L上升到300 g/L时,燃料乙醇的成本能降低0.10美元/加仑[1-2]。高基质浓度(浓醪)酶解工艺相比于低基质浓度酶解工艺,其在经济效益方面的优势非常巨大,主要体现在:(1)由于反应体系体积的减小而导致的设备成本降低;(2)由于加热和冷却所需能耗的降低而减少了操作成本;(3)更高的产物浓度意味着下游工艺的成本会被降低;(4)用水量的减少导致了后期废弃物处理的成本降低[3]。可见,利用纤维素生物质原料生产燃料乙醇的一个挑战在于如何实现高基质浓度的纤维素水解产糖的过程。
另外,纤维素酶成本对纤维素燃料乙醇生产经济性的影响很大,低纤维素酶添加量能够帮助降低整个行业的生产成本(0.5~1.5美元/加仑)[2, 4-5]。文献报道,通常碱催化预处理后基质酶解的加酶量为20 FPU/g纤维素,酸催化预处理基质的加酶量为100 FPU/g纤维素,碱催化后的基质所需的加酶量明显低于酸催化后的基质[6]。总之,如何实现低酶载量时基质高效水解是另外一个值得关注的方向。
截至目前,已有不少关于木质纤维素基质浓醪水解的研究报道。BARYAN等人在180g/L的基质质量浓度,加酶量20 mg/g(分别为10 mg CTec3和HTec3)葡聚糖的条件下酶解72 h,葡萄糖产率为68%,木糖产率为65%[7]。DAVID等人在加酶量为10.7 FPU/g纤维素的条件下通过分批补料的方式使基质质量浓度达到333 g/L,240 h的水解液中的葡萄糖质量浓度达到了将近140 g/L[3]。本实验室前期开展了汽爆-碱性过氧化氢预处理玉米秸浓醪酶解的研究,刘健权等人[8]在加酶量为30 FPU/g基质的条件下,以156 g/L为起始基质质量浓度,在酶解12 h时补加相当于200 g/L初始基质浓度的干物料以及相应量酶液后继续酶解24 h,此时酶解液中的糖质量浓度达到了142 g/L,纤维素转化率接近60%。尽管这些研究结果在酶解条件(酶载量、酶解时间或基质质量浓度)和酶解水平(产糖量、酶解率和酶解效率)的某一个指标方面取得明显进展,但这些研究在低酶载量时木质纤维素基质浓醪水解“三高”水平方面均尚未取得突破。
基于此,本文以常压甘油有机溶剂预处理甘蔗渣为原料,尝试开展低酶载量下基质浓醪水解的实验。首先对浓醪酶解时初始基质浓度和酶载量进行选择,接着选择适用于纤维素酶解的添加剂,最后在选择分批补料方式的基础上对基质的分批补料浓醪酶解进行探讨。
1 材料与方法
1.1 材料与试剂
风干甘蔗渣,取自于广西壮族自治区,用筛子筛选尺寸为5 mm×1 mm左右的甘蔗渣在105℃下烘干,塑封袋保存备用,成分如下:纤维素含量为41.41%,半纤维素含量为23.78%,木质素含量为20.78%。工业甘油(质量分数95%) 购自江苏扬州飞扬化工有限公司;纤维素酶CTecⅡ来自诺维信公司馈赠,酶活力为141 FPU/g。
1.2 仪器与设备
高效液相色谱仪,日本HITACHI公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;HYG-A全温摇瓶柜,江苏太仓实验设备厂。
1.3 实验方法
1.3.1 甘蔗渣的常压甘油碱催化有机溶剂预处理
准确称取10 g甘蔗渣,放入500 mL三孔烧瓶内,添加140 g工业甘油和0.3 g NaOH后机械搅拌混匀,NaOH添加量为2 g/L,对应pH大约为8.2(精密pH试纸测定),并于加热套内加热升温,机械搅拌转速为200 r/min,升温至240 ℃后保温蒸煮10 min,蒸煮结束后冷却约15 min降至150 ℃以下,然后缓慢加入150 g沸水,快速搅拌使纤维充分解离,趁热用G1砂芯漏斗过滤,用400 g常温自来水分2次洗涤过滤后,即获得常压甘油碱催化有机溶剂预处理甘蔗渣纤维。主要组成为:57.69%纤维素、28.65%半纤维素、10.74%木质素。
1.3.2 酶解
酶解在100 mL摇瓶中进行,按不同基质浓度称取相应质量的常压甘油碱催化有机溶剂预处理甘蔗渣,按不同的加酶量添加所需的纤维素酶,最后加入适量的pH 4.8柠檬酸缓冲液,使反应体系中液体的体积为25 mL。将摇瓶放置于50 ℃,180 r/min的全温摇瓶柜中酶解,分别在12、24、36、48、72、96 h取样测定。
1.3.3 分析测定
甘蔗渣原料和常压甘油碱催化有机溶剂预处理物料的3大组分含量均采用美国能源实验室(National Renewable Energy Laboratory)NREL法测定[9];滤纸酶活力(FPA)按照国际理论和应用化学协会(International Union of Pure and Applied Chemistry,IUPAC)推荐的国际标准法测定[10];组分含量测定中葡萄糖、木糖和阿拉伯糖浓度采用高效液相(HPLC)法检测,色谱柱采用BioRadAminex HPX-87H (300 mm×7.8 mm),流动相为5 mmol/L H2SO4,流速为0.6 mL/min,柱温60 ℃,示差检测器[11]。酶解过程中还原糖的测定方法采用3, 5-二硝基水杨酸法[12],葡萄糖含量测定采用SBA-40E生物传感分析仪法。所有实验至少重复1次,数据为2次及以上的平均值。
2 结果与讨论
2.1 基质酶解加酶量的选择
前期实验结果显示,常压甘油有机溶剂预处理甘蔗渣在20 g/L的基质质量浓度,加酶量为5 FPU/g基质时,48 h酶解率达到了90%以上,表明了常压甘油有机溶剂预处理后基质具有较好的可酶解性[13-14]。为了探究该纤维素基质在高基质浓度条件下的可酶解性,本论文首先在100 g/L基质质量浓度下考察了5种不同加酶量(3、6、10、13、15 FPU/g基质)对酶解过程中的还原糖酶解率的影响,具体实验结果如图1所示。

图1 浓醪酶解(100 g/L基质质量浓度)加酶量的选择Fig.1 Selection of the enzyme loading to substrates at 100 g/L solid content
从图1可以看出,在酶解前24 h,还原糖的酶解率与加酶量呈明显的正相关关系,酶解率随着加酶量的增加而提高,酶解24 h后,除加酶量为3 FPU/g基质的酶解体系外,其余4种加酶量酶解体系的液化效果均达到了一个较高水平,此时,所有固体基质全部液化,整个酶解体系的传质传热效果较好。这一结果表明,常压碱催化甘油有机溶剂预处理甘蔗渣基质具有较好的可酶解性,分析认为预处理对原料木质素的有效脱除应该是其重要原因[15]。考虑到碱预处理对纤维质木质素选择性脱除效果较好[16],笔者基于课题组已有的常压甘油自催化有机溶剂预处理尝试建立碱催化的常压甘油有机溶剂预处理(详细信息将另文报道),发现碱催化的预处理更能有效溶解脱出甘蔗渣木质素(75%),比自催化预处木质素脱除(65%)提高15%以上。
在加酶量为6 FPU/g基质时,碱催化预处理基质的48 h酶解率为80.65%,酶载量为15 FPU/g基质所对应的酶解率为87.34%。结果表明,基质酶载量为6 FPU/g基质已达到了较高酶解率,与其他高酶载量相比,高的酶载量已不能有效提高酶解率。鉴于纤维素酶成本和采用低酶载量的考虑,后续实验中选择酶载量为6 FPU/g基质。
2.2 浓醪酶解初始基质浓度的选择
在低纤维素酶酶载量条件下实现高基质浓度的酶解转化是实现纤维素乙醇产业化的必要途径[3]。鉴于此,本论文在纤维素酶添加量为6 FPU/g基质的条件下考察了100、120、150、180和200 g/L基质质量浓度时酶解情况。结果如图2所示。

图2 不同基质质量浓度下48 h的酶解率Fig.2 Enzymatic hydrolysis of substrates at different solid content for 48 h
酶解48 h时基质100 g/L质量浓度的酶解率为80.6%,而120 g/L和150 g/L基质浓度条件下所对应的酶解率略有降低,分别为78.8%和76.8%;180 g/L和200 g/L基质质量浓度所对应的酶解率明显降低,在72%左右。可见,基质酶解率与基质浓度呈负相关,随着基质浓度增加,基质酶解率明显下降,这一现象与其他科研工作者的报道相符[8, 17]。在酶解率相同时,基质浓度越高,意味着基质酶解所产糖浓度越高,这对提高纤维素乙醇工业的生产效率具有重大的意义。因此,本研究选择在150 g/L基质浓度条件下进行后续实验。
2.3 不同酶解添加剂对酶解过程的影响
有文献报道[6, 18-19],在酶解过程中添加一定量的表面活性剂可以有效减少酶解过程的酶用量及增加糖得率。前期研究发现,在底物浓度为0.05g/g底物条件下添加2种非离子表面活性剂吐温80和PEG 6000后,葡萄糖产量分别提高20%;席琳乔等发现,添加3.0 g/L的PEG 6000能显著提高棉秆木质纤维素的酶解效率[20]。鉴于此,本论文在150 g/L基质质量浓度和加酶量6 FPU/g基质的条件下考察生物素、赤霉素、聚丙烯酰胺、吐温80和PEG 4000五种添加剂对酶解过程的影响。根据本实验室前期工作及文献报道[8, 11, 18-19, 21-22],选择生物素、赤霉素、聚丙烯酰胺、吐温80和PEG 4000的添加量分别为75、10、0.05、50和10 mg/g基质,实验结果如图3所示。
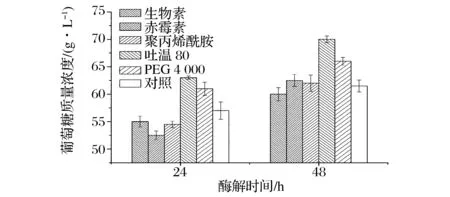
图3 不同添加剂对酶解产糖的影响Fig.3 Effect of different additives on the glucose yield from enzymatic hydrolysis of substrates
从图3可以发现,添加吐温80和PEG 4000对酶解产糖过程起到了明显的促进作用。酶解24 h,添加50 mg/g基质的吐温80所对应葡萄糖产量为63 g/L,添加10 mg/g基质的PEG 4000所对应葡萄糖产量为61 g/L,相比空白对照样品分别提高了10%和7%。同样,48 h时吐温80的添加使得葡萄糖产量提高14%,PEG 4000使得葡萄糖产量提高7%。以上实验数据说明,在酶解过程中添加吐温80和PEG 4000能明显促进纤维素酶酶解,但不同种类的表面活性剂促进效果是可能有差异的。鉴于此,表面活性剂吐温80和PEG 4000被选择用于后续基质浓醪酶解。

图4 PEG 4000和吐温80不同添加量对产糖的影响Fig.4 Effect of the respective dose of PEG 4000 and Tween 80 on the glucose yield from enzymatic hydrolysis of substrates
表面活性剂适宜添加量实验结果如图4所示。由图4可以得出,不同浓度的2种添加剂均对酶解产糖过程起到了一定的促进作用。当PEG 4 000添加量为20 mg/g基质时其对产糖的促进作用最明显,24 h产糖达到了57 g/L,跟空白对照相比提高了9%;当吐温80添加量为30 mg/g基质时,24 h酶解率提高已达最高水平,产糖为59 g/L,比空白对照提高了12%。2种表面活性剂相比,添加吐温80更能促进基质的酶解产糖。这一结果与相关文献报道的结果相似[21, 23-24]。解释添加非离子表面活性剂有利于提高纤维素原料酶解最经典的理论为木质素能够无效吸附纤维素酶的理论。ERICSSON认为,木质纤维素降解过程中,木质素上的大量疏水集团能够与纤维素酶上分子的碳链发生疏水相互作用,对其进行吸附,降低酶解过程中的有效酶量,阻碍纤维素的酶解。添加表面活性剂后,部分表面活性剂可与纤维素酶发生竞争,并部分吸附到木质素表面,从而减少了纤维素酶在木质素表面的无效吸附,最终使整个过程所需的酶负荷量减小,进而提高纤维素原料的酶解率[18, 25]。WILLIAM等人研究发现[22],当添加0.15 g/g干基质的吐温80时纤维素72 h酶解率提高36%,半纤维素酶解率提高18%。吐温80在整个酶解过程的作用主要有3点:纤维素酶稳定剂、木质素破坏剂以及纤维素酶效应物。综上所述,添加吐温80能够促进纤维素酶酶解,这有利于高浓度纤维素基质在低纤维素酶添加量时实现高转化效率。因此,后续实验中选择添加30 mg/g基质的吐温80,以促进基质酶解产糖。
2.4 分批补料浓醪酶解的加酶方式选择
前面基质浓度实验证明了常压碱性甘油预处理甘蔗渣基质具有很好的可酶解性,在酶载量6 FPU/g基质条件下150 g/L浓度基质的48 h酶解率达到了80%。鉴于过高基质浓度的黏度和流体力学问题,本论文采用了分批补料方式进一步提高酶解时的基质浓度[1, 26-27]。实验中选择酶解的初始基质质量浓度为150 g/L,加酶量6 FPU/g基质,在酶解起始12、18、24、30 h分别补加提高50 g/L基质浓度的基质,从而使得酶解30 h时基质质量浓度达到350 g/L,在该条件下考察不同加酶方式对产糖的影响。加酶方式1#是在酶解起始时一次性加入350 g/L基质浓度对应的所有纤维素酶,后面补料时只补加基质;加酶方式2#选择在酶解起始时一次性加入所需纤维素酶总量的2/3,补加基质时再平均补加剩余的1/3的纤维素酶量。
结果如图5所示,加酶方式1#,48 h时葡萄糖产量达到106 g/L,96 h时达到了128 g/L。加酶方式2#,在对应酶解时间点的葡萄糖质量浓度分别为88 g/L和116 g/L。实验表明,在酶解前期一次性添加所有纤维素酶有利于整个分批补料酶解过程的产糖,其葡萄糖产量在整个酶解过程中均明显高于加酶方式2#,加酶方式1#更加有利于分批补料浓醪酶解过程中葡萄糖的生成。该结果似乎与OLOFSSON等人报道相矛盾,他们在利用构建的数学模型研究加酶方式对SSCF过程中糖的转化效率时发现,分批补加纤维素酶有利于糖的转化,其原因在于糖的积累会对纤维素酶造成反馈抑制[28]。不过,本文结果与WANG和GAO等的研究结果一致[29-30],酶解起始时加入所有的纤维素酶能够使基质迅速液化,快速减小酶解液的黏度,当后续补加物料时体系里传质传热均达到了一个比较理想的水平。两种观点不一致的原因可能在于:本实验中基质酶载量相对较低,一次性加酶在促使基质快速液化和减小黏度的同时并没有产生大量葡萄糖以反馈抑制纤维素酶;另外,不同种类纤维素酶对糖反馈抑制的耐受性不同而导致的,本实验中所用的Cellic CTec2酶制剂属于诺维信新一代纤维素酶产品,适用于高浓度基质的酶解发酵,糖浓度耐受性更好。鉴于此,选择加酶方式1#开展后续实验。

图5 分批补料不同加酶方式对产糖的影响Fig.5 Effects of the enzyme feeding mode on enzymatic hydrolysis of substrates
2.5 分批补料基质浓醪酶解产糖
本实验选择初始基质质量浓度为15 g/L,纤维素酶添加量为6 FPU/g基质,吐温80添加量为30 mg/g基质,考察分批补料至350 g/L基质浓度的浓醪酶解。实验结果如图6所示。在酶解前30 h,添加吐温80与否的基质酶解趋势差不多一致,酶解30 h酶解液中葡萄糖质量浓度都在90 g/L左右,此时吐温80添加对酶解产糖未起到明显促进作用。但酶解开始30 h后添加表面活性剂的分批补料浓醪酶解产糖快速提高,72 h基本完成酶解,水解产量基本达到最高水平132 g/L,达到理论产糖量的60%;未添加表面活性剂的分批补料酶解产糖过程相对缓慢,72 h产糖110 g/L,96 h产糖120 g/L。分析认为[22-23],酶解初始时纤维素酶含量较高,相当于14 FPU/g基质,木质纤维素基质结合位点主要被纤维素酶占据,所以吐温80作用不明显;酶解30 h后完成了分批补料,此时醪液中基质浓度是350 g/L,纤维素酶浓度显著降低(理论上为6 FPU/g基质),此时基质的一些结合位点被吐温80占据,所以吐温80此时起发挥有效作用。
不少研究者采取分批补料策略探讨高浓度基质的浓醪酶解,如表1所示。龚信芳等人[31]采用以40 g/L为起始底物浓度,每隔12 h进行补料对木薯渣进行分批补料酶解,使得最终底物浓度为160 g/L,72 h水解液中葡萄糖浓度为65.7 g/L。GAO等[30]以120g/L基质浓度为起始基质浓度,分别在6、12和24 h补加7%基质,从而使得最终基质浓度达到了330 g/L,加酶量10 FPU/g基质,酶解120 h的葡萄糖浓度达到了129.50 g/L,葡萄糖转化率达到了理论值的60%。WANG等[32]在加酶量20 FPU/g纤维素和添加一定量吐温80条件下,以150 g/L基质浓度作为初始基质浓度,在酶解24 h和30 h分别补加50 g/L和100 g/L基质,使得最终基质浓度达到300 g/L,72 h葡萄糖产量为88.95 g/L。

图6 基质的分批补料浓醪酶解Fig.6 Fed-batch thick-mash enzymatic hydrolysis of substrates

表1 不同分批补料酶解结果的对比Table 1 Comparison of various fed-batch thick-mash enzymatic hydrolysis of substrates
相比上述实验结果,本文开展的木质纤维素基质浓醪酶解结果是比较理想的,在实现浓醪酶解 “三高”(高浓度、高转化率和高转化效率)特点方面有明显进展。课题组早期曾评估过常压甘油自催化有机溶剂预基质的可酶解性,发现预处理后麦草具有较好的可酶解性,但该评估是在低基质浓度(20 g/L,加酶量5 FPU/g基质)条件下进行的,缺乏工业应用价值[33]。在此基础上,本文以常压碱性甘油有机溶剂预处理甘蔗渣为原料,探讨预处理后基质浓醪酶解(基质浓度350 g/L, 6 FPU/g基质)的可行性。
3 结论
本论文通过考察不同的加酶方式和不同的添加剂对酶解产糖的影响,利用分批补料酶解手段,使得常压甘油有机溶剂预处理基质在350 g/L质量浓度时酶解72 h,葡萄糖质量浓度为132 g/L,酶解率60%。常压甘油有机溶剂预处理基质在浓醪方面具有很强的可酶解性,实现了在低加酶量条件下的浓醪酶解产糖,这为下一步继续开展低酶载量下浓醪基质的“三高”酶解和纤维素乙醇发酵奠定了基础。
[1] MOHAGHEGHI A,TUCKER M,GROHMANN K,et al.High solids simultaneous saccharification and fermentation of pretreated wheat straw to ethanol[J].Applied Biochemistry and Biotechnology,1992,33(2):67-81.
[2] WINGREN A,GALBE M,ZACCHI G.Techno-economic evaluation of producing ethanol from softwood:Comparison of SSF and SHF and identification of bottlenecks[J].Biotechnology Progress,2003,19(4):1 109-1 117.
[3] HODGE D B,KARIM M N,SCHELL D J,et al.Model-based fed-batch for high-solids enzymatic cellulose hydrolysis[J].Applied Biochemistry and Biotechnology,2009,152(1):88-107.
[4] HE Jie,ZHANG Wen-nan.Techno-economic evaluation of thermo-chemical biomass-to-ethanol[J]. Applied Energy,2011,88(4):1 224-1 232.
[5] LYND L R,LASER M S,BRANSBY D,et al.How biotech can transform biofuels[J].Nature Biotechnology,2008,26(2):169-172.
[6] HERN NDEZSALAS J M,VILLARAM REZ M S,VELOZREND N J S,et al.Comparative hydrolysis and fermentation of sugarcane and agave bagasse[J].Bioresource Technology,2009,100(3):1 238-1 245.
[7] BALS B D,GUNAWAN C,MOORE J,et al.Enzymatic hydrolysis of pelletized AFEXTM-treated corn stover at high solid loadings[J].Biotechnology & Bioengineering,2014,111(2):264-271.
[8] 刘建权,赵晓琴,张裴洋,等.碱性过氧化氢预处理后汽爆玉米秸秆半同步糖化发酵生产乙醇[J].食品与发酵工业,2016,42(11):7-13.
[9] SLUITER A,HAMES B,RUIZ R,et al.Determination of sugars,byproducts,and degradation products in liquid fraction process samples[J].Golden:National Renewable Energy Laboratory,2006.
[10] GHOSE T K.Measurement of cellulase activities[J].Pure & AppliedChemistry,1987,59(2):257-268.
[11] 王亮,刘建权,张喆,等.常压甘油自催化预处理麦草浓醪发酵纤维素乙醇[J].生物工程学报,2015,31(10):1 468-1 483.
[12] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[13] SUN Fu-bao,ZHAO Xiao-qin,HONG Jia-peng,et al.Industrially relevant hydrolyzability and fermentability of sugarcane bagasse improved effectively by glycerol organosolv pretreatment[J].Biotechnology for Biofuels,2016,9(1):1-13.
[14] SUN Fu-bao,WANG Liang,HONG Jia-peng,et al.The impact of glycerol organosolv pretreatment on the chemistry and enzymatic hydrolyzability of wheat straw[J].Bioresource Technology,2015,187:354-361.
[15] GAO Da-hai,HAARMEYER C,BALAN V,et al.Lignin triggers irreversible cellulase loss during pretreated lignocellulosic biomass saccharification[J].Biotechnology for Biofuels,2014,7(1):175.
[16] HE Yu-cai,DING Yun,XUE Yu-feng,et al.Enhancement of enzymatic saccharification of corn stover with sequential Fenton pretreatment and dilute NaOH extraction[J].Bioresource Technology,2015,193:324-330.
[17] DU Jian,ZHANG Fa-zhan,LI Yuan-yuan,et al.Enzymatic liquefaction and saccharification of pretreated corn stover at high-solids concentrations in a horizontal rotating bioreactor[J].Bioprocess and Biosystems Engineering,2014,37(2):173-181.
[18] 孙付保,娄秀平,洪嘉鹏,等.非离子表面活性剂对木质纤维素酶解的促进作用[J].化工进展,2011(12): 2 719-2 723.
[19] 席琳乔,吴书奇,马春晖.非离子表面活性剂PEG对棉秆木质纤维素酶解的影响[J].农业工程学报,2012,28(23):176-183.
[20] 刘媛媛,孙君社,裴海生,等.提高木质纤维素酶水解效率的研究进展[J].中国酿造, 2011, 30(5): 16-20.
[21] HELLE S S,DUFF S J B,COOPER D G.Effect of surfactants on cellulose hydrolysis[J].Biotechnology & Bioengineering,1993, 42(5): 611-617.
[22] KAAR W E, HOLTZAPPLE M T. Benefits from Tween during enzymic hydrolysis of corn stover[J]. Biotechnology & Bioengineering, 1998, 59(4): 419.
[23] KAYA F, JR J A H, JOYCE T W. Influence of surfactants on the enzymatic hydrolysis of xylan and cellulose[J]. Tappi Journal, 1995, 78(10): 150-157.
[24] PARK J W,TAKAHATA Y,KAJIUCHI T,et al.Effects of nonionic surfactant on enzymatic hydrolysis of used newspaper[J]. Biotechnology & Bioengineering,1992, 39(1):117-120.
[25] ERIKSSON T,B RJESSON J,TJERNELD F.Mechanism of surfactant effect in enzymatic hydrolysis of lignocellulose[J].Enzyme & Microbial Technology,2002,31(3):353-364.
[26] BARI I D,VIOLA E,BARISANO D,et al.Ethanol production at flask and pilot scale from concentrated slurries of steam-exploded aspen[J].Industrial &Engineering Chemistry Research,2002,41(7):1 745-1 753.
[27] J RGENSEN H,KRISTENSEN J B,FELBY C.Enzymatic conversion of lignocellulose into fermentable sugars: challenges and opportunities [J].Biofuels Bioproducts & Biorefining,2007,1(2):119-134.
[28] OLOFSSON K,WIMAN M,LID N G.Controlled feeding of cellulases improves conversion of xylose in simultaneous saccharification and co-fermentation for bioethanol production[J].Journal of Biotechnology,2010,145(2):168-175.
[29] WANG Rui-fei,UNREAN P,FRANZ N C J.Model-based optimization and scale-up of multi-feed simultaneous saccharification and co-fermentation of steam pre-treated lignocellulose enables high gravity ethanol production[J].Biotechnology for Biofuels,2016,9(1): 1-13.
[30] GAO Yue-shu, XU Jing-liang, YUAN Zhen-hong, et al. Optimization of fed-batch enzymatic hydrolysis from alkali-pretreated sugarcane bagasse for high-concentration sugar production[J].Bioresource Technology,2014,167(3):41-45.
[31] 龚信芳,李平,梁磊,等.木薯渣分批补料酶水解及酒精发酵的研究[J].食品与发酵工业,2011,37(4):112-116.
[32] WANG Wen,ZHUANG Xin-shu,YUAN Zhen-hong,et al.High consistency enzymatic saccharification of sweet sorghum bagasse pretreated with liquid hot water[J].Bioresource Technology,2012,108(2):252-257.
[33] 孙付保,陈晓旭,娄秀萍,等.提高麦草可酶解性的常压甘油自催化预处理[J].现代化工,2011,31(9):35-38.
Thick-mashenzymatichydrolysisofatmosphericglycerolorganosolvpretreatedsugarcanebagasse
HONG Jia-peng1, YUE Chun2, ZHAO Xiao-qin1, Marie Rose Mukasekuru1,LI-Xiang1, SUN Fu-bao1*, SUN Hai-yan3
1 (The Key Laboratory of Industrial Biotechnology, School of Biotechnology, Jiangnan University, Wuxi 214122, China)2 (School of Biotechnology, Nanyang University of Technology,Nanyang 473004, China)3 (Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences,Haikou 571101, China)
In order to reach the "THREE-HIGH" (High-titer, High-productivity and High-conversion) technical levels of enzymatic hydrolysisat low cellulase loading, the enzymatic hydrolysis at high solid concentration was conducted. The enzymatic hydrolysis conditions were optimized enzyme loading 6 FPU/g substrate, substrate concentration 150 g/L) and the suitable additive (Tween 80 30 mg/g substrate. Further, a fed-batch strategy was adopted to make the final solid concentration up to 35%, followed by detecting a reasonable cellulase addition way.Finally, the final glucose yield achieved 132 g/L at 72 h from the fed-batch thick-mash enzymatic hydrolysis, with 60% of the cellulose conversion.Results indicate that the atmospheric alkali-catalyzed glycerol pretreated substrate very applicable and attractive for the thick-mash enzymatic hydrolysis at a low cellulase loading. The feedbatcha preferable way to realize "THREE-HIGH" technological level of thick-mash enzymatic hydrolysis of lignocellulosic biomass.
atmospheric glycerol organosolv pretreatment; sugarcane bagasse; thick-mash enzymatic hydrolysis; fed-batch; surfactant
10.13995/j.cnki.11-1802/ts.014387
硕士研究生(孙付保为通讯作者,E-mail: fubaosun@jiangnan.edu.cn)。
国家自然科学基金(21176106):中国博士后科学基金(2015M571666;2016T90419);江苏省生物质绿色燃料与化学品重点实验室资助课题(JSBGFC14006);河南省科技开放合作项目(162106000007)
2017-03-21,改回日期:2017-04-27

