天然海水与人工海水对凡纳滨对虾生长及代谢基因表达的影响
胡利华,查珊洁,刘广绪,张 敏,王瑶华,肖国强,闫茂仓,黄贤克*
(1.浙江省海洋水产养殖研究所,浙江 温州 325005;2.浙江大学动物科学学院,浙江 杭州 310058;3.浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005)
天然海水与人工海水对凡纳滨对虾生长及代谢基因表达的影响
胡利华1,3,查珊洁2,刘广绪2,张 敏1,3,王瑶华1,3,肖国强1,3,闫茂仓1,3,黄贤克1,3*
(1.浙江省海洋水产养殖研究所,浙江 温州 325005;2.浙江大学动物科学学院,浙江 杭州 310058;3.浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005)
养殖海水的质量是影响凡纳滨对虾生殖、发育、代谢生长的关键环境因素之一,因此明确不同养殖海水(天然海水、人工海水)对凡纳滨对虾的影响,对凡纳滨对虾养殖产业具有重要的实践指导意义。本研究通过养殖试验和荧光定量PCR技术,对比分析了天然海水、人工海水对雌、雄凡纳滨对虾10个生长与形态指标的影响,并探讨了其对雌、雄凡纳滨对虾关键代谢供能基因己糖激酶(HK)、丙酮酸激酶(PK)、异柠檬酸脱氢酶(IDH)和肉毒碱棕榈酰基转移酶(CPT1)表达的作用。研究结果表明,在天然海水中养殖的凡纳滨对虾,不论雌雄个体,其生长指标(体长、体重、头甲长、头甲宽、躯体周长、肌肉重)均显著高于人工海水饲养组(P<0.05)。进一步的基因表达分析表明,除了雌性对虾的IDH基因被诱导表达之外,人工海水养殖显著抑制了雌、雄凡纳滨对虾代谢供能基因PK、HK、CPT1的表达(P<0.05)。
天然海水;人工海水;凡纳滨对虾;生长;代谢供能;基因表达
凡纳滨对虾(Litopenaeusvannamei)俗称南美白对虾,能广泛适应不同盐度水平,且具有含肉率高、抗逆性强、生长快等优点,是目前我国重要的对虾养殖品种之一[1-3]。近年来,随着凡纳滨对虾海水淡化养殖技术的快速发展,凡纳滨对虾淡水养殖产业得到了迅速发展[4-6]。以沿海省份浙江2014年的统计数据为例,淡水养殖凡纳滨对虾产量8.07×104t,远高于其海水养殖产量的3.10×104t。在养殖实践中,临海的凡纳滨对虾繁育与养殖企业多采用梯度稀释的天然海水(Natural seawater,NSW)进行淡化驯养,而远离海岸的内陆淡水养殖企业则多采用人工配制海水进行初期稳定暂养。因此了解天然海水、人工海水(Artificial seawater,ASW)对凡纳滨对虾的影响,对解决凡纳滨对虾养殖产业中存在的现实问题具有重要的指导意义[6-8]。
在众多的指标中,生长与形态性状既是凡纳滨对虾的经济评价指标,也是重要的机体状态评价指标[9],通过生长与形态指标的测定与对比分析,可以较为综合地反映出不同水体环境对凡纳滨对虾的影响[10-11]。生物体通过三羧酸循环、糖酵解和氧化磷酸化等重要的分子通路进行三大营养物质(糖、脂、蛋白质)的代谢,从而为正常生命活动提供所需的能量供给[12]。己糖激酶(Hexokinase,HK)和丙酮酸激酶(Pyruvate kinase,PK)是糖酵解通路中重要的变构调节酶[13-14];异柠檬酸脱氢酶(Isocitrate dehydrogenase,IDH)是三羧酸循环中的主要限速酶[12,15];而肉毒碱棕榈酰基转移酶(Carnitine palmitoyltransferase 1,CPT1)则是在脂肪酸氧化供能中的重要限速酶[12,16],因此上述基因的表达可一定程度上在分子层面反映出生物体的代谢水平。
为探明天然海水与人工配制海水对凡纳滨对虾生长形态性状和机体分子代谢的影响,本研究通过生态养殖试验对比分析了两种海水对养殖雌、雄凡纳滨对虾体长、体重、头甲长、头甲宽、躯体周长、肌肉重等10个生长形态指标的影响,利用分子生物学技术探讨了两种海水养殖对凡纳滨对虾生长影响的分子机理。本研究结果将有助于为凡纳滨对虾养殖产业合理选择淡化驯养、养殖培育方式提供基础研究数据支持。
1 材料与方法
1.1 凡纳滨对虾的获得与暂养
体格均一的凡纳滨对虾[体长(9.67±0.3)cm,体重(10.05±0.5)g]取自浙江省海洋水产养殖研究所清江试验场。凡纳滨对虾在室内养殖池内暂养7 d后[期间水温、pH、盐度分别控制在(28.8±0.6)℃、(8.3±0.2)和(29.8±0.4)]用于养殖试验。驯养期间分别在08∶00,12∶00,16∶00和20∶00四次投喂体重比1/15的沙蚕,并每天换水1次。
1.2 天然海水和人工海水的来源
天然海水来源、取水时间和水处理方法:2016年7月1日,将乐清湾海区清江支流的自然海水[盐度(18±0.6)]在涨潮时利用水闸抽取至浙江省海洋水产养殖研究所清江基地蓄水塘,经二级砂滤后,再经杭州帕尔水处理科技有限公司组装的海水浓缩装置后获得[盐度(29.8±0.4)]。海水浓缩过滤装置主要由微滤膜过滤和反渗透膜分离两部分组成,其具体步骤如表1所示。

表1 海水浓缩装置
人工海水的配置:将抽取到基地蓄水塘的海水和海水晶配置而成[盐度(29.8±0.4)],海水晶成分如表2所示。
1.3 天然海水与人工海水养殖试验
在1 t水体养殖桶内分别加入等量的天然海水或人工海水进行养殖试验。每组试验设置三个平行重复,各放置经过暂养的凡纳滨对虾50尾。试验中,每天分四次投喂对虾体初始体重1/15的活体沙蚕,并换水一次。整个养殖试验(为期15 d)在相对稳定的水体环境温度(28.8±0.6)℃、pH(8.3±0.2)条件下进行。

表2 海水晶的主要成分
1.4 生长与形态指标的测定
参照董世瑞[17]、吴立峰[18]、柴展[19]等的研究方法,养殖试验结束后,于每平行试验组随机选取雌、雄凡纳滨对虾各10尾,先将虾体用纱布抹干,利用游标卡尺和卷尺对其体长、体重、头甲长、头甲宽、躯体周长(使用卷尺测量躯体第一节和最后一节的周长,求平均值)进行测量,然后去除虾壳、附肢、鳃、胃等非肌肉部分,得到的肌肉用拧干水的纱布吸干后,在电子天平上对其肌肉进行称重,随后计算体长/体重(BL/BW)、头甲长/头甲重(HL/HW)、头甲长/体长(HL/BL)和含肉率(肌肉重量占体重的百分比即为含肉率)。
1.5 PK、HK、IDH、CPT1基因表达荧光定量PCR分析
于每试验组随机选取雌、雄凡纳滨对虾各5尾,冰上解剖取肝胰腺与肌肉组织,使用RNAprep Pure组织样提取试剂盒(Tiangen,DP431)提取组织混合样总RNA,利用M-MLV反转录试剂盒(Invitrogen,C28025-032)制备cDNA模版。使用CFX96TM(Bio-Rad)进行荧光定量PCR分析。

表3 PCR及qt-PCR引物的设计
10 μL的荧光定量PCR反应体系包括了5 μL SsoFastTMEvaGreen Supermix(Bio-Rad,172-5201AP)、2 μL cDNA模版、0.3 μL上下游引物和2.4 μL ddH2O。扩增程序为95℃ 5 min,94℃ 20 s,61℃ 20 s,72℃ 20 s,共40个循环。试验中以β-actin为内参,采用2-ΔΔCt法测定基因的相对表达量用于统计分析。内参β-actin与PK、HK、IDH、CPT1基因引物序列如表3所示。
1.6 统计分析
在对生长形态性状数据进行正态性(Shapiro-Wilk’s test)和方差齐性(Levene’s test)检验后,利用统计分析软件OriginPro 8.0进行单因素方差分析(One-way ANOVA)和Tukey HSD检验。统计分析前对不满足正态性和方差齐性的比例数据均预先进行了反正弦转化,所有数据在本文中均以平均值±标准方差的方式表述,并以P<0.05作为统计检验的显著性标准[20]。参照Tallarida与Murray的方法[21],通过Duncan检验对相应基因表达进行分析,并参照Young等[22]的方法以相对值在结果中表述。
2 结果
2.1 天然海水与人工海水对凡纳滨对虾生长形态指标的影响
如表4所示,不同海水养殖对凡纳滨对虾的生长与形态具有显著性的影响。天然海水中养殖的凡纳滨对虾的体长、体重、头甲长、头甲宽、肌肉重和躯体周长均显著优于人工海水养殖组。而且天然海水饲养的雌性凡纳滨对虾的体长/体重(BL/BW)显著小于人工海水养殖试验组(P<0.05),因此在体型上更为粗壮。此外,天然海水饲养的雄性凡纳滨对虾的头甲长/体长(HL/BL)显著高于人工海水养殖试验组(P<0.05),说明雄性对虾的头部发育在天然海水中更为理想。养殖于天然海水和人工海水中的凡纳滨对虾在头部形态(HL/HW)与含肉率上并无显著差异。

表4 天然海水与人工海水对雌、雄性凡纳滨对虾生长与形态指标的影响
注:不同上标表示天然海水与人工海水两组之间具有显著性差异,P<0.05。
Note:Different superscript showed significant difference,P<0.05.
2.2 天然海水与人工海水对凡纳滨对虾PK、HK、IDH、CPT1基因表达的影响
如图1所示,与天然海水相比,人工海水养殖显著抑制了雄性凡纳滨对虾关键代谢供能基因丙酮酸激酶(PK)、己糖激酶(HK)、异柠檬酸脱氢酶(IDH)和肉毒碱棕榈酰基转移酶(CPT1)的表达。与之类似,雌性凡纳滨对虾PK、HK、CPT1基因在人工海水试验组中的表达水平也显著低于天然海水养殖试验组(图2)。但与雄性对虾试验结果不同,雌性对虾IDH基因的表达则在人工海水中显著上调(图2)。
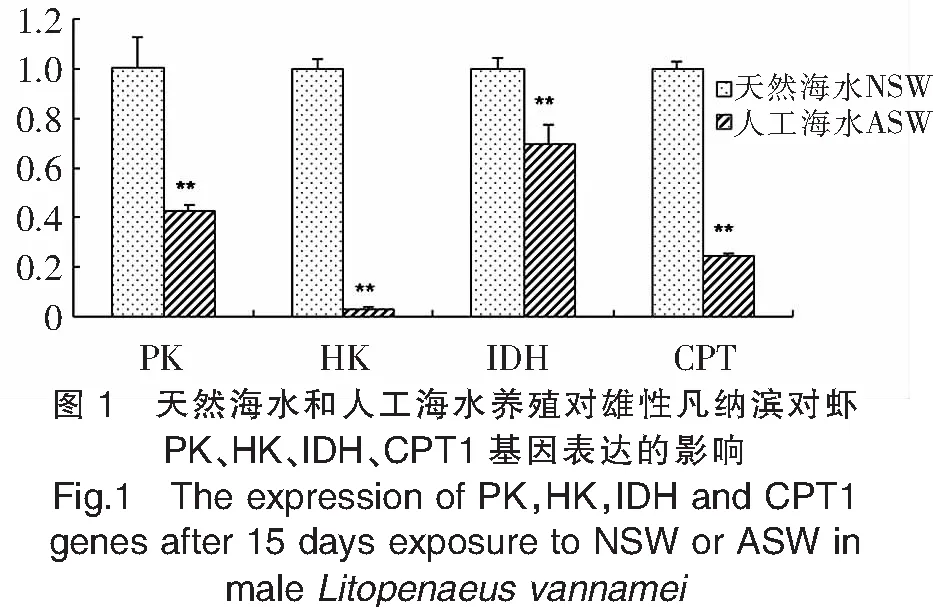
注:**表示两组之间具有显著差异。
Note:**indicated significant differences atP<0.05.

注:**表示两组之间具有显著差异。
Note:**indicated significant differences atP<0.05.
3 讨论
为满足非临海地区海水亲本培育、育苗、养殖、淡化驯养的需要,人工海水在诸如凡纳滨对虾幼虾等海水经济物种的养殖中被广泛使用。例如,为扩大养殖规模、避免虾苗长途运输损失等,崔建荣等[23]、屈锐等[24]分别开展了凡纳滨对虾人工海水育苗养殖的相关研究,并取得了较好的实际效果。然而到目前为止,天然海水、人工海水养殖凡纳滨对虾实际效果的对比分析尚未见报道。由于人工配制海水在理化与生物特性上与天然海水仍存在一系列的差异[24-25],因此明确天然海水与人工配制海水在凡纳滨对虾养殖中的不同,对凡纳滨对虾养殖产业中合理选择亲本培育、繁育育苗与淡化驯养方式具有重要的指导意义。
本研究获得的试验结果表明,人工海水养殖的凡纳滨对虾在生长性能上显著差于天然海水,在分子水平上可能是由于代谢供能基因的表达受到抑制所致。人工海水养殖的雌性凡纳滨对虾的IDH基因显著上调,可能是因为雌性对虾在发育过程中能量需求较大,本身糖代谢水平较高,而IDH是三羧酸循环中的关键酶,是催化三羧酸循环的第二次氧化作用的酶,也是重要的调节酶。此酶的活性决定糖的氧化还原及其代谢作用的发挥,其功能几乎是不可替代的,另外,在人工海水中,其他能量代谢相关基因都被抑制,对于IDH可能存在一种补偿机制使其上调表达[26-28]。到目前为止,天然海水与人工海水的养殖对比试验仍少有报道,但王嫣等[29]的研究发现天然海水饲养的文昌鱼(Branchiostomabelcheri)的体长增长率(10.9%)显著高于人工海水饲养组(7.7%),说明人工海水抑制海洋物种生长的现象并非个例。
在本研究中,人工海水和天然海水在理化特性上的不同可能是导致生长性能和分子代谢差异的主要原因[23,25]。一方面,尽管人工海水是在参照天然海水的无机盐成分基础上,模拟天然海水调配而成,但由于人工海水缺乏天然海水中所含的例如藻多糖、有益微生物、维生素C等生物活性物质,因此可能造成凡纳滨对虾养殖中生物环境条件与营养因子的失衡,进而导致其生长和分子代谢受到抑制[30-32]。另一方面,由于用于配制人工海水的海水晶、海盐在制备过程中普遍采用了蒸发、浓缩等加工工艺,因此不仅会造成部分微量与痕量元素随蒸气流失,并可能使部分金属阳离子无机盐的存在形式发生改变,从而对所养殖的凡纳滨对虾的生长代谢产生影响[33]。此外,之前的研究还发现配制的人工海水还普遍存在氨氮、pH偏高的问题[34-35],因此人工海水可能对养殖的凡纳滨对虾造成环境压力,从而使其生长代谢受到抑制。
虽然本研究反映出海水晶配制的人工海水在凡纳滨对虾养殖应用中尚存在部分问题,但其关键限制因素尚不明晰,仍需开展进一步的研究加以分析验证。在探明人工海水抑制凡纳滨对虾生长代谢关键因子的基础上,基于之前的研究报道,通过添加合适的益生菌[36-38]、生物活性物质[39-41]、微量元素[42-43],适当地调节水体氨氮[44]与金属阳离子(例如Ca2+、Mg2+、K+)浓度[45-46],并配以均衡的营养饲料[30-32,47-48],有望解决人工海水抑制凡纳滨对虾生长代谢的问题。
[1]王兴强,马甡,董双林.凡纳滨对虾生物学及养殖生态学研究进展[J].海洋湖沼通报,2004,37(4):94-100.
[2]符云,麦良彬,钟小庆.2016年全国南美白对虾养殖渔情报告[J].当代水产,2017,42(3):43-45.
[3]熊建华,赵永贞,高永华,等.凡纳滨对虾良种培育研究进展[J].南方农业学报,2011,42(5):556-561.
[4]李世凯,江敏,戴习林,等.凡纳滨对虾池塘水质及对虾肌肉品质的对比分析[J].上海海洋大学学报,2012,12(6):955-964.
[5]索建杰,王玉玮,姜玉声,等.三种凡纳滨对虾养殖模式的水质特征及养殖效果[J].水产学杂志,2015,2(5):12-17.
[6]马行厚,齐绍武,刘臻,等.南美白对虾大水面淡水养殖技术及效益分析[J].水产养殖,2015,36(6):37-39.
[7]徐镇,江锦坡.人工海水培育南美白对虾幼体的初步研究[J].水产养殖,2003,24(1):42-43.
[8]屈锐,江敏,李世凯.凡纳滨对虾人工海水育苗池水质研究[J].广东农业科学,2012,39(1):120-123.
[9]吴立峰,张吕平,沈琪,等.凡纳滨对虾不同家系的形态性状对体重的影响[J].海洋湖沼通报,2010,37(2):37-48.
[10]查广才,周昌清,黄建荣,等.低盐度养殖的凡纳滨对虾体长和体重的增长规律[J].水产学报,2006,30(4):489-494.
[11]文国樑,李卓佳,林黑着,等.规格与盐度对凡纳滨对虾肌肉营养成分的影响[J].南方水产科学,2007,3(3):31-34.
[12]王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2002:63-90.
[13]郭彪,王芳,侯纯强,等.温度突变对凡纳滨对虾己糖激酶和丙酮酸激酶活力以及热休克蛋白表达的影响[J].中国水产科学,2008,15(5):885-889.
[14]Sanchez-Paz A,Sonanea-Organis J G,Peregrino-Uriarte A B,et al.Response of the phosphofructokinase and pyruvate kinase genes expressed in the midgut gland of the Pacific white shrimpLitopenaeusvannameiduring short-term starvation [J].Journal of Experimental Marine Biology and Ecology,2008,362(2):79-89.
[15]张贝贝,陶张欢,汪新颖,等.单体异柠檬酸脱氢酶的研究进展[J].安徽农学通报,2009,15(12):43-47.
[16]魏婷,张永煜,张庆华.肉毒碱棕榈酰基转移酶1A的研究进展[J].生命科学,2013,25(6):614-620.
[17]董世瑞,孔杰,万初坤,等.中国对虾形态性状对体重影响的通径分析[J].海洋水产研究,2007,28(3):15-22.
[18]吴立峰,张吕平,沈琪,等.凡纳滨对虾不同家系的形态性状对体重的影响[J].海洋湖沼通报,2010,37(2):37-48.
[19]柴展,栾生,罗坤,等.基于家系水平的凡纳滨对虾(Litopenaeusvannamei)保种群体出肉率与表型性状的相关性分析[J].渔业科学进展,2015,36(6):63-70.
[20]Zar J H.Biostatistical analysis[M].Englewood:Prentice-Hall,1999.
[21]Tallarida R J,Murray R B.Duncan multiple range test in Manual of pharmacologic calculations[M].Berlin:Springer,1987:125-127.
[22]Young L G,Nelson L.Calcium ions and control of the motility of sea urchin spermatozoa[J].Journal of Reproduction and Fertility,1974,41(2):371-378.
[23]崔健荣,陈丹,莫旺成,等.南美白对虾立体高效混养技术研究[J].科学养鱼,2013,29(11):29-30.
[24]屈锐,江敏,李世凯.凡纳滨对虾人工海水育苗池水质研究[J].广东农业科学,2012,39(1):120-123.
[25]覃莜琦.研究与探讨人工海水水质及其对海豚的影响[J].科技创业家,2011,(10):214-215.
[26]李太武,苏秀榕.中国对虾和日本对虾6种同工酶的比较研究[J].海洋学报,1997,19(2):85-88.
[27]王伟继,孔杰,邓景耀,等.中国对虾(Penaeuschinensis)4个种群的同工酶遗传变异[J].生物多样性,2001,9(3):241-246.
[28]申树芳,张英锋.异柠檬酸脱氢酶[J].化学教育,2016,37(2):2-5.
[29]王嫣,赵平孙,王珺.以人工海水和天然海水饲养的文昌鱼生长发育的比较[J].海南大学学报(自然科学版),2002,20(1):62-66.
[30]周歧存,丁燏,郑石轩,等.维生素C对凡纳滨对虾生长及抗病力的影响[J].水生生物学报,2004,28(6):592-598.
[31]陈乃松,魏涛涛,廖奕招.蝇蛆粉和β-葡聚糖对凡纳滨对虾生长和免疫的影响[J].水产学报,2007,31(6):771-777.
[32]雷爱莹,杨琼,李莉萍.复合海藻多糖对凡纳滨对虾生长和抗病力影响的试验报告[J].广西畜牧兽医,2014,(3):160-162.
[33]李凤华,王安利.饵料和环境中的微量元素对虾类的影响[EB/OL].(2001-11-01)[2017-12-05].http://epub.net/kns/brief/default-result.aspx.
[34]Mallasen M,Valenti W C.Comparison of artificial and natural,new and reused,brackish water for the larviculture of the freshwater prawnMacrobrachiumrosenbergiiin a recirculating system[J].Journal of the World Aquaculture Society,1998,29(3):345-350.
[35]Bielmyer G K,Klaine S J,Tomasso J R,et al.Changes in water quality after addition of sea salts to fresh water:implications during toxicity testing[J].Chemosphere,2004,57(11):1707-1711.
[36]朱学芝,郑石轩,潘庆军,等.微生态制剂对凡纳滨对虾生长及水质的影响[J].中山大学学报(自然科学版),2008,47(S1):58-62.
[37]宋奔奔,傅松哲,刘志培,等.水体中添加两种菌剂对凡纳滨对虾存活、生长及消化酶活力的影响[J].海洋科学,2009,33(4):1-5.
[38]王晓琳,马甡,单洪伟.两株潜在益生菌安全性评价及其对凡纳滨对虾免疫力和抗WSSV能力的影响[J].中国海洋大学学报(自然科学版),2016,46(10):39-47.
[39]张继平,郭照良.小球藻对降低南美白对虾养殖水体中亚硝酸盐氮含量的研究[J].水产科学,2006,25(10):517-519.
[40]单洪伟,高磊,马甡.甘蔗渣作为底质对凡纳滨对虾生长和养殖环境的影响[J].中国海洋大学学报,2013,43(8):37-43.
[41]郑辉,许文超.4种海藻在南美白对虾养殖水体中的生态作用[J].河南农业科学,2016,45(5):144-147.
[42]李远林,庄世鹏,张晓辉.硒铬钴锰对水产动物免疫机能的影响[J].江西水产科技,2010,(2):1-4.
[43]杨春浩,金红春,项迪平.南美白对虾淡化标粗微量元素应用初探[J].水产养殖,2015,36(11):5-6.
[44]姜令绪,潘鲁青,肖国强.氨氮对凡纳滨对虾免疫指标的影响[J].中国水产科学,2004,11(6):537-541.
[45]杨金芳.添加钾离子对低盐度水体养殖凡纳滨对虾(Litopenaeusvannamei)的生长与生理特征影响[D].湛江:广东海洋大学,2011.
[46]戴习林,张立田,藏维玲,等.Ca2+、Mg2+、盐度对凡纳滨对虾存活、生长及风味的影响[J].水产学报,2012,36(6):914-921.
[47]雷爱莹,江林源.蜈蚣藻多糖对凡纳滨对虾免疫相关基因表达的影响[J].南方农业学报,2014,45(4):682-686.
[48]刘群芳,曹俊明,黄燕华,等.β-葡聚糖与硒、维生素E联合添加对凡纳滨对虾生长、血清免疫和抗氧化指标及抗病力的影响[J].中国水产科学,2013,20(5):997-1006.
ImpactsofnaturalseawaterandartificialseawateronthegrowthperformanceandexpressionofmetabolicgenesofPacificwhiteshrimp
HU Lihua1,3,ZHA Shanjie2,LIU Guangxu2,ZHANG Min1,3,WANG Yaohua1,3,XIAO Guoqiang1,3,YAN Maocang1,3,HUANG Xianke1,3*
(1.Zhejiang Mariculture Research Institute,Wenzhou 325005,China;2.College of Animal Sciences,Zhejiang University,Hangzhou 310058,China;3.Key Laboratory of Biological Resources Development and Protection in Coastal Waters,Zhejiang Province,Wenzhou 325005)
The quality of seawater is one of the most important environmental factors affecting the reproduction,development,metabolism and growth of Pacific white shrimp(Litopenaeusvannamei).Therefore,knowing the impacts of different types of seawater(natural seawater and artificial seawater)on white shrimp aquaculture will provide important information for the aquaculture industry.In the present study,rearing experiment and qPCR were conducted to investigate the impacts of two types of seawater on the growth performance and expression of metabolic genes of Pacific white shrimp.The results obtained showed thatP.aibuhitensisreared in natural seawater had significantly greater body length,body weight,head length,head width,muscle weight,and body circumference(P<0.05).In addition,except the expression of IDH gene of female shrimps,the gene expression of PK,HK,IDH,and CPT1 were generally depressed in the artificial seawater groups(P<0.05),which may partially explain the hampered growth performance detected.
natural seawater;artificial seawater;Pacific white shrimp;growth performance;metabolism;gene expression
2017-09-03
浙江省农业(水产)新品种选育重大科技专项(2016C2055-5);浙江省科技计划项目(2017F30043);温州市科技计划项目(N20140015);温州市科技计划项目(N20150040).
胡利华(1982-),男,汉族,湖南岳阳人,工程师,硕士研究生,主要从事水产增养殖研究.E-mail:hulihua1208@163.com
黄贤克(1981-),男,工程师;研究方向:海水增养殖研究.E-mail:hxkdu@163.com
胡利华,查珊洁,刘广绪,等.天然海水与人工海水对凡纳滨对虾生长及代谢基因表达的影响[J].渔业研究,2017,39(6):437-443.
S967.9
A
1006-5601(2017)06-0437-07

