RAPD分子标记对工业大麻诱变材料的分析
姜 颖,张丽娜,潘冬梅,韩承伟,王晓楠,曹 焜,韩喜财,孙宇峰
(1.黑龙江省科学院大庆分院,黑龙江 大庆 163319;2.黑龙江八一农垦大学,黑龙江 大庆 163319)
大麻(Cannabis sativaL.)为大麻科(Cannabinaceae)大麻属(CannabisL.)一年生草本植物[1-2],在我国已有 5 000多年的栽培利用历史,是我国传统经济作物,具有重要的工业及药用价值[3-4]。采用欧盟的划分标准即THC<0.3%为无毒大麻即工业大麻,世界各国都只允许种植工业大麻。大麻的产品利用涉及纺织、服装、造纸、军需、化工、建材、生物能源、食品及制药等多个方面[5-9]。因此,培育高产、优质、高纤、低毒的工业大麻新品种尤为重要。
诱变育种是利用物理或化学的诱变剂处理植物材料如种子、植物或其他器官,使其遗传物质发生改变,产生各种突变,然后在发生突变的个体中选择符合人们需要的植株进行培育,从而获得新品种。随机扩增多态 DNA(Random Amplified Polymorphic DNA,RAPD)具有操作简便、不需提前知道材料基因信息、检测灵敏、多态性强等特点,是目前研究植物种群遗传变异、种质资源评估、栽培植物品种鉴定等方面广泛采用的一种分子标记法[10]。RAPD技术现已广泛应用于作物育种、分子生物学、生态学、植物抗病性以及植物质量性状的标记等研究领域。鉴于此,本研究利用RAPD分子标记技术对EMS化学诱变和Co60-γ射线物理诱变进行变异分析,为工业大麻突变产生提供充分的分子生物学依据。
1 材料与方法
1.1 化学诱变材料的创建与选择
试验于2015年4月28日至2016年9月24日在黑龙江省大庆市东风农场进行。用pH 7.5、0.1 mol/L磷酸钾缓冲液和二甲基亚砜(DMSO)配制EMS,设0、0.4%、0.8%、1.25%、2.0% 5个EMS浓度,对火麻一号工业大麻种子分别浸种处理6 h后,用0.1 mol/L硫代硫酸钠溶液冲洗5次,每次静置5 min以终止反应[5]。然后播种,行距0.30 m,株距0.03 m,田间管理按一般试验田进行,按单株收获。将收获的M1代种子第二年继续播种,小区面积为2.0 m×2.0 m,采用单粒点播,行距0.30 m,株距0.06 m。田间管理按一般试验田进行,适时收获M2代种子。
1.2 物理诱变材料的创建与选择
利用Co60-γ射线对五常40、农安2、火麻一号、格里昂、格里西亚5个工业大麻干种子进行处理,设5个剂量,分别为0、50、100、150、200 Gy,剂量率为0.10 Gy/min。处理后的种子直接播种于温室,田间管理按一般试验田进行,适时收获M1代种子。
1.3 RAPD分子标记鉴定
将收获的工业大麻种子整齐排列在铺有滤纸的培养皿中,置于人工气候培养箱内,24℃恒温、光下进行发芽试验,一段时间后取叶片样品,液氮中速冻,存于-80℃待用。取100 mg样品经液氮研磨后,用ProbeGene公司的植物基因组DNA提取试剂盒进行DNA提取,最后溶于100 μL洗脱缓冲液EB中备用。
RAPD分子标记反应体系:ddH2O 8.0 μL,2×Taq Master Mix 10.0 μL,DNA 1.0 μL,Primer 1.0 μL。反应条件:预变性94℃ 5 min;变性94℃ 1 min、复性36℃ 1 min、延伸72℃ 2 min,35个循环;再延伸72℃ 5 min,4℃保存。所选引物[11]如表1所示。
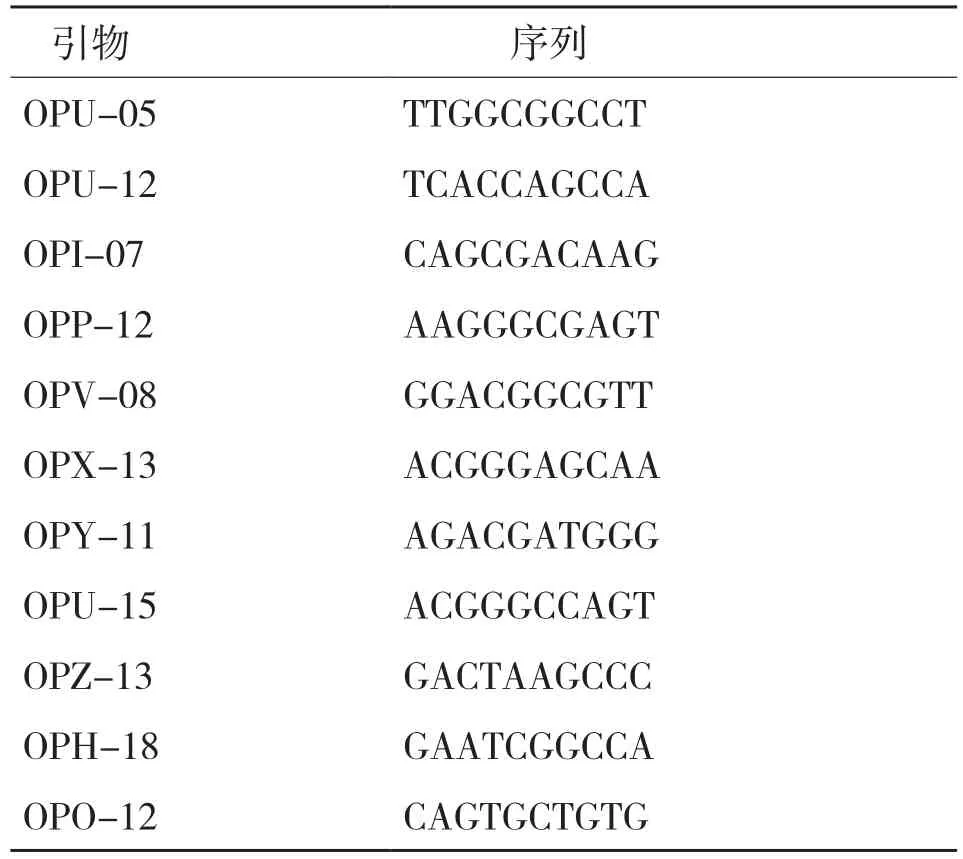
表1 大麻RAPD分析适宜的引物及核苷酸序列(5′-3′)
1.4 数据处理
采用Gel-Pro analyzer软件对扩增条带进行分析,转换成“0”和“1”;然后利用NTSYSpc(W)软件和SLT_NTsys_2.10e软件结合,进行树状图的构建。
2 结果与分析
2.1 DNA的提取
由于大麻含酚类化合物较多(目前已报道的有61种),在DNA的提取过程中极容易被氧化[12],本试验利用DNA提取试剂盒可获得纯度较高的DNA样品(图1),RAPD分析标记以提取的DNA样品为模板进行PCR反应。
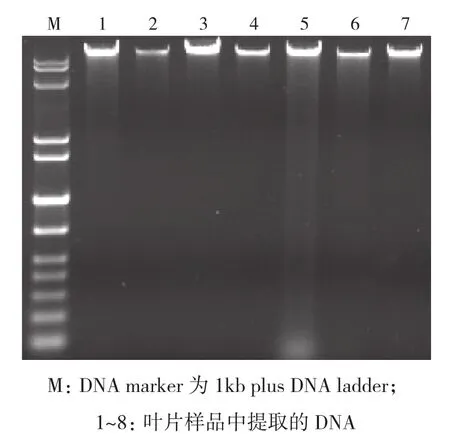
图1 诱变材料叶片中提取的DNA
2.2 化学诱变材料的RAPD分析
选择24株EMS诱变材料进行RAPD分子标记分析,引物OPV-08扩增结果如图2所示。对11个引物扩增的结果进行分析,构建树状图,从图3可以得出,与对照相比基因差异性最大的为c19、c20、c23,其EMS诱变浓度为2%。
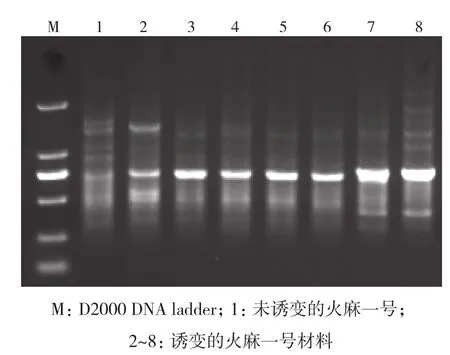
图2 引物OPV-08扩增结果
2.3 物理诱变材料的RAPD分析
2.3.1 农安2 选择19株物理诱变的农安2材料进行RAPD分子标记分析,引物OPI-07扩增结果如图4所示。对11个引物扩增的结果进行分析,构建树状图,从结果(图5)可以得出,与对照相比基因差异性较大的为c13、c14、 c18、c19,其诱变剂量在150~200 Gy之间。

图3 火麻一号化学诱变树状图
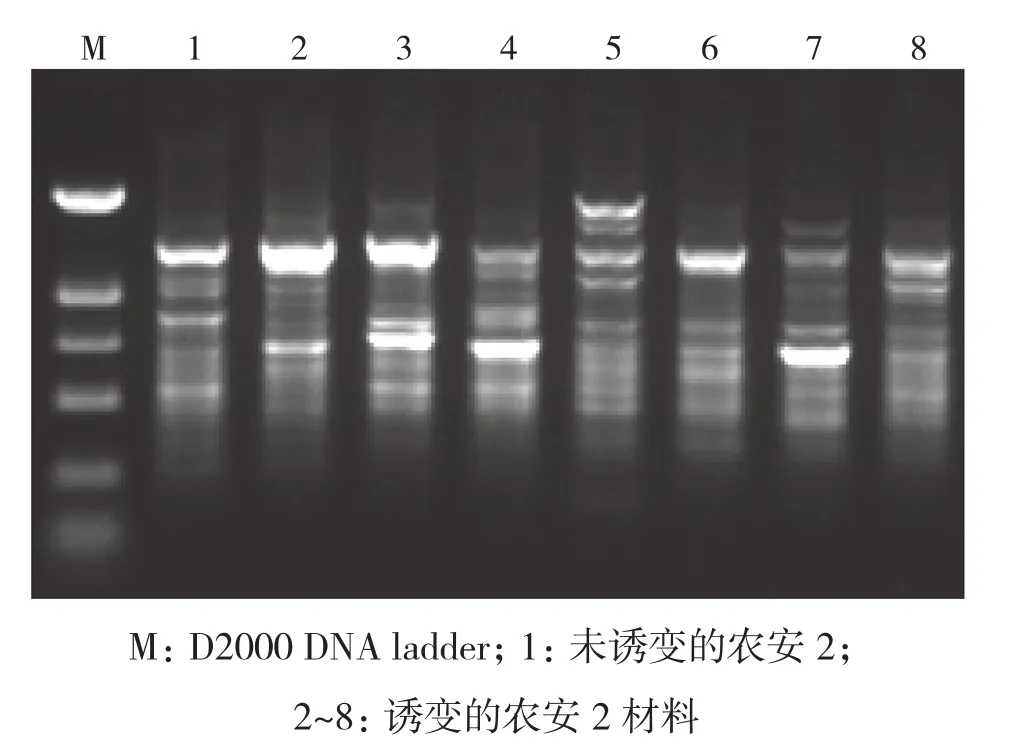
图4 引物OPI-07扩增结果
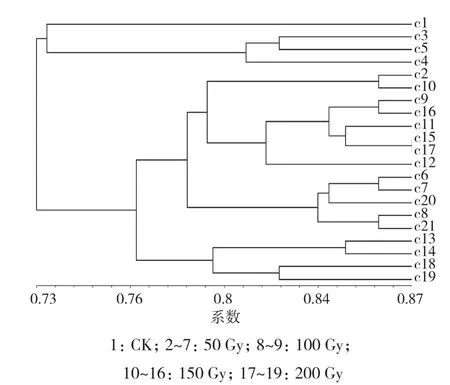
图5 农安2物理诱变树状图
2.3.2 火麻一号 选择29株物理诱变的火麻一号材料进行RAPD分子标记分析,引物OPP-12扩增结果如图6所示。对11个引物扩增的结果进行分析,构建树状图,从结果(图7)可以得出,与对照相比基因差异性较大的为c14、c15、c19、c20,其诱变剂量在100~150 Gy之间。

图6 引物OPP-12扩增结果
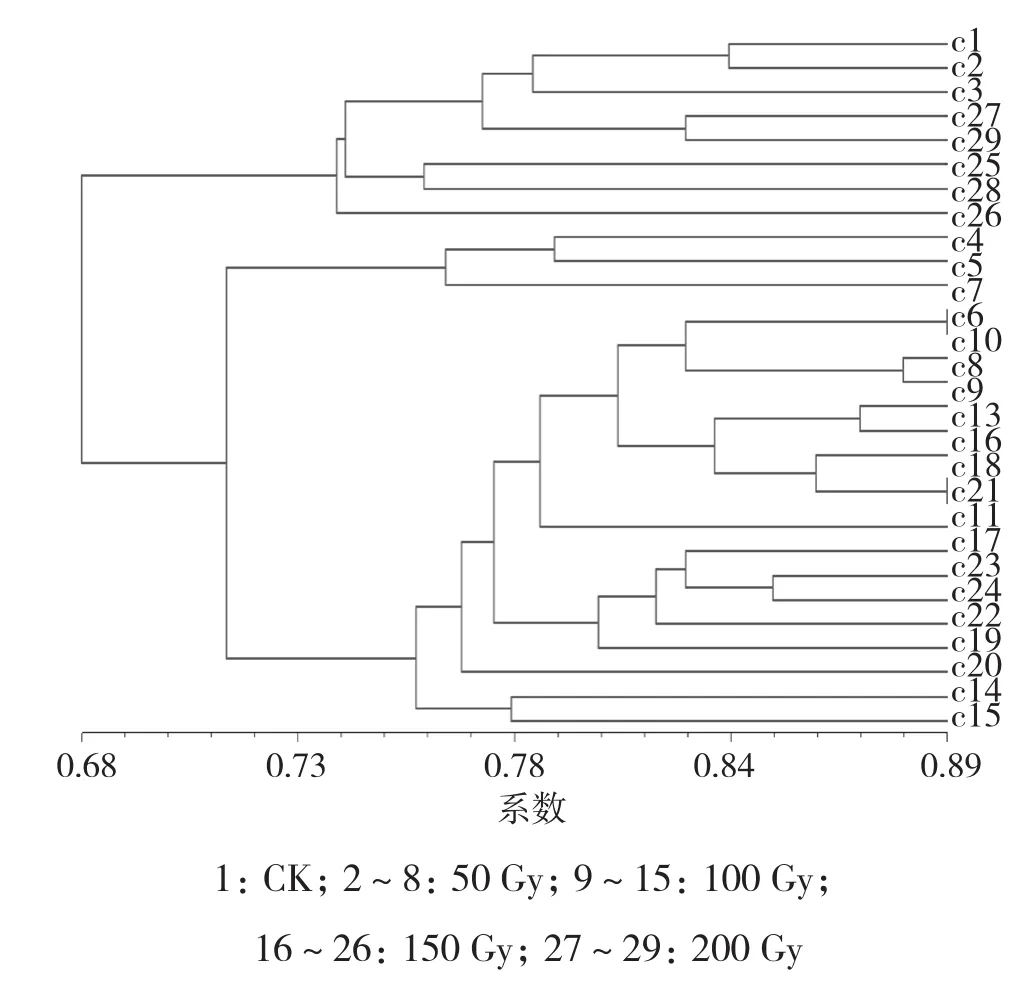
图7 火麻一号物理诱变树状图
2.3.3 五常40 选择13株物理诱变的五常40材料进行RAPD分子标记分析,引物OPU-12扩增结果如图8所示。对11个引物扩增的结果进行分析,构建树状图,从结果(图9)可以得出,与对照相比基因差异性较大的为c10、c11、 c12、c13,其诱变剂量为150 Gy和200 Gy。
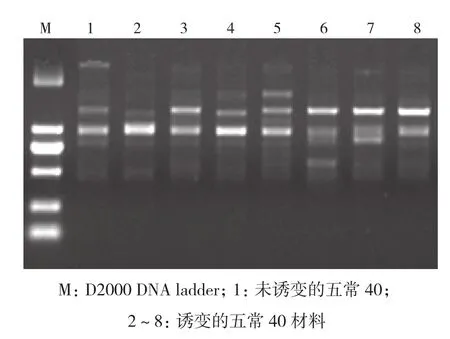
图8 引物OPU-12扩增结果

图9 五常40物理诱变树状图
2.3.4 格里昂 选择11株物理诱变的格里昂材料进行RAPD分子标记分析,引物OPZ-13扩增结果如图10所示。对11个引物扩增的结果进行分析,构建树状图,从结果(图11)可以得出,与对照相比基因差异性较大的为c7、c8、c9,其诱变剂量在150~200 Gy之间。
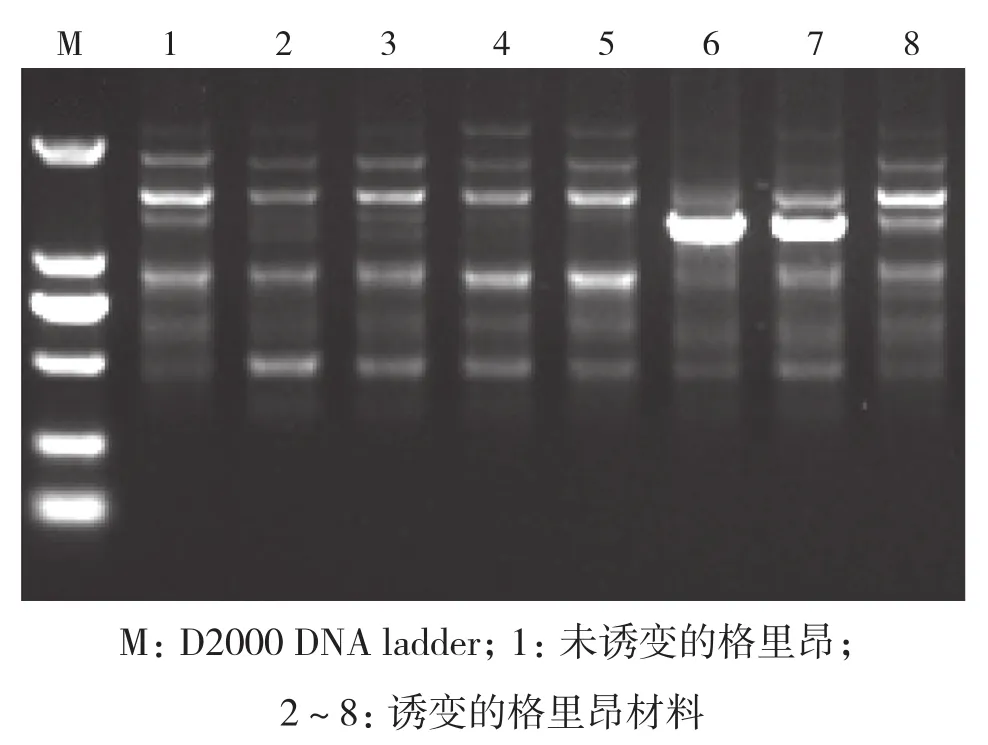
图10 引物OPZ-13扩增结果
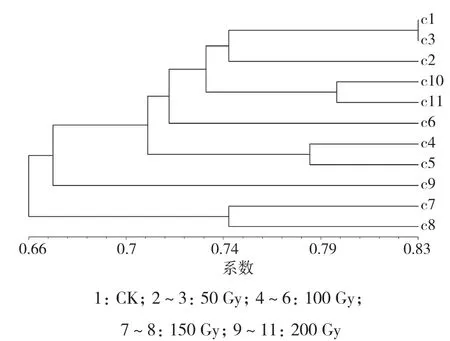
图11 格里昂物理诱变树状图
2.3.5 格里西亚 选择12株物理诱变的格里西亚材料进行RAPD分子标记分析,引物OPY-11扩增结果如图12所示。对11个引物扩增的结果进行分析,构建树状图,从结果(图13)可以得出,与对照相比基因差异性较大的为c8、c12,其诱变剂量在150~200 Gy之间。

图12 引物OPY-11扩增结果
2.3.6 金刀15 选择33株物理诱变的金刀15材料进行RAPD分子标记分析,引物OPX-13扩增结果如图14所示。对11个引物扩增的结果进行分析,构建树状图,从结果(图15)可以得出,与对照相比基因差异性较大的为c18、 c20,其诱变剂量为100~150 Gy。

图13 格里西亚物理诱变树状图

图14 引物OPX-13扩增结果
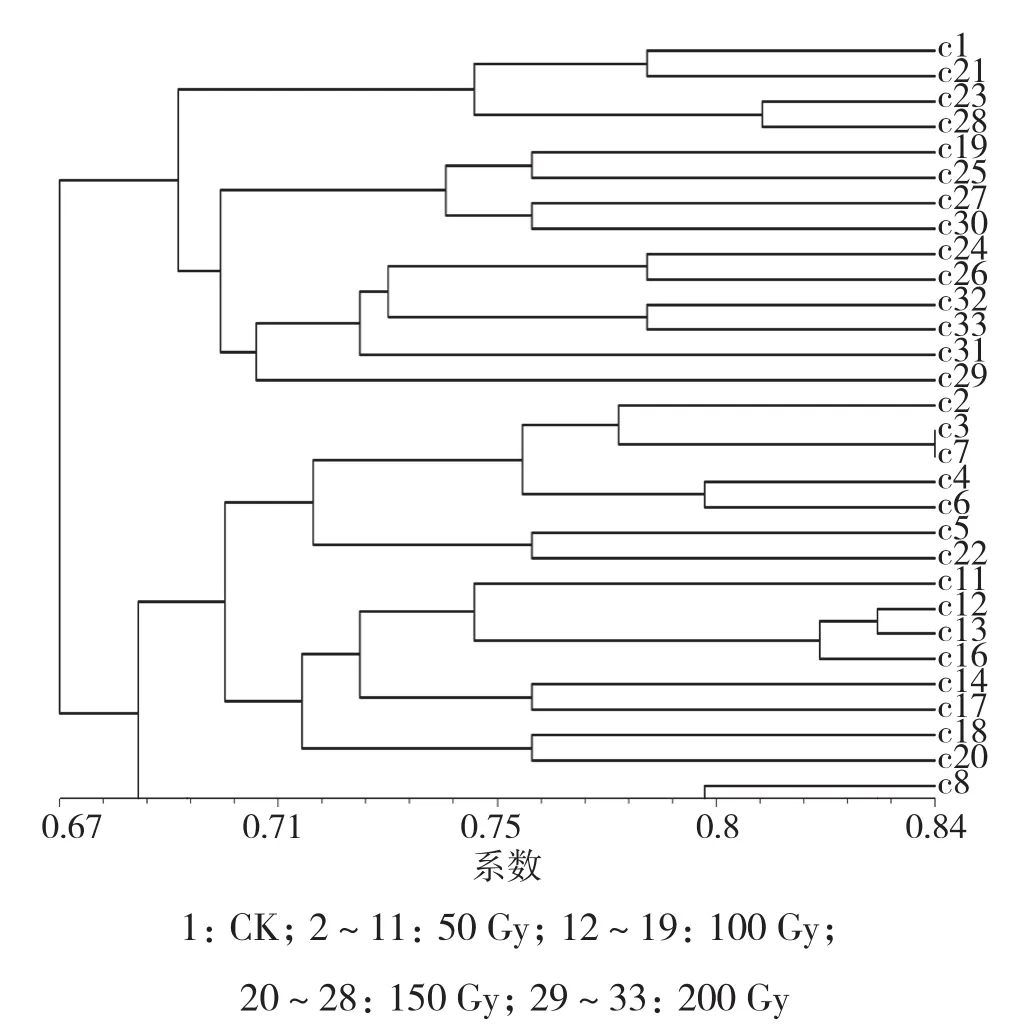
图15 金刀15物理诱变树状图
3 结论与讨论
本试验结果表明,在2%EMS诱变处理工业大麻种子6 h时,后代发生的突变率最高。Co60-γ射线诱变后,农安2、五常40、格里昂、格里希亚的诱变材料与对照基因差异性较大的处理剂量在150~200 Gy之间;火麻一号的诱变材料与对照相比基因差异性较大的为c14、c15、c19、c20,其诱变剂量在100~150 Gy之间;而金刀15的诱变材料与对照相比基因差异性较大诱变剂量为100~150 Gy之间。与对照差异显著的诱变材料,其诱变浓度或剂量与之前筛选的适宜诱变浓度或剂量相近。化学诱变浓度是2.0%,处理6 h[5];Co60-γ诱变剂量基本都在150 Gy左右[13],所以笔者认为RAPD分子标记也可以作为诱变浓度或剂量的筛选标准。
[1]王殿奎,关凤芝.黑龙江省大麻生产现状及发展对策[J].中国麻业,2005,27(2):98-101.
[2]吴广文.黑龙江省大麻发展问题和建议[J].中国麻业科学,2007,29(6):356 -357,370.
[3]熊和平主编.麻类作物育种学[M].北京:中国农业科学技术出版社,2008:297.
[4]Allegret S,Bouloc P,Arnaud L,et al.Hemp:Industrial Production and Uses[M].Bouloc(Ed.),2013:4-26.
[5]姜颖.EMS对工业大麻种子萌发的影响[J].中国麻业科学,2016,38(6):258-262.
[6]姜颖,韩承伟,李秋芝,等.工业大麻籽的开发利用[J].黑龙江科学,2014,5(2):6-7.
[7]Radu S,Robu T.Effects and efficiency of dietary hemp seed and flaxseed oils on the human metabolic function[J].Journal of Environmental Protection and Ecology,2014,15(1):326-331.
[8]Delfin R L,Grant N P.The cardiac and haemostatic effects of dietary hempseed[J].Nutrition & Metabolism,2010,7:32.
[9]Lee M J,Park M S,Hwang S J,et al.Dietary hempseed meal intake increases body growth and shortens the larval stage via the upregulation of cell growth and sterol levels inDrosophila melanogaster[J].Molecules and Cells,2010,30(1):29-36.
[10]沈浩,刘登义.遗传多样性概述[J].生物学杂志,2001,18(3):4-7.
[11]苏友波,朱颖,林春,等.大麻RAPD分子标记的引物筛选[J].中国麻业科学,2002,24(5):12-16.
[12]陈其本,余立惠,杨明,等.大麻栽培利用及发展对策[M].成都:电子科技大学出版社,1993:294-308.
[13]姜颖,孙宇峰,潘冬梅,等.Co60-γ射线辐照对工业大麻种子萌发及幼苗生长的影响[J].农业与技术,2017,37(15):5-7.

