苹果树腐烂病菌挥发性代谢产物的分离提取与致病性研究
袁艮霞,李思南,秦 辰,王 惠*,黄丽丽*
(1.西北农林科技大学 理学院,陕西 杨陵 712100;2.西北农林科技大学 植物保护学院,陕西 杨陵 712100;3.西北农林科技大学 农学院,陕西 杨陵 712100)
随着苹果种植面积的不断扩大,苹果树腐烂病日趋严重,已经严重影响到我国苹果产业的进一步发展。苹果树腐烂病俗称臭皮病、烂皮病、串皮病,是由黑腐皮壳属真菌(Valsamali)引起的树枝干皮层腐烂病害[1],由于对其致病机理还不十分清楚,导致对该病的防治比较盲目。要想搞清楚致病机理,必须对其分泌的致病活性物质进行研究。目前对苹果树腐烂病菌代谢产物的研究主要集中在酶类物质、根皮苷的降解产物、异香豆素类物质、有机酸类等[2-10]。也有研究表明,苹果树腐烂病菌分泌的蛋白类物质有致病活性[11],但关于其挥发性成分目前还尚未见研究报道。
本试验对苹果树腐烂病菌的MS培养滤液中的挥发性成分进行分离提取和结构定性,以苹果树枝条为生物测定材料进行致病性检测,初步确定苹果树腐烂病菌代谢的挥发性成分与致病的关系,以期为该病菌致病机理的研究提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株与培养基 苹果树腐烂病菌野生型菌株03-8,由西北农林科技大学植物保护学院果树病害病原生物学及综合防治研究团队提供,于PDA培养基4℃保存。
MS培养基:取蔗糖5 g,L-天门冬酰胺2 g,磷酸二氢钾1 g,七水合硫酸镁0.5 g,七水合硫酸锌0.88 g,微量元素:水合硝酸铁1.5 mg,五水合硫酸锰0.44 mg,VH0.005 mg,VB10.1 mg,于1 000 mL水中,每1 000 mL培养基中加100 μL微量元素,pH为5~8。
1.1.2 仪器与试剂 气相色谱-质谱联用仪:QP201V1tra型。乙酸乙酯:色谱纯,天津市科密欧化学试剂有限公司。异戊醇,2-苯乙醇均为市售分析纯试剂。
1.2 方法
1.2.1 培养滤液的制备 先将菌株03-8接种至PDA培养基上,于25℃培养3 d。用直径5 cm的打孔器沿菌落边缘打出菌株长势均匀的菌饼接种于MS液体培养基中,并设置空白对照,25℃进行培养,每天摇瓶1次,培养20 d。用布氏漏斗抽滤得到培养滤液。
1.2.2 挥发性代谢产物的收集 取上述培养滤液300 mL于圆底烧瓶中,进行普通蒸馏,用10 mL乙酸乙酯收集馏分,收集液封口保存于4℃冷藏箱中。
1.2.3 挥发性代谢产物的定性分析 取收集液在如下GC-MS条件下进行分析测定,GC-MS条件:石英毛细管柱(30.0 m×0.25 mm),升温程序60~100℃(10℃·min-1),100~240℃(4℃·min-1,240℃保留3 min),柱流量1.0 mL·min-1。接口温度230℃外,进样量2 μL,载气He进样方式为不分流,柱流量1.11 mL·min-1,吹扫流量3 mL·min-1。EI源,电子能量70 eV,离子源温度200℃,接口温度220℃,扫描质量范围50~500。通过与谱库标准物质质谱图对照初步确定收集液中各成分的结构。
1.2.4 纯物质对苹果树枝条的致病活性测定方法 枝条的准备:取粗细和长短相等且长势相近的健康苹果树枝30支,用0.6%的次氯酸钠溶液浸泡10 min进行消毒,然后用无菌水漂洗3次,于超净工作台上晾干,用石蜡封在形态学上端以防止过多水分散失,用湿润棉花包裹形态学下端保湿,保证试验过程中枝条存活。
活性测定:先用灼烧后的打孔器在每个枝条中间表面造成伤口,然后分2组处理进行试验,第1组用微量注射器在枝条伤口处分别滴异戊醇10 μL和2-苯乙醇10 μL,每个样品处理3个枝条。以未滴加任何物质的带伤枝条为对照,保存在密封的培养皿中,在恒温培养室中进行培养,定期观察;第2组在伤口上除滴加相应待测物质后,再将PDA上培养了3 d的苹果树腐烂病菌野生型菌株03-8菌饼接于伤口处,其余条件保持与第1组一致。置于25℃恒温室中培养,80 h后进行病斑大小测定。病斑面积大小以长直径与短直径的乘积表示。
1.2.5 数据分析 数据处理均经过SPSS(16.0)软件进行差异显著性分析,采用LSD法。
2 结果与分析
2.1 挥发性代谢产物的结构确定
用GC-MS分别对空白培养基及培养滤液的收集液进行定性分析得到色谱图(图1)。图1培养滤液中的2个挥发性组分A和B的对应质谱图分别见图2(A)和(B)中上图,在数据库中发现的与其相似度最高的相应标准物质质谱图见图2(A)和(B)中下图。与谱库中标准物质对比得到的相应挥发性代谢产物的结构见图3。由图3可知,这2种物质分别为异戊醇和2-苯乙醇。
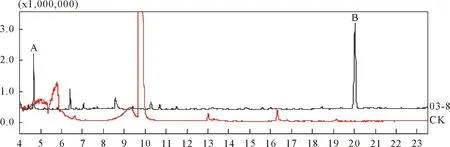
图1 空白培养基及苹果树腐烂病菌03-8的MS培养滤液中挥发性代谢物的色谱图

注:每组图中上边为苹果树腐烂病菌03-8的MS培养滤液中挥发性代谢物的质谱图,下边为数据库中相似度最高的标准物质质谱图;A为异戊醇,B为2-苯乙醇。
图2苹果树腐烂病菌03-8的MS培养滤液中2种挥发性代谢物的质谱图及谱库对比图
Fig.2 Comparison of mass spectra of two volatile metabolites in MS culture filtrate ofV.mali03-8 with standard spectra
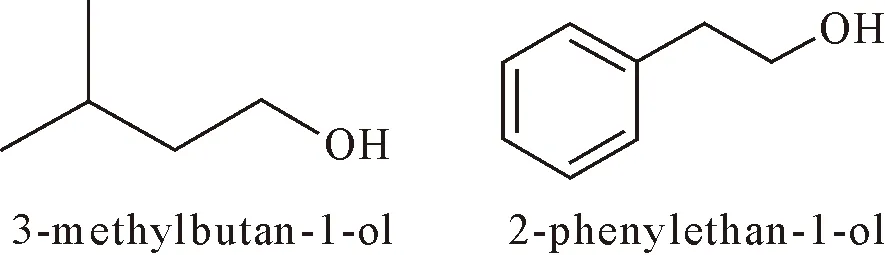
图3 苹果树腐烂病菌03-8的MS培养滤液中2种挥发性代谢物的结构
2.2 异戊醇和2-苯乙醇的生物活性
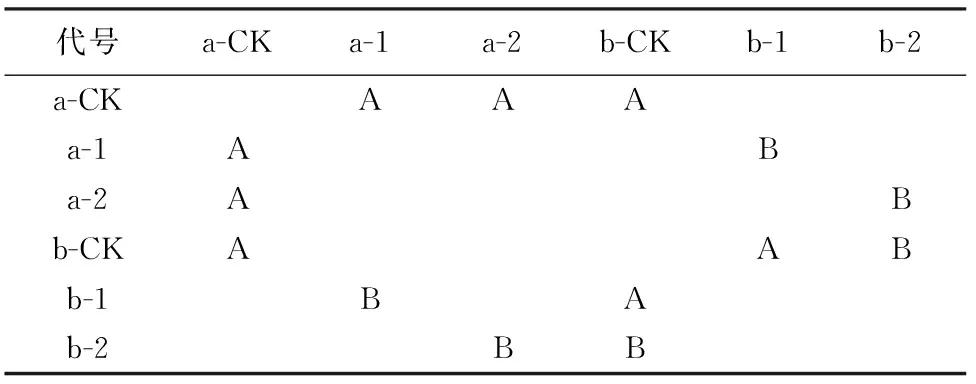
利用苹果枝条作为生测对象,检测纯异戊醇和2-苯乙醇的生物活性结果见图4。由图4可以看出,b-ck的病斑大小明显>a-CK,说明本试验使用的苹果树腐烂病菌具有明显的致病性。从图4还可以看出,a-CK枝条上没有显示病斑,而a-1和a-2枝条上明显有病斑 ,表明异戊醇和2-苯乙醇均对苹果树枝具有致病活性。另外图4还显示,b-1和b-2与b-CK相比,只有b-CK菌丝能够正常生长,而滴加异戊醇和2-苯乙醇后再接的菌饼几乎没有菌丝生长的迹象,表明这2种化合物对03-8的生长具有明显抑制作用。
对图4中各处理的致病斑面积大小进行统计的结果见表1。对表1中各组数据进行显著性分析的结果见表2。表1和表2表明,a-1和a-2的病斑大小均与a-CK在P=0.05水平上差异显著,说明异戊醇和2-苯乙醇对苹果树枝条具有明显的致病活性。

注:a-ck:伤口未处理;a-1:伤口+异戊醇;a-2:伤口+2-苯乙醇;b-ck:伤口+菌饼;b-1:伤口+异戊醇+菌饼;b-2:伤口+2-苯乙醇+菌饼。菌饼:苹果树腐烂病菌03-8菌饼。
图4异戊醇和2-苯乙醇对苹果树枝条的致病活性测定结果
Fig.4 Bioactivity on apple tree branches of 3-methylbutan-1-ol and 2-phenylethan-1-ol
从表1和表2可以看出,b-1与b-CK差异显著,而且b-1的病斑明显 从表1和表2还可以看出,b-2与b-CK差异不显著,似乎意味着在菌饼存在时2-苯乙醇没有显示出致病活性;但将a-2和b-2进行比较发现,a-2和b-2也无显著性差异,似乎在2-苯乙醇存在时菌饼没有表现出致病活性。综合分析认为是2-苯乙醇的存在抑制了03-8菌饼的致病活性。 表1 苹果枝条接触挥发性代谢物后的病斑面积 注:a-CK:伤口未处理;a-1:伤口+异戊醇;a-2:伤口+2-苯乙醇;b-CK:伤口+菌饼;b-1:伤口+异戊醇+菌饼;b-2:伤口+2-苯乙醇+菌饼。菌饼:苹果树腐烂病菌03-8菌饼。 表2 苹果枝条接触挥发性代谢物后的病斑面积的显著性分析结果 注:A表示有显著性差异,B表示无显著性差异(P<0.05)。 本试验从苹果树腐烂病菌的发酵液中分离得到2个挥发性化合物:异戊醇和2-苯乙醇,为了确认,试验中同时改变了培养基进行培养,在培养滤液中也检测到这2种挥发性成分,表明这2种物质是苹果树腐烂病菌的代谢产物。目前还尚未见到从苹果树腐烂病菌甚至从其他果树病害的病原菌代谢产物中分离到这2种物质的报道,仅有从植物及其他微生物中分离得到这2种物质的报道[12-16]。 本试验发现异戊醇和2-苯乙醇对苹果树枝条均有直接的致病活性,表明它们就是苹果树腐烂病菌的致病活性物质。另外,本试验在进行2种挥发性物质的生物活性测定中发现,在滴加了异戊醇的苹果树枝条上接苹果树腐烂病菌的菌饼和不接菌饼,产生的病斑大小在统计分析时差异不显著。在滴加了2-苯乙醇的枝条上同样接苹果树腐烂病菌菌饼,与不接菌饼产生的病斑大小在统计分析时差异也不显著。表明异戊醇和2-苯乙醇的存在都抑制了苹果树腐烂病菌的正常致病性。分析认为,这2种物质都是苹果树腐烂病菌在对苹果树致病过程中产生的致病活性成分,由于致病过程中代谢产生的物质量很少,逐渐进入树体对病原菌本身并无明显抑制作用,使病原菌可以继续代谢进一步发挥致病作用。而本试验直接使用了10 μL纯物质,其浓度远大于病原菌分泌的量,相当于在生物合成反应体系中突然出现了大量的产物,抑制了正反应的进行,因此病原菌分泌异戊醇和2-苯乙醇的反应受到抑制,也就是病原菌的致病作用受到了抑制。这进一步佐证了异戊醇和2-苯乙醇是苹果树腐烂病菌的致病活性物质这一论点。 这一点在之前的文献中也尚未见报道,只有一些关于异戊醇和2-苯乙醇作为香气成分的报道[15-17]。 本试验发现在苹果树枝条上滴加了异戊醇或2-苯乙醇后再接腐烂病病原菌时,该菌不但不能致病,而且没有了生长的迹象,表明这2种物质在10 μL的量上就可以抑制该菌的生长。关于苯乙醇的抑菌活性曾有报道。陈利军[18]等分析了1株分离自淡竹的产香真菌蒙塔涅梨孢假壳的挥发物成分,发现其能够不同程度地抑制5种植物病原真菌的生长,其中主要成分为苯乙醇,说明苯乙醇本身具有抑菌作用。 在进行2种挥发性物质的活性试验中发现,在滴加纯异戊醇的枝条上接苹果树腐烂病菌菌饼,其病斑比直接接菌饼反而小,分析认为可能是本试验使用的异戊醇的浓度过高抑制了苹果树腐烂病菌的正常生长。另外,黄丹[19]等从浓香型大曲中分离得到一株产酯化酶霉菌,鉴定为黄曲霉(Aspergillusflavus)通过GC-MS对其代谢产物分析发现其中含有异戊醇及2-苯乙醇,随着时间的延长,这2种化合物会逐渐转化为对应的酸及酯,其代谢产物的合成大致呈醇-酸-酯的变化规律。对从中分离到的细菌嗜热葡糖苷酶芽胞杆菌的发酵液进行分析,也发现随着培养时间的延长,异戊醇等各种高级醇逐渐减少甚至消失,而酯类物质则逐渐增加[20]。张静[21]等通过SPME-GC-MS测定不同品种牡丹花在3个开花时期的挥发性物质成分,发现花蕾期以醇类为主,盛花期和衰花期酯类物质含量均增加。联系到苹果树腐烂病菌培养后期散发出特殊的气味,因此推测,在含有低浓度异戊醇时,苹果树腐烂病菌能够利用异戊醇合成其他的代谢产物,而当异戊醇浓度达到一定的限度后就会抑制相应的反应。至于这2种挥发性物质在苹果树腐烂病菌中的代谢途径及其在致病机理中的作用还有待进一步的研究及验证。 [1] WANG X,WEI J,HUANG L,etal.Re-evaluation of pathogens causingValsacankeron apple in China [J].Mycologia,2011,103(2):317. [2] 刘福昌,李美娜,王永洤.苹果树腐烂病菌致病因素——果胶酶的初步探讨[J].中国果树,1980(4):45-48. [3] 王娟,马强,庄霞,等.苹果腐烂病病原菌分泌物中果胶酶的测定[J].内蒙古农业科技,2009(4):39-40. WANG J,MA Q,ZHUANG X,etal.Determination of pectinase in fungi sesretion of apple tree canker [J].Inner Mongolia Agricultural Science and Technology,2009(4):39-40.(in Chinese) [4] 王建华,柯希望,黄以超,等.苹果树腐烂病菌发酵液中根皮苷主要降解成分的分析[J].西北农林科技大学学报:自然科学版,2012(8):89-94. WANG J H,KE X W,HUANG Y C,etal.Component analysis ofValsamalivar.malifermentation liquid degrading phlorizin [J].Journal of Northwest A&F University:Nat.Sci.Ed.,2012(8):89-94.(in Chinese) [5] 何媛媛,于哲,王海英,等.不同碳氮源对苹果腐烂病菌胞外果胶酶活性的影响[J].西北农林科技大学学报:自然科学版,2014(11):81-86. HE Y Y,YU Z,WANG H Y,etal.Effects of different carbon and nitrogen sources on activity of extracellular pectinase ofValsamalivar.mali[J].Journal of Northwest A&F University:Nat.Sci.Ed.,2014(11):81-86.(in Chinese) [6] 柯希望.苹果树腐烂病菌在树皮组织内的扩展观察[D].陕西杨陵:西北农林科技大学,2009. [7] NATSUME H,SETO H,OTAKE N.Studies on apple canker disease.The necrotic toxins produced byValsaceratosperma[J].Agricultural & Biological Chemistry,1982,46(8):2101-2106. [8] KOGANEZAWA H,SAKUMA T.Possible role of breakdown products of phloridzin in symptom development byValsaceratosperma[J].Annals of the Phytopathological Society of Japan,1982,48(4):521-528. [9] TRAQUAIR J.Oxalic acid and calcium oxalate produced byLeucostomacinctaandL.persooniiin culture and in peach bark tissues [J].Canadian Journal of Botany,1988,65(9):1952-1956. [10] SVIRCEV A M,BIGGS A R,MILES N W.Isolation and partial purification of phytotoxins from liquid cultures [J].Canadian Journal of Botany,1991,69(9):1998-2003. [11] 王建华.苹果树腐烂病菌致病物质的初步研究[D].陕西杨陵:西北农林科技大学,2012. [12] 祝云飞,黄治国,邓杰,等.浓香型大曲中一株酵母菌的分离鉴定及其挥发性产物分析[J].四川理工学院学报:自然科学版,2016,29(1):7-11. [13] 白岩岩,贾薇,张劲松.樟芝发酵液挥发性物质提取方法及成分比较[J].食品科学,2013,34(24):163-167. BAI Y Y,JIA W,ZHANG J S.Comparison of different extraction methods for the analysis of volatile components of the fermentation broth ofTaiwanofunguscomphoratus[J].Food Science,2013,34(24):163-167.(in Chinese) [14] 王丽娟,刘苏萌,楚明忠.百合产香内生真菌的分离鉴定及其挥发性成分分析[J].食品工业,2013(9):203-205. WANG L J,LIU S M,CHU M Z.Isolation and identification endophytic fungi fromLiliumSiberia and analysis of volatile components [J].The Food Industry,2013(9):203-205.(in Chinese) [15] 谷运璀,宦月琴,钱莉群,等.天然肉桂酸及其酯类的制备[J].香料香精化妆品,2013(Supp.1):36-38. GU Y C,HUAN Y Q,QIAN L Q,etal.The synthesis of natural cinnamic acid and its esters[J].Flavour Fragrance Cosmetics,2013(Supp.1):36- 38.(in Chinese) [16] 晏慧君,王娟,陈敏,等.朋粉(Rosachinensis‘Pallida’)、大马士革蔷薇(R.damascene)、百叶蔷薇(R.centifolia)香气成分分析[J].云南农业大学学报:自然科学,2017,32(1):78-82. YAN H J,WANG J,CHEN M,etal.The analysis of scent compounds fromRosachinensis‘Pallida’,R.damasceneandR.centifoliaby GC/MS [J].Journal of Yunnan Agricultural University:Natural Science,2017,32(1):78-82.(in Chinese) [17] 曹建宏,张振文,张莉,等.霞多丽干白葡萄酒香气成分的GC/MS分析[J].西北林学院学报,2006,21(4):132-134. CAO J H,ZHANG Z W,ZHANG L,etal.Analysis of roma components of chardonnay dry white wine by GC/MS [J].Journal of Northwest Forestry University,2006,21(4):132-134.(in Chinese) [18] 陈利军,王国君,田雪亮,等.产香真菌ZY-2菌株鉴定及其挥发性物质抑菌活性测定与组分分析[J].南方农业学报,2013,44(11):1818-1822. CHEN L J,WANG G J,TIAN X L,etal.Identification of an aroma-producing fungus ZY-2 and its analysis on antifungal activity and chemical component of volatile compounds [J].Journal of Southern Agriculture,2013,44(11):1818-1822.(in Chinese) [19] 黄丹,方春玉,尚志超,等.一株酯化酶霉菌的分离、鉴定及代谢产物特征[J].中国酿造,2010,(6):62-64. HUANG D,FANG C Y,CHU Z C,etal.Isolation and identification of esterase-produce mould and characterization of its metabolites [J].China Brewing,2010(6):62-64.(in Chinese) [20] 黄丹,方春玉,储玉龙,等.一株酯化酶细菌的分离、鉴定及代谢产物特征[J].四川理工学院学报:自然科学版,2010(3):321-323. HUANG D,FANG C Y,CHU Y L,etal.Isolation and characterization of bacteria producing esterifying enzyme [J].Journal of Sichuan University of Science & Engineering:Natural Science Edition,2010(3):321-323.(in Chinese) [21] 张静,周小婷,胡立盼,等.SPME-GC-MS测定不同品种牡丹花挥发性物质成分分析[J].西北林学院学报,2013,28(4):136-143. ZHANG J,ZHOU X T,HU L P,etal.SPME-GC-MS measurement of volatile in different peony varieties [J].Journal of Northwest Forestry University,2013,28(4):136-143.(in Chinese)
3 结论与讨论
3.1 异戊醇和2-苯乙醇是苹果树腐烂病菌的代谢产物
3.2 异戊醇和2-苯乙醇是苹果树腐烂病菌的致病活性物质
3.3 异戊醇和2-苯乙醇具有抑菌活性
3.4 异戊醇可能是苹果树腐烂病菌致病过程中产生的中间体

