吉林延龄草种子内源抑制物质初步研究
, , ,
(中国农业科学院特产研究所, 吉林 长春 130112)
吉林延龄草(TrilliumkamtschaticumPall.ex Pursh)为百合科延龄草属植物,《中华本草》称为“头顶一颗珠”,以干燥根茎入药,分布于亚洲东北部地区,中国主要分布吉林。其根茎含有甾体皂甙、偏诺皂苷、延龄草皂苷、薯蓣皂苷、克里托皂苷、甾酮皂苷、倍半萜苷等多种有效成分[1-3],具有、止痛、活血、止血功效,是治疗高血压、眩晕头痛、神经衰弱、腰腿疼痛、跌打损伤、月经不调、外伤出血等症的名贵药材[4]。近年来,由于森林过度砍伐、生长环境破坏、过量采挖等因素, 使吉林延龄草分布范围日趋缩小,加之种子难以萌发、成苗困难,致使种群数量逐渐减少,已被国家列为三级重点保护野生植物。因此开展吉林延龄草人工栽培将成为保护现有野生资源,实现资源可持续性利用的有效途径。然而,吉林延龄草种子存在深度休眠现象[5],这也成为制约吉林延龄草种植业发展的瓶颈。
种子休眠是指具有生活力的完整种子在适宜的条件下仍不萌发的现象,Kentzen指出,抑制物质的存在是植物种子休眠的主要原因之一[6],多年来,相关学者对休眠种子中存在抑制物质研究报道较多,Paul等研究表明,火炬松休眠种子中含有高浓度抑制物质,萌发的种子中抑制物质未被检测到[7],Welbaum等[8]和Amritphale等[9]指出,葫芦科(Cucurbitaceae)种子外胚乳中存在的抑制物质ABA能够通过抑制β-1,3-葡聚糖酶的表达影响外胚乳中内含物的代谢,从而抑制珠孔端胚乳的降解与破裂,延缓种子的萌发。尽管药用植物种子休眠机理方面的研究工作起步较晚,但在发芽抑制物质的研究方面还是取得了一定的进展。到目前为止,发现种子中含有抑制物质的药用植物有人参,西洋参,刺五加,黄精等数十种[10-13],然而关于吉林延龄草种子内源抑制物质方面的研究,尚未见报道。为此,对吉林延龄草种子内源抑制物质活性及内源抑制物质去除方法进行初步研究,为深入研究吉林延龄草种子内源抑制物质与种子休眠的关系及进一步分离、鉴定其种子中的抑制物质以及更有针对性的采取有效措施打破种子休眠,促进种子萌发奠定基础。
1 材料与方法
1.1 材 料
2013年8月在吉林省敦化市采集野生吉林延龄草种子;白菜种子(秋宝,黑龙江省伊春市春禾种业有限责任公司);水稻种子(吉农大39,吉林农大科茂种业有限责任公司)。乙酸乙酯和甲醇(分析纯,北京化工厂)。
1.2 吉林延龄草种子浸提物制备
取自然干燥的吉林延龄草种子(含水量为6.46%)2 g,共取4份,加入研钵研碎后,移入100 mL三角瓶中,其中3份分别加入25 mL乙酸乙酯、甲醇、蒸馏水,用封口膜密封瓶口,置于25 ℃恒温培养箱中浸泡24 h,超声波提取30 min,提取液过滤后,残渣按上述方法再浸提2次,合并全部浸提液,用旋转蒸发仪40 ℃减压浓缩,最终定容50 mL,乙酸乙酯提取液Ⅰ(A),甲醇提取液Ⅰ(B),水提取液Ⅰ(C);另1份种子粉末按上述方法先加入乙酸乙酯提取3次后,得到乙酸乙酯提取液Ⅱ(与A溶液一致),将残渣置于通风处,待残渣中乙酸乙酯挥干后,按上述方法加入甲醇提取3次,得到甲醇提取液Ⅱ(D),减压浓缩后定容50 mL,用甲醇提取后的残渣,按照同样方法,得到水提液Ⅱ(E),减压浓缩后定容50 mL,得到质量浓度为0.04 g/mL的种子提取液A、B、C、D、E,4 ℃保存备用。
1.3 吉林延龄草种子浸提物抑制活性测定
经预试验,取上述0.04 g/mL吉林延龄草种子浸提液A、B、C、D、E,配制成质量浓度为0.001,0.002,0.004,0.006,0.008 g/mL的溶液,各取5.0 mL种子浸提液至事先灭菌的直径11 cm培养皿 (铺有2层滤纸) 中,待有机溶剂挥干后(种子水提液C、E除外),每皿加入5 mL蒸馏水,对照组每皿加入5.0 mL蒸馏水(加入化学试剂挥干后的处理与蒸馏水对照组无显著性差异(p>0.05),数据未显示),白菜种子每皿放100粒,水稻种子每皿放50粒,25 ℃恒温箱培养,培养表示达到1%的显著水平。下同。
表1 吉林延龄草种子浸提物对白菜幼苗生长的影响
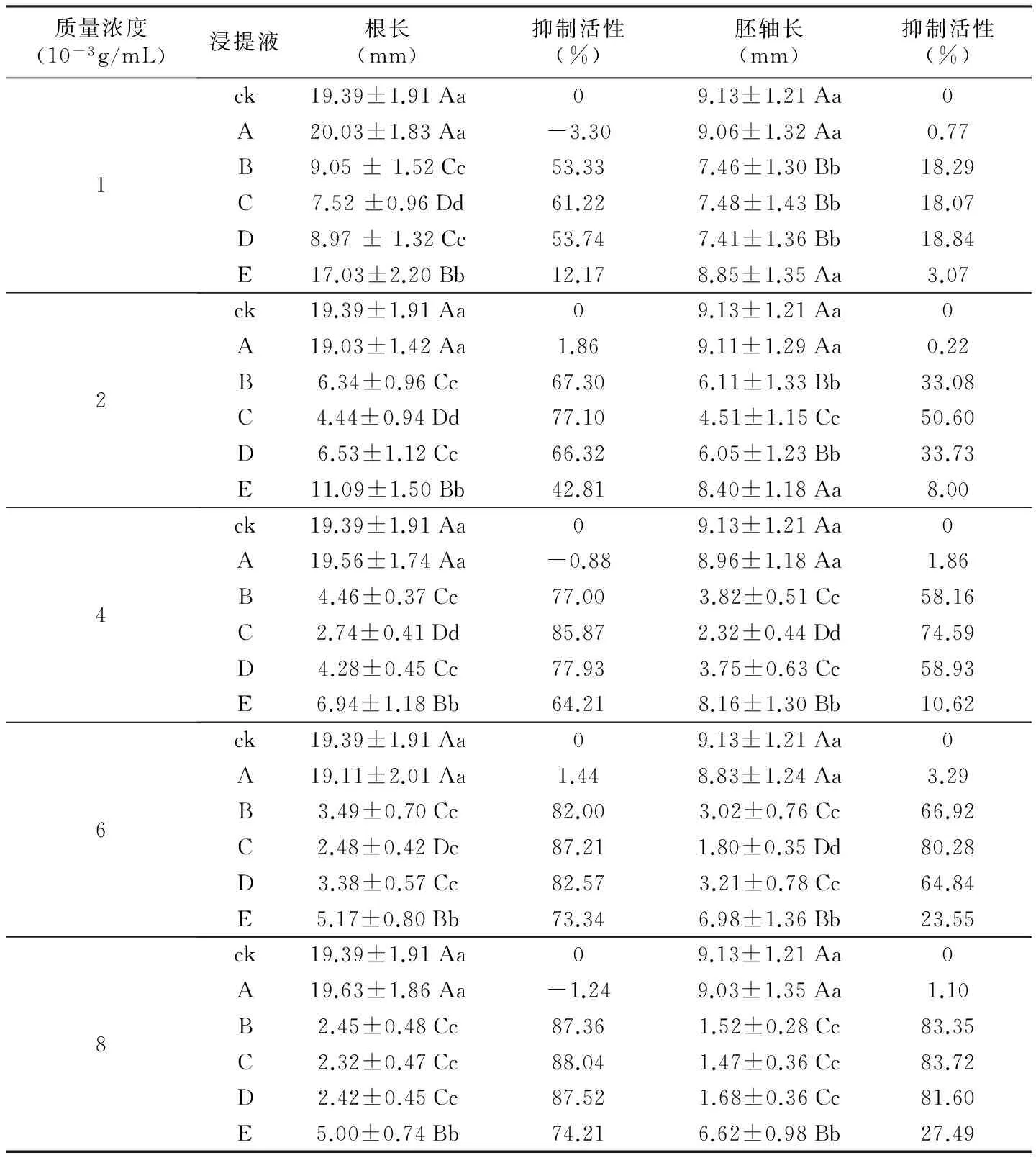
质量浓度(10-3g/mL)浸提液根长(mm)抑制活性(%)胚轴长(mm)抑制活性(%)1ck19.39±1.91Aa09.13±1.21Aa0A20.03±1.83Aa-3.309.06±1.32Aa0.77B9.05±1.52Cc53.337.46±1.30Bb18.29C7.52±0.96Dd61.227.48±1.43Bb18.07D8.97±1.32Cc53.747.41±1.36Bb18.84E17.03±2.20Bb12.178.85±1.35Aa3.072ck19.39±1.91Aa09.13±1.21Aa0A19.03±1.42Aa1.869.11±1.29Aa0.22B6.34±0.96Cc67.306.11±1.33Bb33.08C4.44±0.94Dd77.104.51±1.15Cc50.60D6.53±1.12Cc66.326.05±1.23Bb33.73E11.09±1.50Bb42.818.40±1.18Aa8.004ck19.39±1.91Aa09.13±1.21Aa0A19.56±1.74Aa-0.888.96±1.18Aa1.86B4.46±0.37Cc77.003.82±0.51Cc58.16C2.74±0.41Dd85.872.32±0.44Dd74.59D4.28±0.45Cc77.933.75±0.63Cc58.93E6.94±1.18Bb64.218.16±1.30Bb10.626ck19.39±1.91Aa09.13±1.21Aa0A19.11±2.01Aa1.448.83±1.24Aa3.29B3.49±0.70Cc82.003.02±0.76Cc66.92C2.48±0.42Dc87.211.80±0.35Dd80.28D3.38±0.57Cc82.573.21±0.78Cc64.84E5.17±0.80Bb73.346.98±1.36Bb23.558ck19.39±1.91Aa09.13±1.21Aa0A19.63±1.86Aa-1.249.03±1.35Aa1.10B2.45±0.48Cc87.361.52±0.28Cc83.35C2.32±0.47Cc88.041.47±0.36Cc83.72D2.42±0.45Cc87.521.68±0.36Cc81.60E5.00±0.74Bb74.216.62±0.98Bb27.49
注:根长/胚轴长=mean±SD(n=3),处理间不同小写字母表示达到5%的显著水平,不同大写字母
72 h后采用数显游标卡尺测定白菜种子根长及胚轴长,培养96 h后测水稻种子根长,每个处理重复3次。
1.4 温水浸种去除吉林延龄草种子内源抑制物质的测定
取自然干燥的吉林延龄草种子(含水量为6.46%)0.4 g,放入100 mL三角瓶中,加入50 mL 蒸馏水,瓶口用封口膜封严,置于25,35 ℃和 45 ℃恒温水浴条件下浸提,分别于提取的第 1,2,3,…14天抽取浸提液,每次抽取浸提液后,重新加入 50 mL 蒸馏水,继续浸提。14 d后,采用白菜种子做种子浸提液的生物活性测定,各取5.0 mL种子浸提液至事先灭菌的直径11 cm培养皿 (铺有2层滤纸) 中,对照组每皿加入5.0 mL蒸馏水,白菜种子每皿放100粒,25 ℃恒温箱培养,72 h后采用数显游标卡尺测定白菜种子根长及胚轴长,每个处理重复3次。
1.5 数据处理
利用SAS系统6.12对数据进行单因素方差统计分析,不同处理组间的差异显著性用Fisher’s LSD(least significant difference)法分析。抑制物质活性参照Huang等[14]的方法,抑制活性=(1-处理组)/对照组。
2 结果与分析
2.1 吉林延龄草种子浸提物对白菜幼苗生长的影响
设置种子浸提物质量浓度为0.001,0.002,0.004,0.006,0.008 g/mL,分别测定不同试剂提取、不同浓度粗提物对白菜幼根及胚轴生长的影响。由表 1可见,吉林延龄草种子浸提液(乙酸乙酯提取液除外)对白菜幼根及胚轴生长均有显著抑制作用,说明吉林延龄草种子中存在着活性较强的内源抑制物质,且抑制物质的活性随着粗提物浓度的增加而增强;不同溶剂提取吉林延龄草种子抑制物质的活性不同,以水提取液Ⅰ(C)的抑制物质活性最强,甲醇提取液Ⅰ(B)次之,乙酸乙酯提取液Ⅰ(A)无显著抑制活性(p>0.05),当提取液质量浓度为0.008 g/mL时,水提取液Ⅰ(C)与甲醇提取液Ⅰ(B)两者对白菜幼苗的抑制活性无显著性差异(p>0.05),两者对白菜幼根及胚轴的抑制活性分别达87.36%、88.04%和83.35%、83.72%;在种子浸提物质量浓度为0.001,0.002,0.004,0.006 g/mL培养时,水提取液Ⅰ(C)对白菜幼根及胚轴的抑制活性极显著高于甲醇提取液Ⅰ(B)的抑制活性(p<0.01)(质量浓度为0.001 g/mL时对白菜胚轴抑制活性除外);经乙酸乙酯浸提后,甲醇提取液Ⅱ(D)与甲醇提取液Ⅰ(B)两者抑制作用差异不显著(p>0.05),但其抑制作用极显著高于对照(p<0.01);经甲醇浸提后,水提液Ⅱ(E)抑制作用极显著低于水提液Ⅰ(C)对白菜幼苗的抑制作用(p<0.01);吉林延龄草种子浸提物对白菜幼根抑制活性高于对胚轴的抑制活性。
2.2 吉林延龄草种子浸提物对水稻幼苗生长的影响
吉林延龄草种子浸提液对水稻胚芽鞘生长均无显著抑制作用(p>0.05,数据未显示);由表2可知,吉林延龄草种子浸提液(乙酸乙酯提取液除外)对水稻幼根生长有显著抑制作用,且抑制物质的活性随着粗提物浓度的增加而增强;不同溶剂提取吉林延龄草种子抑制物质的活性不同,以甲醇提取液Ⅰ(B)的抑制活性最强,水提取液Ⅰ(C)次之,乙酸乙酯提取液Ⅰ(A)无显著抑制活性(p>0.05),当浸提液质量浓度为0.008 g/mL时,甲醇提取液Ⅰ(B)对水稻种子幼根抑制作用极显著高于水提取液Ⅰ(C)的抑制作用(p<0.01),对水稻种子幼根抑制活性分别达86.73%和82.74%;经乙酸乙酯浸提后,甲醇提取液Ⅱ(D)与甲醇提取液Ⅰ(B)两者抑制作用差异不显著(p>0.05);经甲醇浸提后,水提液Ⅱ(E)抑制作用极显著低于水提液Ⅰ(C)对水稻幼根的抑制作用(p<0.01),当浸提液质量浓度为0.002 g/mL时,水提液Ⅱ(E)抑制作用不明显,水提液Ⅰ(C)对水稻种子幼根抑制作用达极显著性水平(p<0.01),说明种子水提液Ⅱ(E)中可能含有甲醇提取液Ⅰ(B)中的抑制物质;当浸提液质量浓度为0.001 g/mL时,所有种子浸提液对水稻种子幼根均无显著性抑制作用(p>0.05),可见,吉林延龄草种子浸提物对白菜幼根及胚轴的抑制活性高于对水稻幼根的抑制活性(见表1,表2)。
表2 吉林延龄草种子浸提物对水稻根长的影响
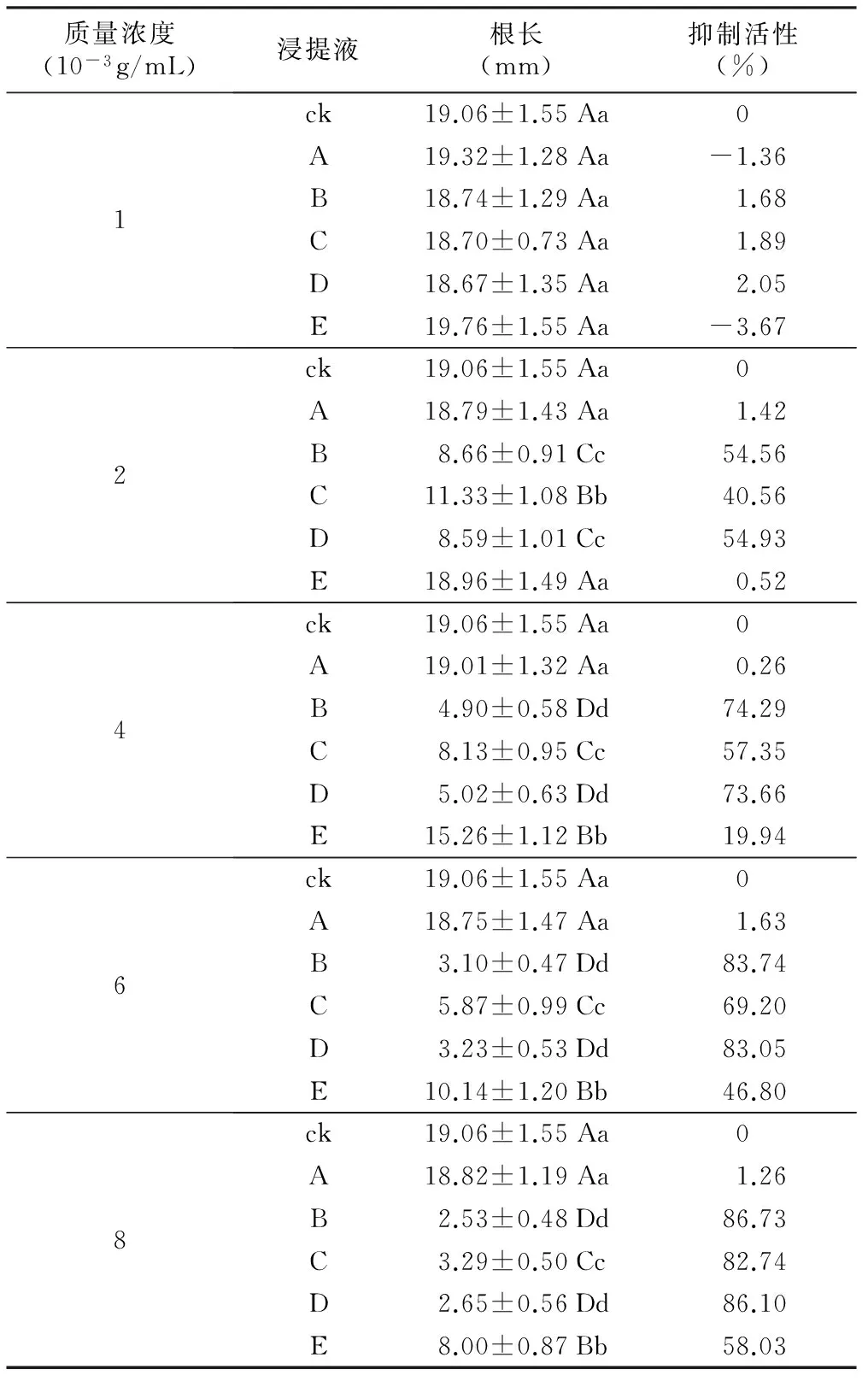
质量浓度(10-3g/mL)浸提液根长(mm)抑制活性(%)1ck19.06±1.55Aa0A19.32±1.28Aa-1.36B18.74±1.29Aa1.68C18.70±0.73Aa1.89D18.67±1.35Aa2.05E19.76±1.55Aa-3.672ck19.06±1.55Aa0A18.79±1.43Aa1.42B8.66±0.91Cc54.56C11.33±1.08Bb40.56D8.59±1.01Cc54.93E18.96±1.49Aa0.524ck19.06±1.55Aa0A19.01±1.32Aa0.26B4.90±0.58Dd74.29C8.13±0.95Cc57.35D5.02±0.63Dd73.66E15.26±1.12Bb19.946ck19.06±1.55Aa0A18.75±1.47Aa1.63B3.10±0.47Dd83.74C5.87±0.99Cc69.20D3.23±0.53Dd83.05E10.14±1.20Bb46.808ck19.06±1.55Aa0A18.82±1.19Aa1.26B2.53±0.48Dd86.73C3.29±0.50Cc82.74D2.65±0.56Dd86.10E8.00±0.87Bb58.03
2.3 温水浸种对去除吉林延龄草种子内源抑制物质的影响
由图 1,图 2,图3可知,用 25,35 ℃和 45 ℃水浸泡吉林延龄草种子,其内源抑制物质大部分可被浸泡出来,随着浸种时间的增加,浸提液对白菜幼根及胚轴的抑制作用呈现先增加而后逐渐降低的趋势。浸提液对白菜幼根生长的抑制活性高于对胚轴的抑制活性。25 ℃水浸泡种子第3天浸提液显著抑制白菜幼苗根长(p<0.05),第4天浸提液对白菜幼根的抑制作用达极显著水平(p<0.01),第5天浸提液抑制作用达到最大,白菜幼根平均根长6.84 mm,抑制活性达65.89%,随后浸提液抑制作用逐渐降低,第11天浸提液对白菜幼根无显著抑制作用(p>0.05),11 d后浸提液对白菜幼根无显著抑制作用(p>0.05)(数据未显示);25 ℃水浸泡种子第5天浸提液极显著抑制白菜胚轴生长(p<0.01),胚轴平均长度为6.77 mm,抑制活性达25.69%,7 d后浸提液对白菜胚轴伸长无显著抑制作用(p>0.05)。35 ℃水浸泡种子第1天浸提液对白菜幼根抑制作用达极显著水平(p<0.01),第3天浸提液抑制作用达到最大,白菜幼根平均根长3.58 mm,抑制活性达82.14%,随后浸提液抑制作用逐渐降低,第7天浸提液对白菜幼根无显著抑制作用(p>0.05),7 d后浸提液对白菜幼根无显著抑制作用(p>0.05)(数据未显示);35 ℃水浸泡种子第3天浸提液极显著抑制白菜胚轴生长(p<0.01),抑制活性达到最强,为59.93%,第6天浸提液对白菜胚轴伸长无显著抑制作用(p>0.05)。45 ℃水浸泡种子第1天浸提液对白菜幼根抑制作用达极显著水平(p<0.01),第2天浸提液抑制作用达到最大,白菜幼根平均根长1.88 mm,抑制活性达90.62%,随后浸提液抑制作用逐渐降低,第5天浸提液对白菜幼根无显著抑制作用(p>0.05),5 d后浸提液对白菜幼根无显著抑制作用(p>0.05)(数据未显示);45 ℃水浸泡种子第1天浸提液极显著抑制白菜胚轴生长(p<0.01),第2天浸提液抑制活性达到最强,为83.86%,随后浸提液对胚轴抑制作用逐渐降低,4 d后浸提液对白菜胚轴伸长无显著抑制作用(p>0.05)。
3 讨 论
前期研究表明,吉林延龄草种子存在胚后熟和上胚轴休眠特性[5]。植物种子中存在萌发抑制物质是导致种子休眠的一个主要因素[15],经研究发现吉林延龄草种子含有活性较高的内源抑制物质,对白菜幼根及胚轴,水稻幼根均有显著抑制作用,抑制物质的生物活性随质量浓度(在试验范围内)的逐渐增大而同步增强。吉林延龄草种子水提取液(C)对白菜和水稻幼苗生长的抑制活性高于甲醇提取物(B)的生物活性,吉林延龄草种子乙酸乙酯提取物对白菜和水稻幼苗无显著抑制作用,吉林延龄草种子经乙酸乙酯、甲醇溶液提取后,再经蒸馏水提取获得的水提液Ⅱ(E)对白菜和水稻幼苗生长的抑制活性显著减弱,表明吉林延龄草种子抑制物质在甲醇溶液中溶解性较强,故推断吉林延龄草种子萌发抑制物质为极性化合物。在植物种子休眠机理研究中,曾有报道推测植物种子中含有不饱和内酯、生物碱、氨、氰化物、有机酸、醛类、酚类等化合物可能是种子中存在的萌发抑制物质[16],相关资料显示,甲醇可提取植物体内多种有效成分,包含部分有机酸,酚类、苷类等化合物[17],Masateru等报道吉林延龄草中有含有白花延龄草皂苷A和B等数十种皂苷类化合物[1-4],近年来有研究结果表明皂苷类化合物对种子萌发及幼根伸长有较强的抑制化感效应[18],由此推测,吉林延龄草种子甲醇提取液有较强抑制活性可能是皂苷化合物起着一定的作用,在此基础上,本实验室正在进行吉林延龄草种子内源抑制物质分离鉴定工作,以进一步明确抑制物质的种类及其作用机制。

注:“*”表示处理间在5%水平上存在显著差异,“**”表示在5%水平上存在显著差异。下同。图1 吉林延龄草种子25 ℃水浸出液对白菜幼根及胚轴生长的影响

图2 吉林延龄草种子35 ℃水浸出液对白菜幼根及胚轴生长的影响
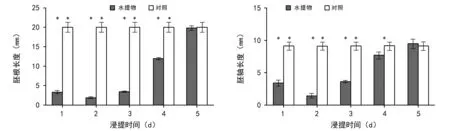
图3 吉林延龄草种子45 ℃水浸出液对白菜幼根及胚轴生长的影响
吉林延龄草种子抑制物质对白菜和水稻幼苗抑制活性不同,在种子抑制物质(甲醇提取液)质量浓度为1×10-3g/mL时,对白菜种子幼根及胚轴抑制活性分别为53.33%(p<0.01)和18.29%(p<0.01),对水稻种子幼根及胚芽鞘均无显著抑制作用(p>0.05),表明不同植物种子对抑制物质的敏感程度有所差异,白菜种子对抑制物质表现极高的敏感度,同时,白菜种子具有一致发芽势及较高发芽率并且比较容易获得,可使抑制物质活性得到快速评价,因此,推荐采用籽粒饱满的白菜种子测定种子抑制物质生物活性。
在农业生产上根据一部分抑制物质溶于水的特性,用水冲洗或浸洗种子来去除种子或果实中的抑制物质。如防风、桔梗、膜荚黄芪栽培生产一般播种前用40~45 ℃温水浸种,间隔一段时间更换清水,可促进种子提早萌发和出苗整齐,水浸种的作用不仅是软化种皮提高其通透性,更重要作用在于温水浸种可浸泡出大量内源抑制物质,降低内源抑制物质对种子萌发和幼苗生长的抑制作用[19-21]。有研究表明,对于非水溶性的抑制物质,可以用有机试剂进行冲洗或浸洗,如黄花乌头、返魂草、狭叶柴胡等种子用乙醚、乙醇等浸种,再将种子用清水洗净,可提高种子发芽率或提前出苗[22-24],但是,能否用有机溶剂浸种来改变种皮透性及浸淋掉部分抑制物质,并将其应用到药用植物栽培生产上,以及浸种对出苗后植株长势、入药部位质量安全性等方面影响尚不明确,有待进一步研究。本研究表明,水溶液浸提吉林延龄草种子可除去中种子内大部分抑制物质,在水温度45 ℃浸提效果最佳,浸提抑制物质的速率快,浸泡种子时间短,避免种子因长时间浸泡而受到毒害。另一方面,在研究中发现吉林延龄草种子成熟时种胚尚未发育完全,需要胚后熟阶段,因此推测种子中存在的萌发抑制物质可能是种子成熟时胚发育不完全及影响胚进一步分化和发育的重要因素,但除去种子内抑制物质能否加快种胚形态后熟还有待进一步研究。一般而言,影响种子休眠的原因不单是由于抑制物质的存在,而是取决于萌发促进物质和抑制物质的相对水平。Amen[15]提出促进物和抑制物之间作用的观点,阐明种子休眠的控制模式。它的基本观点是认为种子休眠状态决定于内源抑制物与促进物的平衡,当促进物和抑制物的平衡有利于抑制时种子发生休眠。一些研究表明,种子提早采收可避免硬实种皮的形成或化学抑制物质的大量产生,降低种子的休眠程度,提早采收也能干扰种子内部抑制物质的生化合成,降低其浓度,缩短发芽时间;但提前采收可能导致种子不发芽或发芽率偏低[25]。因此,下一步将开展吉林延龄草种子抑制物质与种子采收期相关性研究,寻求其最佳采收时间。
吉林延龄草种子综合休眠(形态-生理休眠)严重制约了其种群自然更新速度,人工种植已成为弥补野生资源不足的主要途径,而种子休眠的解除是人工种植亟待解决的关键问题之一。本研究证实吉林延龄草种子中存在活性较高的内源抑制物,同时,用45 ℃温水浸泡可有效除去种子内大部分抑制物质,为深入探讨中国野生濒危植物吉林延龄草种子内源抑制物质种类及作用机制,内源抑制物质有效除去方法奠定基础,为吉林延龄草种子休眠机制提供理论依据。
[1]Masateru O,Yoshihiro Y,Tsuyoshi I,et al.Steroids from the underground parts of trillium kamtschaticum[J].Chemical & Pharmaceutical Bulletin,2003,51(11):1 328-1 331.
[2]Masateru O,Chika T,Fumie S,et al.Two new steroid glycosides and a new sesquiterpenoid glycoside from the underground parts of Trillium kamtschaticum[J].Chemical & Pharmaceutical Bulletin,2007,55(4):551-556.
[3]Masateru O.Fumie S,Syoko S,et al.Three new steroid glycosides from the underground parts ofTrilliumkamtschaticum[J].Chemical & Pharmaceutical Bulletin.2007,55(7):1 093-1 096.
[4]国家中医药管理局.中华本草[M].上海:上海科学技术出版社,1999,8:174-176.
[5]Tetsuya K,Makoto M,Keisuke Y,et al.Seed dormancy in Trillium camschatcense (Melanthiaceae) and the possible roles of light and temperature requirements for seed germination in forests[J].American Journal of Botany,2011,98(2):215-226.
[6]Kentzer T.Gibberellin-like substance and growth inhibitors in relation to the dormancy and afterripening of ash seeds[J].Acta Societatis Botanicorum Poloniae,1966,35:575.
[7]Paul K B,Patel C S,Biswas P K.Changes in endogenous growth regulators in loblolly pine seeds during the process of stratification and germinations[J].Physiologia Plantarum,1973,28(3):530-534.
[8]Welbaum G E,Bradford K.J,Yim K O,et al.Biophysical physiogical and biochemical processes regulating seed germination[J].Seed Science Research,1998,8(2):161-172.
[9]Amritphale D,Yoneyama K,Takeuchi Y,et al.The modulating effect of the perisperm endosperm envelope on ABA-inhibition of seed germination in cucumber[J].Journal of Experimental Botany,2005,56(418):2 173-2 181.
[10]崔树玉,黄耀阁,刘墨祥,等.人参种子发芽抑制物质的初步研究[J].吉林农业大学学报,1996,18(1):25-29.
[11]黄耀阁,崔树玉,李向高,等.西洋参种子抑制物质的初步研究[J].吉林农业大学学报,1994,16(2):9.
[12]张跃进,张玉翠,王占红,等.黄精种子内源抑制物质的初步研究[J].西北农业学报,2011,20(7):50-55.
[13]赵敏,王炎,康莉,等.刺五加果实及种子内源萌发抑制物质活性的研究[J].中国中药杂志,2001,26(8):534-537.
[14]Huang H J,Ye W H,Wei X Y,et al.Allelopathic potential of sesquiterpene lactones and phenolic constituents from Mikania micrantha H.B.K[J].Biochemical Systematics and Ecology,2008,36(11):867-871.
[15]Amen R D.A model of seed dormancy[J].The Botanical Review,1968,34(1):3-6.
[16]Michael E.Germination inhibitors[J].The Botanical Review,1949,15(3):153-186.
[17]中国科学院上海药物研究所.中草药有效成分提取与分离[M].上海:上海科学技术出版社,1983:311-393.
[18]张爱华,雷锋杰,许永华,等.外源人参皂苷对人参种子萌发和幼根抗氧化酶活性的影响[J].生态学报,2009,29(9):4 934-4 941.
[19]赵敏.防风种子中内源抑制物质活性的研究[J].中草药,2004,35(4):441-444.
[20]赵敏,徐兆正,王荣华,等.桔梗种子内源抑制物质特性的初步研究[J].东北林业大学学报,2000(1):51-54.
[21]赵敏,王炎.膜荚黄芪种子萌发抑制物质特性的初步研究[J].中草药,2001,32(7):643-646.
[22]李赫男.黄花乌头种子萌发与水溶性内源抑制物质研究[J].安徽农业科学,2008,36(27):11 790-11 792.
[23]张秋菊,黄宏,朱珠,等.返魂草种子内源萌发抑制物质的生理活性[J].湖南农业大学学报(自然科学版),2005,31(6):609-611.
[24]周艳玲,赵敏,彭元举,等.狭叶柴胡种子萌发与内源抑制物质[J].植物研究,2009,29(3):329-332.
[25]Vaughton G,Ramsey M.Variation in summer dormancy in the lilioid geophyyte Burchardia umbellate(Colchicaceae) [J].American journal of botany,2001,88(7):1 223-1 229.

