杜鹃红山茶叶片叶绿素荧光对干旱胁迫及复水处理的响应
吴刘萍,许衍才,廖飞雄,王代容
(1.广东海洋大学农学院,广东 湛江 524088;2. 阳江市市区公园管理中心,广东 阳江 529500;3.华南农业大学林学与风景园林学院,广东 广州 510642;4.广东省农业科学院环境园艺研究所/广东省园林花卉种质创新综合利用重点实验室/农业部华南都市农业重点实验室,广东 广州 510640)
杜鹃红山茶(Camellia changiiYe)为山茶科山茶属光果红山茶亚组植物,仅分布于广东省阳春市河尾山鹅凰嶂自然保护区内,自然种群数仅800多株,为中国特有种、稀有种,被《中国物种红色名录》列为极危种(CR)和国家一级保护植物[1]。自此种植物被发现以来,学者们对其分类地位[2]、保护生物学[3]、染色体组型及主要性状的遗传变异[4-6],传粉生物学及相关生殖的花粉生物等[7-10]开展了大量研究。由于杜鹃红山茶四季开花,且在高气温6~9月的夏季为盛花期,具有很高的观赏价值,其繁殖利用受到重视,嫁接技术已获突破[11-12],嫁接苗成为杜鹃红山茶产业化发展的主要商品类型,已生产应用于园林景观和盆栽[13]。然而,作为一种分布区域窄、种群数量极少的保护植物,促进其人工栽培及商品化开发应用,有赖于掌握其生态习性和环境适应性。近年来相继开展了对杜鹃红山茶嫁接苗的光利用能力、干旱适应能力等相关研究,如光合日变化特性[14-15]、光响应曲线和光合参数[16]、干旱胁迫的生理响应等[17],但对干旱胁迫及复水处理下光合作用的抑制机理尚未见报道。
植物叶片叶绿体是光合作用的场所,叶绿素的系列变化反映植物的生长状态、光合能力和对环境胁迫的响应,叶绿素荧光参数动力学是研究植物及其对环境胁迫响应的强有力工具[18-21],由于其测定可以无损、实时、准确获取植物生命活动的信息,现已广泛应用于植物光合作用和逆境生理的研究[22-23],同时参考光合作用过程中发生的一系列生理生化指标特别是抗氧化酶活性变化情况[24-25],可系统和客观准确地了解植物光合作用的抑制机理。本研究通过测定干旱胁迫及复水情况下杜鹃红山茶叶片叶绿素荧光参数及抗氧化酶活性的系列变化,探讨杜鹃红山茶对干旱胁迫的响应及复水后的恢复能力,以深入了解杜鹃红山茶的水分适应机制,为杜鹃红山茶的人工栽培和生理生态研究提供参考依据。
1 材料与方法
1.1 试验材料
试验于2016年9~10月在广东海洋大学实验基地大棚中进行,试验期间最高温度35℃,相对湿度75%~85%,光照度>15 000 lx。试验材料为以高州油茶(C. gauchowensisChang)为砧木的3年生杜鹃红山茶嫁接苗,选取地径3 cm、株高、生长势较整齐一致的盆栽苗进行试验,盆栽基质为红壤和河沙配制的栽培土。
1.2 试验方法
盆栽苗上盆预培养3个月,常规养护管理,然后停止浇水进行干旱胁迫处理。试验设干旱胁迫0、5、10、15、20、25 d及复水5 d共7个处理,每个处理3次重复,每个重复6盆,每盆定植苗木1株。干旱胁迫25 d后恢复浇水,每天浇透1次。植株随机排列于棚内,各处理每株取当年生成熟叶片进行测定,每株随机取6片,3次测量取平均值。
1.3 测定指标及方法
干旱胁迫处理 0、5、10、15、20、25 d及复水后5 d,分别取样测定盆中土壤含水量、叶片叶绿素荧光参数。并于干旱胁迫前(0 d)、胁迫25 d、复水5 d分别测定叶片电解质渗出率、抗氧化酶活性。
叶绿素荧光参数测定采用PAM-2100 便携式调制荧光仪(德国Walz公司),参照邹崎[26]的方法进行,光强 500~1 200 μmol/m2·s。测定前将叶片暗适应20 min,分别测定叶片的初始荧光(Fo)、叶片叶绿素最大荧光(Fm)、原初光能转化效率Fv/Fm、可变荧光(Fv= Fm-Fo)、实际光化学效率(ΦQPSII)、电子传递速率(ETR)、荧光光化学猝灭(qP=(Fm'- Fo')/FV和荧光非光化学猝灭(qN=1-FV'/FV)。
叶片相对含水量按照饱和含水量法测定,细胞膜透性用相对电导率法[26]测定,超氧化物歧化酶(SOD)活性采用氯化硝基四氮唑蓝(NBT)光化还原法测定[26],过氧化物酶(POD)活性采用愈创木酚显色法测定[25],过氧化氢酶(CAT)活性测定采用紫外分光光度法[27]。
试验数据采用Excel软件和SPSS软件进行统计分析。
2 结果与分析
2.1 干旱胁迫下土壤含水量和植株生理生化响应
在停止浇水开始干旱胁迫处理后,盆栽中土壤含水量明显下降,并随处理的时间延长,土壤含水量持续下降。由图1可知,停止浇水后25 d,盆中土壤含水量由初始的32.93%降至6.68%,红山茶植株处于高度干旱胁迫状态;恢复浇水后5 d,土壤含水量迅速回升到胁迫前的状态。
由于盆中土壤水分的降低,红山茶植株产生了相应的生理响应,叶片的相对含水量也随之变化,测定结果(表1)表明,干旱胁迫25 d,叶片相对含水量比处理前下降了25.22%,复水后回复到胁迫前的水平;叶片电导率升高了98.85%,复水后有一定下降,但未恢复到处理前水平;抗氧化酶SOD、CAT、POD活性变化对干旱胁迫处理产生了极显著的响应,其中SOD和CAT活性大幅提高、分别比胁迫前提高了近3倍和4倍多,而POD活性明显下降、比胁迫前下降了79.50%,复水后酶活性均有一定程度的恢复,即SOD和CAT活性大幅下降,POD活性一定程度回升,但均未达到处理前水平。
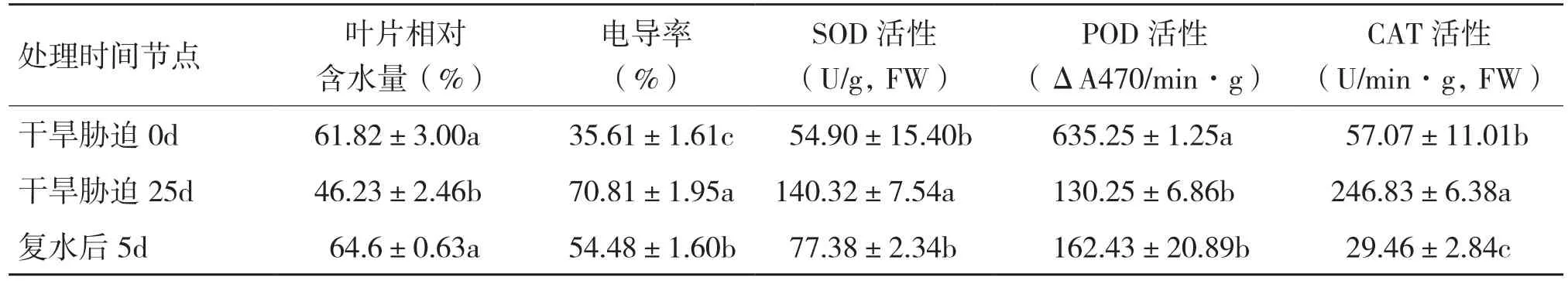
表1 干旱胁迫及复水处理杜鹃红山茶叶片含水量、电导率及抗氧化酶活性变化
2.2 干旱胁迫及复水处理杜鹃红山茶叶片叶绿素荧光参数响应
干旱胁迫后,杜鹃红山茶叶片叶绿素荧光参数对胁迫处理出现了灵敏的响应和变化,整体响应表现为显著差异。多重比较分析(表2)表明,干旱胁迫10 d后(中度胁迫)除光化学荧光猝灭qP外各参数均发生显著变化;干旱胁迫15 d后(重度胁迫)所有参数均较处理前发生显著变化,期间各参数均出现较大幅度变化;复水后,除电子传递速率(ERT)外各参数均有所恢复,趋近处理前水平,但均未能完全恢复正常。

表2 干旱胁迫及复水处理杜鹃红山茶叶片叶绿素荧光参数的变化
2.2.1 PSⅡ初始荧光Fo和最大光化学效率Fv/Fm的变化 从图2可以看出,在干旱胁迫初期,杜鹃红山茶叶片初始荧光Fo先是上升,再有下降起伏,随着干旱胁迫的持续,Fo持续上升,呈极显著变化,至25 d达到高点,复水后Fo则迅速下降。表明杜鹃红山茶叶片PSII反应中心对干旱胁迫有灵敏的响应,当胁迫到一定时间后中心会受到损伤,导致Fo上升,并随胁迫时间延长损伤程度越严重,复水后PSII可得到一定的修复。

图2 干旱胁迫及复水下杜鹃红山茶叶片Fo变化
Fv /Fm是PSⅡ最大光化学效率,反映PSⅡ原初光能转化效率。在正常生长情况下,每一物种的Fv/Fm比较稳定。但在胁迫情况下,光化学效率会受到影响。从图3可以看出,在干旱胁迫处理后10 d,杜鹃红山茶叶片Fv/Fm的值显著下降,降幅为9.76%,干旱胁迫15 d后显著升高,干旱胁迫20 d后再次下降,干旱胁迫25 d后PSⅡ最大光能转化效率(Fv/Fm)比胁迫前降低了5.76%,复水5 d后Fv/Fm恢复性提高。

图3 干旱胁迫及复水下杜鹃红山茶叶片Fv/Fm变化
2.2.2 实际光化学量子产量(Yield)与光合电子传递速率( ETR)的变化 由图4可知,随着干旱胁迫处理时间的持续,实际光化学量子产量持续不断下降,其中在胁迫5 d和20 d后都有一个明显的下降过程,胁迫25 d后下降了19%。复水后,光化学量子产量快速恢复上升。
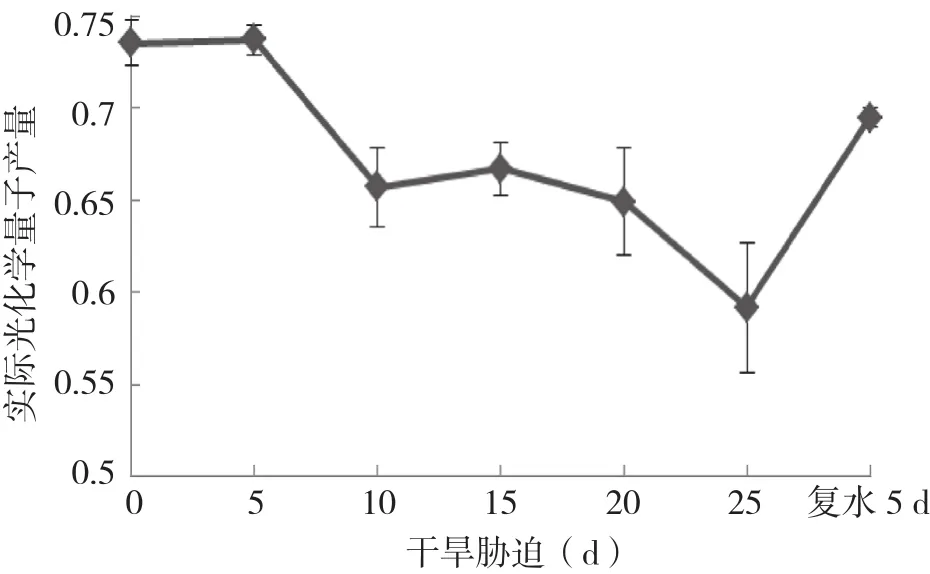
图4 干旱胁迫及复水下杜鹃红山茶叶片Yield变化
从PSⅡ反应中心电子传递情况光合电子传递速率( ETR) 来看(图5),干旱胁迫处理5 d后ETR下降,之后急速上升,胁迫10~20 d呈相对稳定状态,而20 d后又出现明显的下降,复水后再次急速上升,表明ETR会随环境发生剧烈变化而做出相应的响应。
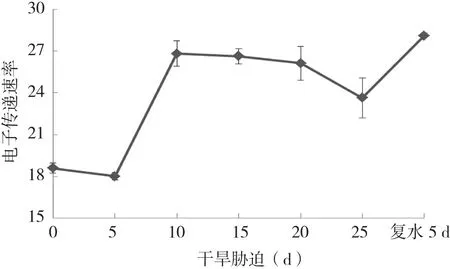
图5 干旱胁迫及复水下杜鹃红山茶叶片ETR变化
2.2.3 光化学淬灭系数(qP)和非光化学淬灭系数( qN )的变化 反映PSⅡ原初电子受体QA的氧化还原状态的光化学淬灭系数qP,随着干旱胁迫处理时间的延长,qP在干旱胁迫初始5 d略有升高后持续不断下降,降幅呈增大趋势,但在胁迫处理20 d后出现明显的增加现象,复水5 d 后略恢复性下降(图6)。
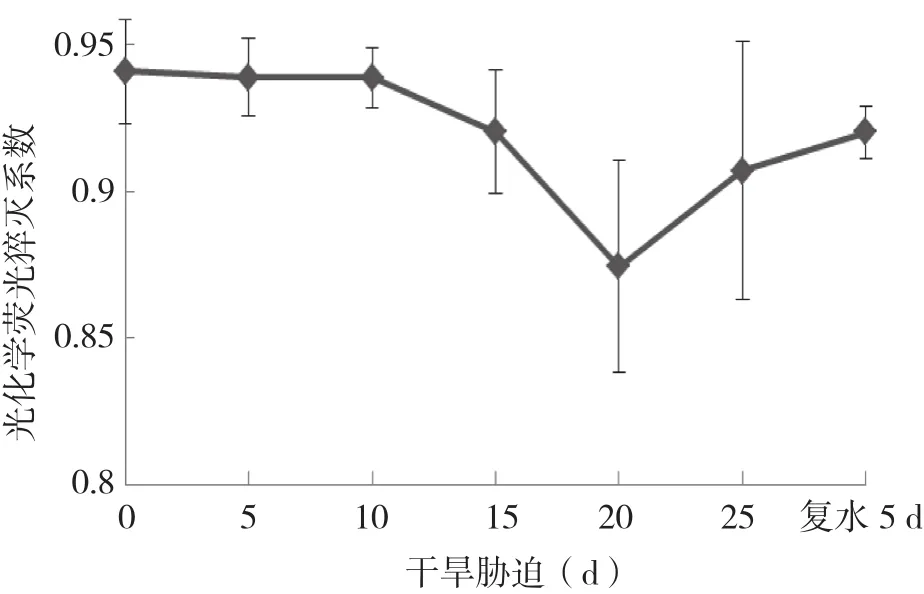
图6 干旱胁迫及复水下杜鹃红山茶叶片qP的变化
相反,非光化学淬灭系数( qN )在干旱胁迫处理5 d小幅度下降后,随胁迫时间的增长,持续不断上升,至胁迫25 d时达到最高值,复水处理5 d后,qN则出现大幅度恢复性下降(图7)。

图7 干旱胁迫及复水下杜鹃红山茶叶片qN的变化
3 结论与讨论
本试验从盆栽土壤含水量和叶片生理生化指标的变化响应来看,干旱胁迫处理15 d后,杜鹃红山茶植株已进入严重胁迫状态;20 d后,土壤含水量接近7%,成为干旱胁迫的临界点;25 d后,严重胁迫达较长时间,电导率大幅提高,表明已对植物叶片细胞膜产生了严重的损伤,而抗氧化酶SOD和CAT活性指标的大幅提高、POD活性明显下降,抗氧化酶系统是适应干旱的生理响应;复水后各项指标虽难以完全恢复,但均得到一定程度的恢复,对干旱胁迫过程的适应性和在复水恢复过程中的恢复能力均表明杜鹃红山茶对干旱环境具较强的适应性,这与杜鹃红山茶叶片较为耐旱的解剖结构研究结果相一致[28]。
Fo是PSⅡ反应中心全部开放即原初电子受体QA全部氧化时的荧光水平,在干旱胁迫5 d后,初始荧光Fo降低,可能由PSⅡ天线色素的热耗散所导;而严重胁迫期Fo的持续增加可能由PSⅡ反应中心的破坏或可逆失活引起,这与前人相关研究结果相一致[18]。任何影响PSII效能的环境胁迫均会使Fv/Fm 降低[26],干旱胁迫下,Fv/Fm和Yield在最初阶段明显下降,说明干旱胁迫下杜鹃红山茶叶片PSⅡ受到伤害,降低了PSⅡ原初光能转化效率,使PSⅡ潜在活性受损,光合作用原初反应过程受到抑制。之后都有所上升,可能是PSⅡ有所恢复并适应干旱的反应,随着干旱时间的持续,PSⅡ继续受到损害,Fv/Fm和Yield再次下降,复水处理后,PSⅡ得到一定修复。干旱处理最初阶段,ETR急速下降,之后上升到一定程度接近平稳,这可能是其遇到干旱后PSII的原初光能捕获能力与光合电子传输能力下降;随着干旱时间延长,ETR升高为了适应干旱环境的表现。qP随干旱胁迫程度增强而降低,在干旱处理的后期有所升高,可能是一定程度的干旱处理有利于提高PSⅡ反应中心开放部分的比例,将更多的光能用于推动光合电子传递,光能用于光化学传递的份额增加。在干旱初期短暂qN值下降后持续上升,表明叶片电子由PSⅡ的氧化侧向PSⅡ反应中心的传递受阻,用于进行光合作用的电子减少,以热或其他形式耗散的光能增加,同时卡尔文循环的活性受抑制程度增大,能量利用率降低。
本研究结果表明,杜鹃红山茶通过PSⅡ系统和抗氧化酶系统来应对外界的干旱胁迫;一定程度的干旱处理有利于提高PSⅡ反应中心开放部分的比例,但随着干旱时间的持续,干旱胁迫使杜鹃红山茶的PSⅡ受到伤害,光合电子传输能力下降。在干旱胁迫及复水过程中,杜鹃红山茶的水分适应机制可应用到其引种和花卉生产中:
(1)干旱胁迫初期,叶绿素各荧光参数产生明显的变化,表明胁迫对杜鹃红山茶叶片PSⅡ产生了影响,PSⅡ潜在活性受损,原初光能捕获能力与光合电子传输能力下降,光合作用原初反应过程受抑制;而之后各个荧光参数变化的幅度减缓或恢复,暗示在PSⅡ系统对干旱胁迫变化可以形成一个相对的适应期,有一定的保护机制,一定程度的干旱处理有利于提高PSⅡ反应中心开放部分的比例。期间,杜鹃红山茶干旱处理后10 d是Fo、Fv/Fm、Yield等主要参数变化拐点,可能是栽培管理中水分处理的较好时间点,这与红山茶类植物“干透浇透”的栽培水分管理基本原则相一致。
(2)干旱胁迫处理15 d后,杜鹃红山茶植株已进入严重胁迫状态,在较长时间的干旱胁迫下,其叶片PSⅡ受到损害加重,会产生较大的损伤,如Fv/Fm和Yield的大幅下降。从各个参数变化的情况看,胁迫处理20 d对杜鹃红山茶来说是重要的时间点,开始产生较为严重的干旱损伤。因此生产过程中应尽量避免这种极端的干旱胁迫。
(3)严重持续的干旱胁迫在复水处理后,杜鹃红山茶叶片的叶绿素各荧光参数如Fo、Fv/Fm、Yield等均出现恢复性变化,光合系统功能得到迅速恢复,表明杜鹃红山茶PSⅡ系统和抗氧化酶系统具较强的干旱胁迫修复能力,对干旱环境具有较好的适应能力。杜鹃红山茶嫁接苗具有较强的耐旱能力,支持了前述的相关研究[14-15,17]。高温、较高的空气湿度是对岭南地区城市夏季环境条件的模拟,而持续干旱胁迫是城市绿化中较常见的问题,干旱胁迫等实验条件模拟说明杜鹃红山茶可通过嫁接苗产业化发展并在城市环境中推广应用。
[1] 汪松,解炎. 中国物种红色名录[M]. 北京:高等教育出版社,2004.
[2] 张宏达,任善湘. 中国植物志第四十九卷第三分册[M]. 北京:科学出版社,1998.
[3] 罗晓莹. 杜鹃红山茶保护生物学研究[D]. 广州:华南农业大学,2006.
[4] 王仲郎,王霜,梁静,等. 珍稀植物杜鹃红山茶的核型及育种学意义//中国首届茶花育种学术研讨会论文集[C]. 2007:27-31.
[5] 罗晓莹,庄雪影,杨跃生. 杜鹃红山茶遗传多样性的ISSR分析[J]. 热带亚热带植物学报,2007,15(2):93-100.
[6] 刘玉玲. 杜鹃红山茶主要性状遗传变异研究[D]. 广州:华南农业大学,2009.
[7] 李天菲,林田,徐碧玉,等. 杜鹃红山茶花粉萌发力及贮藏耐性的研究[J]. 生物技术通报,2008(S):239-243.
[8] 罗晓莹,莫罗坚,庄雪影. 杜鹃红山茶大小孢子发生及雌雄配子体发育研究[J]. 华南农业大学学报,2010,31(4):68-75.
[9] 罗晓莹,唐光大,莫罗坚,等. 杜鹃红山茶的传粉生物学[J]. 生态学杂志,2011,30(3):552- 557.
[10] 王有兵,徐斌,张方秋,等. 杜鹃红山茶的2n 花粉自然发生及其诱导初步研究[J]. 广东林业科技,2011,27(6):9-15.
[11] 黎运枢,崔统华,郑文经,等. 杜鹃红山茶嫁接繁殖试验[J]. 广东林业科技,2004,20(3):37-38,49.
[12] 吴晓静,邓石婷,谭杨帆. 杜鹃红山茶嫁接砧木选择比较试验[J]. 安徽农学通报,2008,14(14):120-121.
[13] 赵平丽,董斌. 杜鹃红山茶特征特性及繁育技术研究进展[J]. 现代农业科技,2011(15):214-217.
[14] 刘红晓,袁莲莲,刘楠,等. 杜鹃红山茶的扦插苗、嫁接苗和砧木的光合作用特征[J]. 生态环境学报,2013,22(6):996-1000.
[15] 刘玉玲,刘信凯,谌光晖,等. 杜鹃红山茶与3个山茶栽培品种光合日变化特性研究[J]. 广东林业科技,2011,27(1):17-22.
[16] 张方秋,杨会肖,徐斌,等. 杜鹃红山茶的光响应特性及其最适模型筛选[J]. 生态环境学报,2015,24(10):1599-1603.
[17] 吴刘萍,王廷芹,杨瑞. 珍稀濒危植物杜鹃红山茶嫁接苗对水分胁迫的生理响应[J]. 福建林业科技,2012,39(3):51-56.
[18] Bjorkman O,Demmig B. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77K among vascular plants of diverse origins[J]. Planta,1987,170:489-504.
[19] Schreiber U,Bilger W,Klughammer C,et al.Applications of Chlorophyll Fluorescence in Photosynthesis Research,Stress physiology,Hydrobiology and Remote Sensing[M].Dordrecht:Kluer Academic Publishers,1988:15-55.
[20] 张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999,16(4):444-448.
[21] 李晓,冯伟,曾晓春. 叶绿素荧光分析技术及应用进展[J]. 西北植物学报,2006,26(9):2186-2196.
[22] 赵琴,潘静,曹兵,等. 气温升高与干旱胁迫对宁夏枸杞光合作用的影响[J]. 生态学报,2015,35(18):6016-6022.
[23] 刘全勇,卢锟,李泽,等. 水分胁迫对刨花润楠幼苗生长及光合特性的影响[J]. 中南林业科技大学学报,2016,36(9):29-35,43.
[24] 张丹,任洁,王慧梅. 干旱胁迫及复水对红松针叶和树皮绿色组织光合特性及抗氧化系统的影响[J]. 生态学杂志,2016,35(10):2606-2614.
[25] 张仁和,郑友军,马国胜,等.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J]. 生态学报,2011,31(5):1303-1311.
[26] 邹琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000:11-12,72-75,159-174.
[27] Türkan I,Bor M,Zdemir F,et al. Differential responses of lipid peroxidation and antioxidants in the leaves of drought tolerantP. acutifoliusG ray and drought sensitiveP. vulgarisL. subjected to polyethylene glycol mediated water stress[J].Plant Science,2005,168:223-231.
[28] 李琳琳,李凯凯,朱纯,等. 张氏红山茶叶片适应于环境的解剖特征[J]. 中山大学学报(自然科学版),2010,49(5):91-97.

