长期低剂量锰染毒对子代大鼠睾丸生精细胞线粒体状态和细胞凋亡的影响*
王乾兴,褚 慧,于明明,张先平
(1.遵义医学院细胞生物学教研室,贵州遵义 563003;2.湖南省娄底市中心医院生殖医学中心 422907)
男性不育是临床常见疾病之一。环境污染、不良生活习惯等使男性精液质量显著下降[1-2],已引起了学界广泛关注。环境锰暴露是引发男性生殖障碍的一个重要因素。锰通过血睾屏障蓄积于睾丸,引起雄性精液质量降低和生精细胞凋亡[3-4]。但慢性锰染毒对子代雄性的生殖毒理效应尚未见报道。此外,线粒体凋亡途径引起的凋亡可能是锰毒性的重要原因[5]。线粒体融合/分裂的动态平衡受视神经萎缩蛋白1(optic atrophy 1,Opa1)和动力相关蛋白1(dynamin related protein 1,Drp1)控制,其动态失衡将导致细胞凋亡[6]。锰的雄性生殖毒性是否也通过这对基因起作用亦未见相关报道。本研究探索母代大鼠长期低剂量锰染毒对子代睾丸生精细胞线粒体功能状态和细胞凋亡的影响,为锰中毒的预防和治疗、环境锰暴露的安全限量确定提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物及分组 满月SPF级雌性SD大鼠(90~120 g)[第三军医大学实验动物中心,SCXK(渝)2012-0005],分为对照组、低、中、高剂量组,每组8只。每天12 h光照,平均环境温度(21±1)℃,自由进食饮水。实验获得遵义医学院伦理学委员会批准。
1.1.2主要试剂 MnCl2·4H2O(分析纯,中国医药集团上海化学试剂公司);TUNEL试剂盒(美国Roche公司);RNAiso Plus(日本TaKaRa公司);qPCR反应试剂盒(北京全式金生物技术有限公司);Drp1、半胱氨酸蛋白酶9(Caspase9)兔多抗(美国Proteintech公司);Opa1兔单抗(英国Abcam公司);qPCR扩增引物序列由生工生物工程(上海)股份有限公司合成:Opa1 (CTC GCT ATC ACT GCC AAC AC,CTT CTT CTC GCC GTC TTC AG);Drp1 (AAC AGG CAA CTG GAG AGG AA,GCA ACT GGA ACT GGC ACA T);Caspase9 (CCA CTG CCT CAT CAT CAA CA,TCG TTC TTC ACC TCC ACC AT);GAPDH (GAC ATG CCG CCT GGA GAA AC,AGC CCA GGA TGC CCT TTA GT)。
1.2方法
1.2.1动物模型及取材 雌性SD大鼠饲养1周,注射生理盐水或2、4、8 mg/kg氯化锰8周,与正常雄性大鼠交配,检测到阴栓后单独饲养。雌鼠在妊娠期和哺乳期继续染毒,总染毒时间14周。给药途径为腹腔注射,1次/天,5天/周。每3天测大鼠体质量以调整MnCl2用量。每组8只12周龄子代大鼠断头处死后分离双侧睾丸,左侧用于qPCR和Western blot实验;右侧用5%戊二醛或4%多聚甲醛固定,用于透射电镜观察、苏木精-伊红(HE)染色、末端标记法(TUNEL)和免疫组织化学实验。
1.2.2透射电镜观察生精细胞线粒体形态 将睾丸剪成 1 mm3组织块,5%戊二醛固定、脱水、树脂包埋,超薄切片、醋酸双氧铀染色,透射电镜观察。
1.2.3TUNLE法检测生精细胞凋亡 睾丸冠状切片常规脱蜡水化。微波修复抗原。0.3%的 H2O2-甲醇封闭10 min。加反应液37 ℃避光温育1 h,加转化剂POD 37 ℃反应30 min,二氨基联苯胺(DAB)显色,复染、脱水、透明、封片、镜检。同时设阴性对照(只加标记反应液)和阳性对照(10 μg/mL 的DNAase Ⅰ预处理)。每张切片选择10个生精小管,计数凋亡信号阳性的生精细胞数占总生精细胞数的比例,即为凋亡指数(apoptosis index,AI)。
1.2.3qPCR检测Opa1、Drp1、Caspase9 mRNA表达 RNAiso Plus提取总RNA,经纯度鉴定和浓度测定后取2 μg总RNA,两步法RT反应合成cDNA(42 ℃ 30 min、85 ℃ 5 s、4 ℃ 10 min)。按说明书进行qPCR(20 μL体系:94 ℃ 30 s、94 ℃ 5 s、60 ℃ 30 s,40个循环)。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,以2-△△CT为目的基因相对表达量。每个标本设置3管重复,取3次的平均值计算mRNA的相对表达量。
1.2.4免疫组织化学检测Opa1、Drp1和Caspase9蛋白表达 石蜡切片常规脱蜡水化,3% H2O2阻断,微波修复抗原,山羊血清封闭。滴加一抗Drp1(1∶50)、Caspase9(1∶50)和Opa1(1∶500),4 ℃过夜。二抗37 ℃反应30 min。DAB显色,复染、脱水、封片,光镜观察。以磷酸缓冲盐溶液(PBS)代替一抗为阴性对照。
1.2.5Western blot检测Opa1、Drp1和Caspase9蛋白表达 睾丸100 mg加500 μL RIPA 裂解液,同时加5 μL PMSF和蛋白磷酸酶抑制剂,4 ℃匀浆,12 000 r/min离心15 min,小心吸取上清,BCA 法测定蛋白浓度。取40 μg蛋白上样,10%分离胶120 V电泳,100 mA转印,5%脱脂奶粉封闭1 h,加入一抗(Opa1为1∶1 000、Drp1为1∶500、Caspase9为1∶1 000、GAPDH为1∶4 000)4 ℃过夜。二抗37 ℃孵育1 h,ECL发光、显影、定影。将胶片扫描,用Image Pro Plus软件分析目的条带光密度值,以目的条带/GAPDH为目的蛋白相对表达量。
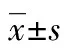
2 结 果
2.1长期低剂量锰染毒对子代大鼠睾丸组织形态学的影响 对照组睾丸曲细精管管腔大小基本一致、各级生精细胞有序排列,管腔内可见大量精子细胞和成熟精子。各锰染毒组睾丸生精小管呈现不同程度的形态学改变。随着锰染毒剂量的增加,生精细胞层数逐渐减少,生精细胞排列紊乱、数量减少或缺如,管腔内成熟的精子数目明显减少,见图1。

A:对照组;B:低剂量组;C:中剂量组;D:高剂量组
图1子代大鼠睾丸组织形态学的改变(HE ×400)

A:线粒体结构完整,连接成网;B:线粒体分离成单个;C.线粒体肿胀,嵴消失(箭头所示)
图2子代大鼠睾丸生精细胞线粒体结构形态的改变(TEM×1400)
2.2长期低剂量锰染毒对子代大鼠生精细胞线粒体形态的影响 对照组生精细胞线粒体结构完整,相互连接成网;低、中剂量组生精细胞线粒体则分离成单个;高剂量组线粒体表现为肿胀、嵴消失,见图2。
2.3长期低剂量锰染毒对子代大鼠生精细胞Opa1和Drp1 mRNA及蛋白表达的影响 qPCR结果显示,与对照组比较,低剂量组Opa1 mRNA表达量无明显变化,但中、高剂量组显著降低,且随锰染毒剂量的增加逐渐递减(P<0.05,P<0.01);Drp1 mRNA表达情况则刚好与Opa1相反,见表1。
免疫组织化学结果显示,Opa1表达于各级生精细胞和精子细胞细胞质,呈棕黄色。其染色强度随锰染毒剂量的增加而减弱;Drp1主要表达于各级生精细胞细胞质,呈棕黄色。低剂量组和对照组染色强度无明显差异,中、高剂量组明显升高,见图3。
Western blot结果显示,与对照组相比,低剂量组Opa1蛋白表达无显著性差异,而中、高剂量组均显著降低,且随锰染毒剂量的增加而降低(P<0.05,P<0.01)。与对照组相比,各锰染毒组Drp1蛋白表达均显著增加,且随锰染毒剂量的增加而递增(P<0.01),见表2。

表1 子代大鼠睾丸组织Opa1、Drp1和Caspase 9 mRNA相对表达量
a:P<0.01,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.01,与低剂量组比较;d:P<0.05,与中剂量组比较;e:P<0.01,与中剂量组比较

表2 子代大鼠睾丸组织Opa1、Drp1、Caspase 9蛋白相对表达量和
a:P<0.05,与对照组比较;b:P<0.01,与对照组比较;c:P<0.05,与低剂量组比较;d:P<0.01,与低剂量组比较;e:P<0.05,与中剂量组比较;f:P<0.05,与中剂量组比较
2.4长期低剂量锰染毒对子代大鼠生精细胞凋亡和Caspase9表达的影响 TUNEL法原位检测大鼠生精细胞凋亡结果显示,各组大鼠均可见生精细胞凋亡,其细胞核呈棕黄色,主要见于精原细胞、精母细胞和精子细胞。各剂量组生精细胞AI均明显高于对照组(P<0.01),且随锰染毒剂量的增加而增加(P<0.01)。qPCR结果显示,与对照组相比,各锰染毒组Caspase 9 mRNA相对表达量均升高,且随锰染毒剂量的增加逐渐增加(P<0.05)。这一规律在免疫组织化学和Western blot结果中也有相同的体现,见表2、图3~5。

图3 子代大鼠生精细胞Opa1、Drp1和Caspase9蛋白表达定位(SP×400)

图4 子代大鼠睾丸组织内蛋白定量(Western blot)

图5 子代大鼠生精细胞的凋亡(TUNEL×400)
3 讨 论
毒理学实验所采用的锰染毒途径有经呼吸道、消化道、循环系统3条[4,7-9]。呼吸道染毒可以较真实地反映锰尘导致的毒性,但操作比较繁琐;消化道染毒由于动物活动度下降而可能影响到最终锰摄入量。以往采用循环系统染毒的剂量大都在7.5 mg/kg以上,远大于环境锰暴露水平,对职业防护指导意义有限。因此本实验采取较低剂量(2、4、8 mg/kg)氯化锰进行腹腔注射,以评价其对子代雄性的生殖毒性。
线粒体的融合/分裂的动态平衡反映了线粒体的功能状态。研究证实线粒体分裂是细胞凋亡的最早阶段,凋亡过程中存在线粒体从管网状向点状的转换[10-11]。本实验结果显示,对照组睾丸生精细胞内线粒体结构完整,相互连接成网;锰染毒后则分离成单个甚至表现出肿胀、嵴消失。结合HE染色结果,随着锰染毒剂量的增加,生精细胞层数逐渐减少,各级生精细胞排列紊乱、数量减少或缺如,管腔内成熟的精子数目明显减少,提示长期低剂量锰染毒后子代大鼠生精细胞线粒体功能降低,降低其能量供应而影响生精功能。
线粒体的融合/分裂的动态平衡主要受到Opa1/Drp1控制。Opa1是由核基因编码的动力相关蛋白,主要诱导线粒体膜融合和控制凋亡过程中嵴的重塑。Opa1低表达凋亡敏感性增加,过表达则抑制凋亡[12-13]。Drp1是动力蛋白GTP酶超家族成员,在线粒体分裂中起关键作用[14]。Drp1磷酸化可引起细胞色素C的释放、促凋亡蛋白释放,激活Caspase9,引起细胞凋亡[15]。本实验发现,长期低剂量锰染毒后,子代大鼠生精细胞中Opa1 mRNA和蛋白表达量在中、高剂量组显著降低,且随锰染毒剂量的增加逐渐递减;Drp1的表达趋势则与之相反。例外的是低剂量组Drp1的Western blot结果也高于对照组,可能和样本量较小有关。所以,当锰染毒剂量达4 mg/kg以上时,Opa1表达下降同时Drp1表达上升,提示子代大鼠睾丸生精细胞线粒体趋向分裂,导致生精细胞能量供应不足,诱导其凋亡,这与大鼠脑胶质瘤细胞的研究结果相似[16-17]。
锰诱导的细胞凋亡主要是通过线粒体途径进行,即通过降低Opa1、增加Drp1的表达,引起线粒体膜电位的改变、细胞色素C的释放,细胞色素C与凋亡酶激活因子(Apaf1) 结合,募集并激活 Caspase9,启动Caspase级联反应,引起细胞凋亡[16-19]。本研究结果显示,Caspase 9 mRNA和蛋白在各锰染毒组均升高,且随锰染毒剂量的增加逐渐增加,且生精细胞 AI 也随锰染毒剂量的增加而上升。提示长期低剂量锰染毒可诱导子代大鼠睾丸生精细胞Caspase级联信号被启动,引起生精细胞的细胞凋亡。
综上所述,长期低剂量锰染毒可抑制Opa1和促进Drp1表达,使线粒体融合/分裂失衡,启动Caspase9信号,最终导致子代大鼠生精细胞凋亡。
[1]HUANG C,LI B S,XU K R,et al.Decline in semen quality among 30 636 young Chinese men from 2001 to 2015[J].Fertil Steril,2017,107(1):83-88.
[2]BORGES E,SETTI A S,BRAGA D P,et al.Decline in semen quality among infertile men in Brazil during the past 10 years[J].Int Braz J Urol,2015,41(4):757-763.
[3]WANG Y X,SUN Y,HUANG Z,et al.Associations of urinary metal levels with serum hormones,spermatozoa apoptosis and sperm DNA damage in a Chinese population[J].Environ Int,2016,94:177-188.
[4]王乾兴,金华,张先平.谷胱甘肽拮抗锰致雄性大鼠生殖损伤的研究[J].中国计划生育学杂志,2011,19(9):537-539,549.
[5]ROTH J A,GARRICK M D.Iron interactions and other biological reactions mediating the physiological and toxic actions of Manganese[J].Biochem Pharmacol,2003,66(1):1-13.
[6]KALIA K,ZHENG W,JIANG W.Importance of mitochondria in manganese-induced cellular toxicity[J].Neurotoxicology,2009,30(4):727-727.
[7]SAPUTRA D,CHANG J,LEE B J,et al.Short-term Manganese inhalation decreases brain dopamine transporter levels without disrupting motor skills in rats[J].J Toxicol Sci,2016,41(3):391-402.
[8]WANG L,SHIRAKI A,ITAHASHI M,et al.Aberration in epigenetic gene regulation in hippocampal neurogenesis by developmental exposure tomanganese chloride in mice[J].Toxicol Sci,2013,136(1):154-165.
[9]SANTOS D,DINAMENE S,BATORÉU M C,et al.Evaluation of neurobehavioral and neuroinflammatory end-points in the post-exposure period in rats sub-acutely exposed to Manganese[J].Toxicology,2013,314(1):95-99.
[10]WU S N,ZHOU F F,ZHANG Z Z,et al.Mitochondrial oxidative stress causes mitochondrial fragmentation via differential modulation of mitochondrial fission-fusion proteins[J].FEBS J,2011,278(6):941-954.
[11]PATTEN D A,WONG J,KHACHO M,et al.Opa1-dependent cristae modulation is essential for cellular adaptation to metabolic demand[J].EMBO J,2014,33(22):2676-2691.
[12]RENAULT T T,FLOROS K V,ELKHOLI R,et al.Mitochondrial shape governs BAX-induced membrane permeabilization and apoptosis[J].Mol Cell,2015,57(1):69-82.
[13]KUSHNAREVA Y,SEONG Y,ANDREYEV A Y,et al.Mitochondrial dysfunction in an Opa1(Q285STOP)mouse model of dominant optic atrophy results from Opa1 haploinsufficiency[J].Cell Death Dis,2016,7(7):e2309.
[14]MACDONALD P J,STEPANYANTS N,MEHROTRA N,et al.A dimeric equilibrium intermediate nucleates Drp1 reassembly on mitochondrial membranes for fission[J].Mol Biol Cell,2014,25(12):1905-1915.
[15]WANG P,WANG P G,LIU B,et al.Dynamin-related protein Drp1 is required for Bax translocation to mitochondria in response to irradiation-induced apoptosis[J].Oncotarget,2015,6(26):22598-22612.
[16]ALAIMO A,GOROJOD R M,BEAUQUIS J,et al.Deregulation of mitochondria-shaping proteins Opa-1 and Drp-1 in manganese-induced apoptosis[J].PLoS One,2014,9(3):e91848.
[17]ALAIMO A,GOROJOD R M,MIGLIETTA E A,et al.Manganese induces mitochondrial dynamics impairment and apoptotic cell death:a study in human Gli36 cells[J].Neurosci Lett,2013,554(1):76-81.
[18]ZHANG L,SANG H,LIU Y,et al.Manganese activates caspase-9-dependent apoptosis in human bronchial epithelial cells[J].Hum Exp Toxicol,2013,32(11):1155-1163.
[19]WANG Y H,YANG X L,HAN X,et al.Mimic of Manganese superoxide dismutase to induce apoptosis of human non-Hodgkin lymphoma Raji cells through mitochondrial pathways[J].Int Immunopharmacol,2012,14(4):620-628.

