酶解辅助乙醇提取 牡丹果皮木犀草素的研究
陈 刚,杨玉珍,张 敏,罗 青,王国霞
(郑州师范学院,河南郑州 450044)
牡丹籽油在2011年被认定为新资源食品,“凤丹”牡丹(Paeoniasuffruticosa“Feng Dan”)是榨取牡丹籽油常用的品种之一,随着牡丹籽油的急性肝损伤保护作用[1],抗糖尿病活性[2],降血脂、降血糖作用[3-4],防晒[5]等保健功能[6-8]逐渐被人们重视,其种植面积也将逐年扩大,同时也将产生大量的果皮,因此为果皮资源的再利用提供技术支持是非常迫切的。木犀草素为黄酮类化合物,具有抗氧化[9]、抗菌[10]、抗肿瘤[11]、抗炎[12]等生物活性。目前有学者[13]研究了牡丹种皮木犀草素的提取工艺,但牡丹果皮中木犀草素的提取研究尚未见报道,本文研究牡丹果皮木犀草素的提取工艺,可为油用牡丹果皮资源的再利用提供技术支持。
1 材料与方法
1.1 材料与仪器
“凤丹”牡丹果皮 2016年8月采收的五年生实生苗“凤丹”牡丹果皮置于室内阴干备用;木犀草素对照品 上海源叶生物科技有限公司;果胶酶(酶活力500 U·g-1) Sigma公司;纤维素酶(酶活力10000 U·g-1) 南京都莱生物技术有限公司;无水乙醇、乙酸、乙酸钠、钼酸铵 均为分析纯。
JA3003N电子天平 上海菁海仪器有限公司;PHSJ-5实验室pH计 上海精科;MINID实验室超纯水器 河南森空仪器设备有限公司;TGL16M冷冻离心机 湖南湘立科学仪器设备有限公司;TH-250B型数控超声波清洗机 济宁天华超声电子仪器有限公司;DHG-9140电热鼓风干燥箱 上海一恒科学仪器有限公司;HH-S4型数显恒温水浴锅 邢台市润联机械设备有限公司;CT410粉碎机 苏州安创仪器有限公司;FCD-270SE电冰柜 青岛海尔特种电冰柜有限公司;T6型紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 乙醇提取工艺单因素实验与正交实验
1.2.1.1 乙醇提取工艺单因素实验 取牡丹果皮,洗净,在55 ℃的干燥箱干燥8 h后用粉碎机制粉,将过100目筛后的粉末存放于磨砂的广口瓶密封,置于4 ℃冰箱中备用。
分别取1 g牡丹果皮粉末,按照10∶1的液料比分别加入60%、65%、70%、75%、80%的乙醇溶液摇匀,静置提取30 min,在10000 r·min-1、4 ℃离心10 min,取出上清液,再按相同比例向残渣中加入乙醇溶液,摇匀并再次静置相同时间,在相同离心条件下离心,取出上清液,合并上清液,考察乙醇体积分数对木犀草素得率的影响。
分别取1 g牡丹果皮粉末,按照10∶1的液料比加入65%的乙醇溶液摇匀静置浸泡提取20、25、30、35、40 min,其它操作同上,考察静置浸泡时间对木犀草素得率的影响。
分别取1 g牡丹果皮粉末,按液料比6∶1、8∶1、10∶1、12∶1、14∶1 (mL·g-1)加入65%的乙醇溶液摇匀,静置提取30 min,其它操作同上,考察液料比对木犀草素得率的影响。
分别取1 g牡丹果皮粉末,按照10∶1的液料比加入65%的乙醇溶液,摇匀静置提取30 min,在10000 r·min-1、4 ℃离心10 min,取出上清液。按相同操作提取1、2、3、4、5次,考察提取次数对木犀草素得率的影响;以上实验均重复三次。
1.2.1.2 乙醇提取工艺正交实验 在上述单因素实验基础上,利用L9(34)正交实验,对乙醇体积分数、液料比、浸泡时间及提取次数这四个因素的条件进行优化,方案如表1所示。

表1 乙醇提取木犀草素正交实验因素和水平Table 1 The orthogonal test factors and levels of ethanol extracttion of luteolin
1.2.2 酶解辅助乙醇提取工艺单因素实验与正交实验
1.2.2.1 酶解辅助乙醇提取工艺单因素实验 分别取10份1 g牡丹果皮粉末置于试管中,加入pH4.0的酶缓冲液5 mL(分别为0.05、0.10、0.15、0.20、0.25 g·L-1的纤维素酶,0.05、0.10、0.15、0.20、0.25 g·L-1的果胶酶)摇匀后于50 ℃水浴保温120 min。再以90 ℃水浴灭活5 min,按照优化的乙醇提取条件提取,测得木犀草素得率,考察不同的酶种类及酶浓度对木犀草素得率的影响。
分别取1 g牡丹果皮粉末,加入pH4.0的0.10 g·L-1的果胶酶缓冲液5 mL,摇匀后于50 ℃水浴保温80、100、120、140、160 min,其他操作同上,考察水浴时间对木犀草素得率的影响。
分别取1 g牡丹果皮粉末,加入pH3.5、4.0、4.5、5.0、5.5的0.10 g·L-1的果胶酶缓冲液5 mL,摇匀后50 ℃水浴保温120 min,其他操作同上,考察pH对木犀草素得率的影响。
分别取1 g牡丹果皮粉末,加入含有pH4.0的0.10 g·L-1的果胶酶缓冲液5 mL,摇匀后在40、45、50、55、60 ℃水浴保温120 min,其他操作同上,考察水浴温度对木犀草素得率的影响;以上实验均重复三次。
1.2.2.2 酶解辅助乙醇提取工艺正交实验 在上述的单因素实验基础上,利用L9(34)进行正交实验,对酶浓度、水浴时间、水浴温度和pH四个因素的条件进行优化,设计方案如表2所示。

表2 酶解辅助乙醇提取木犀草素正交实验因素和水平Table 2 The orthogonal test factors and levels of enzyme assisted ethanol extraction of luteolin
1.2.3 木犀草素得率的测定 参考文献[14]的方法,有改进。以4.00 g·L-1的钼酸铵溶液为对照品,分别配制浓度为0.0040、0.0056、0.0072、0.0088、0.0104、0.0120、0.0136 mg·mL-1的木犀草素标准使用液,在360 nm处测定吸光度,得出线性回归方程。
准确量取提取液1 mL用钼酸盐分光光度法[14]测定吸光度,将结果代入制作好的木犀草素标准曲线方程,根据公式计算结果。
木犀草素得率的计算公式如下:
式中,C为根据测得的吸光度和标准曲线方程计算出的样品中木犀草素浓度(mg·mL-1),V为提取的上清液体积(mL),K为稀释倍数,m为果皮粉末质量(g)。
1.3 数据处理
实验数据用Microsoft office 2010 作图,SPSS 13.0进行数据统计分析,采用邓肯氏新复极差法检验,以p<0.05为差异显著性标准。
2 结果及分析
2.1 木犀草素标准曲线
根据不同质量分数的木犀草素标准溶液及其所对应的吸光度值,拟合线性方程为y=43.906x+0.0173,R2=0.9929,式中y为吸光度值,x为木犀草素质量分数。
2.2 乙醇提取工艺单因素实验结果
2.2.1 乙醇体积分数对木犀草素得率的影响 由图1可知,在乙醇体积分数为60%至65%的范围内,木犀草素得率随着乙醇体积分数的增加而增加,乙醇体积分数为65%时其得率为10.18 mg·g-1,达到最大值,但乙醇体积分数大于65%时,提取得率随乙醇体积分数的增加反而降低,这是因为随着乙醇-水体积分数的变化,溶剂的极性也随之变化,对木犀草素的溶出率发生变化,而且体积分数不同的乙醇水溶液对组织细胞的结构影响不同,同时水的减少也削弱了对颗粒细胞的溶胀,所以乙醇体积分数提高到一定程度,木犀草素的提取率反而降低[15]。体积分数为80%时,木犀草素得率为8.42 mg·g-1,比乙醇体积分数为65%时木犀草素得率10.18 mg·g-1,低17.29%,方差分析结果显示,在乙醇体积分数为65%时,显著(p<0.05)大于其它处理水平的木犀草素得率。

图1 乙醇体积分数对木犀草素得率的影响Fig.1 Effect of volume fraction of ethanol on luteolin yield
2.2.2 浸泡时间对木犀草素得率的影响 由图2可以看出,浸泡时间在20~30 min范围时,木犀草素得率是逐渐上升的,在浸泡时间为30 min时,木犀草素得率达到最大,为9.95 mg·g-1,这是由于浸泡时间越长就会有越多的木犀草素溶解到提取液中;而浸泡时间为30~40 min时,木犀草素得率反而下降,40 min的得率为8.60 mg·g-1,可能是由于木犀草素保存在溶剂里时间过长被氧化破坏的缘故。方差分析结果表明,浸泡时间30 min时的木犀草素得率显著(p<0.05)高于25 min和35 min,故选取25、30和35 min三个处理水平用于正交实验设计。
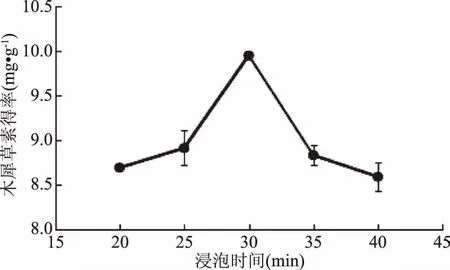
图2 浸泡时间对木犀草素得率的影响Fig.2 Effect of soak time on luteolin yield
2.2.3 液料比对木犀草素得率的影响 由图3可知,液料比在6∶1~10∶1的范围内,木犀草素得率是不断增加的,当液料比为10∶1时,木犀草素得率最大,为10.70 mg·g-1,这是因为随着乙醇量的增加,使其与底物的接触机会增大,从而得到更多的木犀草素;但当液料比在10∶1~14∶1范围内时,木犀草素得率反而降低,是因为与木犀草素竞争乙醇溶液的其他醇溶性杂质溶出量增加,导致木犀草素的溶出率降低,得率下降[16]。当液料比为6∶1时木犀草素得率为9.96 mg·g-1,比液料比为10∶1时木犀草素得率10.70 mg·g-1低6.92%。方差分析结果表明,液料比为10∶1时,显著(p<0.05)大于其他处理水平的木犀草素得率。因此,选取液料比为8∶1、10∶1、12∶1三个水平用于正交实验设计。

图3 液料比对木犀草素得率的影响Fig.3 Effect of liquid to solid ratio on luteolin yield
2.2.4 提取次数对木犀草素得率的影响 由图4可以看出,提取次数在1~2次范围内,木犀草素得率是逐渐增大的,最高为9.42 mg·g-1,这可能是因为提取次数增多使得更多的木犀草素溶解在提取液中;而在提取次数为2~5次时,木犀草素得率反而是下降的,提取5次时的木犀草素得率为9.00 mg·g-1,出现此变化的原因可能是提取次数过多导致提取液中的木犀草素被氧化分解造成的。方差分析结果表明,提取次数为2次时的木犀草素得率显著(p<0.05)高于1次和3次,故选取1、2和3次三个处理水平用于正交实验设计。

图4 提取次数对木犀草素得率的影响Fig.4 Effect of extracting times on luteolin yield
2.3 正交实验及结果分析
正交实验结果以及极差分析结果如表3所示,影响牡丹果皮木犀草素得率的主次关系依次为提取次数、乙醇体积分数、浸泡时间、液料比。

表3 乙醇提取木犀草素正交实验因素结果Table 3 Design and results of orthogonal test of ethanol extract luteolin
由表4可知,乙醇体积分数、浸泡时间、液料比、提取次数四因素都达到了显著(p<0.05)水平,表明实验中的乙醇体积分数、浸泡时间、液料比、提取次数均显著(p<0.05)地影响了木犀草素得率。

表4 乙醇提取木犀草素方差分析结果Table 4 The results of ANOVA of ethanol extract luteolin
2.4 验证实验
经极差分析可知,当组合为A1B2C2D3,即乙醇体积分数60%,浸泡时间30 min,液料比10∶1,提取3次时,木犀草素得率最大。而此组合并未出现在上述正交实验组合中,所以在此工艺条件下验证,得出的最优组合提取条件下的木犀草素得率为(15.48±0.18) mg·g-1。对比优化前的提取条件,即60%乙醇溶液浸泡25 min、液料比为8∶1、提取一次的条件下所得的木犀草素得率9.25 mg·g-1,优化后的得率为优化前的1.67倍。
2.5 酶解辅助乙醇提取工艺单因素实验结果
2.5.1 酶种类及酶质量浓度对木犀草素得率的影响 由图5可知,果胶酶对于木犀草素得率的影响更加明显,所以选用果胶酶辅助提取木犀草素。在果胶酶浓度为0.05~0.10 g·L-1范围内,得率不断增大,果胶酶浓度为0.10 g·L-1时木犀草素的得率达到最大为17.94 mg·g-1,是因为随着果胶酶浓度升高,酶与底物接触的机会增加,有更多的木犀草素被分离出来;而酶浓度为0.10~0.25 g·L-1时,木犀草素得率反而逐渐降低,果胶酶浓度为0.25 g·L-1时,木犀草素得率为16.34 mg·g-1,比0.10 g·L-1时低9.79%。方差分析结果显示,当果胶酶浓度为0.10 g·L-1时的得率显著(p<0.05)大于其他处理水平的木犀草素得率。因此,选择果胶酶浓度为0.05、0.10、0.15 g·L-1三个水平用于正交实验设计。

图5 纤维素酶浓度和果胶酶浓度对木犀草素得率的影响Fig.5 Effect of cellulase concentration and pectinase concentration on luteolin yield
2.5.2 水浴时间对木犀草素得率的影响 由图6可知,在水浴时间为80~140 min范围内,随着水浴时间的不断延长,得率也不断升高,当水浴时间为140 min时得率最大,为17.98 mg·g-1,这可能是因为水浴时间越长就有越多的木犀草素溶解到提取液中;但当水浴的时间在140~160 min时,木犀草素的得率反而降低至16.88 mg·g-1,比水浴时间为140 min时木犀草素得率低6.12%,这可能是因为木犀草素在较高温度下保持时间过长而被氧化破坏的缘故。方差分析结果显示,水浴时间为140 min时,显著(p<0.05)大于其他处理水平的木犀草素得率。所以选择120、140、160 min三个水平用于正交实验设计。

图6 水浴时间对木犀草素得率的影响Fig.6 Effect of water bath time on luteolin yield
2.5.3 pH对木犀草素得率的影响 如图7所示,pH3.5~4.0范围内,木犀草素得率随着pH增大而升高,pH4.0时得率达到最大值,为17.80 mg·g-1,这可能是因为随着pH的升高,酶的活性也随之升高;但当pH4.0~5.5范围内时,木犀草素得率反而降低,pH5.5时为16.62 mg·g-1,比pH4.0时低了6.63%,这可能是pH过高,果胶酶活性降低,从而使得木犀草素得率降低。方差分析结果显示,pH4.0时,显著(p<0.05)大于其他处理水平的木犀草素得率。因此选取pH为3.5、4.0、4.5三个水平用于正交实验设计。

图7 pH对木犀草素得率的影响Fig.7 Effect of pH on luteolin yield
2.5.4 水浴温度对木犀草素得率的影响 由图8可知,水浴温度在40~55 ℃时,木犀草素得率不断增高,在55 ℃时达到最大,为17.62 mg·g-1,这也许是因为温度升高,酶活性也随之增大;但在55~60 ℃范围内时,木犀草素得率反而降低,60 ℃时为16.06 mg·g-1,比55 ℃时低8.85%,这是因为果胶酶的最适温度为55 ℃,温度过高会使果胶酶活性降低,从而使木犀草素得率降低。方差分析结果显示,水浴温度是55 ℃时的得率,显著(p<0.05)大于其它处理水平的木犀草素得率。因此,选取45、50、55 ℃三个水平用于正交实验设计。

图8 水浴温度对木犀草素得率的影响Fig.8 Effect of water bath temperature on luteolin yield
2.6 正交实验及结果分析
正交实验结果和极差分析结果见表5,由表5可知,影响牡丹果皮木犀草素得率的主次关系依次为水浴时间、水浴温度、pH、果胶酶浓度。

表5 酶解辅助乙醇提取木犀草素正交实验因素结果Table 5 Design and results of orthogonal test of enzyme assisted ethanol extraction of luteolin

表6 酶解辅助乙醇提取木犀草素方差分析结果Table 6 The results of ANOVA of enzyme assisted ethanol extraction of luteolin
由表6可知,果胶酶浓度、水浴时间、pH、水浴温度四因素均达到显著(p<0.05)水平,说明了实验中的果胶酶浓度、水浴时间、pH、水浴温度均显著(p<0.05)地影响木犀草素得率。
2.7 验证实验
经极差分析表明,当组合为A1B3C2D3,即在果胶酶浓度0.05 g·L-1、水浴加热160 min、pH4.0、水浴温度55 ℃条件下进行处理后,再在乙醇体积分数60%、浸泡时间为30 min、液料比为10∶1的条件下提取3次,木犀草素得率预计达到最大。因为此组合并没有出现在以上正交实验组合中,所以在此条件下进行验证,得出的最优组合提取条件下的木犀草素得率为(19.30±0.41) mg·g-1。对比未经优化的提取条件,即60%乙醇溶液浸泡25 min、液料比为8∶1、提取一次的条件下所得的木犀草素得率9.25 mg·g-1,优化后的产品得率为优化前的2.09倍;对比酶解条件未优化的得率,即果胶酶0.05 g·L-1、水浴加热120 min、pH3.5、水浴温度45 ℃的条件下处理后,在乙醇体积分数为60%、果皮浸泡30 min、液料比为10∶1条件下提取3次所得木犀草素得率16.70 mg·g-1,优化后的产品得率为优化前的1.15倍。
3 结论
本研究采用酶解辅助乙醇提取牡丹果皮木犀草素的工艺条件,首先进行乙醇提取牡丹果皮木犀草素最优条件的探究,通过正交实验得出最优提取组合,即在乙醇体积分数为60%、浸泡时间30 min、液料比为10∶1的条件下提取3次,木犀草素得率为15.48 mg·g-1;在此最优组合的条件下加入果胶酶,同样在单因素实验的基础上,通过正交实验得出酶解条件的最佳组合为果胶酶0.05 g·L-1、水浴加热160 min、pH4.0、水浴温度55 ℃,再以两次正交实验的结果进行验证,即在果胶酶0.05 g·L-1、pH4.0、水浴加热160 min、水浴温度55 ℃的条件处理后,再在乙醇体积分数为60%、果皮浸泡30 min、液料比为10∶1的条件下提取3次,牡丹果皮木犀草素得率最高达19.30 mg·g-1。对比本实验最初研究结果表明,经过果胶酶辅助乙醇提取后,木犀草素得率为优化前的2.09倍,达到了强化提取的预期效果,节约了能源,提高了提取效率。
[1]翟文婷,朱献标,李艳丽,等. 牡丹籽油对小鼠急性肝损伤的保护作用[J]. 中国油脂,2013,38(11):43-45.
[2]Su J,Wang H,Ma C,et al. Anti-diabetic activity of peony seed oil,a new resource food in STZ-induced diabetic mice[J]. Food & Function,2015,6(9):2930-2938.
[3]Su J,Ma C,Liu C,et al. Hypolipidemic Activity of Peony Seed Oil Rich inα-Linolenic,is Mediated Through Inhibition of Lipogenesis and Upregulation of Fatty Acidβ-Oxidation[J]. Journal of Food Science,2016,81(4):H1001-H1009.
[4]董振兴,彭代银,宣自华,等. 牡丹籽油降血脂、降血糖作用的实验研究[J]. 安徽医药,2013,17(8):1286-1289.
[5]高婷婷,王亚芸,任建武. GC-MS法分析牡丹籽油的成分及其防晒效果的评定[J]. 食品科技,2013,39(6):296-299.
[6]代慧慧,魏安池,李晓栋,等. 牡丹籽油开发应用的研究进展[J]. 粮食与油脂,2016,30(1):4-6.
[7]朱献标,翟文婷,董秀勋,等. 牡丹籽油化学成分及功能研究进展[J]. 中国油脂,2014,39(1):88-91.
[8]王顺利,任秀霞,薛璟祺,等. 牡丹籽油成分、功效及加工工艺的研究进展[J]. 中国粮油学报,2016,31(3):139-146.
[9]吕畅,王红芳,阎雪莹. 木犀草素抗氧化作用研究进展[J].黑龙江医药,2015,28(5):1019-1022.
[10]王倩,谢明杰. 木犀草素对金黄色葡萄球菌的抑菌活性及其机制[J]. 微生物学报,2010,50(9):1180-1184.
[11]魏平平,张振海,金鑫,等. 木犀草素混合胶束的制备及其抗肿瘤活性研究[J]. 中国药学杂志,2015,50(15):1330-1334.
[12]刘圆,李园园,冯婷婷,等. 木犀草素镇痛抗炎作用的实验研究[J]. 齐齐哈尔医学院学报,2010,31(15):2368-2370.
[13]孟庆焕,祖元刚,王化,等.酶解辅助乙醇提取牡丹种皮中的木犀草素[J].东北林业大学学报,2015,43(6):133-135.
[14]徐文峰,廖晓玲,廖文利,等. 钼酸盐分光光度法测定花生壳中木犀草素[J]. 理化检验:化学分册,2008,44(12):1229-1230.
[15]李洪娟. 花生壳中木犀草素的超声提取工艺[J]. 湖北农业科学,2010,49(5):1183-1185.
[16]仇洋,徐艳阳,刘辉,等. 微波-超声辅助提取玉米须木犀草素的工艺优化[J]. 食品安全质量检测学报,2016,7(4):1637-1644.

