德国新上市药品医疗保险支付标准制定的规则与流程
张玉丽 徐睿鸿 吴 晶
1 背景
我国已经建立了覆盖全民的基本医疗保险体系,政府基本医疗保险也已经成为医疗服务市场的主要购买方,但是目前还未形成自己的支付标准体系。2015年我国《推进药品价格改革的意见》(发改价格[2015]904号)中指出“医保基金支付的药品,由医保部门会同有关部门拟定医保药品支付标准制定的程序、依据、方法等规则”,该文件明确了医疗保险基金管理者应该站在购买方的立场上制定“购买”规则。本研究意图通过对德国新上市药品如何被判定是否有资格加入到法定医疗保险报销体系,以及法定医疗保险基金管理者如何对新上市药品制定支付价格的方法与流程进行系统梳理,为我国制定基本医疗保险药品支付标准提供借鉴。
德国是世界范围内第一个实行社会保险的国家,其法定医疗保险(Gesetzliche Kranken-versicherung,以下简称GKV)诞生于1883年,覆盖了德国约7千万民众(占德国人口的87%),是德国医疗保险体系的核心。德国联邦联合委员会(以下简称G-BA)是德国法定医疗保险基金委员会、法定医疗保险医师协会、牙医协会及医院联盟的最高自治决策主体,依法负责法定医疗保险基金支付标准的制定和执行,并受德国联邦卫生部的监督[1]。
德国药品实行分类管理制度,新上市的药品首先被区分为 GKV给予或不予报销两种情况。根据德国社会第五法典(简称SGB-Ⅴ)和G-BA的药品指令,新上市药品只要不是下列四种情况之一都有资格进入法定医疗保险体系。四种情况具体为:①非处方药品,其中根据治疗规范用于治疗严重疾病的药品、12周岁以下参保儿童使用的药品和 18岁周以下参保人用于治疗发育障碍的药品除外;②部分用于缓解18周岁以上成年参保人的感冒、流行感冒症状的药物,治疗非真菌感染的口腔及咽喉病症(如溃疡)的药物,泻药、晕动症之类病症的处方药;③就使用药品的目的而言,一些旨在提高生活质量的药品,如抗自然衰老进程、戒烟、减重药品等;④无效益药品(Inefficient medicines),德国于2002年9月发布了由联邦委员会医师和法定医疗保险一起制定的包含大约 2000个无效益药品的清单,又称为逆向清单(Negative list),列入该清单的药品 GKV不予报销,包括制剂中含有不以治疗或降低用药风险为目的不必要组分(如止痛药与维生素复方制剂)或制剂中所含的活性成分过多不能确认有效成分或准确评估疗效的药品[2-3]。
GKV给予报销的药品又被区分为创新药品(Innovation drugs/New active ingredient drugs)和非创新药品(Analog drug)。德国于2011年1月1日起实施了医药市场重组方案(以下简称AMNOG),该法案规定对新上市的创新药品进行附加效益评估,评估后被划分为有附加效益的创新药品和无附加效益的创新药品,有附加效益的创新药品认为是真正的创新药品。被认为具有附加效益的创新药品的医疗保险支付价格由GKV与企业谈判确定,而无附加效益的创新药品和非创新药品则被纳入参考定价体系。被考虑纳入参考价格体系的药品可以加入已有的参考价格组,若没有适合的参考价格组则为其新设立参考价格组(图1)。
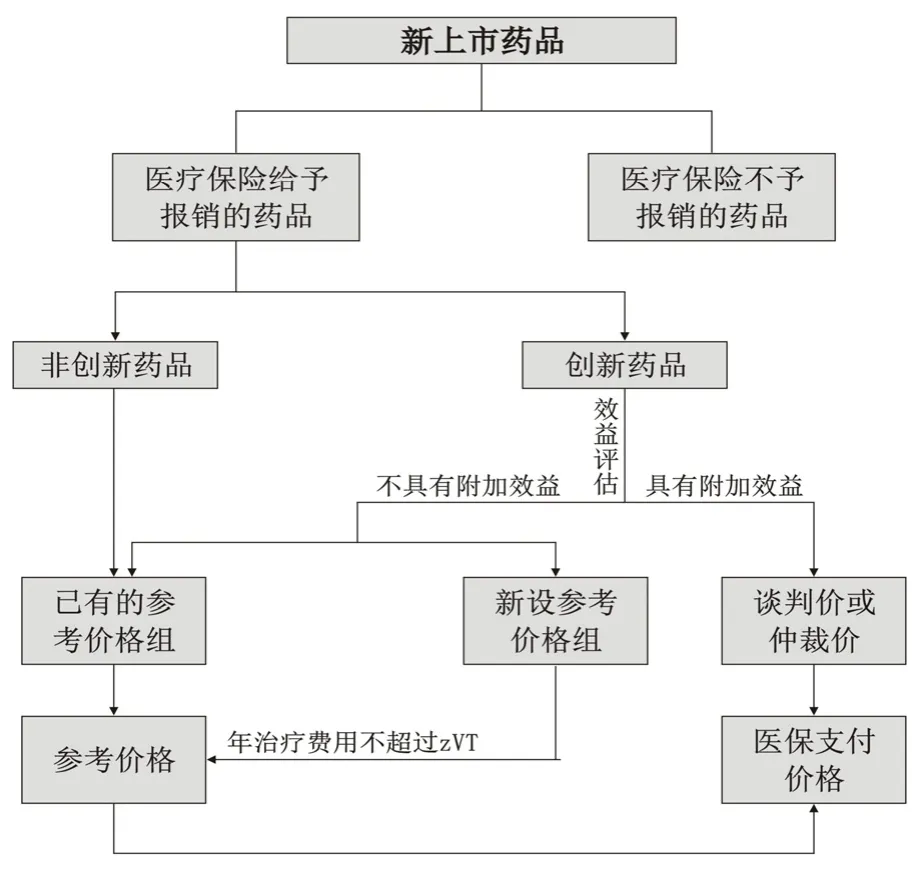
图1 德国新上市药品医疗保险保报销定价流程图
2 德国新上市创新药品医疗保险支付标准制定的规则
AMNOG要求新获批的创新药品企业在新药上市的同时必须向 G-BA提交药品效益档案(Benefit Dossier),用以进行效益评估(Benefit Assessment)。G-BA收到企业提交的效益档案后,委托卫生保健质量和效率研究院(Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen,IQWiG)根据档案内容将新药与G-BA选定的已有的适当治疗方法(Appropriate comparative therapy,zTV)对比进行效益评估。根据效益评估的结果,G-BA公布哪些创新药品可以以“具有附加效益(Additional benefit)”的创新药品身份进入谈判定价程序,哪些药品因不具有附加效益而被放入到参考价格体系。
预期年销售额在5000万欧元(含增值税)以下的用于治疗罕见病的孤儿药和销售额在 100万欧元(含增值税)以下仅在医院使用的药品,可以豁免效益评估[4]。
2.1 附加效益的评估流程作为独立、专业的研究机构,IQWiG从是否延长生存期、是否减轻不良反应、是否缩短病程以及是否改善生活质量四个方面对新药的附加效益进行评价。该评价过程需在 3个月内完成,IQWiG将附加效益等级评定的建议结果提交给G-BA,G-BA在其网站上公布结果。然后,G-BA会参考IQWiG的评价,在接下来的3个月内举行听证会,并经过综合评估后将创新药品的附加效益评定为具有重大的附加效益(Major additional benefit)、显著的附加效益(Considerable additional benefit)、轻微的附加效益(Minor additional benefit)、不可定量的附加效益(Additional benefit not quantifiable)、无附加效益(no additional benefit)或差于适当治疗方法(Benefit smaller than appropriate comparative therapy)这6个等级中的一个等级。附加效益级别评定后的 4周内,企业可以决定是否继续下一程序,若此期间企业决定撤出(Opt-out)德国市场,将不会留下任何评定及后续价格记录[4]。
2.2 具有附加效益的创新药品的医疗保险支付标准如果创新药品被评为前 4个等级,则认为是具有附加效益的创新药品,企业可以与法定医疗保险基金协会进行价格谈判以确定医疗保险的支付价格。谈判需在 6个月内完成,且谈判价格自谈判产品上市后的第13个月的第一天开始生效(创新药品上市后前12个月的药品价格由企业自主制定、GKV全额支付)。此谈判价格不仅适用于法定医疗保险,也适用于私立保险机构和自付费用的患者。若谈判期间未能就医疗保险支付价格达成一致意见,则谈判双方中的任何一方都可以向仲裁委员会申请价格仲裁,仲裁委员会需在3个月内裁定药品支付价格,其价格具有追溯效力,即该价格追溯至被仲裁药品上市后的第13个月开始生效。仲裁价格生效后,企业若想撤出德国市场则会留下价格记录,此价格可能成为其他欧洲国家的外部参考价格。谈判价格或仲裁价格将作为医疗保险的最高支付价格。
被认定不具有附加效益的创新药品会被纳入现有的第二等级参考价格组(即组内药物具有相似药理作用和疗效,特别是具有相似化学结构,通常包含同种药品的仿制[me-too]类药物),或视情况为其设立新的参考价格组。此种情况下,新设立参考价格组的参考价格换算成年治疗费用不应该超过效益评估中zVT的年治疗费用,若G-BA同时选定了不止一个zVT,则参考价格不超过最经济的(The most cost-effective alternative)那个zVT的年治疗费用[5]。
2.3 不具有附加效益的创新药品的医疗保险支付标准德国于1989年由《医疗市场改革法案》(Health Care Reform Act)引入药品参考定价(Reference Pricing)体系,该体系包含参考定价适用范围的确定、参考价格组的划分、参考价格的制定以及发布参考价格信息四部分内容。参考价格组的划分和参考价格的制定分别由 G-BA和法定医疗保险协会(GKV-SV)依照SGB-Ⅴ进行。
2.3.1 参考价格组的划分流程首先,GKV-SV 向G-BA提议设立新的参考价格组或将某(些)药品纳入已有的参考价格组;其次,G-BA药品小组委员会负责讨论并审核提议,召集法定医疗保险基金会代表、医师代表和患者代表等参与听证会并初步做出决定;再次,G-BA办公室对药品小组委员会的决策进行评估,根据 SGB-Ⅴ第 91条规定编制和汇总草案,包括文件摘要、决策理由和最终决定,并提交至联邦卫生部(Federal Ministry of Health);最后,联邦卫生部如无异议则在联邦公报(Bundesanzeiger)发布确定参考价格组的联邦公告。如果存在异议,则交由药品小组委员会重新讨论和审核[6]。
2.3.2 参考价格组划分的一般性原则首先,从药理(药品活性物质)和治疗属性层面区分不同药品的药理治疗作用。其次,按照国际卫生组织(WHO)的解剖学、治疗学及化学分类系统(ATC)将药品分类,并从ATC-4级进行参考价格组的划分。这其中也需要考虑ATC-5级药品在药理学与治疗学上的不同,如口服、静脉注射等不同给药途径,常释、缓控释等不同剂型对药品进行组别的划分,如布洛芬参考价格组2和参考价格组4分别是口服缓释控释剂型和外用乳膏剂产品组。另外,相同活性物质、相同剂型的药品也会根据是否为处方药划分为不同的亚组,如口服常释剂型布洛芬参考价格组 1A和1B分别是处方药和非处方药参考价格组。再次,应用于共同的治疗领域、疗效相当的活性物质(主要指复方制剂)可以认为是具有可比性的药品[4,7]。
按照上述原则将药品划分为不同级别的参考价格组,其中第 1等级参考价格组内药品含有相同的活性物质,主要由过期专利药及被证明具有生物等效性的通用名药品组成,例如二甲双胍参考价格组;第 2等级参考价格组内药品具有相似药理作用和疗效,特别是具有相似的化学结构,通常包含同种药品的me-too类药物,例如由口服质子泵抑制剂泮托拉唑(Pantoprazol)、奥美拉唑(Omeprazol)、兰索拉唑(Lansoprazo)、右旋兰索拉唑(Dexlansoprazol)、雷贝拉唑(Rabeprazol)和埃索美拉唑(Esomeprazol)组成的参考价格组;第 3等级参考价格组内药品常用于治疗相同的疾病和症状,尤其是复方制剂组,例如血管紧张素Ⅱ受体拮抗剂(Angiotensin-Ⅱ-Antagonisten)与氨氯地平(Amlodipin)组成的复方制剂坎地沙坦+氨氯地平(Candesartan +Amlodipin)、氯沙坦+氨氯地平(Losartan +Amlodipin)、奥美沙坦+氨氯地平(Olmesartan +Amlodipin)、替米沙坦+氨氯地平(Telmisartan +Amlodipin)和缬沙坦+氨氯地平(Valsartan +Amlodipin)组成的参考价格组[8]。
参考价格是法定医疗保险基金给予可报销药品的最高支付价格,企业可以自主制定销售价格,但是高出参考价格的部分完全由患者负担。医师在开具处方时有义务告知患者所开具药品的价格是否高于参考价格,并向患者提供不高于参考价格的药品信息供患者选择。为鼓励企业降价以获得更多的市场份额,若企业的定价低于参考价格 30%以上,则患者可以申请免除共付费用[5]。GKV 通过每年采集药品销售量及价格,为每年一次参考价格的审查提供最新信息,参考价格组也会根据市场情况及时做出调整。2016年德国对53个参考价格组进行了调整,其中28组中产品数量减少,13组中产品数量增加,新增设2个参考价格组,撤销10个参考价格组。截至2016年底,德国共有药品参考价格组441个,其中第1等级参考价格组314个,覆盖药品16 957个;第2等级参考价格组64个,覆盖药品10 719个;第3等级参考价格组63个,覆盖药品5980个。参考价格体系共覆盖了33 656个药品,占据德国法定医疗保险基金支付医药市场份额的 81%,医疗保险药品支付额度的37%[9]。
3 讨论与启示
本研究系统地介绍了德国法定医疗保险基金可报销药品支付价格的制定方法,期望为我国基本医疗保险制定药品支付标准提供参考。
首先,德国的法定医疗保险基金覆盖德国人口的 87%,与我国的基本医疗保险基金有相似的“垄断”购买能力。尤其是在德国AMNOG实施后,通过对其新上市专利药品进行的早期效益评估打破了专利药品上市后由企业自主定价的格局。在进一步加强法定医疗保险基金对新上市药品价格管控能力的同时,鼓励真正具有创新精神的企业研发更具有临床效益的药品,而被甄别出的“伪创新”专利药品被加入到参考价格体系则为法定医疗保险节省了基金的支出。更重要的是,德国依据药品创新程度的不同将药品导入不同的支付标准制定程序,使得不同创新程度的药品都有各自的定价路径可以遵循。可报销的新上市药品在上市后就可以按照程序进入法定医疗保险报销体系,或是谈判定价或是参考定价都可以尽早为患者提供相应的医疗福祉。
其次,德国参考价格是医疗保险基金作为购买方给出的支付标准,企业依然可以自主定价。这使得德国的参考价格制度是一种间接的价格管控手段,具有良好的价格管控能力。一方面,参考价格信息经由德国医学文献和信息网(Deutschen Institut für medizinische Dokumentation und Information,DIMDI)每两周更新一次向公众发布,并特别公布那些定价低于法定医疗保险支付标准的药品名单,这一做法提高了公众以及医师对药品价格的知晓度,而且通过患者共付制度和满足一定条件下的共付豁免机制,进一步提高了患者对药品价格的需求弹性,从而引导企业为获得更大的市场份额而降价[10]。另一方面,GKV每年都会收集药品市场价格信息并对参考价格进行审查、调整,在保障市场供应的前提下实现药品价格的螺旋式下降。我国医疗保险基金管理者也可以考虑从以上两方面着手,即提高药品销售价格的透明度、建立合理的药品价格共担机制来提高我国患者对药品价格的敏感度。
最后,德国的药品参考价格是依据药品的市场价格而制定的,在制定参考价格的过程中,不仅考虑到排除极端高价产品对参考价格的拉升影响,而且考虑了药品供应的适当性与安全性。“参考价格要求满足一个特定条件,即此价格下应涵盖同组药品中至少20%的处方量和至少20%的产品数量”,以保证充足的市场供应,使得医师和患者在参考价格下有充足的治疗药品可以选择。
综上所述,参考定价机制是在保障了治疗药品供应充足的前提下,以市场价格为基础、通过提高患者和医师对药品价格的敏感度,并及时调整参考价格的一整套机制来进行价格管控的方法。参考价格组的合理划分是这一机制得以实施的前提条件,德国依据“相同药理药效的药品价格应该相同”的理念,首先从第1级参考价格组的划分及定价入手,以后又逐步划分了第2级和第3级参考价格组。由于我国目前尚未完成通用名药品生物等效性的一致性评价,这可能会被认为是不能按照通用名对药品定价的一个理由,但是建立制定医疗保险药品支付标准的机制和方法可以先行一步,考虑先从临床应用广泛、医师熟悉的治疗常见疾病和慢性疾病的药品入手,进行通用名药品参考价格组的划分,再根据药品的销售价格和市场份额等情况制定参考价格。
[1]Geschichte der gesetzlichen Krankenversicherung,version_6,September 2017[EB/OL].http://www.bundesgesundheitsministerium.de/krankenversicherung/grundprinzipien/geschichte.html.
[2]Richtlinie des Gemeinsamen Bundesausschusses über die Verordnung von Arzneimitteln in der vertragsärztlichen Versorgung[EB/OL].https://www.g-ba.de/downloads/62-492-1338/AM-RL_2016-12-15_iK-2016-12-15_AT-23-01-2017-B5.pdf.
[3]Arzneimittelübersicht zur "Negativliste" nennt unwirtschaftliche Arzneimittel[EB/OL].https://www.g-ba.de/institution/presse/pressemi tteilungen/33/.
[4]Verfahrensordnung[EB/OL].https://www.g-ba.de/downloads/62-492-1331/VerfO_2016-10-20_iK-2017-01-20.pdf.
[5]Fragen und Antworten,Thema: AMNOG,AMNOG allgemein,Zuletzt aktualisiert:03.05.2017[EB/OL].https://www.gkv-spitzenverband.de/krankenversicherung/arzneimittel/verhandlungen_nach_amnog/faq_amnog/amnog_faq.jsp.
[6]Grafik: Verfahrensgang zur Festbetragsgruppenbildung (20,2 kB,PDF[EB/OL].https://www.g-ba.de/downloads/17-98-2482/2010-01-1 1-Verfahren_Festbetragsgruppenbildung.pdf.
[7]Festbeträge und Zuzahlungsfreistellungsgrenzen Stand: 01.07.2017[EB/OL].https://www.gkv-spitzenverband.de/media/dokumente/krankenversicherung_1/arzneimittel/arzneimittel_festbetraege_1/festb etraege_weitere_uebersichten_/Linien_20170701_sort_FB-Gruppe.pdf.
[8]Sozialgesetzbuch (SGB) Fünftes Buch (V)[EB/OL].http://www.gesetze-im-internet.de/sgb_5/__35.html.
[9]GKV-spitzenverband Geschäftsbericht 2016[EB/OL].https://www.gkv-spitzenverband.de/gkv_spitzenverband/presse/publikationen/bros chuerenbestellung.
[10]常峰,崔鹏磊,夏强,等.德国药品参考价格体系对构建我国医保支付标准的启示[J].中国卫生政策研究,2015,8(7):55-60.

