恩诺沙星及其代谢物环丙沙星在大黄鱼体内的代谢动力学
牛曰华,张天闻,邹红梅,朱琳,陈庚,施媛媛,费海榕,杨云辉
(福建省海洋环境与渔业资源监测中心, 福州350003)
大黄鱼(Larimichthyscrocea)是中国重要的海水养殖鱼类和出口创汇水产品。福建沿海是大黄鱼最主要的养殖区域。2016年福建省大黄鱼养殖产量为1.465×105t,占中国大黄鱼养殖总产量的 88.53%[1]。
恩诺沙星(enrofloxacin)是人工合成的第3代喹诺酮类(quinolones)药物,在水产养殖中广泛使用,主要用来治疗细菌性疾病,具有抗菌谱广、抗菌活性强以及与其他抗生素无交叉耐药性等特点[2],其在动物体内的主要代谢产物为环丙沙星(ciprofloxacin)。环丙沙星同样也具有较强的抗菌活性。但此类药物容易引起细菌的耐药性,从而对人体健康和生态环境带来损害[3],因此中国农业部制定了恩诺沙星残留限量标准,规定恩诺沙星及其代谢产物环丙沙星总残留量在水产动物肌肉中不得超过100 μg/kg[4]。在水产养殖过程中,若不合理使用恩诺沙星,往往会造成药物残留超标,而药物在动物体内的代谢过程和消除规律则是制定用药方案和休药期的理论基础,因此开展恩诺沙星在水产动物中的代谢动力学和残留消除研究,对促进水产养殖产业健康发展和保障广大消费者的健康具有重要意义。目前已开展恩诺沙星药物代谢动力学和残留消除研究的水产动物主要有大菱鲆(Scophthalmusmaximus)、牙鲆(Paralichthysolivaceus)、半滑舌鳎(Cynoglossussemilaevis)[5-7]、日本鳗鲡(Anguillajaponica)[8]、欧洲鳗鲡(Anguillaanguilla)[9-10]、乌鳢(Ophicephalusargus)[11]、鲟(Acipenserschrenckii)[12]、黑裙(Sebastodesfuscescens)[13]、吉富罗非鱼(JifuTilapia)[14]、异育银鲫(Carassiusauratusgibelio)[15]、泥鳅(Misgurnusanguillicaudatus)[16]、中国对虾(Penaeuschinensis)[14]、凡纳滨对虾(Penaeusvannamei)[17]、罗氏沼虾(Macrobrachiumrosenbergii)[18]、拟穴青蟹(Scyllaparamamosain)[19]、三疣梭子蟹(Portunustrituberculatus)[20]、中华绒螯蟹(Eriocheirsinensis)[21-22]等,尚未见在大黄鱼体内代谢规律的研究。
本研究以大黄鱼为实验对象,采用肌注给药方式,研究恩诺沙星及其主要代谢产物环丙沙星在大黄鱼体内的药代动力学和残留消除规律,并提出休药期建议,以期为大黄鱼养殖过程中科学使用恩诺沙星提供参考。
1 材料与方法
1.1 材料
1.1.1 实验用鱼
健康大黄鱼由福建省宁德市富发水产有限公司提供,鱼体重在200~300 g之间。实验前大黄鱼在宁德市富发水产有限公司养殖池暂养一周。随机抽取5尾,进行血浆、肌肉、肝脏和性腺等组织的液相色谱-串联质谱分析,确认无恩诺沙星和环丙沙星残留。实验用饲料为福建天马科技集团股份有限公司生产的人工配合饲料,经检测均不含恩诺沙星和环丙沙星。
本实验于2016年12月至2017年2月在福建省宁德市富发水产有限公司进行。在整个实验过程中,大黄鱼养殖池水温从23 ℃逐渐降至17 ℃。实验期间大黄鱼成活率为100%。
1.1.2 仪器设备
实验中使用的主要仪器包括:QTRAP 5500液相色谱-串联质谱仪(AB SCIEX公司);Waters Acquity超高效液相色谱仪;BP211D电子天平(德国Sartorius公司);Sigma 3-30K高速冷冻离心机;旋转蒸发仪(瑞士Buchi公司);超声波清洗器(昆山超声仪器有限公司);MS3涡旋混合器(德国IKA公司);Milli-Q超纯水系统(美国Millipore公司)等。
1.1.3 药品与试剂
实验主要试剂包括:恩诺沙星、环丙沙星标准品(纯度≥98%,德国CNW公司),恩诺沙星-D5、环丙沙星-D8(纯度≥98%,德国Witega公司)。丁香油水门汀(上海医疗器械股份有限公司);肝素钠(国药集团化学试剂有限公司);乙腈、乙酸铵(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);无水硫酸钠(分析纯,国药集团)。
1.2 方法
1.2.1 注射用恩诺沙星药液的配制
精确称取恩诺沙星标准品5.000 g,用适量5%冰醋酸溶解,再用超纯水定容至100 mL,摇匀,得到恩诺沙星溶液浓度为50 mg/mL。
1.2.2 肌注给药和样品采集
取20 L海水于实验桶中,加入1 mL丁香油水门汀,搅拌均匀,此时丁香油水门汀质量浓度为50 mg/L。将实验用大黄鱼放入实验桶中,待完全麻醉后,取出称重,按50 mg/kg鱼体重的剂量对鱼背部肌肉进行注射。分别于给药后的5、10、15、30 min,1、2、4、8、12 h和1、2、4、5、7、9、11、13、20、30、45、60 d,采集血浆、肌肉、肝脏和性腺组织,每个采样时间点采集5尾鱼。以尾静脉采血的方式采集血浆,将采集的血浆转移至2 mL预先用1%肝素钠溶液处理过的离心管中,以2 348 g转速离心10 min,取上清液血清为血浆样品,储存于-20 ℃保存待检。
1.2.3 色谱和质谱条件
色谱柱为Waters Acquity BEH C18柱,50 mm×2.1 mm,粒径1.7μm;流动相A为0.1%甲酸溶液(含5 mmol/L乙酸铵),流动相B为乙腈,梯度洗脱程序见表1;流速为0.200 mL/min;柱温30 ℃;进样量1.00 μL。
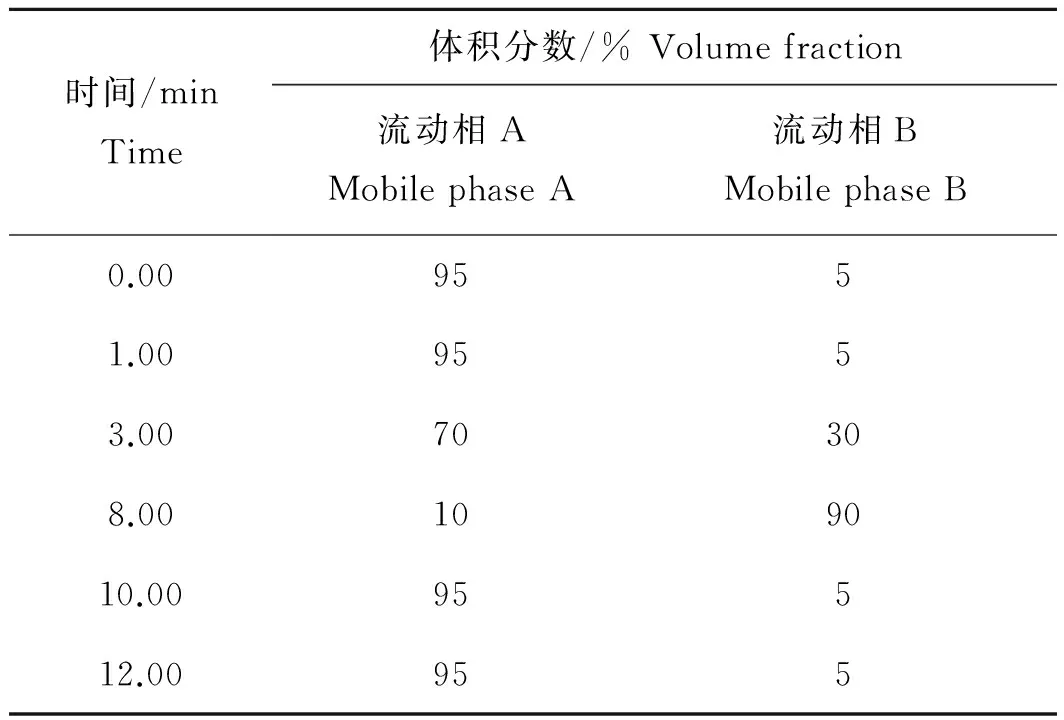
表1 流动相梯度洗脱程序Tab.1 Gradient elution program of the mobile phase
注:流动相A为0.1%甲酸溶液(含5 mmol/L乙酸铵);流动相B为乙腈。
离子化模式为大气压喷雾电离源(ESI),正离子模式;喷雾电压5 500 V;气帘气(curtain gas)35 psi;碰撞气(collision gas)7 psi;雾化气(gas 1)50 psi;辅助加热气(gas 2)50 psi;离子源温度500 ℃;采用选择反应监测(MRM)扫描模式,选择反应监测母离子、子离子、去簇电压(DP)和碰撞能量见表2。
1.2.4 样品处理与检测
对于肌肉、肝脏和性腺样品,参照农业部1077号公告-1-2008[23]的方法进行检测。对于血浆样品,按下述方法进行检测:取1.00 mL血浆样品至10 mL离心管中,准确加入25 μL 1.00 mg/L内标溶液,然后加入5 mL 1%的甲酸-乙腈溶液(V/V),涡旋混合1 min,再加入3 g无水硫酸钠,再次涡旋混合1 min,以 9 391 g转速离心5 min。残渣重复提取1次,上清液转移至25 mL鸡心瓶中,40 ℃水浴旋蒸至近干,用1 mL流动相溶解,过0.22 μm滤膜后上机检测。
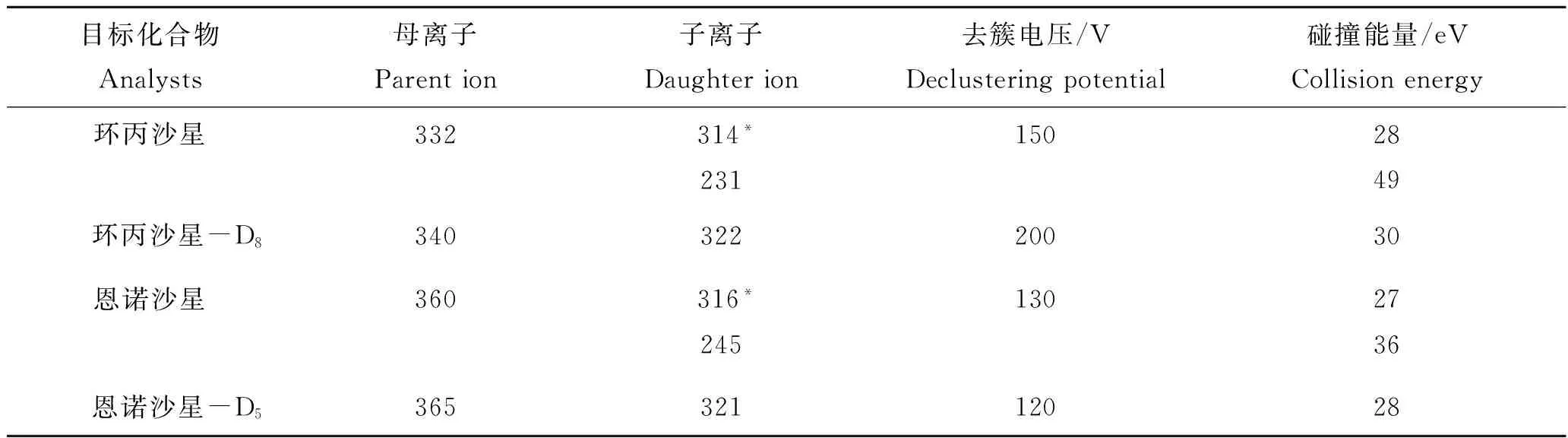
表2 MRM模式下质谱测定的特征离子Tab.2 Characteristic ions of mass spectrum determination in MRM mode
注:标*为定量离子。
当样品中环丙沙星和恩诺沙星含量过高时,可适当减少称样量,或同倍数的加大内标加入量和定容体积,使样液浓度落在线性范围内。
1.2.5 方法的回收率和精密度
往大黄鱼空白基质(血浆、肌肉、肝脏、性腺)中添加环丙沙星和恩诺沙星混标溶液,使其含量为2、10、100 μg/L(或 μg/kg)3个水平,每个水平6份平行。按照1.2.4的方法进行处理,计算回收率和相对标准偏差。
1.2.6 休药期计算
恩诺沙星是按一级动力学在体内消除的,即在消除后期服从指数消除:C=C0e-Ket。休药期的计算公式为:
式(1)
式(1)中,T为休药期(h);C0为残留消除半对数曲线的纵截距(mg/kg);MRL为最高残留限量(mg/kg);Ke为残留消除曲线速率常数,t为给药后某个时间点。
1.3 数据处理
本实验采用DAS 2.0药代动力学软件以及Origin 8.0、Excel软件进行数据处理。
2 结果
2.1 分析方法验证
在质量浓度1 ~ 100 μg/L范围内,以恩诺沙星和环丙沙星峰面积与其内标物峰面积之比为纵坐标(Y),以质量浓度为横坐标(X),绘制标准曲线,得到恩诺沙星和环丙沙星曲线方程分别为Y=1.177 10X+0.003 62和Y=1.892 67X- 0.076 07,相关系数R2均大于0.99。这表明恩诺沙星和环丙沙星在1~100 μg/L范围内线性关系良好。两种药物在血浆中的检测限均为2 μg/L,在肌肉、肝脏和性腺中的检测限分别为1、2、2 μg/kg。方法的回收率和精密度见表3,满足残留分析要求。
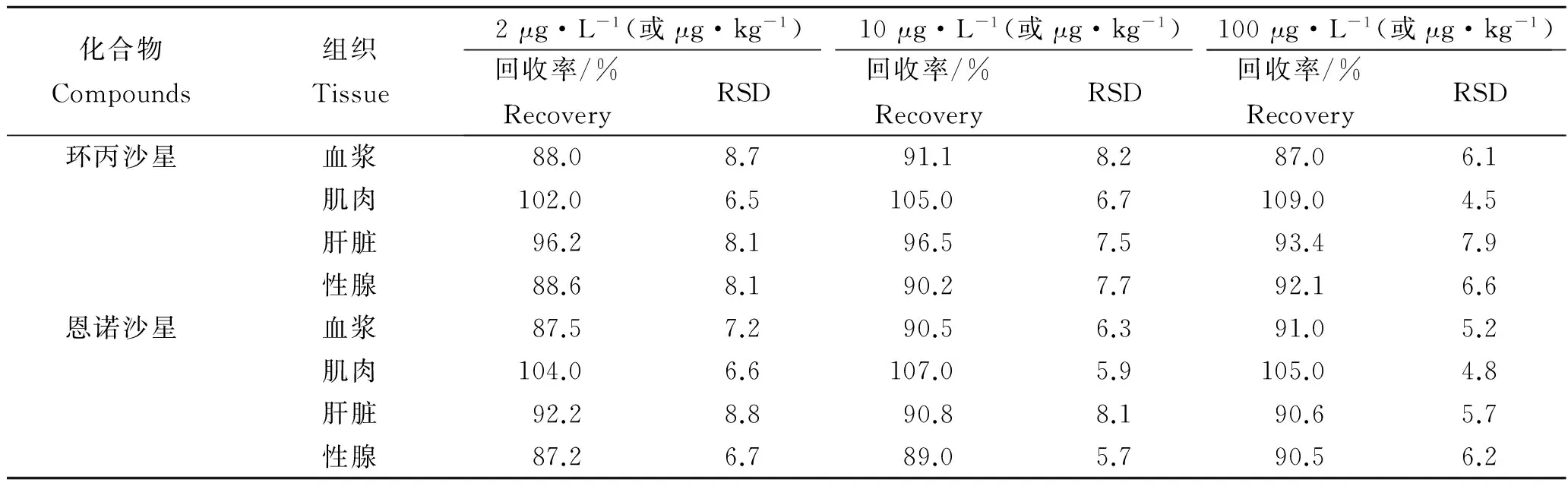
表3 环丙沙星和恩诺沙星在大黄鱼组织中的回收率和精密度Tab.3 Recovery and precision of enrofloxacin and ciprofloxacin in Larimichthys crocea n=6
2.2 药代动力学
2.2.1 恩诺沙星药代动力学
大黄鱼以50 mg/kg的剂量肌注给药后,血浆、肌肉、肝脏和性腺中的恩诺沙星含量变化如图1所示。给药后,血浆中的恩诺沙星浓度呈直线上升趋势,在给药后10 min即达到最大质量浓度41.5 mg/L;肌肉中恩诺沙星在给药后30 min达到最高含量水平108 mg/kg;肝脏中恩诺沙星在给药后1 h达到最高含量水平68.8 mg/kg;性腺中恩诺沙星在给药后1 h达到最高含量水平22.5 mg/kg,之后开始迅速下降。
应用DAS 2.0软件对恩诺沙星浓度-时间关系进行房室模型分析,结果表明,恩诺沙星在血浆、肌肉、肝脏和性腺中的代谢过程符合二室开放模型,药物时量曲线方程分别为:C血浆=23.805e-0.639t+4.256e-0.023t,C肌肉=19.569e-0.049t+0.227e-0.01t,C肝脏=21.277e-0.097t+5.532e-0.014t,C性腺=25.051e-0.037t+0.084e-0.01t, 主要动力学参数如表4所示。
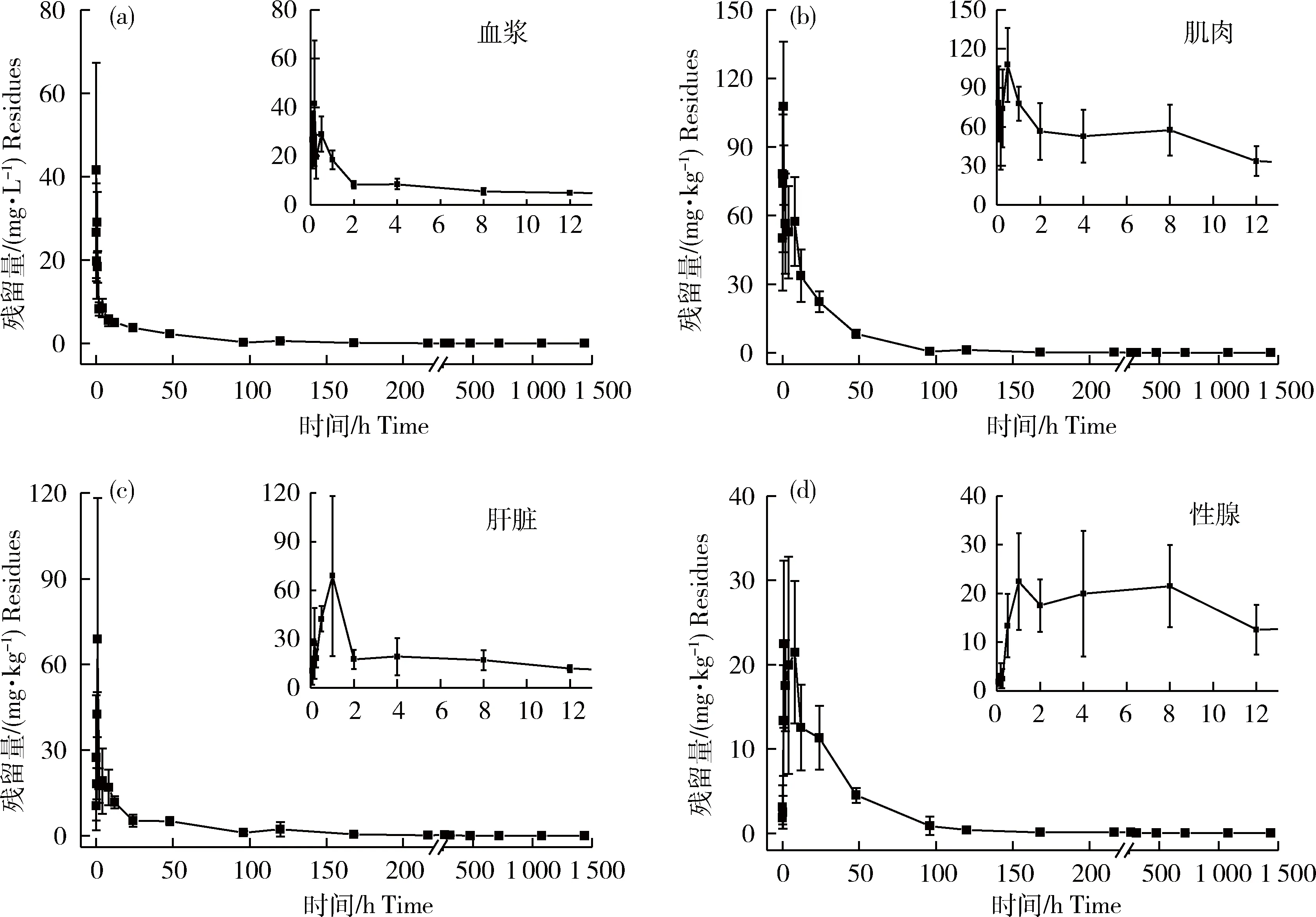
图1 恩诺沙星在大黄鱼各组织中的含量变化(a)血浆;(b)肌肉;(c)肝脏;(d)性腺。图(a)~(d)中右上图为给药后0~12 h恩诺沙星在大黄鱼各组织中的含量变化。Fig.1 Variation of enrofloxacin in the tissues of Larimichthys crocea during the experiment(a)plasma; (b) muscle; (c) liver; (d) gonad. The top right-hand corner of Fig. (a)-(d) mean the variation of enrofloxacin in the tissues of Larimichthys crocea during 0-12 h after intramuscular injection.
2.2.2 环丙沙星药代动力学
环丙沙星为恩诺沙星主要代谢产物。恩诺沙星肌注给药后,环丙沙星在血浆、肌肉、肝脏和性腺中的含量变化如图2所示。给药后5 min,在肝脏、血浆、肌肉组织中即检测到环丙沙星,之后环丙沙星含量呈上升趋势,直至到达最大值,其中肝脏和血浆中的环丙沙星含量上升迅速,性腺和肌肉中的环丙沙星含量上升速率较肝脏和血浆中慢。在肝脏中,环丙沙星含量具有明显的双峰现象,在给药后1 h达到最大峰值3.96 mg/kg,在给药后4 h形成第二个峰值2.18 mg/kg。血浆中的环丙沙星在给药后1 h质量浓度达到最大值0.693 mg/L。肌肉和性腺中的环丙沙星均在给药后24 h达到最大值,含量分别为0.579 mg/kg和1.11 mg/kg。
应用DAS 2.0软件对环丙沙星浓度-时间关系进行房室模型分析,结果表明,环丙沙星在血浆、肌肉、肝脏和性腺中的代谢过程不符合一室和二室模型。
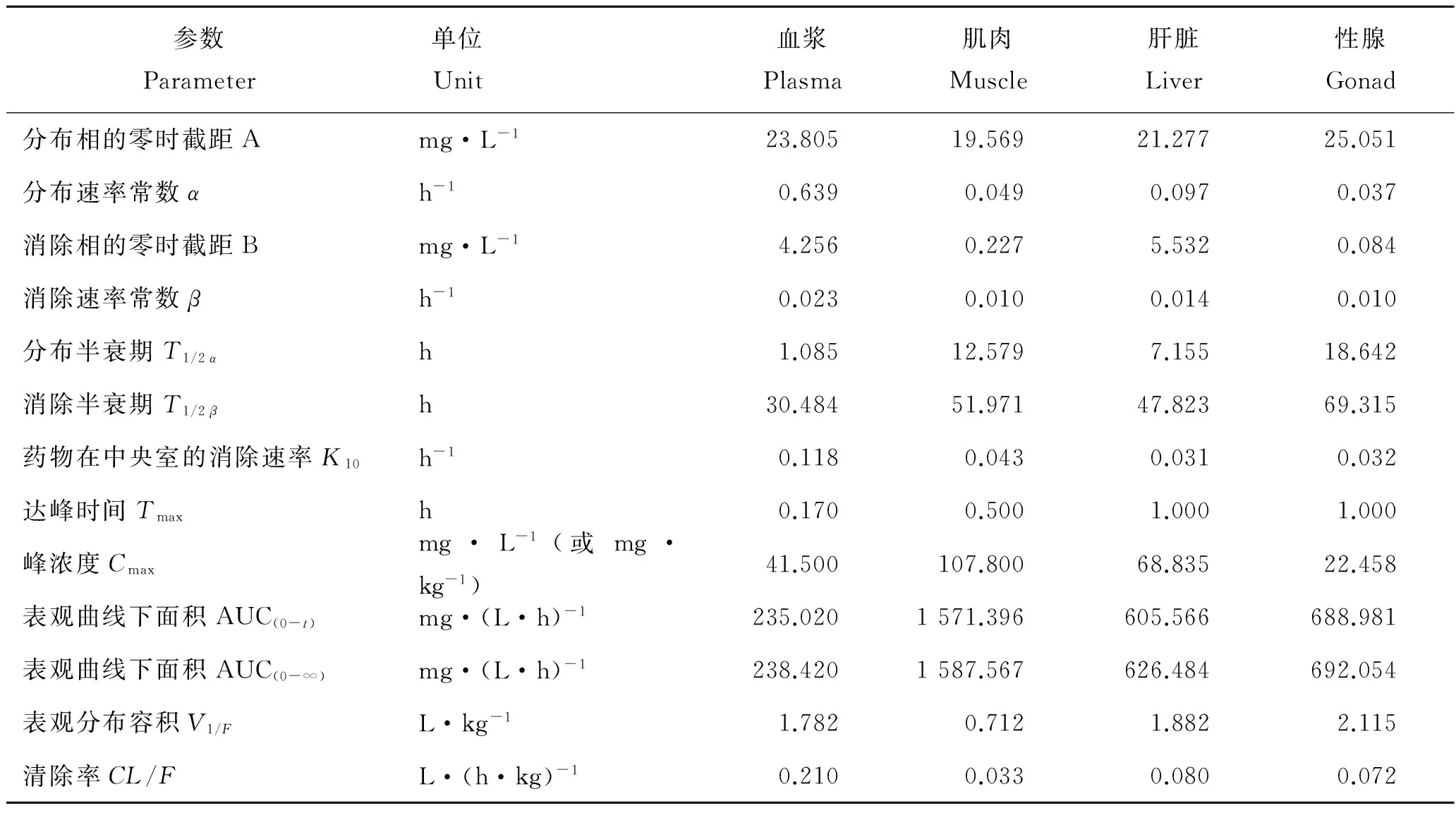
表4 恩诺沙星在大黄鱼体内的药代动力学参数Tab.4 Pharmacokinetic parameters of enrofloxacin in Larimichthys crocea

图2 环丙沙星在大黄鱼各组织中的含量变化(a)血浆;(b)肌肉;(c)肝脏;(d)性腺。图(a)~(d)中右上图为给药后0 ~ 24 h环丙沙星在大黄鱼各组织中的含量变化。Fig.2 Variation of ciprofloxacin in the tissues of Larimichthys crocea during the experiment(a)plasma; (b) muscle; (c) liver; (d) gonad. The top right-hand corner of Fig. (a)-(d) mean the variation of ciprofloxacin in the tissues of Larimichthys crocea during 0-24 h after intramuscular injection.
2.3 残留消除规律
恩诺沙星含量在大黄鱼体内达到最大值后,在给药后的前48小时下降明显,血浆中的恩诺沙星质量浓度从最高的41.5 mg/L降至2.32 mg/L;肌肉、肝脏、性腺中的恩诺沙星含量分别从最高的108、 68.8、 22.5 mg/kg降至8.25、 5.18、 4.53 mg/kg,之后药物浓度保持稳定下降,但消除速度明显变慢,一直到给药后的第60天,恩诺沙星在血浆、肌肉、肝脏和性腺中均可检出,浓度分别为5.58×10-3mg/L、1.62×10-2mg/kg、2.25×10-2mg/kg、3.93×10-2mg/kg。如表4所示,恩诺沙星在血浆、肌肉、肝脏和性腺中的消除半衰期分别为30.484、 51.971、 47.823、 69.315 h。
恩诺沙星在大黄鱼体内仅有少部分代谢成环丙沙星,因此环丙沙星浓度较恩诺沙星低很多。血浆中的环丙沙星在给药后1 h质量浓度达到最大值0.693 mg/L,之后下降迅速,给药9 d后,血浆中的环丙沙星再未检出。环丙沙星在给药后的前96小时,肌肉、肝脏、性腺中的环丙沙星含量下降较快,分别从最高的0.579、 3.96、 1.11 mg/kg降至8.12×10-2、 8.58×10-2、 9.76×10-2mg/kg,之后消除速率变慢。直至在给药后的第30天,肌肉中的环丙沙星仍可检出,含量为1.68×10-3mg/kg。
对环丙沙星在血浆、肌肉、肝脏和性腺中的药物浓度达到最大值之后的浓度-时间数据用Excel软件进行拟合,得到环丙沙星在大黄鱼体内的残留消除曲线方程,如表5所示,其消除半衰期分别为28.88、 57.75、 43.31、 40.76 h。
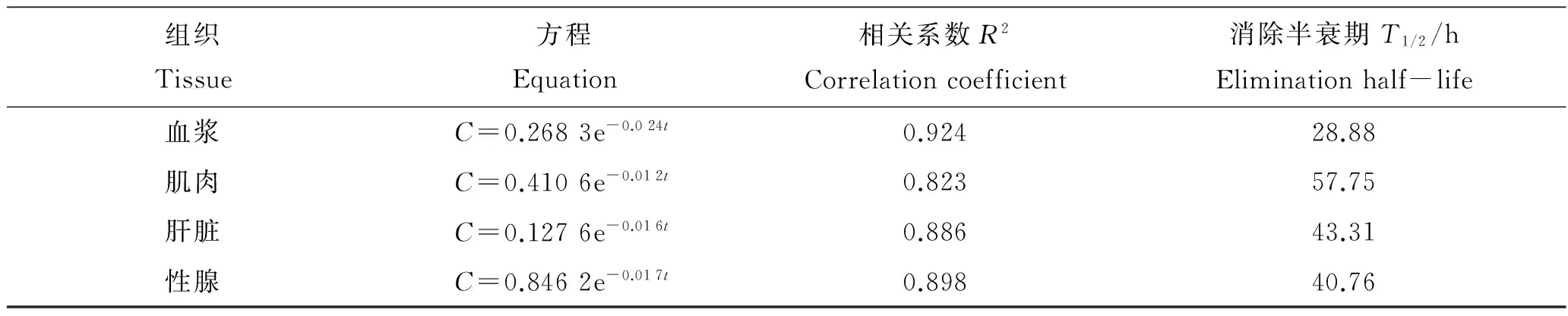
表5 环丙沙星在大黄鱼体内的消除曲线方程及参数Tab.5 Elimination curve equation and parameters of Ciprofloxacin in Larimichthys crocea mg·kg-1, n=5
2.4 理论休药期
中国农业部第235号公告规定恩诺沙星在水产动物肌肉中的最大残留限量(MRL)为100 μg/kg。以肌肉作为靶组织,根据恩诺沙星在大黄鱼肌肉中的药物浓度-时间数据,用Excel软件进行拟合,得到恩诺沙星在大黄鱼体内的残留消除曲线方程为:C=0.245 1e-0.002t,相关系数R2=0.863。通过休药期公式计算得到休药期为448.3 h,即18.7 d。
3 讨论
3.1 恩诺沙星在大黄鱼体内的药动学特征
本研究结果显示,在肌注给药方式下,恩诺沙星在大黄鱼血浆中的药物代谢动力学过程符合二室开放模型。这与恩诺沙星在大菱鲆[5]、鳗鲡[9]、鲟[12]、黑裙[13]等鱼体内的代谢模型相似。
达峰时间Tmax和峰浓度Cmax是反映药物在体内吸收快慢的重要指标。本实验条件下,大黄鱼血浆、肌肉、肝脏和性腺Tmax分别为0.170、 0.500、 1.000、 1.000 h,Cmax分别为41.500 mg/L、 107.800 mg/kg、 68.835 mg/kg、 22.458 mg/kg。这说明恩诺沙星在大黄鱼体内吸收较快,其中在血浆中吸收最快,其次为肌肉。同为肌注给药方式,大黄鱼血药达峰时间小于大菱鲆(0.5 h)[5]、异育银鲫(0.75 h)[15]、乌鳢(2 h)[11],大于拟穴青蟹(0.017 h)[19]、中华绒螯蟹(0.083 h)[22]、罗氏沼虾(0.083 h)[18]。这说明在肌注给药方式下,大黄鱼恩诺沙星吸收速率大于大菱鲆、异育银鲫和乌鳢,小于拟穴青蟹、中华绒螯蟹和罗氏沼虾。
分布半衰期T1/2α、表观曲线下面积AUC和表观分布容积V1/F是反映药物在体内分布的主要药动学参数。本实验条件下,大黄鱼血浆、肌肉、肝脏和性腺T1/2α分别为1.085、 12.579、 7.155、 18.642 h,V1/F分别为1.782、 0.712、 1.882、 2.115 L/kg。AUC较大,说明恩诺沙星在大黄鱼体内分布广泛,可以起到很好的杀菌作用。在肌注给药方式下,大黄鱼血浆T1/2α与大菱鲆(0.987 h)[5]相近,小于异育银鲫(4.925 h)[15],大于中华绒螯蟹(0.580 h)[22]和罗氏沼虾(0.581 h)[18]。
消除半衰期T1/2β和清除率CL/F是反映药物在体内消除快慢的主要药动学参数。本实验条件下,大黄鱼血浆、肌肉、肝脏和性腺T1/2β分别为30.484、 51.971、 47.823、 69.315 h,CL/F分别为0.210、 0.033、 0.080、 0.072 L/(h·kg),这说明恩诺沙星在血浆中消除的最快。在肌注给药方式下,大黄鱼血浆T1/2β小于大菱鲆(68.003 h)[5]、拟穴青蟹(57.02 h)[19]、中华绒螯蟹(83.833 h)[22]、罗氏沼虾(69.315 h)[18],大于异育银鲫(9.292 h)[15]。大黄鱼血浆CL/F与杂交鲟[0.228 8 L/(h·kg)][12]较为接近,大于欧洲鳗鲡[0.074 L/(h·kg)][9]和牙鲆[0.083 L/(h·kg)][24]。这说明大黄鱼消除速率与杂交鲟接近,大于大菱鲆、牙鲆、欧洲鳗鲡、拟穴青蟹、中华绒螯蟹和罗氏沼虾,小于异育银鲫。
由上可见,在肌注给药方式下,恩诺沙星在大黄鱼体内总体吸收、分布和消除较快。
喹诺酮类药物对常见细菌的治疗效果通常与药动学和药效学参数有关。一般认为,当血浆中药物的峰浓度(Cmax)与最低抑菌浓度(MIC)的比值达到10以上时,即可起到良好的治疗效果,并且当Cmax/ MIC=10时,效果最佳[25-26]。马寅等[27]测得恩诺沙星对溶藻弧菌(Vibrioalginolyticus)、最小弧菌(V.mimicus)、哈维氏弧菌(V.harveyi)、创伤弧菌(V.vulnificus)等4种常见的水产治病弧菌的MIC为0.1~0.8 mg/L,由此得到本实验CmaxMIC为51.9 ~ 415。可见,在本实验条件下,肌注恩诺沙星对大黄鱼常见的细菌性疾病可以起到较好的治疗效果。
为了保持一定的稳态血药浓度,徐叔云等[28]提出了稳态血药浓度Css的计算公式,见式(2)。
式(2)
式(2)中,Css为期望达到的稳态血药浓度;F为生物利用度;X0为每次给药剂量;Vd为表观分布容积;K10为药物在中央室的消除速率;τ为给药时间间隔。由表4可知,Vd=1.782 L/kg,K10=0.118 1/h。MIC按平均值0.45 mg/L计,Css按10倍MIC计,Css= 4.5 mg/L,F按80%计。结合消除半衰期T1/2β为30.484 h,建议一天给药一次,τ=24 h。根据上述公式,得到X0=28.4 mg/kg。因此,对大黄鱼可采取如下给药方案:按鱼体重每次肌注恩诺沙星28.4 mg/kg,一天一次,连续给药2次。
3.2 恩诺沙星代谢产物环丙沙星在大黄鱼体内的药动学特征
环丙沙星为禁用药物,在水产养殖中禁止使用,但本实验中在大黄鱼体内检出的环丙沙星并不是由直接肌注给药产生的,而是恩诺沙星在代谢过程中产生的。此外,中国农业部第235号公告中的恩诺沙星残留限量为恩诺沙星和其代谢产物环丙沙星的总残留量。因此,研究恩诺沙星代谢产物环丙沙星在大黄鱼体内的代谢动力学同样具有重要意义。恩诺沙星有多种代谢途径,最主要的是脱去乙基代谢成为环丙沙星,但其代谢程度存在种属差异。王洪艳等[24]研究恩诺沙星在牙鲆体内的代谢规律发现,环丙沙星在血液、肝脏和肾脏中均可检出,但在肌肉中未检出。Koc等[29]对褐鳟(Salmotrutta)进行静脉注射和口灌恩诺沙星实验,血浆中均未检测到环丙沙星。在本研究中,环丙沙星在大黄鱼血浆、肌肉、肝脏和性腺中均可检出,但环丙沙星占恩诺沙星和环丙沙星总量的比值很低,绝大部分都在15%以下,其中血浆中的环丙沙星占比绝大部分都在5%以下。这说明恩诺沙星进入大黄鱼体内后,绝大部分以原药形式存在,仅有少部分脱去乙基代谢为环丙沙星。
应用DAS 2.0 软件对大黄鱼体内的环丙沙星浓度-时间数据进行房室模型分析,发现环丙沙星在大黄鱼体内的代谢过程不符合一室和二室模型。环丙沙星在血浆中的最大质量浓度为0.693 mg/L,在肝脏、肌肉和性腺中的最大含量分别为3.96、 0.579、 1.11 mg/kg。环丙沙星在肝脏、血浆、肌肉和性腺中的含量达到最大值的时间依次为1、 1、 24、 24 h。由此可以看出,肝脏中环丙沙星的最大含量明显高于血浆、肌肉和性腺的最大含量,并且达到最大含量的时间明显早于肌肉和性腺,这说明恩诺沙星是在肝脏中脱去乙基代谢成环丙沙星,然后通过血液循环输送到大黄鱼其他组织。在给药后的前5天,环丙沙星在各组织中的含量首先上升,达到最大浓度后,其含量整体呈下降趋势,但其间也会出现浓度上升和保持平稳的现象,这可能是由于恩诺沙星在不断代谢为环丙沙星的同时,环丙沙星自身也在不断的进行代谢造成的。
3.3 恩诺沙星及其代谢产物环丙沙星在大黄鱼体内的残留消除规律
大黄鱼体内的恩诺沙星含量在给药后的前48小时下降明显,这说明在给药后的前48小时恩诺沙星消除较快,之后保持稳定下降,但消除速率明显变慢。恩诺沙星在血浆、肌肉、肝脏和性腺中的消除半衰期分别为30.484、 51.971、 47.823、 69.315 h,由此可见,恩诺沙星在大黄鱼体内整体消除较快,但在不同组织中存在一定的差异,消除速率由大到小依次是血浆、肝脏、肌肉和性腺。
恩诺沙星进入大黄鱼体内后,仅有少部分代谢成环丙沙星。在给药后的前96 小时,环丙沙星浓度下降速度较快,之后消除速率变慢。由环丙沙星消除曲线方程得到环丙沙星在血浆、肌肉、肝脏和性腺中的消除半衰期分别为28.88、 57.75、 43.31、 40.76 h。由此可知,环丙沙星在大黄鱼体内整体消除较快,但在不同组织中存在一定的差异,其中在血浆中消除的最快,在肌肉中消除的最慢。
3.4 休药期的确定
休药期是根据食用组织中药物的允许残留量和药物的消除速率来确定的。中国农业部第235号公告规定恩诺沙星及其代谢产物环丙沙星总残留量在水产动物肌肉中不得超过100 μg/kg。药物消除速率在实际养殖中则受多种因素的影响,主要包括水产动物的种属、规格、养殖水温、给药剂量、给药方式、水质状况、光照条件等[30]。本实验于2016年12月至2017年2月进行,实验大黄鱼规格为200~300 g,对大黄鱼进行恩诺沙星肌注给药,给药水平为50 mg/kg,给药后进行正常饲养,在整个实验过程中,养殖池水温从23 ℃逐渐下降至17 ℃,在此实验条件下,以肌肉作为靶组织,根据休药期公式,计算得到恩诺沙星在大黄鱼体内的休药期为18.7 d。因此,在本实验条件下,建议休药期不低于19 d。与本实验采取肌注给药方式研究恩诺沙星在大黄鱼体内的代谢动力学不同,大多数研究者采取的是口灌和投喂给药方式。李娜等[6]在11~12 ℃水温条件下,以30 mg/kg的剂量对大菱鲆连续口服恩诺沙星7 d,每天2次,在停药后的第94天,恩诺沙星残留量仍超过限量标准。常志强等[7]在20 ℃水温条件下,以30 mg/kg剂量的恩诺沙星对大菱鲆、牙鲆和半滑舌鳎连续进行灌胃3 d,得到大菱鲆、牙鲆和半滑舌鳎的休药期分别为44、 33、 47 d。郭娇娇等[12]以10 mg/kg的剂量对杂交鲟单次口灌给药,得到恩诺沙星在杂交鲟中的休药期至少为20 d。李佳蔚等[13]在18 ℃水温条件下,以20 mg/kg的剂量对黑裙单次灌服给药,得到黑裙的休药期至少为35 d。徐维海等[14]以50 mg/kg的剂量对吉富罗非鱼和中国对虾连续投喂7 d,得到吉富罗非鱼的休药期为22 d,中国对虾的休药期为12 d。余开等[20]以10 mg/kg的剂量对三疣梭子蟹口灌给药,得到三疣梭子蟹的休药期为14 d。由此可见,在不同的实验条件下,得到的恩诺沙星休药期数据均存在一定的差异。这说明休药期与水产动物的种属、给药方式、给药剂量以及养殖水温等密切相关。本实验采取肌注给药方式进行研究,可以精确控制每一个实验个体的药物注射剂量,因此能更准确地考察药物的代谢情况。口灌给药操作难度较大,在实际生产中无法广泛采用;投喂给药与实际生产较为接近,但存在部分药物易扩散到水体中,并且由于个体进食量的差异,无法准确获得单个个体的实际给药量。梁俊平等[5]研究发现,在肌注给药条件下,恩诺沙星的吸收和消除均快于口服给药,并且比口服给药吸收完全。因此,尽管本研究与实际生产存在一定差异,但仍可以为在大黄鱼实际生产过程中科学使用恩诺沙星提供参考。
4 结论
在(20±3)℃水温条件下,以50 mg/kg恩诺沙星肌注大黄鱼后,恩诺沙星在大黄鱼体内吸收、分布迅速,消除较快。以肌肉作为靶组织,根据休药期公式,计算得到恩诺沙星在大黄鱼体内的休药期为18.7 d。因此,在本实验条件下,建议休药期不低于19 d。该研究结果可为大黄鱼在实际养殖过程中科学使用恩诺沙星提供参考。
[1] 中国农业部渔业渔政管理局. 2017 中国渔业统计年鉴[J]. 北京: 中国农业出版社, 2017.
[2] 杨先乐. 新编渔药手册 [M]. 北京: 中国农业出版社, 2005.
[3] 宋红波, 吴光红, 沈美芳, 等. 恩诺沙星在水产品中残留的风险评估[J]. 渔业现代化, 2008, 35(5): 39-42.
[4] 中华人民共和国农业部. 中华人民共和国农业部公告 第235号 动物性食品中兽药最高残留限量[EB/OL]. (2002-12-24) [2017-05-01].http://www.moa.gov.cn/zwllm/tzgg/gg/200302/t20030226_59300.htm.
[5] 梁俊平, 李健,张喆, 等. 肌注和口服恩诺沙星在大菱鲆体内的药代动力学比较[J]. 水生生物学报, 2010, 34(6): 1122-1129.
[6] 李娜, 李健, 王群. 恩诺沙星在养殖大菱鲆体内的残留及消除规律[J]. 渔业科学进展, 2009, 30(2): 26-33.
[7] 常志强, 李东利, 李健. 恩诺沙星在大菱鲆(Scophthalmusmaximus)、牙鲆(Paralichthysolivaceus)和半滑舌鳎(Cynoglossussemilaevis)体内的残留消除规律[J]. 渔业科学进展, 2016, 37(5): 16-21.
[8] 张德云, 匡维华, 郑映钦. 恩诺沙星在日本鳗鲡体内残留消除规律研究[J]. 水产科学, 2007, 26(4): 210-213.
[9] 房文红, 于慧娟, 蔡友琼, 等. 恩诺沙星及其代谢物环丙沙星在欧洲鳗鲡体内的代谢动力学[J]. 中国水产科学, 2007, 14(4): 622-629.
[10] 余培建. 药浴给药恩诺沙星及其代谢产物在欧洲鳗鲡体内的药代动力学研究[J]. 福建水产, 2007(4): 38-43.
[11] 张乐, 许宝青, 刘超. 恩诺沙星在乌鳢体内的代谢及其代谢产物消除的研究[J]. 安徽农学通报, 2013, 19(23): 15-16.
[12] 郭娇娇, 潘红艳 , 杨虎, 等. 恩诺沙星在杂交鲟体内的药物代谢动力学[J]. 大连海洋大学学报, 2011, 26(4): 362-366.
[13] 李佳蔚, 刘慧慧, 于召强, 等. 恩诺沙星在黑鲪体内的药物代谢动力学研究[J]. 中国渔业质量与标准, 2012, 2(1): 52-57.
[14] 徐维海, 林黎明, 朱校斌, 等. 恩诺沙星及其代谢产物在吉富罗非鱼、中国对虾体内的残留规律研究[J]. 水产科学, 2004, 23(7): 5-8.
[15] 王习达, 刘训猛, 方苹, 等. 恩诺沙星在异育银鲫体内药代动力学研究[J]. 金陵科技学院学报, 2013, 29(1): 78-81.
[16] 孙慧宇, 陈君义, 王云飞, 等. 恩诺沙星和环丙沙星在泥鳅(Misgurnusanguillicaudatus)体内的残留和消除规律[J]. 渔业科学进展, 2015, 36(4): 128-131.
[17] 赵海军, 欧安, 简纪常, 等. 恩诺沙星在凡纳滨对虾体内的代谢和残留消除规律[J]. 广东海洋大学学报, 2010, 30(6): 31-34.
[18] 钱云云, 唐俊, 郑宗林, 等. 恩诺沙星在罗氏沼虾体内的药物代谢动力学[J].动物学杂志, 2007, 42(5): 62- 69.
[19] 周帅, 胡琳琳, 房文红, 等. 恩诺沙星及其代谢产物环丙沙星在拟穴青蟹体内的药代动力学[J]. 水产学报, 2011, 35(8): 1182-1190.
[20] 余开, 赵青松, 陈寅儿, 等. 恩诺沙星在三疣梭子蟹主要组织中的代谢动力学[J]. 生物学杂志, 2011, 28(4): 21-25.
[21] 吴光红, 张静波, 孟勇, 等. 不同水温下恩诺沙星在中华绒螯蟹体内药物代谢动力学[J]. 南京大学学报, 2008, 31(2): 105-110.
[22] 郑宗林, 叶金明, 李代金, 等. 恩诺沙星及其代谢产物在中华绒螯蟹血淋巴中的比较药代动力学[J]. 海洋渔业, 2011, 33(1): 74-82.
[23] 中华人民共和国农业部. 农业部1077号公告-1-2008 水产品中17种磺胺类及15种喹诺酮类药物残留量的测定液相色谱-串联质谱法[EB/OL]. (2008-08-12) [2017-04-10]. http://www.moa.gov.cn/govpublic/SCYJJXXS/201006/t20100606_1533084.htm.
[24] 王洪艳, 李兆新, 邢丽红, 等. 恩诺沙星及其代谢产物环丙沙星在牙鲆体内代谢消除规律[J]. 渔业科学进展, 2014, 35(3): 44-49.
[25] Walker R D. The use of fluoroquinolones for companion animal antimicrobial therapy[J]. Aust Vet J, 2000, 78 (2): 84-90.
[26] AliAbadi F S, Lees P. Antibiotic treatment for animals: effect on bacterial population and dosage regimen optimisation[J]. Inter J Antimic Agents, 2000, 14(4): 307-313.
[27] 马寅, 金珊, 余开, 等. 恩诺沙星对 4 种水产致病弧菌的抑杀菌效应[J]. 微生物学通报, 2011, 38(8): 1216-1221.
[28] 徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 北京: 人民卫生出版社, 2002.
[29] Koc F, Uney K, Atamanalp M, et al. Pharmacokinetic disposition of enrofloxacin in brown trout (Salmotruttafario) after oral and intravenous administrations[J]. Aquaculture, 2009, 295(1): 142-144.
[30] Palominos R, Freer J, Mondaca M A, et al. Evidence for hole participation during the photocatalytic oxidation of the antibiotic flumequine[J]. J Photochem Photobiol A: Chem, 2008, 193(2): 139-145.

