抗黄曲霉毒素B1单链抗体在大肠杆菌和毕赤酵母中的表达和活性研究
胡 莉, 王小红
(1. 黄淮学院 生物与食品工程学院, 驻马店 463000; 2. 华中农业大学 食品科技学院, 武汉 430070)
黄曲霉毒素( Aflatoxins,AFs)是一类主要由黄曲霉、寄生曲霉等真菌分泌的次级代谢产物的总称,这类化合物的化学结构基本类似,均含有二呋喃环和香豆素,前者为基本毒性结构,后者与致癌有关。目前已经分离鉴定出的有将近20种,主要分子型式有B1、B2、G1、G2、M1、M2等,其中黄曲霉毒素B1(AFB1)的毒性最强,研究最为透彻,也是最具代表性的一种毒素[1]。1993年,AFB1被国际癌症研究机构(international agency for research center,IARC)划为I类致癌物质[2-3],与乙型肝炎病毒一起成为肝癌的两大诱因[4-5]。然而,食品中的黄曲霉污染非常常见,从农作物的生产到转化为食物、从食物链的低端到顶端,AFB1都有可能造成淀粉类食品、肉类食品、蛋、奶类食品以及动物饲料等的连锁污染,除此之外,AFB1还可通过皮肤接触、饮食摄入等一些方式进入人和动物的机体。因此,对食品中黄曲霉毒素定量检测变成一项很重要的工作[6]。目前的检测方法主要有仪器法和酶联免疫吸附法[7-8],但前者耗时、耗力且成本较高、工序繁琐。目前常采用酶联免疫吸附法进行检测,然而,该法需要高质量的抗体,因此,获得高质量的抗AFB1scFv是上述研究方法的保证。scFv作为小分子功能性抗体,具有多种低成本的表达方式[9-11],目前这种重组抗体已经获得许多研究学者的关注[12]。
外源蛋白采用真核表达系统进行表达,能够有效避免在原核表达系统中的不足,表达的外源蛋白能得到较为完整的加工修饰,其构象与天然蛋白质的分子结构模式也较为接近,相对于原核表达系统表达外源蛋白的生物活性也较高,因此,真核表达系统表达外源蛋白越来越受到研究者们的青睐[13]。
毕赤酵母表达系统,可以将甲醇作为碳源使用,因此也叫甲醇营养型表达系统。其内有编码醇氧化酶的AOX1 基因,当培养基中的碳源耗尽时,加入甲醇,AOX1基因会启动转录醇氧化酶物质,该物质可以将甲醇转化为醛类物质,进而转化成酵母生长所需要的能量[14]。其次AOX1是强启动子,能够多次有效启动转录编码区,使得诱导外源基因的表达时,具有较高的效率和蛋白表达量[15]。毕赤酵母表达系统操作简单、稳定性好、生产成本低、繁殖速度快和易于高密度生产发酵的优势使得它的应用极为广阔[16-17]。鉴于此,本实验选用大肠杆菌表达系统和甲醇营养型酵母表达系统进行抗黄曲霉毒素B1单链抗体的分泌表达并进行比较。
1 材料与方法
1.1 材料
AFB1购于瑞士Alexis公司;毕赤酵母GS115菌株、表达载体pPICZαA、pET-30a、pET-22b及E.coli菌株Trans5α均为本实验室常规保存;AFB1-O-OVA实验室自制; EasyTaq酶、 Trans5K Plus DNA Marker、Trans2K Plus DNA Marker购于中国北京全式金生物技术有限公司;Ni-NTA 亲和层析填料、ECL 显色液、Page RulerPrestained Protein Ladder购于美国Thermo公司;杂交瘤细胞株2C10由本实验室培养并保存;YNB、Zeocin购自Invitrogen公司;质粒小提、DNA 凝胶回收试剂盒购于杭州AxyGen;所用引物的合成由南京金斯瑞生物科技有限公司完成;羊抗小鼠IgG-HRP酶标二抗购于中国华美生物工程公司; DNA连接酶、限制性内切酶、T4连接酶、dNTP、 PMD19-T Simple Vector 购自TaKaRa公司; DNA凝胶回收纯化试剂盒由中国北京庄盟国际生物基因科技有限公司提供;质粒提取试剂盒购于中国北京擎科新业生物技术有限公司。
1.2 方法
1.2.1 引物设计与目的基因扩增
以实验室已经成功构建的重组载体pMD19-T-VH-2C10和pMD19-T-VL-2C10分别为模板,设计相应的引物,通过PCR扩增获得scFv-2C10片段,并在目的基因两端分别引入XbalⅠ(NcoⅠ)和EcoRⅠ(XhoⅠ)酶切位点,其次,考虑到后续的纯化工作,在引物设计时特别引入histag 标签,其具有可以特异性的结合镍离子的功能,方便重组蛋白的纯化和回收。PCR引物由南京金斯瑞生物科技有限公司合成,序列如下所示:
引物1:CATGTCTAGA(CCATGG)CGGAGGTGAAGCTGGTGGAG [划线处为酶切位点XbalⅠ(NcoⅠ)]
引物2:GCCACCGCCGGATCCACCACCGCCCGAGCCACCGCCACCTGAGGAGACTGTGAGAGTGGT(划线处为部分linker序列)
引物3: GGCGGTGGTGGATCCGGCGGTGGCGGTTCCCAGGCTGTTGTGACTCAGGAA(划线处为部分linker序列)
引物4: CCGGAATTC(CTAGAG)TTAGTGGTGATGGTGATGATGCTTGGGCTGACCTAGGACAGT(划线处为酶切位点EcoRⅠ(XhoⅠ),波浪线为histag 标签)
首先,以引物1和引物2为引物,PCR扩增出带有部分Linker的VH-Linker片段;以引物3和引物4为引物,PCR扩增出带有部分Linker的Linker-VL片段。PCR 扩增条件如下:95℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸30 s,28个循环;72℃延伸8 min。每轮PCR后,将3 μL PCR产物与1 μL 6×Loading buffer混匀,采用0.8%的琼脂糖凝胶电泳分析并借助凝胶回收试剂盒纯化回收PCR产物VH-Linker和Linker-VL。然后,通过重叠延伸PCR法(gene splicing by overlap extension PCR,SOE-PCR)构建scFv-2C10基因,SOE-PCR分两步:第一步,以上述回收的产物VH-Linker和Linker-VL为模板进行PCR 扩增反应,将VH 和VL 通过Linker连接合成一条单链。PCR扩增条件如下:95℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸30 s,10个循环;72℃延伸8 min。经0.8% 的琼脂糖凝胶电泳分析并纯化回收PCR产物。第二步,以第一步纯化产物为模板,以引物1和引物4为引物,PCR扩增scFv-2C10基因。PCR 扩增条件如下:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min;30个循环;72℃延伸10 min。经0.8%的琼脂糖凝胶电泳分析并纯化回收PCR产物scFv-2C10。根据所用引物的不同,最后获得两种不同的PCR产物,即为NcoⅠ-scFv-2C10-XhoⅠ和XbalⅠ-scFv-2C10-EcoRⅠ。
1.2.2 重组质粒pET-30a-pelB-scFv的构建和鉴定
pelB信号肽可以引导蛋白产物在细胞周质表达,为了方便后续的蛋白纯化工作,现将pET-22b载体上的pelB信号肽序列克隆到最终使用载体pET-30a上,方法分为两步,首先将“1.2.1” 中第二步获得的PCR产物NcoⅠ-scFv-2C10-XhoⅠ和质粒pET-22b均采用限制性内切核酸酶NcoⅠ和XhoⅠ进行双酶切,纯化回收产物后,采用DNA连接酶将scFv-2C10和pET-22b进行连接获得重组质粒pET-22b-scFv-2C10,并转化E.coliTrans5α细胞。挑取单克隆进行菌落PCR验证。
然后提取上述阳性克隆子pET-22b-scFv-2C10的质粒,纯化后将重组质粒pET-22b-scFv-2C10和质粒pET-30a分别用NdeⅠ和XhoⅠ进行双酶切,纯化回收产物后,采用DNA连接酶将pelB-scFv-2C10和pET-30a进行连接获得重组质粒pET-30a-pelB-scFv-2C10,并转化E.coliTrans5α细胞。挑取单克隆进行菌落PCR验证,选取阳性转化子送至南京金思瑞生物科技有限公司测序。
测序正确的阳性转化子培养并提取质粒后,将空载体pET-30a和所提取质粒分别转化到BL21(DE3)感受态细胞中,挑取菌落转化子进行PCR验证,阳性转化子分别命名为BL21(DE3)-pET-30a和BL21(DE3)- pET-30a-pelB-scFv-2C10。
1.2.3 重组质粒pET-30a-pelB-scFv的表达及鉴定
无菌条件下挑取1.2.3中转化成功的单菌落转化子BL21(DE3)-pET-30a和BL21(DE3)- pET-30a-pelB-scFv-2C10,分别培养于100 mL液体LB培养基中(含有100 μL 的50 mg/mL的kana),于200 r/min 、37℃条件下培养至OD600为0.8左右时,加入诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)并使其终浓度为1 mmol/L、16℃诱导表达20 h,多次试验发现,诱导时间为20 h时蛋白表达量达到最高。收集菌体,进行蛋白预表达分析实验。
由于pelB信号肽的存在,所以基本确定目的蛋白主要存在于细胞周质内。又由于只有当新生肽链的合成速率大于蛋白折叠速率时,蛋白才会以包涵体的形式存在,而肽链的合成速率又与温度有着直接的关系,所以我们选择16℃低温诱导蛋白的表达可以有效地避免包涵体形式的形成,且实验证明的确如此。
采用SDS-PAGE对scFv-2C10的预表达情况进行验证分析,将破碎后的菌体细胞4℃低温离心,可溶性蛋白经镍柱亲和层析法进行蛋白纯化,纯化后的蛋白与上样缓冲液混匀后煮沸6 min直接上样,经SDS-PAGE验证后,接着转印PVDF膜,再以5%牛奶封阻PVDF膜,最后采用羊抗小鼠IgG-HRP 酶标二抗孵育后,利用ECL显色液显色,观察结果。
1.2.4 重组质粒pPICZαA-scFv的构建和鉴定
将“1.2.1” 中第二步获得的PCR产物XbalⅠ-scFv-2C10-EcoRⅠ和质粒pPICZαA均采用限制性内切核酸酶XbalⅠ和EcoRⅠ进行双酶切,纯化回收产物后,采用DNA连接酶将scFv-2C10和pPICZαA进行连接获得重组质粒pPICZαA-scFv-2C10,并转化E.coliTrans5α细胞。挑取单克隆进行菌落PCR验证,选取阳性转化子送至南京金思瑞生物科技有限公司测序。
1.2.5 毕赤酵母GS115感受态细胞制备
1)挑取毕赤酵母GS115单菌落于5 mL液体YPD 培养基中,28℃、200 r/min活化培养16 h;
2)将活化好的1 mL 菌液转接于100 mL的液体YPD培养基中,28℃、2000 r/min 培养至OD600约于1.2时,将菌体转入45 mL的离心管中、4200 r/min、4℃离心5 min;
3)弃上清,菌体沉淀用冰冷的无菌蒸馏水重悬,4200 r/min、4℃离心5 min;
4)弃上清,重复(3)1次;
5)弃上清,菌体用1 mol/L冰冷的无菌山梨醇重悬,4200 r/min、4℃离心5 min;
6)弃上清,重复(5)1次;
7)弃上清,菌体用1 mol/L冰冷的无菌山梨醇重悬,分装成80 μL/管,-70℃保存备用。
1.2.6E.coliTrans5a-pPiczαA-scFv-2C10质粒的线性化
对空载E.coliTrans5a-pPiczαA菌株和测序正确的菌株进行质粒提取,用限制性内切酶BstXⅠ对质粒E.coliTrans5a-pPiczαA、E.coliTrans5a-pPiczαA-scFv-2C10进行线性化酶切,45℃条件下,酶切20 h。以0.8%的琼脂糖凝胶电泳验证酶切结果,然后回收酶切线性产物E.coliTrans5a-pPiczαA和E.coliTrans5a-pPiczαA-scFv-2C10,以0.8%的琼脂糖凝胶电泳检验回收效果。
1.2.7 重组质粒转化毕赤酵母及鉴定
将1.2.3中保存的感受态细胞80 μL和10 μg回收的线性化质粒(E.coliTrans5a-pPiczαA和E.coliTrans5a-pPiczαA-scFv-2C10)分别进行混匀后,一起加入已经预冷30 min的电转杯中(0.2 cm),冰上静置5 min;将电转仪调至Fungi 档,2000 V进行电击转化,电转产物迅速加入1 mL预冷的1 mol/L无菌山梨醇混匀,将混合产物转移到2 mL的EP管中,28℃,200 r/min 孵育2 h;取孵育好的产物200 μL 轻轻涂在固体YPD平板(含有100 μg/mL 的博莱霉素)上,28℃培养箱中培养3 d左右,挑取菌落转化子进行PCR验证,转化子命名为GS115-pPiczαA和GS115-pPiczαA-scFv-2C10。
1.2.8 重组酵母的表达及鉴定
无菌条件下挑取转化成功的单菌落转化子GS115-pPiczαA和GS115-pPiczαA-scFv-2C10分别转到BMGY培养基中,于28℃条件下培养至OD600为4左右时,离心回收菌体并将其重悬于100 mL BMMY培养基中,实验设置两个平行组,两组均培养至OD600为1.2左右,200 r/min、28℃条件下加入甲醇进行诱导表达,并且每隔24 h向培养基中再次添加甲醇,并使其终浓度为0.5%,第一小组诱导满20 h后,收集菌体和上清,进行蛋白预表达分析实验。通过第二小组实验发现,当诱导满72 h后,蛋白表达量达到最高。
采用SDS-PAGE对scFv-2C10的预表达情况进行验证分析。检测结果表明,上清液中的目的蛋白几乎不存在,而菌体中的目的蛋白要多得多。所以接着采用Western blot 对菌体目的蛋白scFv-2C10进行验证分析。将破碎后的菌体细胞经镍柱亲和层析法进行蛋白纯化,纯化后的蛋白采取同1.2.3中同样的验证方法进行初步验证,最后采用ECL显色液显色,观察并分析结果。
1.2.9 抗AFB1 scFvs-2C10的性质分析
以20 mL PBS缓冲溶液悬浮,在冰浴条件下将细胞超声破碎(30 min,功率105 W,2 s开启,2 s关闭),4℃下10 000 r/min 离心10 min,取上清液,采用镍柱亲和层析纯化上清液,纯化后所得到的蛋白经SDS-PAGE初步验证后,再以间接竞争 ELISA 检测上述两种表达载体所表达的目的蛋白抗 AFB1scFv-2C10的灵敏度,试验中以pET-30a和pPICZαA两种空载体的表达为阴性对照。
用CBS缓冲液稀释AFB1O-OVA为1 μg/mL包被96孔板过夜,PBST洗涤甩干。每孔加入200 μL封阻液,37℃静置2 h,甩干封阻液,PBST洗涤甩干。每孔加入90 μL用PBST 稀释的抗AFB1 scFv-2C10和10 μL以PBS 稀释的不同浓度的AFB1 溶液(浓度分别为2、8、20、40和60 μg/mL),37℃静置1 h,甩干液体,PBST洗涤甩干。每孔加入100 μL 的羊抗鼠IgG-HRP酶标二抗(以PBST 4000倍稀释),37℃静置1 h,甩干液体,PBST洗涤甩干。每孔加底物缓冲液100 μL后,37℃静置15 min,每孔加入50 μL 2 mol/L H2SO4终止反应,492 nm 测吸光值。
2 结果
2.1 目的基因scFv-2C10扩增
以质粒pMD19-T-VH-2C10和pMD19-T-VL-2C10分别为模板,经SOE-PCR第一步扩增产物为模板,进行第二步PCR获得两端带有酶切位点的产物scFv-2C10基因。经0.8% 琼脂糖凝胶电泳检测(图1),大小约为750 bp,与理论值一致。回收试剂盒回收scFv-2C10基因片段。
2.2 重组质粒pET-30a-pelB-scFv的构建及鉴定
将pET-30a质粒和回收产物pelB-scFv-2C10分别进行NdeⅠ和XhoⅠ双酶切反应和连接反应,获得重组质粒pET-30a-pelB-scFv。将重组质粒转化到E.coliTrans5α细胞,挑取转化子,以引物1和引物4对其进行菌落PCR验证(图2-A),PCR产物大小约为750 bp,与理论预期值一致。测序结果进一步验证了重组质粒构的建成功。
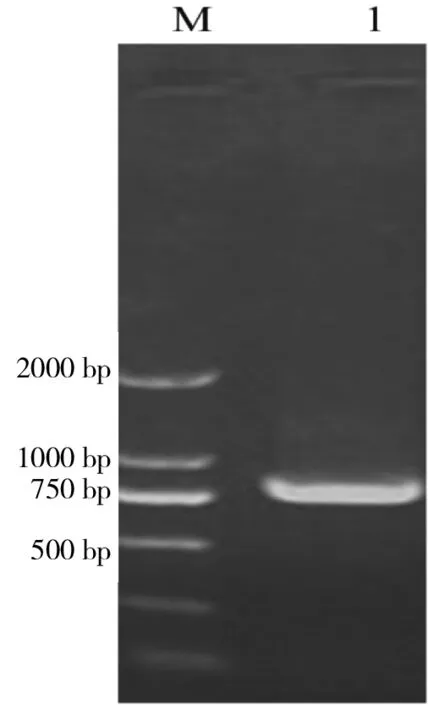
图1 scFv基因的PCR扩增结果
M:Trans2K DNA Marker;1:scFv-2C10 gene fragments
将测序成功的阳性转化子pET-30a-pelB-scFv和空质粒pET-30a分别转化到BL21(DE3)感受态细胞中,转化子进行PCR验证(图2-B),PCR产物大小约为750 bp,与理论值一致。
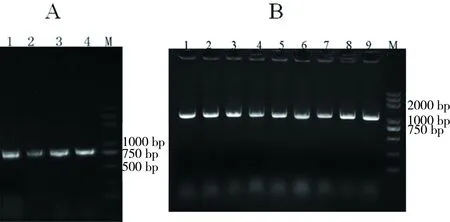
图2含目的基因的转化子PCR验证结果Fig 2 PCR results of transformants containing target gene
A:M为Trans5K Plus DNA Marker; 1、2为different transformants containg scFv-2C10 gene。B:M为Trans5K Plus DNA Marker; 1~10为different transformants containg scFv-2C10 gene
2.3 重组质粒pET-30a-pelB-scFv的表达及鉴定
挑取固体LB平板上生长的阳性菌落进行诱导表达,镍柱亲和法纯化表达蛋白,采用SDS-PAGE和Western blot 对抗AFB1scFv-2C10蛋白进行验证,结果见图3。由图可知,SDS-PAGE和Western blot鉴定结果表明已成功诱导表达了目的蛋白,该蛋白质分子质量约为29 ku,与目的蛋白理论值一致。BCA法测定诱导20 h纯化后目的蛋白的产率约为34 mg/L。
2.4 重组质粒pPiczαA-scFv的构建及鉴定
将pPICZαA质粒和回收产物scFv-2C10分别进行XbalⅠ和EcoRⅠ双酶切反应和连接反应,获得重组质粒pPICZαA-scFv-2C10。将重组质粒转化到E.coliTrans5α细胞,挑取转化子,以引物1和引物4对其进行菌落PCR验证(图4-A),PCR产物大小约为750 bp,与理论预期值一致。与测序结果进行对比后,进一步验证了重组质粒的构建成功。
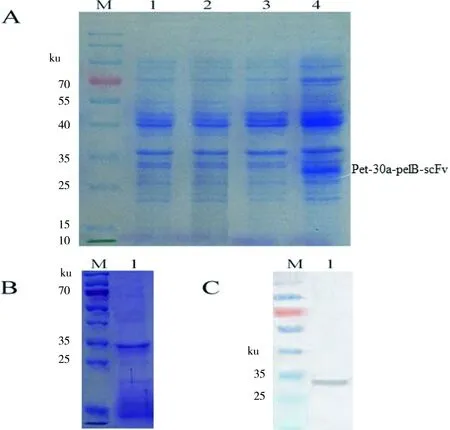
图3抗AFB1 scFv-2C10表达的SDS-PAGE和Western-blot分析Fig 3 SDS-PAGE and Western-blot analysis for expression of anti-AFB1 scFv-2C10
A:抗AFB1scFv-2C10表达的SDS-PAGE分析;B:纯化后的抗AFB1scFv-2C10的SDS-PAGE分析;C:抗AFB1scFv-2C10表达的Western-blot分析。M:Marker;1:purified scFv-2C10
线性化质粒E.coliTrans5a-pPiczαA和E.coliTrans5a-pPiczαA-scFv-2C10分别与GS115感受态细胞进行混匀后,进行电转化,挑取3 d左右的培养皿中的转化子进行PCR验证(图4 B),PCR产物大小约为750 bp,与理论值一致。
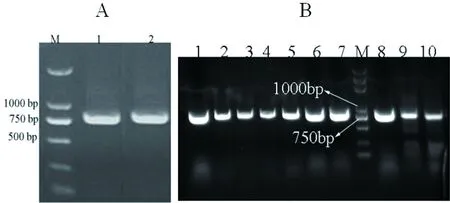
图4 含目的基因的转化子PCR验证结果Fig 4 PCR results of transformants containing target gene
A:M为Trans5K Plus DNA Marker; 1、2为different transformants containing scFv-2C10 gene; B:M为Trans5K Plus DNA Marker; 1~10为different transformants containing scFv-2C10 gene
2.5 重组酵母的表达及鉴定
挑取YPD 平板上生长的阳性菌落进行诱导表达,镍柱亲和法纯化表达蛋白,采用SDS-PAGE和Western blot 对抗AFB1scFv-2C10蛋白进行验证,结果见图5。由图可知,SDS-PAGE和Western blot鉴定结果表明已成功诱导表达了目的蛋白,该蛋白质分子质量约为29 ku,与目的蛋白理论值一致。BCA法测定诱导72 h后纯化的目的蛋白的产率约为132 mg/L。
2.6 抗AFB1scFv-2C10的性质分析
分别以间接非竞争ELISA和间接竞争ELISA纯化后的scFv-2C10进行分析。间接非竞争ELISA 表明,AFB1O-OVA包被浓度为1 μg/mL,抗AFB1scFv-2C10的浓度约为0.17 mg/mL时,OD492约为1.0。在此条件下,以AFB1为竞争抗原,进行间接竞争ELISA检测不同表达系统表达的目的蛋白的灵敏度,并取5个点以绘制scFv-2C10的间接竞争抑制曲线,由图6可知,两种表达系统得到的目的蛋白scFv-2C10的检测灵敏度分别约为40 μg/mL和35 μg/mL,结果表明采用酵母表达系统获得的目的蛋白scFv-2C10与AFB1的结合活性较同一种蛋白采用E.coliBL21(DE3)表达时要稍有好转,但是仍然没有达到预期目标。
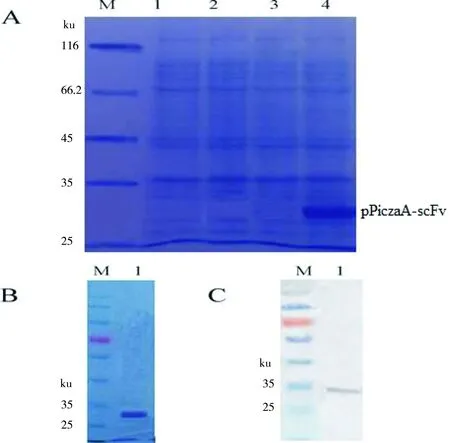
图5 抗AFB1 scFv-2C10表达的SDS-PAGE和Western-blot分析Fig 5 SDS-PAGE and Western-blotanalysis for the expression of anti-AFB1 scFv-2C10
A:抗AFB1 scFv-2C10表达的SDS-PAGE和Western-blot分析;B:纯化后的抗AFB1 scFv-2C10的SDS-PAGE分析;C:抗AFB1 scFv-2C10 表达的Western-blot分析。M:Marker;1:purified scFv-2C10
3 讨论
基于AFB1的毒性,其检测的极限尤为重要。目前的检测分析方法中使用较广的是酶联免疫吸附法,该法以检测快速、灵敏、样品制备简单等优点而广受关注。在该检测方法中,抗体是核心试剂,以实验室保存的抗AFB1单克隆杂交瘤细胞株为原料构建scFv 基因。
目前,对于外源蛋白的表达,E.coli表达系统是应用较多、研究较多的,也最具有代表性的,E.coli作为AFB1scFv的表达系统,E.coli具有操作方便快速、实验周期不长、生产成本小等优点。但其不能对蛋白质进行有效的翻译后修饰( 如二硫键形成、蛋白质折叠等),存在一定局限性。而真核细胞表达系统的翻译后修饰机制接近天然形式。
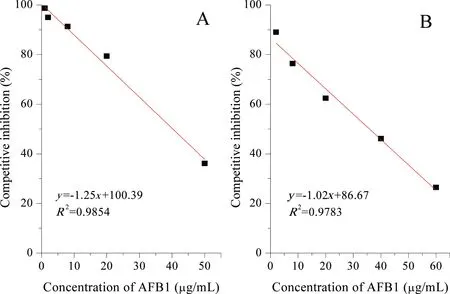
图6 scFv-2C10的间接竞争ELISA抑制曲线Fig 6 IC-ELISA inhibition curves of pET-30a-pelB-scFv (A) and pPICZαA-scFv (B)
毕赤酵母表达系统又称甲醇酵母表达系统,是因为毕赤酵母中的醇氧化酶AOX1基因,在当甲醇作为碳源时,醇氧化酶可以将甲醇转化为醛类物质,进而再在其他酶类的作用下,转化成酵母所需要的能量,以供酵母细胞的生长繁殖。当线性化的重组质粒在5′AOX1和3′AOX1之间和宿主菌的基因组发生同源重组时,就成功地获得了整合基因组的转化子。控制醇氧化酶转录的启动子(PAOX1)是强启动子,当培养液中加入甲醇时,PAOX1可以更高效启动醇氧化酶的转录,而目的基因也正好处于其中,所以毕赤酵母表达系统的外源蛋白的产量较高。又由于它是真核表达系统,所以外源蛋白在构象上折叠的更成熟。
pelB信号肽可以引导目的蛋白在细胞周质内表达,并且采取一定的手段可以避免包涵体的形成,增加可溶蛋白的表达,提高纯化效率[18]。基于此,实验先将目的基因克隆到带有pelB信号肽的载体pET-22b上,再将pET-22b上的pelB信号肽序列和目的基因序列一同克隆到载体pET-30a上,这样是为了充分利用pelB信号肽的上述特性。基于此,实验还将目的基因采用了毕赤酵母表达体系进行蛋白表达以与E.coli表达体系相比较。最终本研究成功构建了两种重组载体pET-30a-pelB-scFv-2C10和pPiczαA-scFv,并将其转化到相应的表达细胞中进行蛋白表达,以期望scFv的亲和力和蛋白表达量能有所提高。实验结果显示,酵母表达系统中获得的目的蛋白的最高表达量132 mg/L是E.coli表达系统中蛋白最高表达量的4倍。经ELISA实验结果表明,两种表达系统得到的目的蛋白scFv-2C10均显示出较好的活性,经检测,灵敏度分别约为40 μg/mL和35 μg/mL,这说明在酵母表达系统中目的蛋白的活性得到了一定的提高,原因可能是scFv得到了较为充分的折叠和翻译后修饰。但是距离预期目标仍有较大的差距,接下来的实验还需要大量的分析和改进,分析其原因可能是因为scFv的自身编码基因的亲和力不够高,所以在未来的实验中,可能会采取基因工程技术手段,如基因定点突变或随机突变等对scFv的亲和力进行提高。
[1]黄惠明,徐群英,胡 敏. 黄曲霉毒素检测方法研究的概述[J]. 中国卫生检验杂志,2001,11(4):510-512.
[2]ONO E Y, ONO M A, FUNO F Y, et a1. Evaluation of fumonisin-aflatoxin co-occurrence in Brazilian corn hybrids by ELISA [J]. Food Addit Contam, 2001, 18(8):719-729.
[3]DORNER J W, COLE R J, BLANKENSHIP P D. Effect of inculum rate of biological control agents on preharvest aflatoxin contamination of peanuts [J]. Biol Control, 1998, 12(3):171-176.
[4]QIAN G S, ROSS R K, YU M C, et al . A follow-up study of urinary markers of aflatoxin exposure and liver cancer risk in Shanghai, People′s Republic of China [J]. Cancer Epidemiol Biomarkers Prevent , 1994, 3(1): 3-10.
[5]RIESWIJK L, CLAESSEN S M H, BEKERS O, et al. Aflatoxin B1 induces persistent epigenomic effects in primary human hepatocytes associated with hepatocellular carcinoma [J]. Toxicology, 2016, 350-352:31-39.
[6]ClEGG B S, STEPHENSON G R, HALL J C. Development of an enzyme-linked immunosorbent assay for the detection of dicamba [J]. Journal of Agriculture Food Chemistry, 2001, 49(5): 2168-2174.
[7]TAHER F A, CAPPOZZO J, ZWEIGENBAUM J, et al. Detection and quantitation of mycotoxins in infant cereals in the U.S. market by LC-MS/MS using a stable isotope dilution assay [J]. Food Control, 2017, 72 (Part A) :27-35.
[8]LIU J W, LU C C, LIU B H, et al. Development of novel monoclonal antibodies-based ultrasensitive enzyme-linked immunosorbent assay and rapid immunochromatographic strip for aflatoxin B1 detection [J]. Food Control, 2016, 59:700-707.
[9]WANG H, ZHAO F, HAN X, et al. Production and characterization of a biotinylated single-chain variable fragment antibody for detection of parathion-methyl [J]. Protein Expres Purif, 2016, 126:1-8.
[10]LI B, YE J, LIN Y, et al. Preparation and identification of a single-chain variable fragment antibody against Newcastle diseases virus F48E9 [J]. Vet Immunol Immunop, 2014, 161 (3-4) :258-264.
[11]PALMIERI D, RICHMOND T, PIOVAN C, et al. Human anti-nucleolin recombinant immunoagent for cancer therapy [J]. P Natl Acad Sci USA, 2015, 112 (30) :9418-9423.
[12]MIN W K, NA K I, YOON J H, et al. Affinity improvement by fine tuning of single-chain variable fragment against aflatoxin B1 [J]. Food Chem, 2016, 209 (9) :312-317.
[13]UNGER T, PELEG Y. Recombinant protein expression in the baculovirus-infected insect cell system [J]. Methods Mol Biol, 2012, 800: 187-199.
[14]HU S, LI L, QIAO J, et al. Codon optimization, expression, and characterization of an internalizing anti-ErbB2 single-chain antibody inPichiapastoris[J]. Protein Expr Purif, 2006, 47(1): 249-257.
[15]邓春梅, 葛玉强, 刘 丽, 等. 外源基因表达系统的研究进展[J]. 现代生物医学进展, 2010, 10(19):3744-3746.
[16]HANG H, YE X, GUO M, et al. A simple fermentation strategy for high-level production of recombinant phytase byPichiapastorisusing glucose as the growth substrate [J]. Enzyme Microb Tech, 2009, 44(4):185-188.
[17]CREGG J M, CEREGHINO J L, SHI J, et al. Recombinant protein expression inPichiapastoris[J]. Mol Biotechnol, 2000, 16(1):23-52.
[18]CHEN W, HU L, LIU A, et al. Expression and characterization of single-chain variable fragment antibody against staphylococcal enterotoxin A inEscherichiacoli[J]. Can J Microbiol, 2014, 60 (11) :737-743.

