魔芋葡甘聚糖-乙基纤维素包膜尿素的制备及其缓释性能
黄迪菲, 严文莉, 匡 映, 肖 满, 姜发堂, 倪学文
(湖北工业大学食品与制药工程学院,湖北武汉 430068)
尿素是使用最普遍和最经济的含氮肥料,因为其较高的含氮量(46%)而被广泛应用于全球农业[1]。但是,尿素中只有30%~50%的氮被植物吸收,大量氮的流失造成了严重的环境污染问题[2-3]。开发缓/控释尿素肥料,可以改善氮的利用率,满足植物的营养需要并保护环境。通过物理方式包膜尿素颗粒,制备缓/控释包膜尿素肥料,不仅可以提高氮的利用率,还可以增加尿素抗压强度,避免运输时的破损。来源丰富、可生物降解的尿素包膜材料引起了大量研究者的兴趣,如淀粉[4-5]、木质素[6]、纤维素[7]、壳聚糖[8]等。这些生物聚合物可以形成尿素颗粒表面的包衣,避免尿素在水中快速溶解,使其缓慢释放。但是,这些材料存在缺陷,如因机械性能差导致包膜层破裂,使氮快速释放[9]。有许多关于改善生物聚合物特性的研究,比如通过聚合物物理共混、化学改性以及添加增容剂等[10-11]。
魔芋葡甘聚糖(konjac glucomannan,KGM)是从魔芋根茎中提取的水溶性高分子多糖,具有较好的成膜性、凝胶性、生物相容性和生物降解性等特点[12-13],是具有应用潜力的环保材料。通过化学改性或与其他生物聚合物共混,KGM的应用范围得到扩展,可以广泛应用于食品加工、包装薄膜[14-15]、缓控释药物[16-17]、医用绷带[12]等。乙基纤维素(ethyl cellulose,EC)是一种线性多糖,可溶于大多数有机溶剂但不溶于水。EC因具有良好的成膜性、稳定性、生物降解性及高的机械强度,被广泛应用于包装材料[18-19],EC还可作为缓控释药物和肥料的载体材料[20-21]。笔者前期研究发现KGM-EC复合膜具有良好的机械性能、耐水性、耐热性和生物相容性,KGM-EC 复合膜可以作为尿素的包膜材料[22]。因此,本研究利用转鼓包衣锅喷雾热固的方法制备KGM包膜尿素、EC包膜尿素和KGM-EC复合膜包膜尿素,对这3种包膜尿素进行比较;用质构仪测定包膜尿素的硬度,用扫描电镜(SEM)观察包膜尿素的表面和截面的微观结构,对不同包膜尿素在水中的释放行为进行比较分析,并将3种包膜尿素按照一定比例混合,形成组合包膜尿素,以期获得理想的尿素缓释效果。本研究将为KGM-EC复合膜作为包膜材料的应用提供一定理论依据。
1 材料与方法
1.1 材料
魔芋葡甘聚糖(KGM,武汉市力诚生物科技有限公司),乙基纤维素(EC,成都市科龙试剂有限公司),颗粒尿素(Urea,湖北产农用级别),葵二酸二丁酯(DBS)、乙酸乙酯、浓硫酸、对二甲氨基苯甲醛(PDAB)均为国产分析纯,HH-2型数显恒温水浴锅(国华电器有限公司),BY-400包衣锅(湖南吉首市中湘制药机械厂),UV-2100紫外-可见光分光光度计(北京山峰万泰科技发展有限公司),TMS-PRO质构分析仪(美国FTC),扫描电镜(JSM-6390LV,X-650,Hitachi,日本)。
1.2 方法
1.2.1 包膜尿素制备 KGM包膜液:称取一定质量的KGM,加入100 mL蒸馏水中,60 ℃水浴搅拌2 h,得到KGM水溶胶。
EC包膜液:称取一定质量的EC,加入400 mL乙酸乙酯中,常温搅拌20 min,再加入EC质量25%的DBS,继续水浴搅拌30 min,得到EC油基相。
KGM-EC复合包膜液:将上述方法制备的KGM水溶胶加入到EC溶液中,快速搅拌30 min(700 r/min),得到均匀的复合乳液。复合乳液于60 ℃恒温保存备用。包膜液的总固形物含量为1%。
包膜尿素制备:过筛得到大小均匀、表面完整的颗粒尿素(粒径范围1.00~2.80 mm),烘干后备用。调节风机频率为40.00 Hz,打开包衣锅的进风和加热开关,调整包衣锅进风温度为70 ℃。将尿素颗粒倒入包衣锅内;将配制的包膜液倒入液杯,打开液体出口阀,采用喷雾方式制备包膜尿素。按照设计包膜量分别为5%、10%、15%,制备不同包膜层尿素样品。包膜量=(MA-MB)/MB×100%,其中MA是包膜尿素(尿素和包膜层)的质量(g),MB是未包膜尿素的质量(g)。包膜尿素样品配比如表1所示。
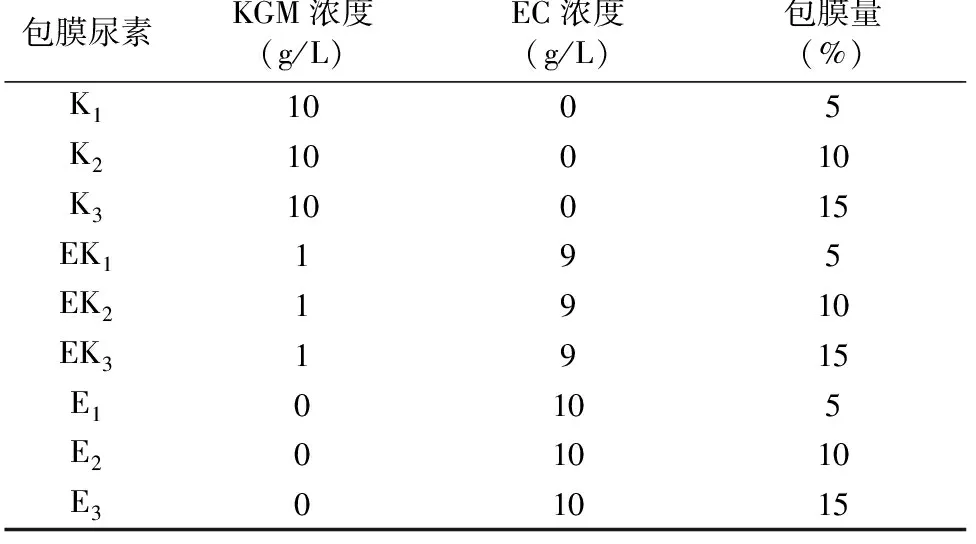
表1 不同包膜层尿素样品配比
1.2.2 包膜尿素大小和硬度测定 包膜尿素的直径采用游标卡尺进行测量。包膜尿素的硬度采用TMS-PRO质构分析仪检测,初始压力为2 N,以60 mm/s的速度来挤压尿素颗粒,使颗粒破碎时的力即为样品的硬度。
1.2.3 扫描电镜观察 将样品切成两半,置于干燥器中平衡24 h后进行SEM分析。将样品置于铜台,在13.3 Pa真空度下喷金,厚度约为20 nm,加速电压为30 kV,观察样品表面和截面的微观结构形态(30×~500×)。
1.2.4 尿素释放率测定 为测定包膜尿素的释放率,设计尿素在水中静态释放的装置,见图1。取10 g样品放置在用支架固定的尼龙网中,尼龙网保持水平使样品之间没有挤压,样品完全浸入蒸馏水中(24 ℃)。在开始的24 h内,每隔2 h取1 mL溶液检测;24 h后,每隔24 h取1 mL溶液检测,持续 21 d。每次取溶液后,立即补充1 mL蒸馏水到原溶液中使其体积不变。将取出的1 mL溶液加入50 mL比色管中,再加入10 mL PDAB、5.0 mL硫酸(2.0 mol/L),加蒸馏水稀释至 25 mL,摇匀,在25~30 ℃静置5 min后,用紫外-可见分光光度计测定D430 nm,通过标准曲线,计算出尿素的释放量和释放率。标准曲线方程:Cr=0.029 9×D430 nm+0.002 2(r2=0.997),其中Cr为尿素的浓度(mg/mL)。

1.2.5 数据处理 每个试验重复3次,统计数据采用Excel 2010软件分析,采用OriginPro(8.5.0)和Photoshop CS6软件作图。
2 结果与分析
2.1 包膜层的微观结构
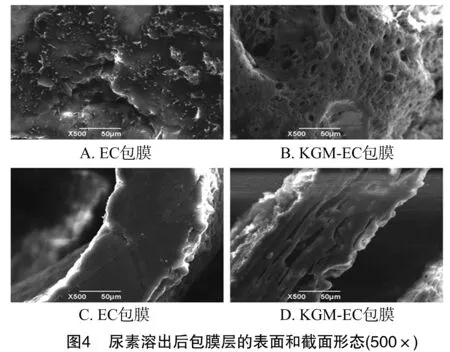
如图2所示,未包膜的尿素、KGM包膜尿素、EC包膜尿素和KGM-EC包膜尿素的表面形貌有明显的差别。未包膜的尿素颗粒表面凹凸不平,有许多孔隙;KGM包膜尿素颗粒的表面不规则、粗糙、多孔隙;EC包衣量为5%时,未能完全覆盖尿素颗粒表面,存在许多孔洞;包衣量增加到10%、15%时,EC包衣层表面致密光滑。5%包衣量的KGM-EC包膜尿素,包膜层结构松散,有孔隙;当包衣量增加到10%、15%时,KGM-EC包膜层结构致密,均匀分布在颗粒表面。KGM-EC 包膜层结构均一,表明KGM与EC发生了相互作用,有较好的相容性[22]。

包膜尿素的截面形态如图3所示。包膜层厚度随着包膜量的增加而增加,EC包膜层厚度为49.18~144.22 μm,KGM-EC包膜层厚度为113.14~169.97 μm。KGM-EC包膜层比EC包膜层厚,且结构松散、有孔隙,可见在KGM-EC复合膜形成过程中由于分子间相互作用而形成了新的膜结构。
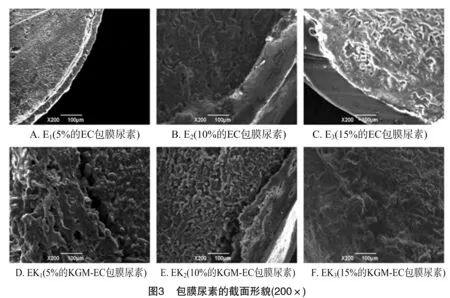
尿素溶出后包膜层的表面和截面的微观结构见图4。EC包膜层出现长裂缝,分裂成碎片(图4-A、图4-C),可能是由于EC包膜层结构完全崩解,导致尿素溶出。KGM-EC包膜层在尿素溶出后显示的结构是布满孔洞的完整结构(图4-B、图4-D),这些孔洞是包膜层中KGM的溶胀和溶解形成的,而EC不溶于水,可维持膜结构完整。由于水溶性KGM分散在不溶于水的EC连续相中,所以KGM-EC包膜层有一定的亲水性,使尿素可以通过包膜层溶出;同时,包膜层又有一定的疏水性,使包膜层维持完整的结构。KGM-EC包膜层与EC包膜层的结构和特性是明显不同的,有待后面的尿素释放率试验进一步证实这个结论。
2.2 包膜尿素的尺寸和硬度
尿素颗粒通过由外向内冷却生产结晶,结构上存在粒子内部压力和尿素颗粒硬度低的特点,尿素在贮藏、装载、运输和施肥过程中很容易破碎[23]。不同包膜尿素的大小和硬度如表2所示,EC包膜尿素和KGM-EC包膜尿素比未包膜的尿素尺寸和硬度都高,抗压性好;KGM包膜尿素尺寸增大,但硬度降低,这可能是由于KGM水溶胶喷洒在尿素表面时使颗粒表面部分溶解导致硬度下降。随着尿素包膜层包膜量的增加,包膜尿素的硬度增加(除KGM包膜尿素)。其中,5% KGM-EC包膜尿素的硬度大于5% EC包膜尿素,是由于5% EC包膜的尿素颗粒表面没有被完全包裹(图2),因此硬度的提高并不明显。当包膜量大于5%时,相同包膜量的尿素颗粒,EC包膜尿素颗粒尺寸小于KGM-EC包膜尿素颗粒,但硬度却更高,这是由于EC的包膜层结构较KGM-EC包膜层结构致密,与图3结果分析一致。
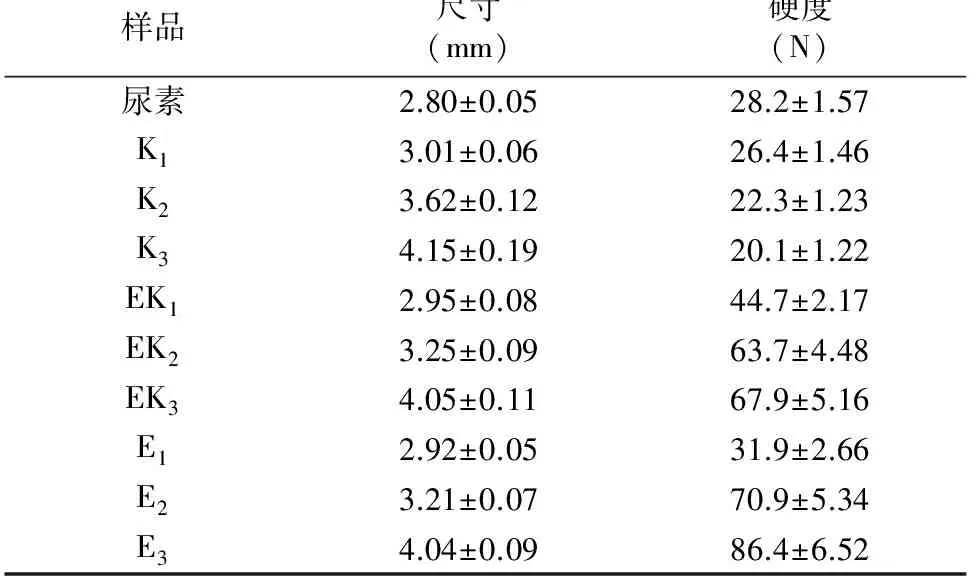
表2 不同包膜尿素的尺寸和硬度
2.3 包膜尿素在水中的释放率
不同的包膜材料,尿素的释放率有很大的不同。样品K1、K2、K3和未包膜尿素的释放曲线如图5-A所示,未包膜尿素在25 min内完全释放,KGM包膜尿素在1 h内完全释放,这是因为KGM包膜层在水中快速地溶胀和溶解。KGM-EC包膜层和EC包膜层对尿素释放率有很大的影响。当包膜量为5%时,EK1尿素释放率较E1低(图5-B),这是由于5% EC不能在尿素颗粒表面形成完整包膜层,EK1包膜层比E1包膜层致密(图2)。当包膜量为10%,到达24 h时,EK2释放率为48.13%,E2释放率为8.57%;之后E2释放率加快,在203 h后E2释放率超过EK2,E2先达到100%释放(图5-C)。EC是不溶于水的聚合物,EC包膜层阻碍尿素与水接触,尿素溶解非常难。但KGM是水溶性的,KGM-EC包膜层比EC包膜层有较好的亲水性[22],由于KGM的溶胀和溶解在KGM-EC包膜层形成孔隙,水分子能穿过孔隙造成尿素的溶解和释放。E2后期释放率的加快,是由于E2包膜层的崩解使尿素快速溶解,和图4结果一致;另外,溶解的尿素可以促进EC的溶解[24]。当包膜量为15%,EK3释放率比E3快,而且包膜量越大,尿素释放率越低(图5-D)。
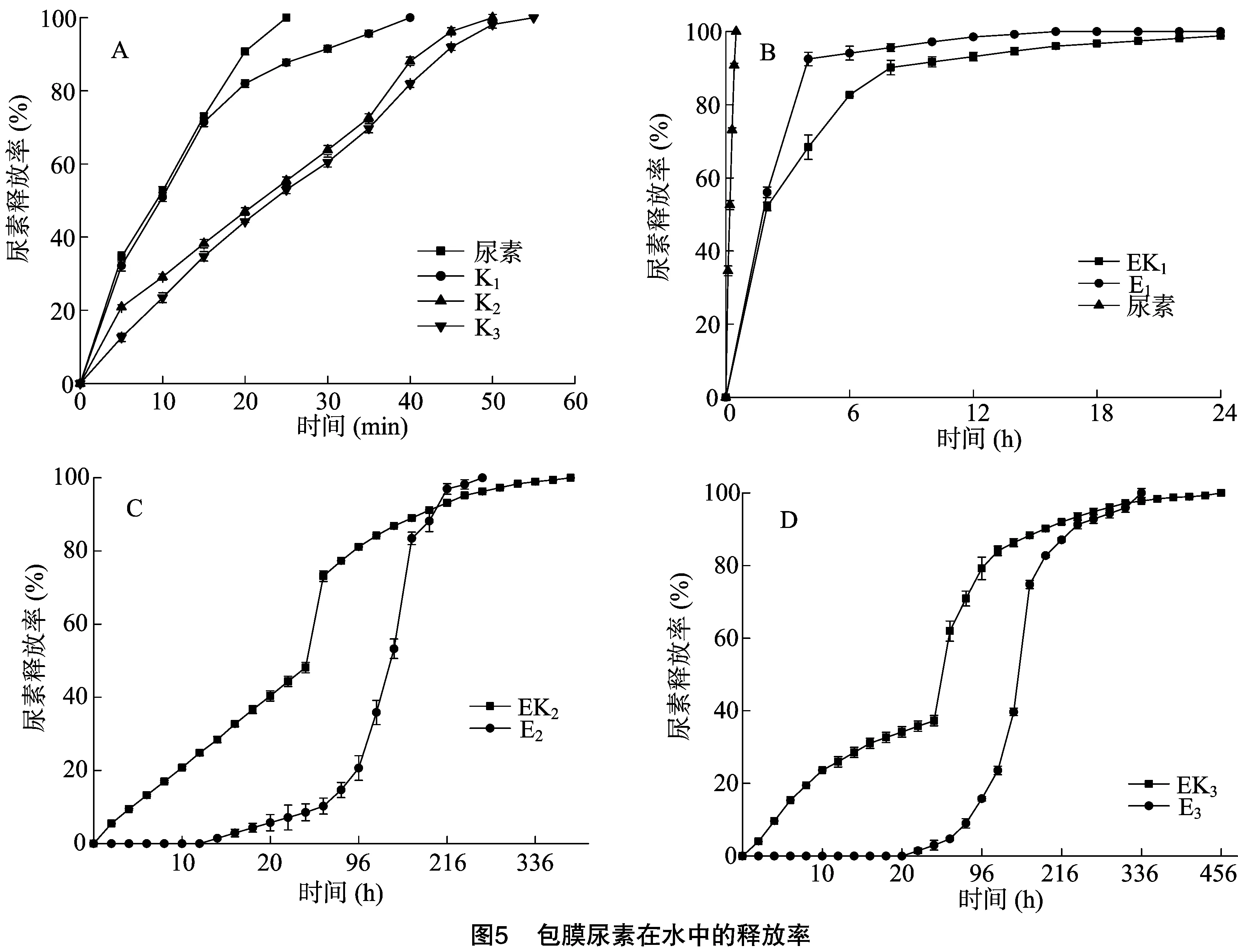
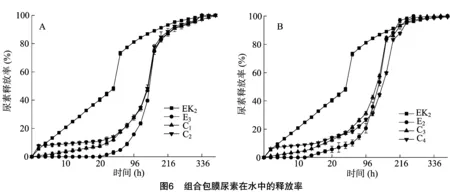
理想的包膜尿素是利用环保、可降解的包膜材料,尿素的释放率能够满足不同作物生长的营养需要。如果将3种包膜尿素(KGM包膜尿素、EC包膜尿素、KGM-EC包膜尿素)按照一定比例混合,可以调整尿素的释放曲线,以满足不同作物或不同环境下作物的营养供给。根据上述包膜尿素的释放特征,笔者初步设计了4个组合样品(表3),并将组合样品的释放率与单个样品的释放率进行了比较。释放时间达到24 h时,C1、C2、C3和C4的释放率分别为12.16%、14.12%、17.16%和17.51%(图6)。C1和C2相比,C2释放率高是因为它含有K3尿素,K3尿素释放率很高;同样的,C3和C4相比,C4含有释放率高的K3尿素,C4比C3释放率高。可见,通过调整组合的形成,可以得到不同的尿素释放曲线。
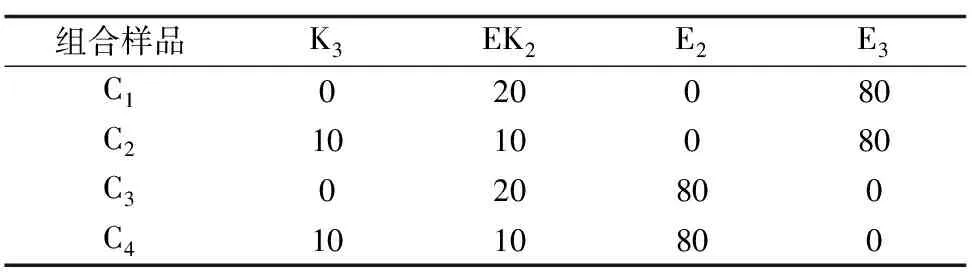
表3 组合样品形成 %
3 结论
以魔芋葡甘聚糖(KGM)和乙基纤维素(EC)为基材,利用转鼓包衣锅喷雾热固的方法制备KGM包膜尿素、EC包膜尿素和KGM-EC复合膜包膜尿素,对包膜尿素的微观结构及其在水中的释放行为进行研究。结果表明,包膜材料性质和包膜层结构对包膜尿素的释放特性有很大的影响。KGM包膜层粗糙且多孔隙,包膜的尿素在水中快速释放;EC包膜层致密光滑,包膜的尿素在水中很难释放;但KGM-EC包膜层结构均一,较KGM包膜层致密,对尿素有较好的缓释效果。将3种包膜尿素按照一定比例混合,形成组合包膜尿素,不同组合的包膜尿素具有不同的尿素释放特性,可以满足不同作物生长对养分的需要,这种组合方式是制备缓释尿素的一种有效方法,具有较好的应用前景。
[1]Allison F E. The enigma of soil nitrogen balance sheets[J]. Advances in Agronomy,1955,7:213-250.
[2]Junejo N,Yusop M K. Evaluation of Cu coated urea on selected soil series of Malaysia[J]. International Society for Southeast Asian Agricultural Sciences,2009:230.
[3]Shaviv A,Mikkelsen R L. Controlled-release fertilizers to increase efficiency of nutrient use and minimize environmental degradation:a review[J]. Fertilizer Research,1993,35(1/2):1-12.
[4]Riyajan S A,Sasithornsonti Y,Phinyocheep P. Green natural rubber-g-modified starch for controlling urea release[J]. Carbohydrate Polymers,2012,89(1):251-258.
[5]Ariyanti S,Man Z,Bustam M A. Improvement of hydrophobicity of urea modified tapioca starch film with lignin for slow release fertilizer[J]. Advanced Materials Research,2012,626:350-354.
[6]Mulder W J,Gosselink R,Vingerhoeds M,et al. Lignin based controlled release coatings[J]. Industrial Crops and Products,2011,34(1):915-920.
[7]Fernández-Pérez M,Garrido-Herrera F J,González-Pradas E,et al. Lignin and ethyl cellulose as polymers in controlled release formulations of urea[J]. Journal of Applied Polymer Science,2008,108(6):3796-3803.
[8]Wu L,Liu M Z. Preparation and properties of chitosan-coated NPK compound fertilizer with controlled-release and water-retention[J]. Carbohydrate Polymers,2008,72(2):240-247.
[9]Azeem B,Kushaari K Z,Man Z B,et al. Review on materials & methods to produce controlled release coated urea fertilizer[J]. Journal of Controlled Release,2014,181(1):11-21.
[10]Ni B L,Liu M Z,Lü S,et al. Environmentally friendly slow-release nitrogen fertilizer[J]. Journal of Agricultural and Food Chemistry,2011,59(18):10169-10175.
[11]Siew L F,Basit A W,Newton J M. The properties of amylose-ethyl cellulose films cast from organic-based solvents as potential coatings for colonic drug delivery[J]. European Journal of Pharmaceutical Sciences,2000,11(2):133-139.
[12]Huang Y C,Yang C Y,Chu H W,et al. Effect of alkali on konjac glucomannan film and its application on wound healing[J]. Cellulose,2015,22(1):737-747.
[13]Jin W P,Song R K,Xu W,et al. Analysis of deacetylated konjac glucomannan and xanthan gum phase separation by film forming[J]. Food Hydrocolloids,2015,48:320-326.
[14]Rhim J,Wang L. Mechanical and water barrier properties of agar/k-carrageenan/konjac glucomannan ternary blend biohydrogel films[J]. Carbohydrate Polymers,2013,96:71-81.
[15]Leuangsukrerk M,Phupoksakul T,Tananuwong K,et al. Properties of konjac glucomannane-whey protein isolate blend films[J]. LWT-Food Science and Technology,2014,59:94-100.
[16]Wang J,Liu C H,Shuai Y,et al. Controlled release of anticancer drug using graphene oxide as a drug-binding effector in konjac glucomannan/sodium alginate hydrogels[J]. Colloids and Surfaces B-Biointerfaces,2014,113(13):223-229.
[17]Lu M L,Li Z J,Liang H,et al. Controlled release of anthocyanins from oxidized konjac glucomannan microspheres stabilized by chitosan oligosaccharides[J]. Food Hydrocolloids,2015,51:476-485.
[18]Davidovich-Pinhas M,Barbut S,Marangoni A G. The gelation of oil using ethyl cellulose[J]. Carbohydrate Polymers,2015,117:869-878.
[19]Zhu J,Dong X T,Wang X L,et al. Preparation and properties of a novel biodegradable ethyl cellulose grafting copolymer with poly(p-dioxanone) side-chains[J]. Carbohydrate Polymers,2010,80(2):350-359.
[20]Costa M M,Cabral-Albuquerque E C,Alves T L,et al. Use of polyhydroxybutyrate and ethyl cellulose for coating of urea granules[J]. Journal of Agricultural and Food Chemistry,2013,61(42):9984-9991.
[21]Verma S,Nagpal K,Singh S K,et al. Unfolding type gastroretentive film of cinnarizine based on ethyl cellulose and hydroxypropylmethyl cellulose[J]. International Journal of Biological Macromolecules,2014,64(2):347-352.
[22]Li X,Jiang F T,Ni X E,et al. Preparation and characterization of konjac glucomannan and ethyl cellulose blend films[J]. Food Hydrocolloids,2015,44:229-236.
[23]Lai X J,Roberts K J,Svensson J,et al. Reaction calorimetric analysis of batch cooling crystallization processes:studies of urea in supersaturated water-methanol solutions[J]. Crystengcomm,2011,13(7):2505-2510.
[24]Guo Y,Zhou J P,Wang Y C,et al. An efficient transformation of cellulose into cellulose carbamates assisted by microwave irradiation[J]. Cellulose,2010,17(6):1115-1125.

