番茄灰霉病菌内生拮抗细菌的筛选及鉴定
马 超,朱洪磊,黄太伟,张宝俊
(山西农业大学农学院,山西太谷 030801)
番茄灰霉病是影响番茄种植的重要病害之一。其在各种植区均有发生,特别是对保护地番茄生产造成极大威胁,可造成减产40%~50%,甚至达60%以上[1]。番茄灰霉病病原为半知菌亚门的灰葡萄孢菌(Botrytis cinerea),除为害番茄外,还可为害辣椒、茄子、黄瓜等200多种作物[2]。寄主的茎、叶、花、果均可为害,但通常以青果发病较重。病症初呈水浸状斑点,后扩展为长圆形或不规则形病斑,湿度大时形成灰色的霉层,可产生大量的分生孢子及分生孢子梗,分生孢子可借助气流、雨水溅射或农事操作等迅速传播、繁殖、为害。持续的化学防治措施的实施,一方面可导致果实农药残留增加的风险;一方面喷施时,施药器械产生的气流也助长了病原菌分生孢子的传播;再次,番茄灰霉病菌抗药性问题等导致化学药剂防治困难,生产上番茄灰霉病频发[3-4]。
利用有益微生物及其代谢产物来防治番茄灰霉病已成为一种有效且绿色环保的病害防治途径。国内外关于利用有益微生物防控番茄灰霉病的研究已有很多报道,筛选出了包括哈茨木霉、粘帚霉、芽孢杆菌、荧光假单孢菌、链霉菌等多种对番茄灰霉菌具有良好抑菌效果的有益微生物,并且一些已被开发为制剂应用于生产[5-6]。
植物内生菌是定殖在健康植物组织内,并与植物建立和谐联合关系的一类微生物,一方面植物内生菌可通过分泌抗菌物质,提高植物抗病、抗逆能力,另一方面植物内生菌定殖于植物组织内部,可受到植物组织的保护,比暴露于恶劣环境中的附生微生物具有更稳定的生存环境,更易于其生物功能的发挥。
本研究主要从健康梓树的根部和茎叶部分离内生细菌,并通过其次生代谢物的抑菌活性测定、拮抗菌株分类地位的鉴定等,筛选出对番茄灰霉病有明显抑制效果的内生拮抗细菌,以期为番茄灰霉病的微生物防治提供依据。
1 材料和方法
1.1 供试材料
供试菌株:植物内生细菌GZ-1,GZ-2,GZ-3,GZ-4,GZ-5,GZ-6,GZ-7,GZ-8,GZ-9,GZ-10,GZ-11和GZ-12菌株,分离自山西农业大学校园梓树的根、茎、叶等不同部位。
供试植物病原菌:番茄灰霉病菌(Botrytis cirerea)FQ-1、番茄灰霉病菌(Botrytis cirerea)FQ-2、草莓灰霉病菌(Botrytis cirerea)CM-1、草莓灰霉病菌(Botrytis cirerea)CM-2、番茄早疫病菌(Alternaria solani)、番茄枯萎病菌(Fusarium oxysporum f.sp.lycopersic)、黄瓜灰霉病菌(Botrytis cirerea)、小麦赤霉病菌(Fusarium graminearum)、西瓜枯萎病菌(Fusarim oxysporum f.sp.niveum)、辣椒枯萎病菌(Fusarium oxysporum f.sp.vasinfectum),均为山西省绿色生物农药工程技术中心保存菌种。
1.2 拮抗菌株的筛选
采用平板对峙法[7],以番茄灰霉病菌、番茄早疫病菌和番茄枯萎病菌等3种病原菌为指示菌,对12株内生细菌的抑菌活性进行测定[8]。并采用十字交叉法测量对照组直径和处理组直径,计算抑菌率,以不接内生细菌为对照,3次重复。
1.3 拮抗菌株发酵液活性测定
采用生长速率法[8],以番茄灰霉病菌、番茄早疫病菌和番茄枯萎病菌等3种病原菌为指示菌,测定12株内生细菌的抑菌活性。将12个菌株分别接种于BPY液体培养液中[8],30℃,170 r/min振荡培养72 h,将发酵液以8 500 r/min离心15 min后收集上清液,并将所得上清液用0.45 μm微孔滤膜过滤,得到过滤后的发酵液以1∶9(V∶V)的比例与PDA培养基混合制备平板,取直径为5 mm病原菌接种于平板中央,并在25℃恒温培养箱中培养5 d后测定病原菌的直径,计算其抑菌率。以无菌发酵液为对照,3次重复,并计算抑菌率。
1.4 GZ-5和GZ-3菌株抑菌谱测定
采用生长速率法,并以番茄灰霉病菌、草莓灰霉病菌、黄瓜灰霉病菌等植物病原菌作为指示菌,测定GZ-5和GZ-3菌株的抑菌活性及抑菌广谱性,测定方法同1.2。
1.5 拮抗菌株的分类鉴定
1.5.1 形态特征及生理生化 依据《Bergey's manu al ofdeterminative Bacteriology》[9]和《常见细菌系统鉴定手册》[10]。根据菌落特性、菌体形态大小和菌株菌体的生理生化反应等对内生细菌进行初步的鉴定。
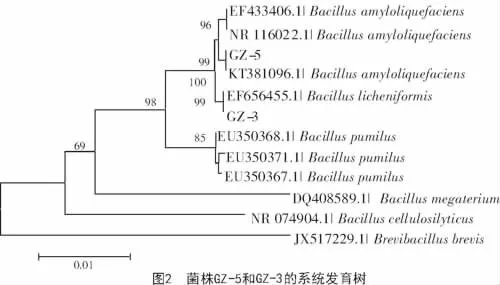
1.5.2 16S rDNA序列分析测定及同源性比对 细菌DNA的提取采用蛋白酶/SDS法制备[11],采用细菌通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′扩增16S rDNA基因序列。PCR扩增反应体系(50 μL):10×buffer(含 Mg2+)5 μL,dNTP(2.5 mmol/L)2 μL,引物 27F(10 mmol/L)1 μL,引物 1492R(10 mmol/L)1 μL,Taq 酶(5 U/L)0.5 μL,3 μL上清液作为模板,ddH2O37.5 μL。PCR 反应程序:95 ℃,5 min,94℃,30 s,48 ℃ 30 s,72 ℃ 1 min,30 个循环;72 ℃延伸7 min,10℃保存。纯化后的PCR产物送至北京华大基因科技股份有限公司测序。测序后在NCBI上进行同源性分析,结合形态学特征和生理生化测定结果,初步鉴定出该菌株的分类地位,并构建系统发育树。
2 结果与分析
2.1 拮抗菌株的筛选结果
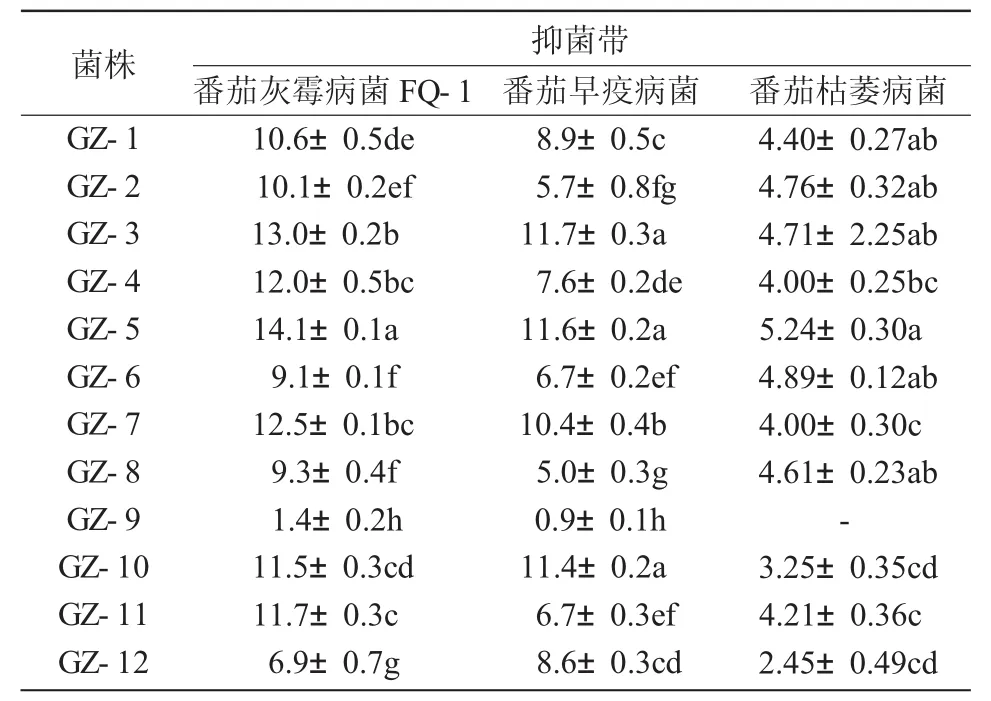
表1 12株内生细菌对不同病原真菌对峙培养抑菌带分析 mm
从表1可以看出,12株内生细菌对3种植物病原菌均表现出不同程度的抑制作用。其中,GZ-5,GZ-3,GZ-7和GZ-10菌株均对3种病原菌表现出较强的抑菌带,尤其GZ-5菌株对番茄灰霉病菌的抑菌作用最强,抑菌带为14.1 mm,GZ-3菌株对番茄灰霉病菌的抑菌带可达13.0 mm。
2.2 拮抗菌株发酵液活性测定分析
由表2可知,12株内生菌的发酵液对番茄灰霉病菌的抑制率最高的是 GZ-5,GZ-3,GZ-7,GZ-4和GZ-11菌株,其抑制率均在80%以上;其中,GZ-5,GZ-3菌株对番茄早疫病菌也具有良好的抑菌活性,其抑制率分别可达85.5%和82.3%,对番茄枯萎病菌的抑制率也在50%以上。总体分析,GZ-5和GZ-3菌株对3种植物病原菌的抑制活性较好,值得进一步研究。
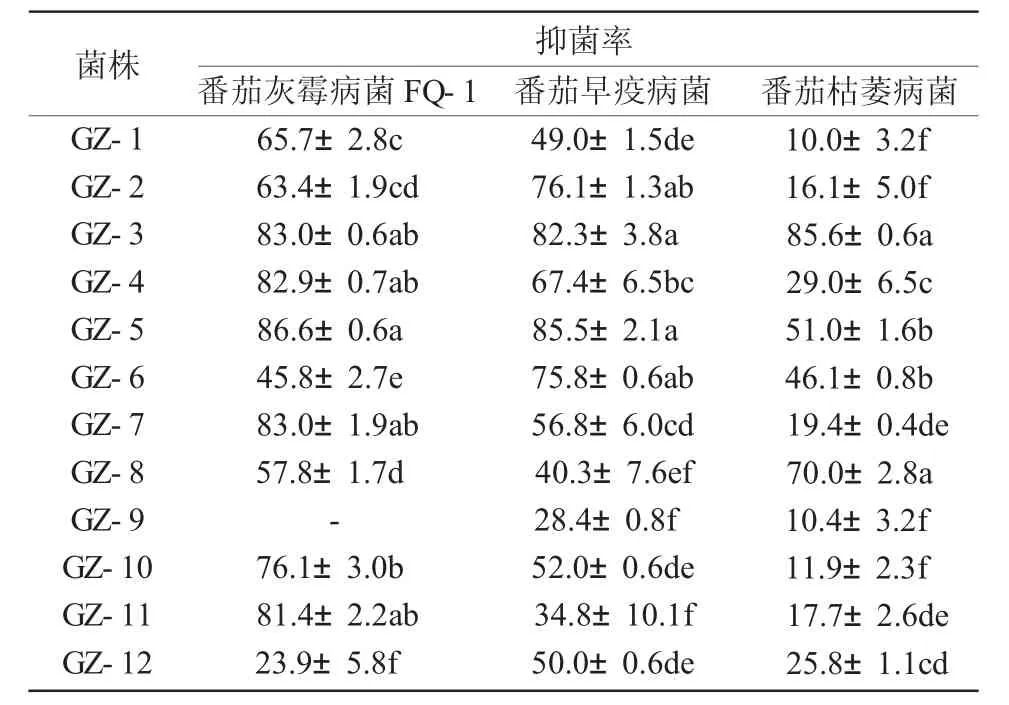
表2 12株内生细菌发酵液对不同病原真菌的抑菌活性分析 %
2.3 GZ-5和GZ-3菌株抑菌活性及抑菌谱分析
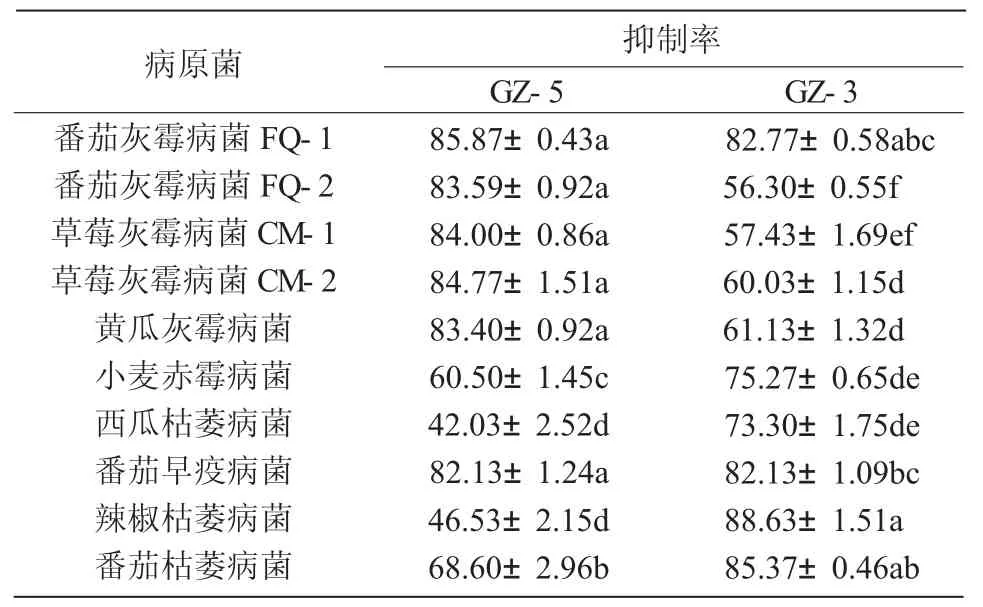
表3 2株内生细菌代谢物对10种植物病原真菌的抑制活性分析 %
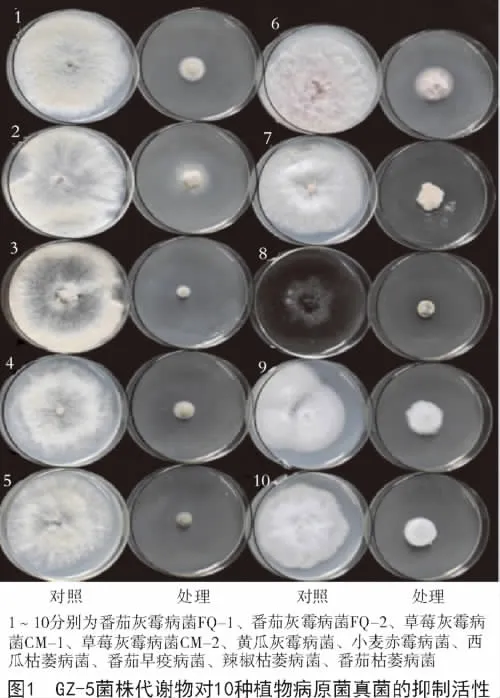
GZ-5和GZ-3菌株代谢物对5种灰霉病菌及其他5种病原真菌的抑菌效果如表3所示,2株内生细菌的代谢物质均对10株病原真菌均有一定的抑制作用。其中,GZ-5菌株对所测病原真菌的抑制率在42.03%~85.87%(图1);GZ-3菌株对所测病原真菌的抑制率在56.30%~88.63%,表明2个菌株具有较好的广谱性,且GZ-5菌株代谢发酵产物对5种灰霉病原菌的抑制率高于GZ-3菌株,GZ-3菌株代谢发酵产物对另外5种病原菌的抑制率高于GZ-5菌株,这还有待于进一步分析。
2.4 GZ-5和GZ-3菌株的分类鉴定结果
2.4.1 形态特征及生理生化反应结果 在NA培养基上,菌株GZ-5的菌落呈米白色,表面褶皱不透明,边缘呈现裂纹。菌株GZ-3的菌落呈米黄色,不透明,不光滑,与培养基接触不紧密。
2个菌株的生理生化特性如表4所示。经接触酶、厌氧性、MR和C/N利用等特性的测定结果表明,2个菌株的生理生化特性均具有芽孢杆菌属(Bacillus)细菌的典型特征。

表4 GZ-3和GZ-5菌株生理生化反应
2.4.2 16S rDNA序列及系统发育分析 PCR扩增产物片段约为1.5 kb,与预期目标大小一致,从GenBank数据库获得相关属及种的16S rDNA基因序列,以16S rDNA基因序列为基础构建系统发育树如图2所示,其中,GZ-5菌株与解淀粉芽孢杆菌聚为一类,与Bacillus amyloliquefaciens(登录号KT381096.1)相似度达100%。GZ-3菌株与地衣芽孢杆菌聚为一类,与Bacillus licheniformis(登录号EF656455.1)相似度为99%。
结合形态观察、生理生化鉴定、16S rDNA序列分析等,初步将GZ-5菌株鉴定为解淀粉芽孢杆菌,GZ-3菌株为地衣芽孢杆菌。
3 结论与讨论
植物内生细菌作为植物有益微生物的重要组成部分,利用其协助宿主植物抵制病原菌侵染已经开展了许多的研究。通过大量的分离、纯化、鉴定测定一些细菌的抑菌活性,发现一些植物内生菌具有一菌多防的效果。曲田丽等[12]从植物合欢叶分离的内生菌H8对6种病原菌都有抑制作用;吴红玉等[13]从核桃分离出1株内生菌,其发酵滤液对多种病原菌都有抑制作用;YANG等[14]从冬凌草中分离出1株对多种病原真菌具有拮抗作用的内生细菌;李宁[15]从油菜中分离出的内生拮抗细菌SF3,SF4均对核盘菌及多种病原真菌有拮抗作用。并且植物内生菌代谢中的抑菌物质具有很好的开发利用价值,为宿主植物抵抗外来病原菌的入侵奠定了基础。GONG等[16]研究表明,内生细菌代谢物中存在可以抑制植物病原真菌的抗菌脂肽;欧雄常等[17]研究表明,红树内生细菌AmS2发酵液甲醇提取物对多种植物病原真菌有抑制作用;李晨楚等[18]研究表明,对多种病原菌有较强抑制作用的枯草芽孢杆菌B43能够产生多种脂肽类抗生素;陈梅春等[19]研究发现,地衣芽胞杆菌FJAT-4产生的抑菌脂肽会致使尖孢镰刀菌菌丝体发育畸形。本研究所筛选的GZ-5菌株及GZ-3菌株经初步鉴定分别为解淀粉芽孢杆菌和地衣芽孢杆菌,2个菌株不仅对灰葡萄孢菌多菌株、尖孢镰刀菌多菌株有较好的拮抗性,而且对所测多种病原真菌具有抑菌活性,但在对不同类病原菌的抑制率上存在差异,具有显著差异性,其具体原因有待于进一步分析。关于2个菌株的发酵条件、抗菌物质类型、抑菌机理等仍需进一步研究。
[1]赵统敏,余文贵,赵丽萍,等.番茄抗灰霉病育种研究进展[J].江苏农业学报,2011,27(5):1141-1147.
[2]高苇,王勇,张春祥.番茄灰霉病拮抗细菌的筛选与鉴定[J].中国植保导刊,2016,36(8):16-19.
[3]乔广行,林秀敏,黄金宝,等.8种杀菌剂对番茄灰霉病菌多重抗药性菌株生物活性测定[J].农药,2013,52(1):57-59.
[4]刘圣明,车志平,陈根强.河南省番茄灰霉病菌对嘧霉胺的抗药性检测[J].农药,2014,53(6):442-444.
[5]刘伟,宋双,沈小英,等.番茄灰霉病拮抗芽孢杆菌LW-6-1的筛选、鉴定及抑菌活性研究[J].西北农林科技大学学报(自然科学版),2013,41(11):73-79.
[6]甘良.4株生防菌对番茄灰霉病的防治及改良菌株F1-35的GFP标记研究[D].杨凌:西北农林科技大学,2015.
[7]慕立义.植物化学保护研究方法[M].北京:农业出版社,1994.
[8]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[9]布坎南R E.伯杰细菌鉴定手册 [M].8版.北京:科学出版社,1984.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11]陈德富.现代分子生物学实验原理与技术[M].北京:科学出版社,2006.
[12]曲田丽,张淑颖,金玉兰.合欢内生菌H8的分离、鉴定及其抗菌代谢物质研究[J].华北农学报,2015,30(1):54-60.
[13]吴红玉,郑美艳,许敏,等.核桃内生菌HT-6发酵滤液的抑菌作用研究[J].山西农业科学,2015,43(10):1315-1317.
[14]YANGK,YUM,SHENYH,et al.Isolation&identification ofentophytic bacterial strain from Rabdosia rubescens&its biocontrol effects against plant pathogens[J].Journal ofMicrobiology,2013,33(1):20-24.
[15]李宁.油菜内生拮抗细菌的筛选及对菌核病菌的抑制作用研究[D].合肥:安徽农业大学,2013.
[16]GONDS K,BERGENMS,TORRES MS,et al.Endophytic Bacillus spp.produce antifungal lipopeptides and induce host defence gene expression in maize[J].Microbiological Research,2015,172(1):79-87.
[17]欧雄常,柳凤,何红,等.红树内生细菌AmS2对多种植物病原真菌的抑制作用[J].广东农业科学,2013,40(5):73-75.
[18]李晨楚,张荣意,康迅,等.枯草芽孢杆菌B43对香蕉枯萎病菌抑菌活性及其活性成分分析 [J].中国南方果树,2017,46(3):57-63.
[19]陈梅春,王阶平,肖荣凤,等.地衣芽胞杆菌FJAT-4脂肽结构鉴定及其对尖孢镰刀菌的抑制作用 [J].微生物学报,2017,57(12):1924-1934.

