血清15与21型蓝舌病病毒的分离与鉴定
李文良,毛 立,杨蕾蕾,许宝军,唐朝忠,杨 恒,郝 飞,张纹纹,邵 坤,李华春,江杰元*
(1.江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,江苏 南京 210014;2.盱眙县动物疫病预防控制中心,江苏 盱眙 211700;3.云南省畜牧兽医科学院,云南 昆明 650224)
【研究意义】虫媒病毒病是一类由媒介昆虫传播的病毒性传染病,对牛羊危害较大的虫媒病毒病包括蓝舌病(Bluetongue, BT)、牛流行热(Bovine ephemeral fever, BEF)、流行性出血病(Epizootic hemorrhagic disease, EHD)、阿卡斑(Akabane, AKA)。蓝舌病是由呼肠孤病毒科环状病毒属的蓝舌病病毒(Bluetongue Virus, BTV)引起的一种严重侵害反刍动物的传染病,OIE将其列为必需报告的疫病,我国将其列为一类传染病[1-2]。随着全球气候的变化和国际贸易的增加,蓝舌病有扩大流行的趋势,世界多地已报道该病的存在,对牛羊养殖业发展构成潜在威胁[2-4]。有必要对其流行分布情况进行调查分析。【前人研究进展】BTV以库蠓为传播媒介,主要感染反刍动物,绵羊最易感,山羊和牛次之。目前已报道BTV至少有27个血清型[4-6]。我国云南、广东、广西、贵州、湖北、安徽、四川、内蒙古、江苏和辽宁等省均检出BTV 血清学阳性动物并分离到病毒,但多为隐性感染,无明显临床症状[7-12]。【本研究切入点】江苏省地处亚热带,地势低平,河湖众多,雨水丰沛,温暖潮湿,适合库蠓等昆虫的滋生和蓝舌病的传播,但近年来对该病的流行分布情况没有研究报道。【拟解决的关键问题】为了解BTV在江苏的流行情况,我们先前对江苏部分地区牛、羊血清样品BTV抗体进行了检测,发现在某些县市抗体阳性率较高,并通过设置阴性监控动物监测血清学抗体转阳情况证明BTV感染的存在[11]。本研究在此基础上,通过监控动物血清学监测,选择抗体转阳的个体血液样品进行RT-PCR检测和病毒分离鉴定,分析病毒及不同血清型的流行情况。
1 材料与方法
1.1 试剂与材料
Transzol UP、一步法RT-PCR试剂盒及大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;限制性内切酶和pMD18-T载体购自大连宝生物工程有限公司;质粒提取试剂盒和琼脂糖凝胶回收试剂盒购自杭州Axygen公司;其他常规试剂为国产分析纯。MEM、M199培养基购自Hyclone公司,胎牛血清购自Gibco公司。10日龄SPF鸡胚购自南京天邦生物技术有限公司。C6/36和BHK-21细胞由云南省热带亚热带动物病毒病重点实验室馈赠。
1.2 监控动物的设置与样品采集
根据流行病学调查结果,选择江苏省盱眙县桂五镇一山羊养殖户(存栏800只)作为监控点,选择血清学阴性(经BTV C-ELISA检测阴性)的山羊5头作为监控动物,与养殖户羊群混合饲养,并打上耳号。2015年5-10月每周采血1次,11月至2016年4月每月采血1次,每次每头动物分别采集肝素抗凝血、EDTA抗凝血、全血各1份。抗凝血置4 ℃保存,血清分离后置-20 ℃保存。
1.3 血清学检测
用云南省热带亚热带动物病毒病重点实验室提供的BTV C-ELISA试剂盒按照说明书检测血清样品中BTV抗体水平[13]。
1.4 RT-PCR检测
选择抗体转阳前2周内的EDTA抗凝血,处理后按照Transzol UP试剂说明书提取RNA,使用引物S6-A/S6-B和S6C /S6-D进行套式PCR检测(表1)。先以提取的RNA为模板,采用RT-PCR扩增。反应体系为20 μl:2×Buffer 10 μl,Enzyme Mix 0.4 μl,S6-A 0.5 μl,S6-B 0.5 μl,ddH2O 4.6 μl,RNA模板4 μl。反应参数为45 ℃ 30 min,94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环,最后72 ℃延伸10 min。然后以RT-PCR产物为模板进行PCR扩增。反应体系为25 μl:10×PCR Buffer 2.5 μl,dNTPs 2 μl,Taq酶0.5 μl,S6-C 1 μl,S6-D 1 μl,ddH2O 17 μl,模板1 μl。反应参数为94 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 20 s,35个循环,最后72 ℃延伸10 min。2 %的琼脂糖凝胶电泳检测目的条带。阳性样品对应的肝素抗凝血用于病毒分离。

表1 RT-PCR检测用引物
1.5 病毒分离
1.5.1 鸡胚接种 吸取0.1 mL肝素抗凝血加1 mL无菌PBS混匀,2000 r/min离心10 min,弃上清,加入0.9 mL灭菌双蒸水,振荡混匀后鸡胚静脉接种0.1 mL,每份血样接种3枚10日龄SPF鸡胚,接种后置于37 ℃培养箱孵育5 d,逐日观察鸡胚的生长和死亡情况。收获24 h以后死亡鸡胚的肝脏。
1.5.2 细胞接种 收获的鸡胚肝放入2 mL无菌EP管中,加入0.9 mL无菌PBS,用注射器(带18G针头)反复吹吸后,2000 r/min离心10 min,取上清液0.2 mL接种于6孔板上的C6/36细胞,37 ℃孵育1 h,加入含2 %胎牛血清M199维持液,28 ℃培养5~7 d。然后吸取细胞悬液接种于6孔板上的BHK-21细胞中,37 ℃孵育1 h,加入含2 %胎牛血清的MEM维持液,逐日观察细胞病变(CPE)。出现病变的细胞样品收获后4 ℃保存,未出现CPE的孔7 d后收获培养物,以2000 r/min离心5 min,取上清液按上述方法继续接种BHK-21细胞传代2代,出现CPE的孔收获置4 ℃保存作后续鉴定,无CPE出现视为阴性。
1.6 分离毒株的鉴定
1.6.1VP7基因检测 按照Transzol UP试剂说明书提取细胞分离物的RNA,使用Anthony等[14]报道的引物S7-FA/S7-RA和S7-FB /S7-RB进行RT-PCR检测(表1)。反应体系为20 μl:2×Buffer 10 μl,Enzyme Mix 0.4 μl,引物各0.5 μl,ddH2O 3.6 μl,RNA模板4 μl。反应参数为45 ℃ 30 min,94 ℃ 5 min,94 ℃ 30 s,48 ℃ 30 s,72 ℃ 1min,35个循环,最后72 ℃延伸10 min。1 %的琼脂糖凝胶电泳检测目的条带。阳性样品对应的肝素抗凝血用于病毒分离。
1.6.2 血清型鉴定 参照Maan等[15]设计的引物对BTV-1、BTV-2、BTV-3、BTV-9、BTV-12、BTV-15、BTV-16、BTV-20、BTV-21、BTV-23的VP2基因序列进行RT-PCR扩增。PCR结束后进行琼脂糖凝胶电泳,观察扩增结果。回收PCR产物,送南京金斯瑞生物科技有限进行测序,利用DNAStar软件分析测序结果并进行BLAST分析。
2 结果与分析
2.1 血清学监测与病毒的分离
用BTV C-ELISA试剂盒对进行血清学监测。6月开始动物血清学检测结果转阳性,至12月,监控动物全部转为阳性。用套式RT-PCR检测转阳前2、1周和转阳本周的血液样品,共检测到8份阳性样品(其中81和83号羊因转阳时间较晚,无转阳前1周和2周的血样)。将对应日期的肝素抗凝血处理后静脉注射10日龄鸡胚,其中24 h内死亡的5枚鸡胚和5 d后仍存活的3枚鸡胚丢弃,接种后第2~5天有16枚鸡胚出现死亡。鸡胚全身不同程度的出血(图1)。将同一样品的死亡鸡胚肝组织混合后匀浆、PBS悬浮、离心,上清接种C6/36细胞传1代转到BHK-21细胞盲传3代。在BHK-21细胞传代到第1、2代分别开始出现CPE,共分离到5份疑似分离物(83号样品未分离成功)。接毒48 h后被感染细胞开始呈圆形、聚集成团,出现空泡化及呈现网状或放射状等典型的CPE,之后大片融合、死亡脱落(图2 B,C)。检测与病毒分离情况见表2。
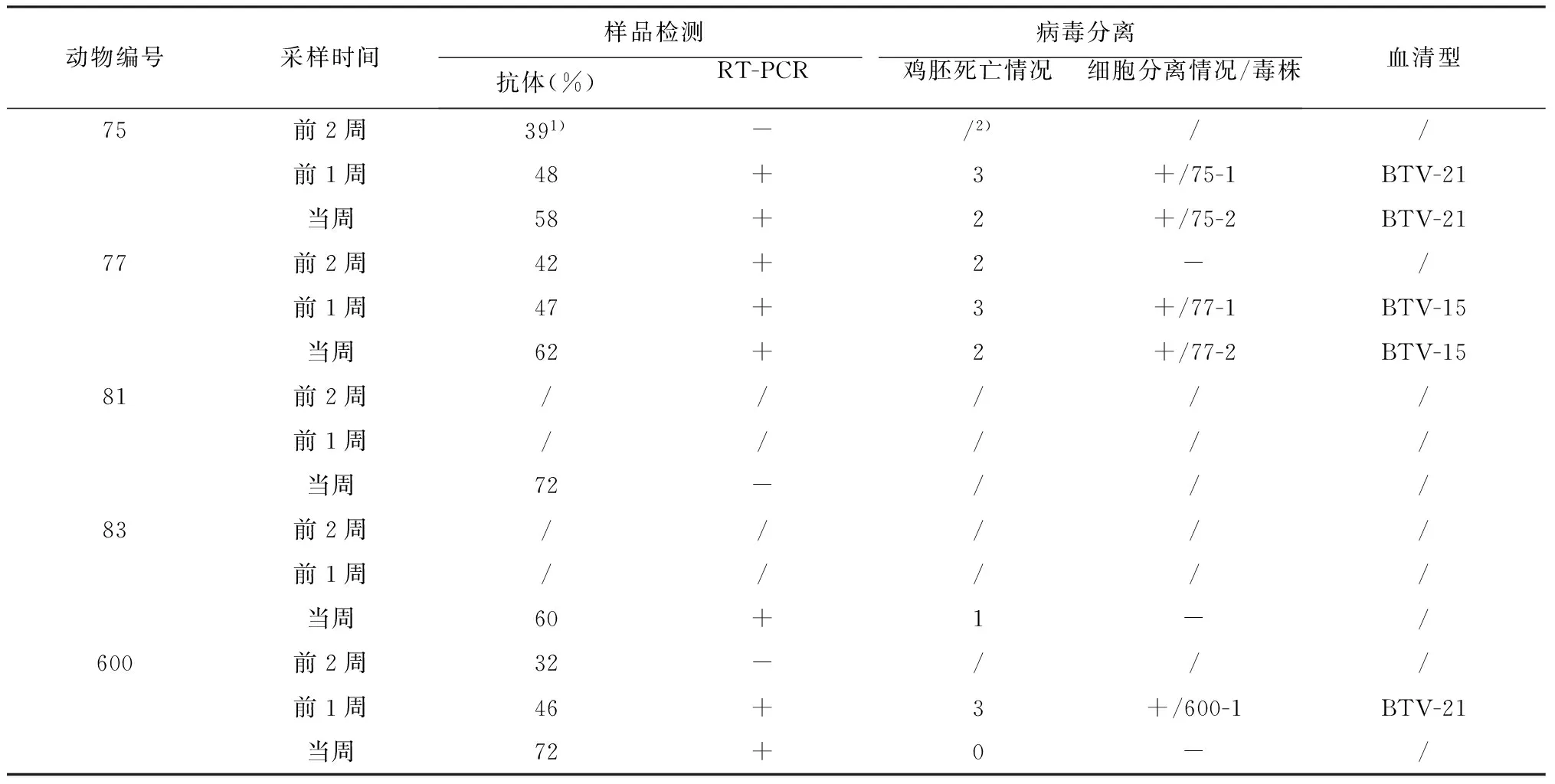
表2 监控动物BTV检测与病毒分离情况
注:1)阻断率大于50 %为阳性;2)未进行试验操作。
Note:1)Blocking rate more than 50 % means positive;2)No experiment is conducted.

A. 阴性对照;B. 接毒后3 d;C.接毒后5 dA.Negative control; B. 3dpi; C.5dpi图2 BTV接种BHK-21的细胞病变Fig.2 CPE observed in BTV inoculated BHK-21
2.2 分离毒株的鉴定
将5份疑似分离物离心取上清,使用引物S7-FA/S7-RA和S7-FB /S7-RB进行RT-PCR鉴定。琼脂糖凝胶电泳显示,5份分离株均在1156 bp位置处出现VP7基因的扩增条带,与理论预期相符(图3 A)。确认5个分离株均为蓝舌病病毒。
进一步对分离毒株的VP2基因片段进行扩增,分别获得约990和1520 bp的目的条带(图3 B)。表明2株(77-1、77-2)为BTV-15、3株(75-1、75-2、600-1)为BTV-21。将测序结果进行Blast检索进一步证实了上述结果。
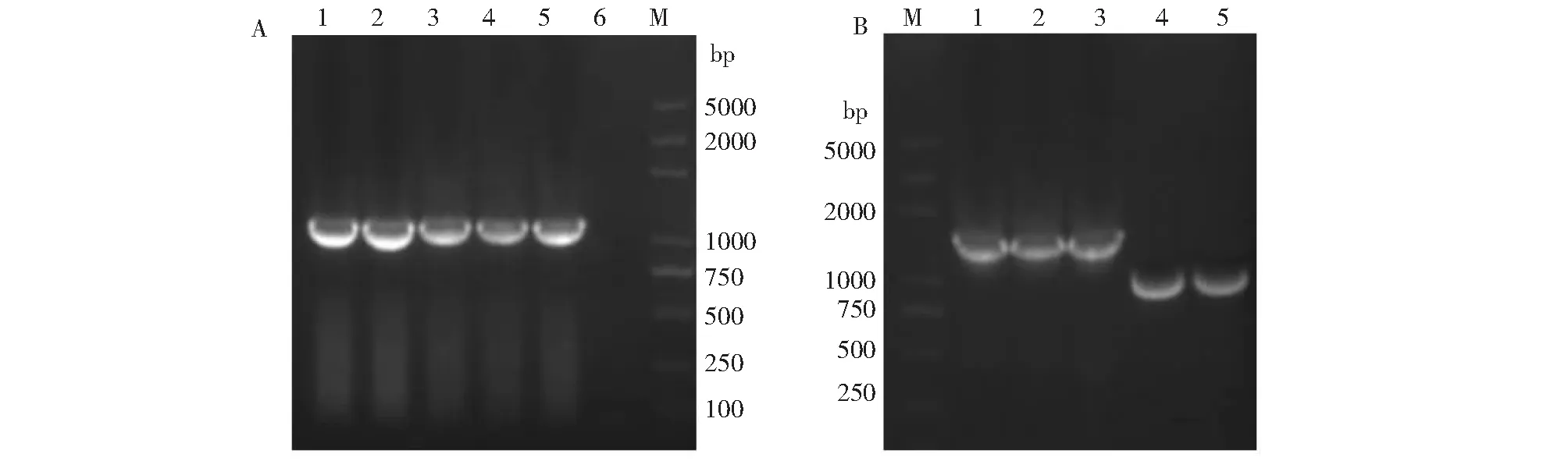
1.75-1;2.75-2;3.600-1;4.77-1;5.77-2;6.阴性对照;M.DNA分子量标准DL2000 plus1.75-1; 2.75-2; 3.600-1; 4.77-1; 5.77-2; 6.Negative control; M.DNA marker DL2000 plus图3 分离毒株的RT-PCR鉴定(A.VP7基因检测;B.VP2基因检测)Fig.3 RT-PCR detection of BTV isolates (A.VP7 gene detection; B.VP2 gene detection)
3 讨 论
我国对动物虫媒病毒包括BTV的研究相对滞后,对BTV的分布、流行情况及变化规律缺乏系统研究。自1979年张念祖等在中国云南省师宗县首次发现蓝舌病并成功分离到病毒后,在1983-1993年间,湖北、安徽、广西、四川省、山西等地先后报道了该病[16]。但之后鲜有研究报道。受全球气候变化及畜产品贸易增长的影响,蓝舌病呈现出向北方、高纬度蔓延的流行趋势。有必要对BTV流行分布情况进行监测。近年来,通过血清学与病原学检测,全国多地报道了该病的存在并分离到不同血清型的病毒[7-12]。
江苏省地处亚热带,气候温暖潮湿,适合虫媒滋生和疾病传播。本研究根据先前调查结果,选择阳性率高的盱眙县某养殖户作为监控点,该地为丘陵山区,靠近洪泽湖,且附近有水库,有利于虫媒病毒的传播。牛、绵羊、山羊感染BTV多为持续性或隐性感染,往往不表现特征性临床症状。这给BTV流行病学监测与防控带来困难。在高阳性率地区投入BTV抗体阴性动物作为“监控动物”或“哨兵动物”,通过监测监控动物感染情况可以评价BTV流行情况。本研究发现在6月之前,BTV抗体一直表现为阴性。6月底开始,监控羊群BTV抗体逐渐转阳,至8月份,已有60 %(3/5)转阳,至12月全部转阳,而且BTV抗体水平稳定直至监测结束。监控动物BTV抗体全部转阳,说明了该地区存在BTV感染,且流行普遍。但本次监控的山羊未出现任何蓝舌病症状,仍可分离到病毒,表明其可携带传播BTV。
由于蓝舌病病毒血清型多,通过病毒中和试验进行血清型鉴定繁琐、费时,且试验要求苛刻。利用PCR方法检测病毒核酸简便、快速、特异性高,已广泛用于病原检测与鉴定。不同血清型病毒的VP2基因序列同源性在29 %~59 %,因此可通过检测VP2基因来进行血清型鉴定并结合测序进行分子流行病学研究[17]。本研究采用先前报道的方法[10, 17],利用RT-PCR扩增分离毒株的VP2基因,并进行测序和BLAST比对分析,将所分离毒株鉴定为BTV-15和BTV-21。
4 结 论
本研究通过在BTV高流行地区设置监控动物的方法分离到5株BTV,经鉴定分别为BTV-15和BTV-21型,丰富了该地区BTV流行病学数据,为进一步开展相关的病原学和流行病学研究提供了科学依据。
参考文献:
[1]陈溥言.兽医传染病学[M]. 北京:中国农业出版社,2006.
[2]苗志强,郑明学,古少鹏,等. 蓝舌病的流行状况及防控措施[J]. 黑龙江畜牧兽医,2010(5):28-30.
[3]Saegerman C, Berkvens D, Mellor P S. Bluetongue epidemiology in the European union[J]. Emerging Infect Dis, 2008, 14(4):539-544.
[4]Feenstra F, van Rijn PA. Current and next-generation bluetongue vaccines: Requirements, strategies, and prospects for different field situations[J]. Crit Rev Microbiol. 2017, 43(2):142-155.
[5]Sun EC, Huang LP, Xu QY, et al. Emergence of a novel bluetongue virus serotype, China 2014[J]. Transbound Emerg Dis, 2016, 63(6):585-589.
[6]Savini G, Puggioni G, Meloni G, et al. Novel putative Bluetongue virus in healthy goats from Sardinia, Italy[J]. Infect Genet Evol. 2017, 51: 108-117.
[7]覃绍敏,白安斌,吴健敏,等. 广西山羊蓝舌病血清学调查及流行区域分布的影响因素分析[J]. 中国预防兽医学报,2011,33(1):28-31.
[8]王 慧,覃 岚,尹 鑫,等. 2012年贵州羊蓝舌病血清流行病学调查及影响因素分析[J]. 中国动物检疫,2013,30(11):52-56.
[9]吕敏娜,林丽琴,陈琴苓,等. 广东地区蓝舌病流行病学初步研究[J]. 中国预防兽医学报,2015,377:499-501.
[10]林丽琴,吕敏娜,孙铭飞,等. 广东某奶牛场蓝舌病病毒分离株血清型与基因型的鉴定[J].中国兽医科学,2015,45(6):615-621.
[11]毛 立,李文良,杨蕾蕾,等. 江苏省部分地区牛羊蓝舌病血清学调查及监控[J]. 西南农业学报,2015,28(6):2784-2787.
[12]张胜男,李华春,朱建波,等. 2015 年内蒙古地区蓝舌病及流行性出血热流行病学调查及血清型鉴定[J]. 中国预防兽医学报,38(12):939-943.
[13]苗海生,李 乐,朱建波,等. 蓝舌病病毒阻断ELISA抗体检测方法的建立[J]. 中国预防兽医学报,2014,36(2):111-115.
[14]Anthony S, Jones H, Darpel KE, et al. A duplex RT-PCR assay for detection of genome segment 7 (VP7 gene) from 24 BTV serotypes[J]. J Virol Methods, 2007, 141(2):188-197.
[15]Maan NS, Maan S, Belaganahalli MN, et al. Identification and differentiation of the twenty six bluetongue virus serotypes by RT-PCR amplification of the serotype-specific genome segment 2[J]. PLoS One, 2012, 7(2):e32601.
[16]肖 雷,孟锦昕,李 楠,等. 云南省师宗县蓝舌病病毒的分离及鉴定[J]. 中国动物传染病学报,2014,22(4):1-6.
[17]Maan S, Maan NS, Samuel AR, et al. Analysis and phylogenetic comparisons of full-lengthVP2 genes of the 24 bluetongue virus serotypes[J]. J Gen Virol, 2007, 88(2):621-630.

