梅毒螺旋体黏附素Tp0751核酸菌影的构建及免疫原性研究*
张佳俐 曹二龙 曹龙古 赵飞骏 余 坚 唐一之 符 波 段 武 曾铁兵
(南华大学病原生物学研究所,衡阳 421001)
梅毒是由梅毒螺旋体(Treponemapallidum,Tp)感染引起的一种严重危害成人和新生儿健康[1]的性传播疾病,并促进艾滋病传播[2]。梅毒全球流行,近年来疫情呈上升趋势[3],尤其在男-男同性性行为者[4]和孕妇[5]中,亟待疫苗的研发。目前尚无疫苗防控梅毒,阻碍疫苗研究的因素主要包括:Tp不可人工培养;Tp外膜蛋白(Outer membrane protein,OMP)稀少[6];梅毒疫苗方法学相对其他病原体疫苗方法学落后;研究者较少[7,8]。
Tp的OMP(免疫应答主要靶位)稀少、缺乏脂多糖,也不产生明显外毒素,但具有强大侵袭力,能通过生殖道黏膜入侵并经血流播散,因此抗黏附作用一直成为梅毒疫苗的研究焦点[7,9]。Tp0751是目前研究最多和最重要的Tp黏附素[7-9],能吸附血管内皮细胞[10]和细胞外基质(Extracecellular matrix,ECM)[11]并降解后者[12],导致Tp播散[10,12];最近观察到,以重组Tp0751蛋白免疫新西兰兔后宿主器官的Tp负荷明显降低[13],而且Tp0751在各临床株间高度保守[13],以上表明Tp0751是很有希望的梅毒疫苗候选分子。
目前普遍认为,理想的梅毒疫苗应该能持久诱发系统和局部黏膜的Th1和Th2混合型应答[7-9]。而作为第三代疫苗的核酸疫苗,在应用适当佐剂/DNA递送系统条件下可诱导上述特点的免疫应答。为此,本研究构建Tp0751的核酸疫苗,并以新型菌影(Bacterial ghost,BG)作为天然佐剂和DNA递送系统,应用DNA初免-蛋白加免的异源加免(Heterologous prime-boost) 策略,观察其诱导小鼠产生体液免疫和细胞免疫应答的能力,为发展梅毒新型疫苗奠定基础。
1 材料与方法
1.1材料
1.1.1质粒、菌株、细胞株与实验动物 质粒pcDNA3.1(+)、Tp(Nichols株)、空大肠埃希菌菌影(空EBG)、E.coliJM109菌株、鼠源性巨噬细胞Raw264.7均为本研究所保存[14]。雌性BALB/c小鼠购自湖南斯莱克景达实验动物有限公司。
1.1.2主要试剂 Tp感染兔血清、重组Tp0751蛋白(rTp0751)为本研究所保存;Taq DNA聚合酶、BamHⅠ、XhoⅠ限制性内切酶、T4 DNA连接酶购自美国NEB公司;Tp DNA提取试剂盒购自天根生化科技(北京)有限公司,质粒提取试剂盒、DNA纯化试剂盒为美国Omega生物技术公司产品;HRP-羊抗兔IgG、HRP-羊抗鼠IgG与SIgA为美国Proteintech公司产品;CCK-8淋巴细胞增殖试剂盒购自海门碧云天生物技术研究所,IFN-γ ELISA试剂盒为美国eBioscience公司产品。
1.2方法
1.2.1pcD/Tp0751真核表达载体构建 根据GenBank数据库,设计去除信号肽序列的Tp0751扩增引物,P1:5′CGCGGATCCCGGGACACCGCCGCA 3′(划线为BamHⅠ酶切位点);引物 P2:5′CCGCTC-GAGTTAGGGCGAAGGAGCACTAGCC 3′(划线为XhoⅠ酶切位点),引物由上海生工公司合成。以Tp DNA为模板(本所保存),PCR扩增Tp0751基因,将其克隆入pcDNA3.1(+)质粒,构建成真核表达重组体pcD/Tp0751,酶切及测序鉴定(广州英潍捷基公司测序)。
1.2.2pcD/Tp0751装载菌影 在制备的100 μl pcD/Tp0751中,依次加入用温控法预先制备的100 μlE.coliJM109空菌影(50 mg/ml)、250 μl CaCl2(0.1 mol/L),最后加PBS(0.01 mol/L,pH7.4)至总体积1.0 ml,同时用核酸蛋白仪测定质粒浓度(C装载前),混匀后24℃孵育30 min,然后12 000 r/min离心5 min,取上清测定质粒浓度(C装载后),计算质粒装载率:η′=(1-C装载后/C装载前)×100%。
1.2.3重组质粒转染RAW264.7细胞与表达蛋白鉴定 取装载pcD/Tp0751的菌影100 μl转染RAW264.7细胞,培养24 h。提取转染细胞蛋白,电泳转膜,以Tp感染兔血清(1∶100稀释)为一抗,HRP-羊抗兔IgG(1∶2 000稀释)为二抗,Western blot鉴定目的蛋白表达。
1.2.4动物免疫与血清收集 选用6~7周龄的BALB/c雌性小鼠48只,随机分为6组,每组8只,双侧股四头肌等量肌注,每次100 μl,间隔两周免疫一次,共三次。A、B、C组为对照组,分别注射PBS、空EBG[1 mg/(只·次)]、空质粒pcD[20 μg/(只·次)],D、E、F组为实验组,分别注射裸pcD/Tp0751[20 μg/(只·次)]、pcD/Tp0751-BG[1 mg/(只·次),约含20 μg DNA]、pcD/Tp0751-BG[免疫2次,1 mg/(只·次)]+rTp0751[加免1次,0.3 mg/(只·次)]。首次免疫后第2、4、6、12周,采集小鼠尾静脉血分离血清,同时收集生殖道冲洗液,-80℃保存备用。
1.2.5特异性血清IgG与生殖道SIgA检测 用rTp0751(10 μg/ml)以每孔100 μl包被96孔酶标板,以HRP-羊抗鼠IgG/SIgA(1∶10 000稀释)为二抗,间接ELISA分别检测待测血清(1∶100稀释)和生殖道冲洗液(1∶50稀释)中特异性IgG和SIgA的A450值。测定F组在末次加免后IgG和SIgA效价。
1.2.6淋巴细胞增殖试验 首次免疫后第12周处死小鼠,无菌取小鼠脾脏,制备淋巴细胞,调整细胞数至1×104/孔,阳性对照每孔以100 μg ConA、阴性对照组加PBS、实验组每孔以10 μg rTp0751刺激培养48 h。培养结束前4 h,每孔加入CCK-8溶液10 μl(5 mg/ml),培养至结束,酶标仪测定A450值,计算刺激指数(SI)=刺激组A450值/无刺激阴性对照组A450值。
1.2.7IFN-γ分泌水平检测 调整淋巴细胞数至1×105/孔,每孔以10 μg rTp0751刺激培养48 h,离心细胞,收集上清液,用ELISA试剂盒检测IFN-γ水平,测定A450值,以标准品做标准曲线,计算IFN-γ含量。
1.3统计学分析 实验数据用SPSS13.0软件进行统计学分析,每组标本取平均值,应用t-Test检验,P<0.05表示差异有统计学意义。
2 结果
2.1真核表达载体构建鉴定与菌影装载率 真核重组表达质粒pcD/Tp0751经双酶切得到大小与预期位置相符的5 400 bp和555 bp两个片段(图1),测序结果与公布Tp0751序列完全一致,表明真核重组质粒构建成功。重组质粒对空菌影的装载率η′=(1-15.6/65.4)×100%=76.1%。
2.2pcDNA3.1(+)/Tp0751真核重组蛋白鉴定 WB结果显示,重组质粒装载的菌影作用RAW264.7细胞24 h后,细胞表达的目的蛋白与Tp感染兔血清出现了明显的特异性反应(图2),表明重组质粒转染细胞后成功表达目的蛋白。
2.3特异性抗体水平 D、E、F实验组小鼠特异性血清 IgG与生殖道SIgA水平均随免疫次数增加而增加,各时间点均显著高于三个对照组(P<0.01),于末次加免后第8周(初免后第12周)达到峰值,此时F组IgG与SIgA效价分别为1∶102 400与1∶12 800;首次加免2周(初免后第4周)及以后,E、F组均显著高于D组(P<0.01);末次加免2周(初免后第6周)及以后,F组显著高于E组(P<0.01)(图3A、B)。
2.4小鼠脾淋巴细胞增殖 首次免疫后第12周(末次加免后第8周),D、E、F组的SI均显著高于A、B和C组(P<0.01),E、F组均显著高于D组(P<0.01),F组高于E组(P<0.05)(表1)。
2.5鼠脾淋巴细胞分泌IFN-γ水平 首次免疫后第12周(末次加免后第8周),D、E、F组的IFN-γ水平均显著高于A、B和C组(P<0.01),E、F组均显著高于D组(P<0.01),F组高于E组(P<0.05)(图4)。
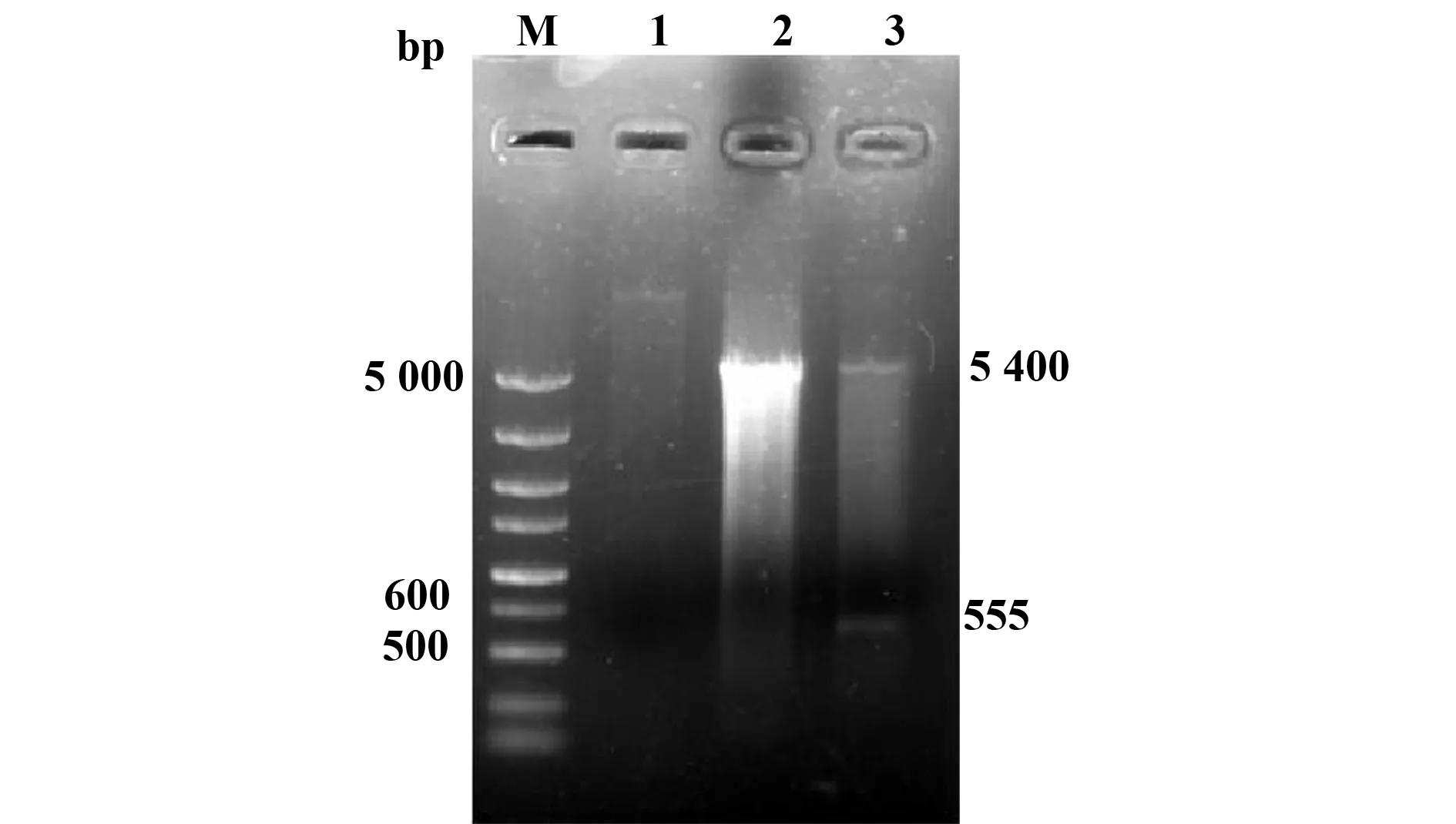
图1 pcDNA3.1/Tp0751重组质粒的酶切鉴定Fig.1 Identification of recombinant pcDNA3.1/Tp0751 digested with BamHⅠ and Xho ⅠNote: M.DNA marker;1.Negtive control;2.Empty pcDNA3.1;3.Recombinant pcDNA3.1/Tp075.

图2 Tp0751真核重组蛋白的Western blot鉴定Fig.2 Identification of eukaryotic expression of recombi-nant Tp0751 by Western blotNote: 1.RAW264.7 cells untreated with pcD/Tp0751-BG;2,3.RAW264.7 cells treated with pcD/Tp0751-BG;4.RAW264.7 cells treated with empty pcDNA3.1.

图3 不同时间点各免疫组小鼠特异性血清IgG(A)及生殖道SIgA(B)Fig.3 IgG and SIgA against Tp0751 in vaccinated mice at different time pointNote: Vs groups A,B,C,*.P<0.01;vs group D,#.P<0.01;vs group E,△.P<0.01.
表1小鼠脾淋巴细胞刺激指数(SI)
Tab.1StimulationIndexofspleenlymphocytesofimmun-izedmice

GroupsSIA:PBS1.019±0.135B:EBG1.079±0.025C:pcDNA1.032±0.031D:pcD/Tp07511.447±0.1111)E:pcD/Tp0751-BG9.896±0.2591)2)F:pcD/Tp0751-BG+rTp075111.985±0.3191)2)3)G:ConA2.318±0.145
Note:Vs groups A,B,C,1)P<0.01;vs group D,2)P<0.01;vs group E,3)P<0.05.

图4 小鼠脾淋巴细胞分泌IFN-γ水平(pg/ml)Fig.4 Levels of IFN-γ produced by spleen lymphocytes in vaccinated mice(pg/ml)Note: Vs groups A,B,C,*.P<0.01;vs group D,#.P<0.01;vs group E,△.P<0.05
3 讨论
重组蛋白疫苗是目前国外唯一应用的梅毒疫苗类型,但存在一些不足[7],如通过E.coli高水平表达时可能难以准确保持天然蛋白的构象;易降解,纯化技术要求高;以常规佐剂免疫难以诱导局部黏膜的免疫应答等,因此需发展其他类型的疫苗[7-9]。核酸疫苗是近20年来发展起来的第三代疫苗。与传统疫苗相比,核酸疫苗具有明显的优势[15,16]:能模拟病原体自然感染,在宿主细胞内表达近乎天然构象的目的蛋白,不仅能持久诱导体液免疫,而且能产生强有力的细胞免疫。此外,DNA疫苗还具有制备简单、使用安全等诸多优点成为近年研究的热点,具有良好的应用前景。
核酸疫苗在真核细胞中的有效转染和表达目的蛋白是诱导免疫应答的前提。本研究中 pcD/Tp0751真核质粒在转染真核细胞RAW264.7中能有效表达目的蛋白,为下一步研究提供了基础。
目前普遍认为,Th1型免疫应答是早期清除Tp的主要机制[7-9],通过CD4+Th1细胞等分泌IFN-γ为主[17]的Th1型细胞因子活化巨噬细胞,促进其吞噬杀伤Tp[18]。本研究发现,pcD/Tp0751-BG同源加免和异源加免均在末次加免后8周仍能诱导非常明显的小鼠脾淋巴细胞增殖和IFN-γ分泌,表明Tp0751的核酸菌影能有效诱导小鼠系统性细胞免疫应答。
体液免疫应答也是必不可少的[7-9],局部黏膜特异性抗黏附素的SIgA能早期阻止Tp从生殖道黏膜吸附上皮细胞而入侵[8],而血清中特异性IgG等能防止Tp黏附血管内皮细胞从而向远处组织播散,还能特异性介导巨噬细胞靶向吞噬杀伤Tp(调理吞噬)[19],与细胞免疫应答协同作用最终清除Tp[7-9]。本研究发现,pcD/Tp0751-BG同源加免和异源加免诱导IgG与SIgA水平均随着免疫次数的增加而上升,于末次加免后8周到达峰值,水平最高的异源加免组效价能分别达到1∶102 400和1∶12 800,表明Tp0751的核酸菌影能有效诱导小鼠系统性与黏膜的体液免疫应答。
质粒DNA本身免疫原性低,选择合适的DNA递送系统和佐剂对有效诱导应答十分关键。近年,菌影(BG)作为理想的天然抗原(DNA或蛋白)递送系统和佐剂引起极大关注,目前已被广泛地用于沙眼衣原体、幽门螺杆菌、HIV等许多病原体的疫苗[20,21]。BG是革兰阴性细菌被温控法或化学法裂解后失去胞浆成分而保留完整细胞壁和细胞膜结构和天然形态的细菌空壳。除了装载重组蛋白外,BG还具有强大的外源DNA装载能力,每个BG可在裂解通道中装载数千个DNA拷贝,而且装载简单高效[20],在本研究中,BG装载重组DNA质粒的装载率达到了76%,显示出高效的装载能力;同时,BG保留了颗粒状活菌天然的表面抗原结构(脂多糖、肽聚糖、菌毛等),APC表面的模式识别受体很容易将其识别和靶向性摄入而被充分活化,继而激活T细胞启动适应性免疫应答[20]。因此,BG 也是良好的天然免疫佐剂。菌影这些特性使其能增强DNA/重组蛋白疫苗诱导系统和局部的细胞免疫和体液免疫应答水平,且能维持持久免疫记忆[22]。本研究发现,pcD/Tp0751-BG同源加免和异源加免诱导体液免疫和细胞免疫的水平均明显高于不加佐剂的裸pcD/Tp0751,而且在末次免疫后8周能达到最高水平,表明能维持较好的免疫记忆。
为进一步提供DNA疫苗诱导免疫应答水平,本研究设立了DNA初免两次、继以重组Tp0751蛋白加免一次的异源加免(prime-boost)组。结果显示,与三次DNA同源加免组相比,异源加免诱导的体液免疫应答和细胞免疫应答均更高。当前DNA初免-蛋白加免(异源加免)被认为是理想的免疫策略,比同一蛋白或DNA的同源加免能诱导更强的免疫应答,但机制不甚明确,可能是DNA疫苗与蛋白疫苗以不同的机制刺激特异性应答。DNA疫苗能诱导细胞免疫应答,同时也高效诱导记忆性B细胞产生,当以蛋白抗原加免时,直接活化记忆性B细胞[23]。
本实验首次构建Tp0751的真核重组菌影,有效诱导了小鼠系统和黏膜体液免疫应答及细胞免疫应答,下一步拟对免疫鼠进行抗Tp攻击感染实验以验证其免疫保护性,为进一步研发新型梅毒疫苗奠定基础。
参考文献:
[1] Lawn JE,Blencowe H,Waiswa P,etal.Stillbirths:rates,risk factors,and acceleration towards 2030 [J].Lancet,2016,387(10018):587-603.
[2] Douglas JM.Penicillin treatment of syphilis:clearing away the shadow on the land [J].JAMA,2009,301(7):769-771.
[3] Abara WE,Hess KL,Neblett Fanfair R,etal.Syphilis trends among men who have sex with men in the United States and Western Europe:A systematic review of trend studies published between 2004 and 2015 [J].PLoS One,2016,11(7),e0159309.
[4] Peterman TA,Su J,Bernstein KT.Syphilis in the United States:on the rise?[J].Exp Rev Anti Infect Ther,2015,13(2):161-168.
[5] Wijesooriya NS,Rochat RW,Kamb ML,etal.Global burden of maternal andcongenital syphilis in 2008 and 2012:a health systems modelling study[J].Lancet Glob Health,2016,4:e525-e533.
[6] LaFond RE,Lukehart SA.Biological basis for syphilis [J].Clin Microbiol Rev,2006,19(1):29-49.
[7] Cullen PA,Cameron CE.Progress towards an effective syphilis vaccine:the past,present and future [J].Exp Rev Vaccines,2006,5(1):67-80.
[8] Lithgow KV,Cameron CE.Vaccine development for syphilis [J].Expert Rev Vaccines,2017,16(1):37-44.
[9] Cameron CE,Lukehart SA.Current status of syphilis vaccine development:need,challenges,prospects [J].Vaccine,2014,32(14):1602-1609.
[10] Kao WA,Pětrosová H,Ebady R,etal.Identification of Tp0751 (Pallilysin) as atreponemapallidumvascular adhesin by heterologous expression in the lyme disease spirochete [J].Sci Rep,2017,7(1):1538.
[11] Cameron CE,Brouwer NL,Tisch LM,etal.Defining the interaction of thetreponemapallidumadhesin Tp0751 with laminin[J].Infect Immun,2005,73(11):7485-7494.
[12] Houston S,Hof R,Honeyman L,etal.Activation and proteolytic activity of thetreponemapallidummetalloprotease,pallilysin[J].PLoS Pathog,2012,8(7):e1002822.
[13] Lithgow KV,Hof R,Wetherell C,etal.A defined syphilis vaccine candidate inhibits dissemination oftreponemapallidumsubspecies pallidum [J].Nat Commun,2017,8:14273.
[14] 江银波,曹二龙,朱 洪,等.梅毒螺旋体粘附素Tp0751重组菌影的构建与鉴定[J].中南医学科学杂志,2016,44(2)121-124,129.
Jiang YB,Cao EL,Zhu H,etal.Constructiong and identification of recombinant E.Coli bacterial ghosts expressingtreponemapallidumadhesin Tp 0751[J].Medical Science J Central South China,2016,44(2):121-124,129.
[15] Saade F,Petrovsky N.Technologies for enhanced efficacy of DNA vaccines[J].Exp Rev Vaccines,2012,11(2):189-209.
[16] 李开铭,谢梅花,余敏君,等.B群脑膜炎奈瑟菌外膜蛋白NMB0315核酸疫苗的免疫活性和免疫保护作用初步研究[J].中国免疫杂志,2015,31(12):1648-1653,1658.
Li KM,Xie MH,Yu M,etal.Immunocompetence and immunoprotection of a DNA vaccine NMB0315 against N.meningitidis sergroup B in mice[J].Chin J Immunol,2015,31(12):1648-1653,1658.
[17] Leader BT,Godornes C,VanVoorhis WC,etal.CD4+lymphocytes and gamma interferon predominate in local immune responses in early experimental syphilis[J].Infect Immunol,2007,75(6):3021-3026.
[18] Baker-Zander SA,Lukehart SA.Macrophage-mediated killing of opsonizedTreponemapallidum[J].J Infect Dis,1992,165(1):69-74.
[19] Cruz AR,Ramirez LG,Zuluaga AV,etal.Immune evasion and recognition of the syphilis spirochete in blood and skin of secondary syphilis patients:two immunologically distinct compartments[J].PLoS Negl Trop Dis,2012,6(7):e1717.
[20] Muhammad A,Champeimont J,Mayr UB,etal.Bacterial ghosts as carriers of protein subunit and DNA-encoded antigens for vaccine applications[J].Exp Rev Vaccines,2012,11(1):97-116.
[21] Langemann T,Koller VJ,Muhammad A,etal.The bacterial ghost platform system:production and applications[J].Bioeng Bugs,2010,1(5):326-336.
[22] Eko FO,Ekong E,He Q,etal.Induction of immune memory by a multisubunit chlamydial vaccine[J].Vaccine,2011,29(7):1472-1480.
[23] Kardani K,Bolhassani A,Shahbazi S.Prime-boost vaccine strategy against viral infections:Mechanisms and benefits[J].Vaccine,2016,34(4):413-423.