大豆糖蛋白的抗氧化特性
夏秀芳,王 博,郑幸子,邓思杨,潘 男,王 浩*
20世纪初美国蛋白质委员会首次对糖蛋白进行描述:主要是指由蛋白质分子和除核酸外的包含碳水化合物基团的物质共同组成的一类复合物[1-2]。在食品的加工和贮藏过程中,氨基化合物和羰基化合物之间极易发生非酶褐变反应,糖蛋白产物中糖链与蛋白质的氨基酸残基通过共价键相连,形成特殊的三级、四级结构,国内外很多研究发现,糖蛋白能够有效地提高蛋白质的乳化性、凝胶性和溶解性等。肖连冬等[3]以大豆分离蛋白(soy protein isolate,SPI)与蔗糖为研究材料,在一定浓度下,经糖基化反应得到的糖蛋白乳化性逐渐升高,增加了体系的黏稠度。刘颖等[4]以南极磷虾为研究材料,实验得到的南极磷虾糖蛋白具有更好的乳化稳定性、起泡性、溶解性等功能特性。Nakamura等[5]合成的溶菌酶-葡萄糖的共价复合物具有很好的乳化特性,同时也提高了溶菌酶的抗菌范围。Moreno等[6]利用酪蛋白和乳糖在40 ℃下合成的糖蛋白乳化性得到了显著的提高。因此糖蛋白作为一种食品添加剂,能够满足人们对蛋白质的一些特殊需求,如今已经广泛地应用于食品加工等领域。
随着对蛋白组学研究的深入,国际上很多学者对各种糖和蛋白质反应得到的糖蛋白进行了深入的研究,结果发现糖蛋白的抗氧化性和抗菌性得到了不同程度的提高。陈黎洪等[7]在对金华火腿研究时,对其副产物酶解物与木糖反应得到的糖蛋白的抗氧化性进行测定,结果发现,随着反应的深入,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)清除率与还原能力逐渐增强。马志玲等[8]采用不同种类氨基酸和葡萄糖进行模式美拉德反应得到的糖蛋白,反应时间越长,体系的褐变程度加深,糖蛋白的抗氧化性越强。项惠丹等[9]在研究酪蛋白和SPI与多种还原糖发生反应时发现,不同反应条件下的产物都具有较强的抗氧化性。Deepak等[10]对鳞茎中29 kDa糖蛋白的抗真菌活性进行研究,发现糖蛋白糖部分被高碘酸氧化后失去抗真菌活性,说明糖蛋白糖部分在抗真菌活性中起到重要的作用。以上研究大多集中在糖蛋白抗氧化性方面,但是关于抗氧化性提高的机理方面研究很少,本研究将以SPI和葡萄糖为原料,研究不同反应条件下糖蛋白抗氧化性的变化及机理,为深入研究大豆糖蛋白及其在食品中的应用提供理论支持。
1 材料与方法
1.1 材料与试剂
脱脂低温豆粕 黑龙江省大自然粮油集团有限公司;β-巯基乙醇、DPPH、Tris 美国Sigma公司;十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)标准分子蛋白 大连宝生物科技有限公司;三氯乙酸、磷酸氢二钠、铁氰化钾、磷酸二氢钠等均为国产分析纯试剂。
1.2 仪器与设备
DK-8B电热恒温水浴锅 上海精宏实验设备有限公司;JJ-1精密增力电动搅拌器 常州国华电器有限公司;AL-104型精密电子天平 梅特勒-托利多(上海)仪器设备有限公司;AM-1磁力搅拌器 北京鼎昊源实验仪器有限公司;GL-21M冷冻离心机 湖南湘仪实验室仪器开发有限公司;Mini电泳仪 美国伯乐公司;FD-2A冷冻干燥机 北京博医康试验仪器有限公司;UT-1800紫外-可见分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1 SPI的制备
取200 g脱脂低温豆粕粉与15 倍体积的去离子水混合,用2 mol/L NaOH溶液调pH值至8.0,搅拌2 h后,将其悬浮液在4 ℃条件下6 000 r/min离心20 min,取上清液用2 mol/L HCl溶液调pH值至4.5。静置后在4 ℃条件下6 000 r/min离心10 min。取蛋白沉淀分散于5 倍体积水中并用2 mol/L NaOH溶液调pH值至7.0,冷冻干燥后测定蛋白含量,置于4 ℃冰箱保存备用。
1.3.2 大豆糖蛋白的制备
SPI和葡萄糖按蛋白与糖的质量比1∶1放于烧杯中用蒸馏水溶解,使蛋白质量分数为8%,保鲜膜密封,将混合液分别放入70、80 ℃和90 ℃的恒温水浴锅中反应,分别在0、1、2、3、4、5、6 h取样,将样品冷冻干燥,测定样品蛋白含量,备用。
1.3.3 还原能力测定
采用He Yuehua等[11]的方法,并稍作修改。取0.5 mL大豆糖蛋白,加入2.5 mL浓度为0.2 mol/L、pH值为6.6的磷酸盐缓冲液和2.5 mL质量分数为1%的铁氰化钾,充分混合。将混合物在50 ℃水浴下保温20 min,再加入2.5 mL质量分数10%的三氯乙酸溶液,然后将混合物在3 000×g下离心10 min。取2.5 mL上层清液,加入2.5 mL蒸馏水和0.5 mL质量分数0.1%的三氯化铁溶液,混合均匀,在700 nm波长处测定其吸光度,以吸光度表征还原能力。
1.3.4 羟自由基清除能力测定
参照金鸣等[12]的方法,取1 mL 0.75 mmol/L的邻二氮菲溶液,加入2 mL pH 7.4磷酸盐缓冲液和1 mL蒸馏水,充分混匀,再加入1 mL 0.75 mmol/L硫酸亚铁溶液和1 mL体积分数0.01%过氧化氢溶液,37 ℃保温60 min,于536 nm波长处测得吸光度Ap;用1 mL蒸馏水代替1 mL过氧化氢溶液,测得吸光度AB,1 mL大豆糖蛋白溶液代替蒸馏水,测得吸光度As。采用式(1)计算大豆糖蛋白对羟自由基的清除率。

1.3.5 DPPH自由基清除能力测定
参照Saiga等[13]的方法,并略作修改。取大豆糖蛋白溶液0.5 mL和3.5 mL 1×10-4mol/L DPPH无水乙醇溶液加入同一带塞试管中摇匀,在室温下密闭静置30 min,用无水乙醇作参比,于517 nm波长处测吸光度。根据公式(2)计算大豆糖蛋白对DPPH自由基的清除率。
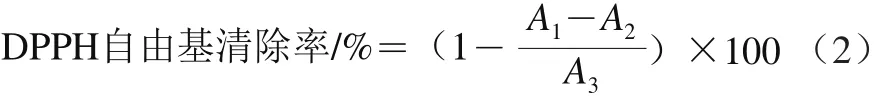
式中:A1为加大豆糖蛋白后DPPH溶液的吸光度;A2为大豆糖蛋白溶液的吸光度;A3为未加大豆糖蛋白时DPPH溶液的吸光度。
1.3.6 游离氨基含量的测定
参照Benjakul等[14]的方法并稍作修改。取大豆糖蛋白溶液125 μL,与2.0 mL 0.212 5 mol/L、pH 8.2的磷酸盐缓冲液混合,再加入体积分数0.01%的2,4,6-三硝基苯磺酸溶液1.0 mL。充分混合后,在50 ℃水浴中避光保温30 min。再加入2.0 mL 0.1 mol/L的Na2SO3终止反应,冷却15 min,于420 nm波长处测定吸光度。以L-亮氨酸为标准物,重复以上步骤得出标准曲线,并计算样品中的游离氨基含量。
1.3.7 褐变程度的测定
准确称取25 mg大豆糖蛋白溶于5 mL水中,以水作空白样,于420 nm波长处测定吸光度,用吸光度来表示大豆糖蛋白的褐变程度。
1.3.8 紫外吸收光谱的测定
以去离子水为空白,在室温下测定各处理组大豆糖蛋白(1 mg/mL)的紫外吸收及其二阶导数图谱。
1.3.9 SDS-PAGE分析
参照Xia Xiufang等[15]的方法,10%分离胶,5%浓缩胶,上样量为12 µL;开始电泳时电压为80 V,待样品进入分离胶后改为120 V;取出胶片用考马斯亮蓝染色30 min,用甲醇-冰醋酸脱色液脱至透明。电泳胶片置于凝胶成像仪摄像,结合Tanon软件进行分析和处理。
1.4 数据统计分析
每个实验重复3 次,结果表示为 ±s。数据统计分析采用Statistix 8.1软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用Sigma Plot 10.0软件作图。
2 结果与分析
2.1 不同反应温度和时间制得大豆糖蛋白的还原能力
还原能力是评价天然抗氧化剂抗氧化能力的重要指标,本实验中制得的大豆糖蛋白具有很好的还原能力,这可能是由于反应过程产生了大量褐色素、吡咯酮、脱氧果糖嗪类、还原酮等能够提供氢电子的物质,其提供的电子可将Fe3+还原为Fe2+,使自由基成为较为稳定的物质,从而中断自由基连锁反应[16]。从图1中可以看出,随反应温度的升高大豆糖蛋白的还原能力逐渐增强,3 个温度制得大豆糖蛋白的还原能力变化趋基本一致,0~4 h其还原能力随着反应时间的延长显著提高,5 h其还原能力有所下降,反应进行6 h还原能力呈现上升趋势,这可能是由于反应生成的美拉德产物在长时间高温下有部分分解,造成还原力有所下降,而后又重新发生聚集使还原能力增强。此外,不同条件制得大豆糖蛋白还原能力均高于SPI,90 ℃ 6 h的大豆糖蛋白具有最高的还原能力,比SPI还原能力提高4.6 倍,说明糖基化改性后的SPI具有更好的抗氧化活性。美拉德产物具有还原作用,Kim等[17]对此也有研究,其发现甘氨酸、三甘氨酸、甘氨酰甘氨酸这3 种氨基酸与葡萄糖生成的大豆糖蛋白的还原力随着反应时间的延长而增加。此外,其对间接诱导脂类氧化的过氧化物具有较强的消除能力,Yoshimura等[18]研究表明,葡萄糖-赖氨酸反应体系制得的大豆糖蛋白中含有焦糖化物或杂环物质,这些化合物都能消除过氧化物,具有较强的抗氧化能力。另外,其抗氧化能力随着加热时间的延长而明显增强,经脱色处理后的大豆糖蛋白抗氧化能力显著下降,这就一定程度上证明了褐色素物质具有抗氧化作用。

图1 不同反应温度和时间制得大豆糖蛋白的还原能力Fig. 1 Reducing power of soy glycoprotein obtained at different reaction temperatures and times
2.2 不同反应温度和时间制得大豆糖蛋白的羟自由基清除能力

图2 不同反应温度和反应时间制得大豆糖蛋白的羟自由基清除能力Fig. 2 Hydroxyl radical scavenging capacity of soy glycoprotein obtained at different reaction temperatures and times
抗氧化剂可以提供氢原子与脂类的自由基反应,使自由基结合形成比较稳定的非活性化合物,从而干扰或阻断链式反应的继续进行。蛋白质与糖质量比为1∶1条件下不同反应温度和反应时间制取大豆糖蛋白的羟自由基清除能力见图2。随着反应时间的延长,70 ℃大豆糖蛋白的羟自由基清除能力不断增强,最大清除率为4.71%;同时80 ℃ 0~4 h大豆糖蛋白随反应时间延长羟自由基清除能力也呈上升趋势,在反应时间为4 h时清除率达到最大为5.04%,5~6 h羟自由基清除能力呈现降低趋势;90 ℃大豆糖蛋白在反应开始随反应时间延长显示出羟自由基清除能力的提高,在5 h时达到最高清除率5.87%,6 h大豆糖蛋白的羟自由基清除能力低于5 h的。从图2还可以看出,高反应温度制得的大豆糖蛋白具有更高的羟自由基清除能力;此外,90 ℃ 5 h的大豆糖蛋白羟自由基清除能力最高,比SPI提高了0.69 倍,说明其具有比SPI更高的羟自由基清除能力。本实验中制得的大豆糖蛋白具有较强的羟自由基清除能力,且它的羟自由基清除能力随反应时间的延长而增加。这是因为大豆糖蛋白在发挥抗氧化作用时,有可能是作为氢供体,其本身也是金属螯合剂,可以螯合Fe2+,因此大豆糖蛋白拥有比较强的羟基自由基清除能力,也有可能与其具有螯合Fe2+的能力有关[19]。这与Vhangani等[20]的研究相一致,他们的研究结果表明赖氨酸与果糖的美拉德反应产物具有较强的羟自由基清除能力。
2.3 不同反应温度和时间制得大豆糖蛋白的DPPH自由基清除能力

图3 不同反应温度和反应时间制得大豆糖蛋白的DPPH自由基清除能力Fig. 3 DPPH radical scavenging capacity of soy glycoprotein obtained at different reaction temperatures and times
DPPH的乙醇溶液呈紫色,它是以氮为中心的稳定自由基,在517 nm波长处有最大吸收。当DPPH溶液中有自由基清除剂加入时,其孤电子被配对,导致其溶液在517 nm波长处的吸光度变小。通常清除率大小表示样品对自由基的清除能力。如图3所示,不同反应温度和反应时间制得的大豆糖蛋白都具有一定的DPPH自由基清除能力,其DPPH自由基清除能力随着反应温度的升高而增强。因为温度高有利于美拉德反应,温度越高在较短时间内就能生成类黑精、还原酮及一系列含N、S的杂环化合物,这些物质都具有清除DPPH自由基的能力。80 ℃大豆糖蛋白和90 ℃大豆糖蛋白的DPPH自由基清除能力呈相同趋势,0~5 h大豆糖蛋白的DPPH自由基清除率显著增加,在反应5 h清除率达到最高,分别为45.59%和68.55%,6 h大豆糖蛋白自由基清除能力有下降;70 ℃大豆糖蛋白DPPH自由基清除能力随反应时间的延长总体呈现上升趋势。另外,最高的大豆糖蛋白自由基清除率比SPI提高了2.68 倍。这是因为美拉德反应达到一定程度时,美拉德反应终产物类黑精形成,其是美拉德中间产物与与氨基化合物反应而成,而且其短肽含有抗氧化活性的支链氨基酸。在产生类黑精的同时,有一系列的美拉德反应中间体——还原酮类物质及杂环类化合物生成,这些产物也具有抗氧化等活性[8]。
2.4 不同反应温度和反应时间制得大豆糖蛋白的游离氨基含量
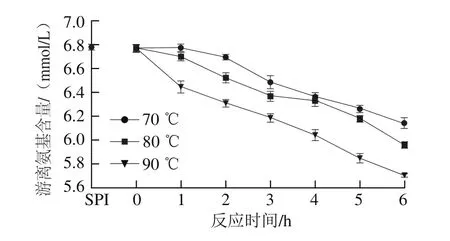
图4 不同反应温度和反应时间制得大豆糖蛋白的游离氨基含量Fig. 4 Free amino group contents of soy glycoprotein obtained at different reaction temperatures and times
游离氨基含量的变化关系着美拉德反应程度,游离氨基减少越多,反应进行的程度就越大[21]。由图4可以看出,反应过程中随着加热时间的延长游离氨基含量显著降低(P<0.05),70、80、90 ℃ 大豆糖蛋白的游离氨基含量由6.79 mmol/L分别降到6.14、5.93、5.68 mmol/L,这是因为随着反应的进行葡萄糖和SPI的—NH2聚合成高分子质量的大豆糖蛋白,从而使游离氨基含量逐渐降低。另外,随着反应温度的提高游离氨基含量降低幅度增大,说明温度的提高有利于美拉德反应产物的生成,在美拉德反应过程中,游离氨基含量随着美拉德反应的进行消耗的越多,其游离氨基含量的变化一定程度上反映美拉德反应的进程。Naranjo等[22]研究了酪蛋白与还原糖进行美拉德反应,结果发现随着反应时间的延长,氨基酸含量也逐渐降低。这个结果表明,当加热进行时,蛋白质或氨基酸的α-或ε-NH2基团更大程度地与糖共价结合形成糖基化蛋白,同时,大豆糖蛋白重新排列成一个更稳定的酮胺或Amadori产物。
2.5 不同反应温度和反应时间制得大豆糖蛋白的褐变程度

表1 不同反应温度和反应时间制得大豆糖蛋白的褐变程度Table 1 Effect of different reaction temperatures and time on browning degree of soy glycoprotein
蛋白质与糖接枝反应往往伴随着褐变现象,反应后期形成一种大分子质量的棕褐色聚合产物,这一类物质统称为类黑精。美拉德反应的末期阶段,SPI和葡萄糖片段缩合成大分子的褐色素类黑精,类黑精在420 nm波长处有明显吸收,420 nm波长处吸光度越高说明褐色素类黑精的生成量越多,反应体系溶液颜色越深。随着反应时间的延长,形成色素物质越来越多,反应产物的褐变程度也随之加深。反应褐变程度对大豆糖蛋白的抗氧化活性也有影响[23],本研究通过测定反应液在420 nm波长处的吸光度表示褐变程度,反映类黑精的生成量。由表1可以看到,同一温度下随着反应时间的延长,褐变程度逐渐增大且差异性显著(P<0.05),5 h大豆糖蛋白在420 nm波长处吸光度有所降低,到6 h褐变程度又显示出升高趋势,这与其还原能力的变化一致。这可能是由于美拉德反应的初始阶段,还原糖和氨基酸反应可生成不稳定的无色氨基还原酮,反应后期形成褐色物质类黑精。主要有3 种结构的类黑精:蛋白质与低分子质量着色化合物交联产生的以蛋白质为基本成分的类黑精;由呋喃或吡咯重复单元组成的类黑精聚合物;醇醛缩合形成糖降解产物中的以碳水化合物为基础的类黑精。在类黑精混合体中,类黑精是一种以短肽和色素相结合的混合体,其短肽的氨基酸序列结构具有抗氧化肽的特征。所以类黑精类物质具有相同显著的抗氧化和消除活性氧等性能,其抗氧化强度可与食品中常用的抗氧化剂相当[24]。Murakami等[25]指出早期阶段产生的无色产物的自由基清除活性比有色产物的自由基清除活性小,随着反应加热时间过长反应产物裂解退化为前期产物。这也是随着反应时间的延长大豆糖蛋白的还原能力变化的原因。另外,随着反应温度的升高,褐变程度不断增大且具有显著性差异(P<0.05),可能是因为温度越高越有利于美拉德反应高级阶段的进行。
2.6 不同温度和反应时间制得大豆糖蛋白紫外光谱二阶导数分析结果

图5 不同温度、反应时间制得大豆糖蛋白的紫外光谱二阶导数分析Fig. 5 Secondary derivative UV spectral analysis of soy glycoprotein obtained at different reaction temperatures and times
蛋白质中苯丙氨酸、色氨酸和酪氨酸这些芳香族氨基酸能产生紫外吸收光谱,这3 种氨基酸残基的侧链基团在280 nm波长处都有特征吸收峰,由于谱峰的信号叠加很难分辨出峰的具体特征。因此对紫外吸收光谱进行求导得到其二阶导数光谱,用于分析近紫外区域复杂的蛋白谱图迁移信息和描述3 种芳香族氨基酸的结构变化[26]。SPI在250~300 nm范围内存在两个正吸收峰(269 nm和296 nm)和两个负吸收峰(259 nm和279 nm)。296 nm波长处的正峰被认为是色氨酸的贡献[16]。如图5所示,相对于SPI,大豆糖蛋白的色氨酸吸收峰发生不同程度的红移,即原来蛋白分子表面的芳香族氨基酸减少。70 ℃大豆糖蛋白色氨酸吸收峰红移不明显,80 ℃和90 ℃大豆糖蛋白的色氨酸吸收峰红移程度变大,且90 ℃条件下制得的大豆糖蛋白色氨酸吸收峰红移程度大于80 ℃反应体系,这可能是随着糖基化的进行,暴露的色氨酸吲哚结构中的—NH基团发生美拉德反应而导致其含量降低,有研究报道美拉德反应的蛋白侧链芳香族氨基酸残基是较强的自由基清除剂,因为它们可提供氢原子给自由基,达到猝灭自由基的效果,同时通过共振结构保持自身稳定[27],大豆蛋白与葡萄糖反应产生的大豆糖蛋白结构不同,导致自由基清除能力有差异。
2.7 不同反应温度和时间制得大豆糖蛋白的SDS-PAGE结果

图6 不同反应温度和反应时间制得大豆糖蛋白的SDS-PAGEFig. 6 SDS-PAGE analysis of soy glycoprotein obtained at different reaction temperatures and times
本实验采用SDS-PAGE分析蛋白质亚基分子质量的组成。经过SDS处理后的蛋白质分子的二级结构、三级结构和四级结构都被破坏;同时,蛋白质分子二硫键被疏基乙醇破坏导致链间和链内二硫键被还原。蛋白质因为这两种因素而发生变性,变性蛋白多肽链与SDS以质量比1∶4结合,形成SDS-蛋白质混合物,使蛋白质所带负电荷的量远超过其本身所带有的电荷,这种情况下,SDS-蛋白质的电泳迁移率取决于蛋白质分子质量的大小,而不取决于蛋白质所带电荷的性质。大分子物质在凝胶网络结构中移动时受到较大的阻力,因此滞留在凝胶的上方,较小的分子则具有较大的迁移率,分布在凝胶的下方。通过电泳分析糖基化改性对蛋白的降解或聚合作用。图6很清晰地显示出未经处理的SPI的各亚基条带,其中α’、α和β为大豆β-伴球蛋白的3 个亚基,A和B分别是大豆球蛋白的酸性多肽链和碱性多肽链。随着反应时间的延长大豆糖蛋白的α’和α亚基条带逐渐变浅,最终几乎消失,这说明了糖基化温度为90 ℃时糖基化反应速度快,生成的糖基化SPI多。这与Diftis等[28]的研究结果一致,他们发现SPI与羧甲基纤维素的接枝物中,7S亚基完全消失不见。同时,还可以看出,80 ℃和90 ℃反应生成的大豆糖蛋白在凝胶顶部存在的一些颜色较暗的条带,很可能就是SPI中的亚基与葡萄糖发生了聚合作用,形成了大分子聚合物,这种聚合物可能是类黑素,它们的分子质量过大,不能穿过凝胶网络,因此堆积在胶的顶部,而70 ℃反应生成的大豆糖蛋白在浓缩胶与分离胶接缝处基本没有条带,推测70 ℃条件下制得的大豆糖蛋白起抗氧化作用的主要物质可能为还原酮或挥发性杂环化合物。从大豆糖蛋白的电泳图中也不难看出,大豆糖蛋白均随着温度的升高,亚基谱带减少,特别是90 ℃、6 h制得的大豆糖蛋白的电泳图谱上基本看不到亚基的条带,这是因为考马斯亮蓝通常情况下在酸性环境中通过静电等非共价作用与蛋白质分子上的自由氨基等活性基团结合,从而呈现颜色反应,随着反应温度的升高和反应时间的延长,SPI和葡萄糖进行更加充分的糖基化作用,使得蛋白质中自由氨基含量减少,同时考马斯亮蓝与蛋白质分子的结合也就相应地减少,使大豆糖蛋白的电泳凝胶用考马斯亮蓝染色时颜色变淡或消失。同时发现在浓缩胶和分离胶的接缝处新条带的生成,并且该化合物分子质量大于200 kDa,这说明SPI经过美拉德反应后生成了大分子化合物。
3 结 论
大豆糖蛋白的抗氧化性随着反应温度的升高逐渐增强,同时,随着反应时间的延长,大豆糖蛋白的抗氧化性也会相应提高,当达到一定反应时间时,大豆糖蛋白中的抗氧化成分发生裂解导致抗氧化能力降低。随着反应的进行,大豆糖蛋白的游离氨基含量都明显下降,反应温度越高、反应时间越长,其游离氨基含量下降越多。同时,大豆糖蛋白溶液颜色均有不同程度的加深且差异显著(P<0.05),且温度越高大豆糖蛋白的褐变程度越大,即其中类黑精含量越高。另外,通过其紫外光谱二阶导数分析可知,经过反应后蛋白中色氨酸发生偏移,芳香族氨基酸暴露出来,导致大豆糖蛋白的结构发生变化,而从SDS-PAGE的分析中也看出蛋白与糖发生聚合。物质的结构决定性质,大豆糖蛋白的抗氧化性和其结构存在着密切联系,由于美拉德反应的复杂性,需要考虑多重因素,对大豆糖蛋白的抗氧化机理有待于更深入的研究。
参考文献:
[1] 鲁倩, 林亲录, 吴伟, 等. 糖基化修饰产物的抗氧化功能研究进展[J]. 食品工业科技, 2013, 34(9): 382-386. DOI:10.133386/j.issn1002-0306.2013.09.078.
[2] 徐真真, 黄国清, 肖军霞. 干热条件下大豆分离蛋白-木糖美拉德反应研究[J]. 粮油食品科技, 2015, 23(2): 26-30. DOI:10.16j.210/cnki.1007-7561.2015.02.015.
[3] 肖连冬, 程爽, 李杰. 大豆分离蛋白起泡性和乳化性影响因素的研究[J]. 中国酿造, 2014, 33(4): 83-86. DOI:10.3969/j.issn.0254-5071.2014.04.020.
[4] 刘颖, 冯实, 石彦国, 等. 湿法糖基化改性对南极磷虾蛋白质功能特性的影响[J]. 安徽农业科学, 2015, 43(33): 94-97. DOI:10.3969/j.issn.0517-6611.2015.33.034.
[5] NAKAMURA S, KATO A, KOBAYASHI K. New antimicrobial characteristics of lysozyme-dextran conjugate[J]. Journal of Agricultural and Food Chemistry, 1991, 39(4): 647-650. DOI:10.1021/jf00004a003.
[6] MORENO F J, LÓPEZ-FANDIÑO R, OLANO A. Characterization and functional properties of lactosyl caseinomacropeptide conjugates[J]. Journal of Agricultural and Food Chemistry, 2002, 50(18):5179-5184. DOI:10.1021/jf020118u.
[7] 陈黎洪, 唐宏刚, 肖朝耿. 金华火腿副产品酶解物的MRPs抗氧化活性[J]. 中国农业科学, 2011, 44(6): 1218-1223. DOI:10.3864/j.issn.0578-1752.2011.06.017.
[8] 马志玲, 王延平, 吴京洪. 模式美拉德反应产物抗氧化性能的研究[J]. 中国油脂, 2002, 27(4): 68-71. DOI:10.3864/j.issn.0578-1752.2011.06.017.
[9] 项惠丹, 许时婴, 王璋. 蛋白质与还原糖美拉德反应产物的抗氧化活性[J]. 食品科学, 2008, 29(7): 52-57. DOI:10.3321/j.issn:1002-6630.2008.07.005.
[10] DEEPAK A V, THIPPESWAMY G, SHIVAKAMESHWARI M N, et al. Isolation and characterization of a 29-kDa glycoprotein with antifungal activity from bulbs of Urginea[J]. Biochemical and Biophysical Research Communications, 2003, 311: 735-742.DOI:10.1016/j.bbrc.2003.10.056.
[11] HE Yuehua, SHAHIDI F. Antioxidant activity of green tea and its catechins in a fish meat model system[J]. Journal of Agricultural and Food Chemistry, 1997, 45: 4262-4265.
[12] 金鸣, 蔡亚欣, 李金荣, 等. 邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J]. 生物化学与生物物理进展, 1996(6): 553-555.
[13] SAIGA A, TANNBE S, NISHIMURA T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agricultural and Food Chemistry, 2003,51(12): 3661-3667. DOI:10.1021/jf021156g.
[14] BENJAKUL S, MORRISSEY M T. Protein hydrolysates from Pacific whiting solid wastes[J]. Journal of Agricultural and Food Chemistry,1997, 45(9): 3423-3430. DOI:10.1021/jf970294g.
[15] XIA Xiufang, KONG Baohua, LIU Qian, et al. Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83: 239-245.
[16] LIU J H, RU Q M, DING Y T. Glycation a promising method for food protein modification: physicochemical properties and structure,a review[J]. Food Research International, 2012, 49(1): 170-183.DOI:10.1016/j.foodrese.2012.07.034.
[17] KIM J S, LEE Y S. Antioxidant activity of Maillard reaction products derived from aqueous glucose/glycine, diglycine, and triglycine model systems as a function of heating time[J]. Food Chemistry, 2009,116(1): 227-232.
[18] YOSHIMURA Y, LIJIMA T, WATANABE T, et al. Antioxidative effect of Maillard reaction products using glucose-glycine model system[J]. Journal of Agricultural and Food Chemistry, 2012, 45(10):4106-4109. DOI:10.1021/jf9609845.
[19] WAGNER K H, DERKITS S, HERR M, et al. Antioxidative potential of melanoidins isolated from a roasted glucose-glycine model[J]. Food Chemistry, 2002, 78(3): 375-382.
[20] VHANGANI L N, VAN WYK J. Antioxidant activity of Maillard reaction products (MRPs) derived from fructose-lysine and ribose-lysine model systems[J]. Food Chemistry, 2013, 137(1/2/3/4): 92-98.
[21] 张海瑞, 何志勇, 秦昉, 等. 热处理热处理制备高凝胶性大豆分离蛋白的工艺[J]. 食品与发酵工业, 2012, 38(3): 81-84. DOI:10.3321/j.issn:1003-7969.2002.04.024.
[22] NARANJO G B, MALEC L S, VIGO M S. Reducing sugars effect on available lysine loss of casein by moderate heat treatment[J]. Food Chemistry, 1998, 62(3): 309-313.
[23] 张海瑞, 何志勇, 秦昉, 等. 热处理制备高凝胶性大豆分离蛋白的工艺[J]. 食品与发酵工业, 2012, 38(3): 81-85. DOI:10.13995/j.cnki.11-1802/ts.2012.03.029.
[24] YADAV M P, STRAHAN G D, MUKHOPADHYAY S, et al.Formation of com fiber gum-milk protein conjugates and their molecular characterization[J]. Food Hydrocolloids, 2012, 26(2): 326-333.
[25] MURAKAMI A, SHIGEEDA K, DANJO K, et al. Radical-scavenging activity and brightly colored pigments in the early stage of the Maillard reaction[J]. Journal of Food Science, 2002, 67(1): 93-96.DOI:10.1111/j.1365-2621.2002.tb11365.x.
[26] 翁燕霞, 叶泉莹, 王庆佳. 大豆蛋白改性的研究进展及其应用[J].农产品加工(学刊), 2013(16): 89-91. DOI:10.3969/jissn.1671-9646(X).2013.08.058.
[27] PARRELLA A, CATERINO E, CANGIANO M, et al. Antioxidant properties of different milk fermented with lactic acid bacteria and yeast[J]. International Journal of Food Science and Technology, 2012,47(12): 2493-2502. DOI:10.1111/j.1365-2621.2012.03127.x.
[28] DIFTIS N, KIOSSEOGLOU V. Improvement of emulsifying properties of soybean protein islate by conjugation with carboxymethyl cellulose[J]. Food Chemistry, 2003, 81(1): 1-6.

