食品中黄曲霉毒素B1污染研究进展
张牧臣,郑 楠*,王加启
自然环境下,诸如玉米、油菜籽、花生、水稻、小麦、棉籽等农作物,在生长、收获的过程中,尤其是在洪涝、虫害等环境胁迫下,极有可能遭遇来自空气传播或者虫害携带的产毒真菌的污染[1]。此类真菌在代谢过程中又会产生大量代谢毒物——霉菌毒素。被真菌及其毒素污染的谷物,在储藏、加工等过程中高湿温热的环境作用下又会加剧霉变,所制成的粮油等食品存在被多种霉菌毒素共同污染的风险;同时,被污染的农作物作为饲料资源被畜禽食用后,携带的霉菌毒素又可在肉、蛋、奶等食品中蓄积,通过食物链传递,危害人类健康[2]。食品遭受产毒真菌以及霉菌毒素污染的问题在世界范围内反复发生,不仅给农业生产带来巨大的经济损失,还给人类健康带来威胁[1]。据联合国粮食与农业组织估计,全球的粮食作物及其衍生食品中大约有1/4存在霉菌毒素污染[3],研究表明,这些被报道的代谢毒物大部分具有潜在的致癌、致畸、致突变性,以及肝脏毒性、肾脏毒性、免疫毒性、出血毒性[1]。在众多的霉菌毒素中,黄曲霉毒素(aflatoxin,AF)是较常见且毒性较强的一种,据美国疾病控制中心估算,在发展中国家,大约有45亿 人面临AF的暴露危害[4]。2005年发生在肯尼亚的规模较大的一次毒玉米中毒事件,就是因为数千人食用了被黄曲霉毒素B1(aflatoxin B1,AFB1)污染的玉米产品而引发的急性中毒,共造成125 人死亡,300多人肝衰竭[5]。
1 食品中AFB1污染发生的来源及影响因素
AF最早被发现于1960年,主要是由黄曲霉(Aspergillus flavus)、寄生曲霉(Aspergillus parasiticus)和集峰曲霉(Aspergillus nomius)产生的高毒性次生代谢产物。目前已分离鉴定出AFB1、AFB2、AFB2a、AFG1、AFG2、AFG2a、AFM1、AFM2、AFP1、AFQ1和AFH1等20 种结构类似的化合物,均属于二氢呋喃香豆素的衍生物,其中又以AFB1最为常见,主要分布在玉米、花生、大米、小麦等农作物及其油类副产品中,奶制品、调味品中也有少量分布[6-7]。
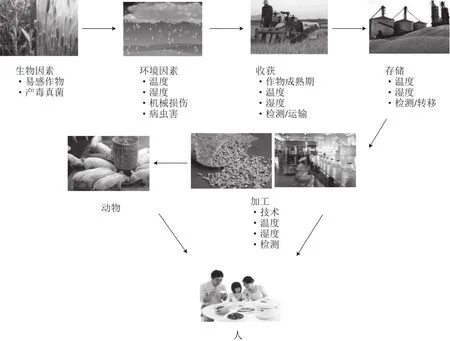
图1 食品中AFB1污染的来源及影响因素Fig. 1 Origin and factors affecting AFB1 in foods
影响曲霉菌生长和产毒的主要因素包括作物种类(基因型)、作物物理损伤程度、病虫害侵袭程度、土壤类型、其他共存的霉菌种类、环境温度、湿度(图1)等。其中,温度和湿度为AF产生的主要限制条件:Aspergillus parasiticus生长在6~46 ℃温度范围内,其中较适宜的范围是25~35 ℃;Aspergillus flavus在12~34 ℃均可生长并产毒,但36 ℃时产毒被抑制,适宜温度范围为28~30 ℃,产毒的适宜相对湿度为85%[8-9]。曲霉合成AF所需要的最佳环境pH值为3.4~5.5,碱性介质抑制AF生物合成[10]。基于上述的曲霉产毒特点,AF对粮油食品的污染过程可被划分为2 个阶段:一是农作物的生长期,一般生长期农作物可以抵抗部分霉菌的侵染,但当作物受到大面积物理损伤或者遭遇病害侵袭等环境迫害,尤其是这些迫害又发生在高湿温暖的天气时,作物易被霉菌感染;第二阶段是从作物成熟到消费的过程中,收获时高湿的天气条件、加工时干燥不充分、储存环境潮湿、储存温度较高等因素都会促进谷物霉变及AF的大量产出,造成粮油产品的污染。此外,被污染的农作物作为饲料资源被畜禽食用后,还可在肉、蛋、奶等产品中蓄积,造成畜产品的污染[11-13]。
2 AFB1的分子结构与毒性
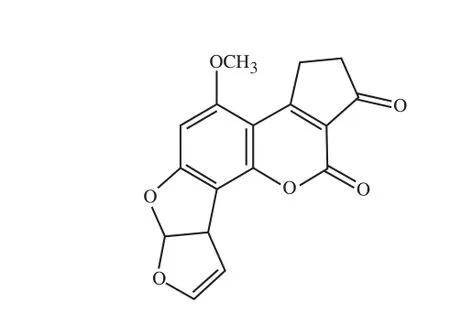
图2 AFB1的分子结构式Fig. 2 Molecular structure of AFB1
在常见的AF中,AFB1是最常见且毒性最高的一种[5]。其分子式为C17H12O6,相对分子质量为312~346,分子结构如图2所示。它的理化性质稳定,不易溶于水,易溶于极性有机溶剂,如甲醇、氯仿、丙酮等;内酯环结构使其在365 nm波长紫外光照射下发出蓝紫色的荧光。AFB1结构中含有1 个双呋喃环,环末端的双键形成的共轭结构使得其具有较高的裂解温度(约280 ℃)[14]。AFB1末端带有双键的双呋喃环结构,容易发生环氧化反应,形成的环氧化物容易与核酸和蛋白质等生物大分子结合从而发挥毒性作用,AFB1结构中还有一个氧杂萘邻酮环(香豆素),主要与其致癌性能相关[15-16]。
AFB1毒性约为氰化钾的10 倍、砒霜的68 倍、奶黄油的900 倍、二甲基亚硝胺的75 倍、三聚氰胺的416 倍,被世界卫生组织认定为IA级危险物[17]。国际癌症研究机构研究指出,AFB1对人体有明确的致癌性,可引起急慢性中毒甚至死亡,诱导癌变、畸形,降低人体或动物的免疫力,造成营养紊乱等,被划定为Ⅰ类致癌物[18]。有报道指出,人类摄入该毒素后可诱导原发性肝癌、胃癌、肺癌等,致癌所需时间最短仅为24 周,乙肝病毒携带者接触AFB1后,引发肝癌的概率是一般人的60 倍[19]。还有研究指出,小儿的恶性营养不良症、瑞氏综合征与AF的摄入也有关系[20]。毒理学中的半数致死剂量(median lethal dose,LD50)是指毒物引起一群个体50%死亡所需剂量,表1列出了AFB1对不同动物的LD50[21]。
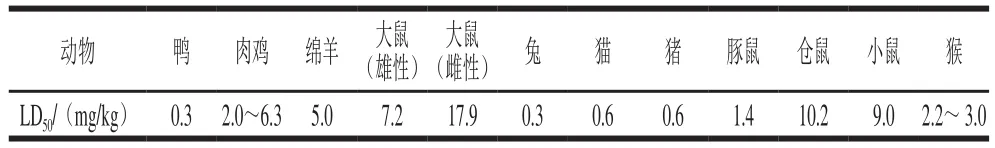
表1 AFB1的半数致死剂量Table 1 Half lethal dose (LD50) for aflatoxin B1
3 AFB1的致病机理
AFB1被机体摄入后,80%以上在肠道上部十二指肠、空肠被吸收,主要吸收方式为被动运输[22],吸收后主要蓄积在肝脏、肾脏、脾脏等器官,少量游离在肠系膜静脉[23]。
3.1 AFB1的肠道致病性
消化道是机体最先接触食物及污染物的器官。肠道不仅具有消化吸收营养物质的功能,还是抵御营养型抗原、病原体以及毒素等外来污染物的有效屏障。肠道结构的完整对于肠道功能的发挥至关重要。近年来越来越多的人开始关注AFB1对动物肠道的影响,尤其是对禽类而言,但文献中报道的结果差异较大[24]。
用AFB1含量为0.02 mg/kg或0.7 mg/kg的日粮饲喂肉鸡3 周,会降低小肠密度[25-26],表明小肠吸收面积降低。用含有0.6 mg/kg AFB1的日粮饲喂肉鸡3 周,对肠道组织病理学检测发现肉鸡肠道绒毛萎缩脱落,绒毛高度显著降低(P<0.05),空肠细胞发生明显的G2/M期细胞阻滞现象,肠损伤严重[27]。用高剂量AFB1(1 mg/kg)污染的日粮饲喂肉鸡4 周,可造成小肠淋巴细胞和单核细胞浸润,并伴有卡他性肠炎的发生[28]。但是Ledoux等[29]用含有4 mg/kg AFB1的日粮饲喂肉鸡3 周,却未能观测到十二指肠、空肠、回肠、盲肠发生组织病理学变化。这些结果的差异,可能与所检测位置、暴露时间、实验动物的品种不同等有关。在小鼠模型上的实验显示,AFB1可以造成肠黏膜形态学损伤,抑制肠上皮细胞的增殖[30]。紧密连接蛋白是肠道屏障的重要组件,用于封闭肠道上皮细胞之间的空隙,它们在肠腔表面形成的交织网络,是阻止腔内病原体通过细胞旁路的重要结构[31]。用1~100 μmol/L AFB1处理人结肠癌细胞模型(Caco-2细胞),细胞活力随着AFB1浓度的增加而降低;同时,Caco-2细胞单层跨膜电阻值显著降低(P<0.05),紧密连接蛋白mRNA表达水平显著降低(P<0.05)[32]。除肠道自身完整的结构外,肠道正常的微生物区系对于机体肠道健康也至关重要[33],尤其是益生菌如乳酸菌等的存在,对于肠道免疫、营养物质的消化吸收等都有益处。研究表明,AFB1可影响动物肠道微生物区系,给雄性F344大鼠持续灌胃不同剂量的AFB1,20 d后,与空白对照组相比,AFB1暴露组大鼠肠道微生物区系组成发生显著改变(P<0.05),一些乳酸菌含量显著降低(P<0.05)[34]。
3.2 AFB1的肝脏致病性
大量研究表明,肝脏是代谢AFB1的主要器官,同时也是AFB1发挥毒性的主要靶器官。AFB1肝毒性极强,能引起肝细胞坏死、胆管增生、肝纤维化甚至肝癌,是公认的与原发性肝细胞癌发生紧密相关的两大重要因素之一[35]。给雄性F344大鼠饲喂含有150 μg/kg AFB1的日粮,14 d后再饲喂正常日粮,随后检测血清临床生化指标,结果发现与对照组相比,AFB1处理组大鼠血中尿素氮、血钾水平显著增加(P<0.05),肝细胞凋亡、细胞分裂比例增加,肝脏组织发育不良,同时肝脏谷胱甘肽S转移酶阳性灶(GST-P+)数量及大小显著增加(P<0.05),而GST-P+的出现被认为是癌前病变的重要标志,这些数据表明AFB1可以造成大鼠肝脏损伤并可诱发肝癌[36]。Lu Xiaoyan等[37]用低(0.25 mg/kg)、中(0.75 mg/kg)、高(1.50 mg/kg)3 种剂量的AFB1灌胃雄性F344大鼠,连续灌胃7 d后,在中、高剂量组检测到大鼠肝脏出现大面积水肿变性、细胞质空泡、炎症细胞侵润等现象,同时,与对照组相比,血清中谷丙转氨酶、谷草转氨酶、总胆红素含量升高,总蛋白含量降低,这些肝脏组织病理变化及血清生化指标均表明,中、高剂量AFB1的摄入造成了大鼠肝脏组织损伤严重。Zhang Limin等[38]研究指出,给SD大鼠饲喂含有1.6 mg/kg AFB1的日粮12 d,与对照组相比,大鼠肝脏组织出现脂肪滴,肝脏细胞出现空泡,酮体含量升高,表明AFB1可引起肝脏脂肪沉积及脂肪酸氧化。近来还有研究表明,AFB1可以通过引发肝细胞过量产生活性氧,导致肝脏氧化应激,造成肝脏炎症,从而损伤肝脏,诱发癌变。Singh等[39]给大鼠腹腔注射1 mg/kg的AFB1,连续8 周后,与空白对照组相比,大鼠肝脏活性氧的含量显著升高(P<0.05),谷胱甘肽含量显著降低(P<0.05),超氧化物歧化酶含量及活性降低,总谷胱甘肽过氧化物酶活性降低,炎症因子(肿瘤坏死因子α和白介素-1α)表达水平显著升高(P<0.05),连续注射10 周后,变异肝细胞病灶显著增加(P<0.05)。另外,流行病学研究表明,AFB1暴露可与慢性乙型肝炎病毒感染协同诱发肝癌。这可能与两者可以协同诱发抑癌基因p53发生点突变有关[40]。
3.3 AFB1的免疫器官致病性
硏究表明,动物低剂量摄入AFB1即可表现明显的免疫抑制症状,包括免疫器官质量降低、T细胞亚群数量降低、抗体效价和补体活性降低、淋巴组织病理损伤等,其中禽类对AFB1的免疫毒性较敏感[41-42]。禽类的法氏囊是负责B细胞增殖和分化的中心免疫器官,与体液免疫密切相关。用含有0.6 mg/kg AFB1的日粮连续饲喂科宝肉鸡21 d后,与空白对照组相比,AFB1暴露组肉鸡法氏囊质量显著降低(P<0.05),法氏囊内的淋巴细胞减少,淋巴小结空泡增多,凋亡细胞比率显著增大(P<0.05),细胞内凋亡和抗氧化相关基因如Bax、钙调蛋白、p53等mRNA表达水平显著增加(P<0.05),表明AFB1可促进免疫器官细胞凋亡,损伤肉鸡免疫系统[41]。Shank等[43]用AFB1污染的日粮饲喂3 月龄樱桃谷鸭,其脾脏、法氏囊和胸腺中的B淋巴细胞、T淋巴细胞数量显著减少(P<0.05)。脾脏和胸腺是哺乳动物重要的周围免疫器官和中枢免疫器官。Jebali等[44]给雌性Balb/c小鼠连续15 d灌胃剂量为0.25 mg/kg的AFB1,与空白对照组相比,小鼠体质量增长量降低,脾脏和胸腺细胞数量显著降低(P<0.05),脾脏血管扩张,发生淋巴细胞侵润现象,脾脏干扰素和肿瘤坏死因子表达水平降低,但白介素-4水平升高,胸腺近端小叶的皮层细胞处出现肿胀、颗粒变性、树突状细胞萎缩、血管扩张等现象。表明该剂量AFB1的暴露可以损伤小鼠脾脏、胸腺,造成小鼠免疫抑制,同时还检测到AFB1引起骨髓细胞微核数量显著增加(P<0.05),染色体出现畸形,表明AFB1可以损伤骨髓细胞染色体,从而损害骨髓细胞的免疫功能。猪摄入AFB1后,淋巴细胞的活性降低,脾脏中肿瘤坏死因子α、白介素-6、白介素-1β及干扰素γ等促炎因子的表达水平提高[45]。AFB1对机体免疫系统的破坏可能是畜禽饲养中疫苗防疫失败和疫病增加的重要原因。
3.4 AFB1的生物转化与致病机理

图3 AFB1的生物转化与致病机理Fig. 3 Biotransformation and pathogenesis of AFB1
从生理学的角度出发,AFB1在体内代谢的生物转化过程就是它发挥毒性的过程(图3)[46]。被肠道吸收后,AFB1主要在肝脏被代谢,包括羟化、脱甲基化和环氧化反应等代谢过程。肝脏是细胞色素P450多功能氧化酶系统的聚集地,肝微粒体内的该酶系统可以通过O-脱烷基化或者羟基化作用将AFB1转化为AFM1、AFP1、AFQ1,它们可以进一步被一些酶类代谢成硫酸盐共轭物而随尿液或粪便排出机体。该系统内还有一些酶类,如P450 1A2和3A4等,可氧化AFB1的双呋喃环,使AFB1转变为AFB1-8,9-环氧化物(AFBl-8,9-epoxide,AFBO)[47]。该物质是高活性的亲电子化合物,一部分可以与还原性谷胱甘肽结合而最终以AFB1-硫醇尿酸形式经尿排出体外;另一部分与DNA或者RNA碱基对上鸟嘌呤(N7位)结合形成AFB1-N7-鸟嘌呤加合物,诱导后续脱嘌呤反应,或形成无嘌呤嘧啶位点,诱发染色体畸变,干扰DNA的合成与转录,干扰蛋白质的合成;或者氧化鸟嘌呤生成8-OH-鸟嘌呤(8-OH-dG),而8-OH-dG具有致突变性质[46,48-49]。另外AFBO还可以与血清白蛋白的赖氨酸ε-氨基共价结合,形成加合物而残留在血液中,同时AFBO还可以被水解成二氢二醇,再与一些蛋白相结合,抑制细胞内蛋白发挥正常功能。p53基因被认为是多种致癌因素诱发癌症的重要靶基因,该基因的突变被认为是多种癌症发生的一种重要标志[50]。AFBO与抑癌基因p53的突变密切相关,它可以诱导该基因第249位密码子中的第3个碱基G突变成碱基T,抑制该基因活性,诱发肝细胞癌变[51]。可以看出,事实上,AFB1的毒性作用主要是通过其代谢形成的环氧化物体现,AFBO是AFB1毒性的主要实施者。
从分子生物学的角度出发,新近发展的组学技术对解析AFB1的致病机理发挥了重要作用。转录组学研究表明,与大鼠正常肝脏组织相比,AFB1暴露而诱发的大鼠肝脏癌变组织中有1 452 个基因差异表达,它们的功能主要集中在细胞黏附、细胞运动、细胞周期调控、细胞增殖等方面,同时,还有一些长链非编码RNA表达水平发生显著上调(P<0.05),它们的主要功能是调控与细胞凋亡、细胞DNA修复等相关的编码基因的表达[52-53]。Lu Xiaoyan等[37]分析了AFB1暴露造成的大鼠肝脏损伤组织转录组、代谢组数据信息,结果表明:与正常组织相比,AFB1的暴露诱导了肝脏中与排毒反应、抗氧化反应、炎症反应、细胞增殖、DNA修复等相关的基因发生差异表达,主要集中在p53信号通路、膀胱癌相关信号通路;代谢水平主要造成糖异生和脂代谢紊乱;与病理水平相比,机体转录组、代谢组对AFB1的暴露更敏感。综上所述,AFB1主要通过调控细胞内与细胞凋亡、细胞增殖及细胞癌变等过程相关的编码基因和调控基因的表达,从而改写细胞命运,发挥强致病性。
4 食品中AFB1的限量标准
2003年联合国粮农组织发布的全世界食品和饲料真菌毒素法规报告中显示,除国际食品法典委员会以外,全球100多个国家和地区制定了各类食品中AF的限量标准,其中食品中的AF总量(AFB1、AFB2、AFG1、AFG2)的限量范围为0~35 μg/kg,AFB1限量范围为1~20 μg/kg。目前至少有29 个国家对AFB1采用2 μg/kg的限量标准。这些国家绝大多数属于欧盟,或者是欧洲自由贸易联盟成员国及欧盟的候选国。另一个使用较多的限量标准是5 μg/kg,有21 个国家采用了这一标准,这些国家主要分布在非洲、亚洲、大洋洲、拉丁美洲[3]。美国是第一个制定AF限量的国家,但和加拿大一样只限定了食品中总AF的最大允许量,美国遵守政策指南中规定总AF在食品中采用20 μg/kg的限量标准,动物饲料采用300 μg/kg的限量标准[54-55]。日本规定所有食品中AFB1含量不得超过10 μg/kg,进口食品中不得检出AFB1,牛、猪、鸡和鹌鹑(除仔畜外)饲料中AFB1含量不得超过20 μg/kg,用于仔畜的不得超过10 μg/kg。
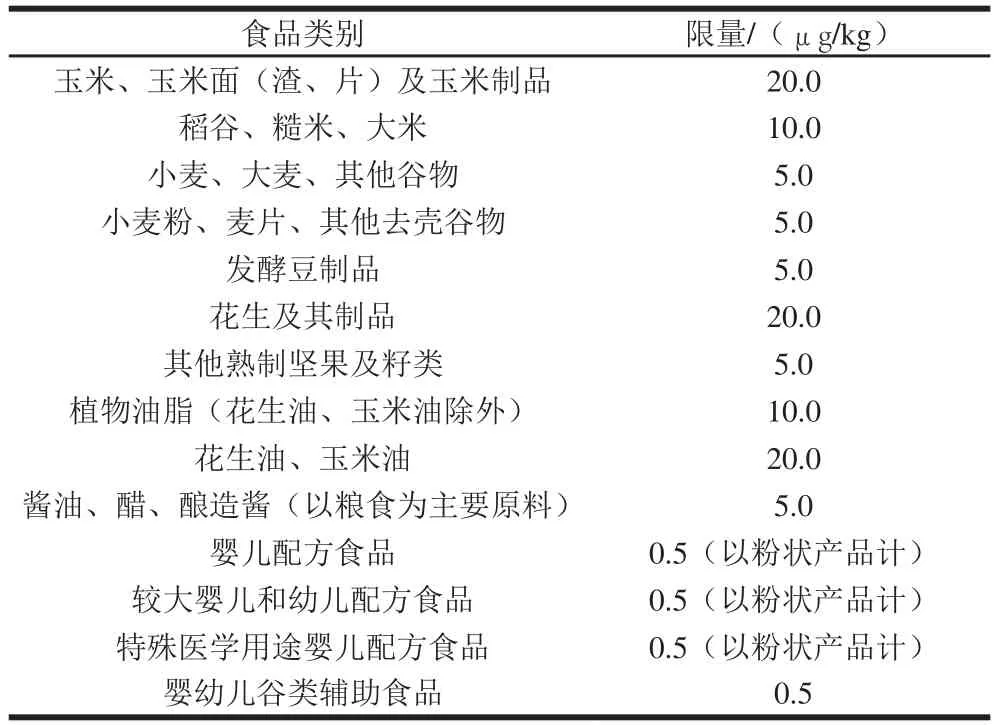
表2 中国关于食品中AFB1的限量标准[56]Table 2 Limit standard for AFB1 in foods in China[56]
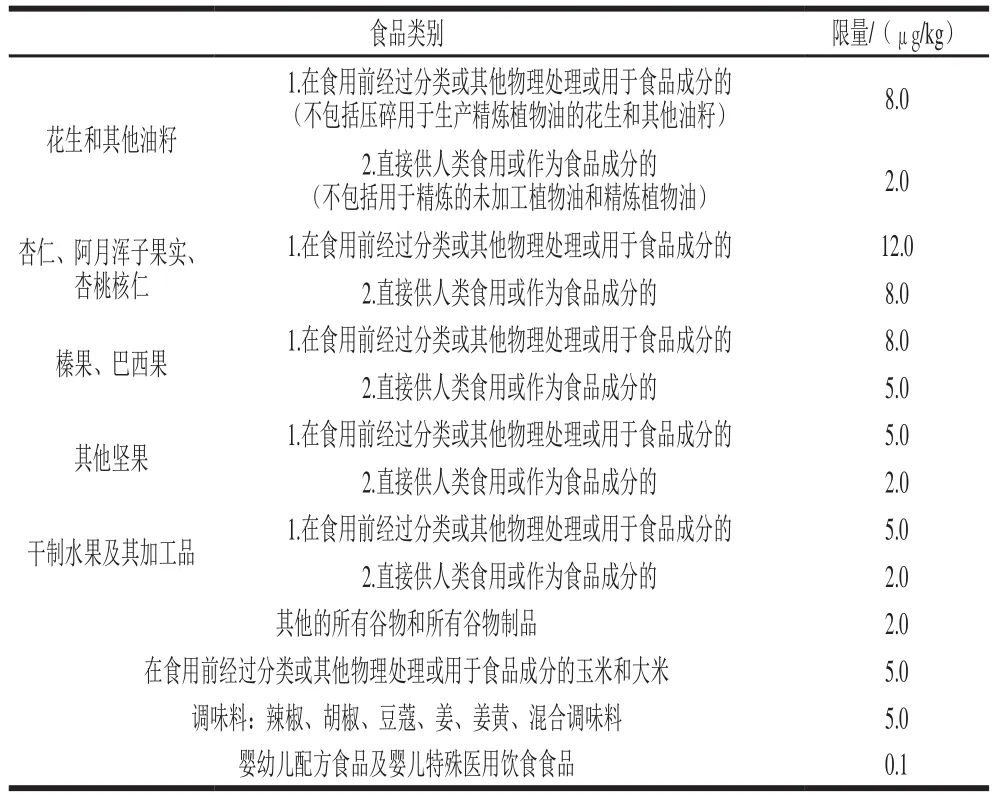
表3 欧盟关于食品中AFB1的限量标准[57]Table 3 Limit standard for AFB1 in foods in the European Union[57]
表2、3分别列出了中国、欧盟规定的食品中AFB1详细的限量标准,可以看出,中国和欧盟均对不同的食品采用不同的限量标准,总体来说,欧盟多采用8.0、5.0、2.0 μg/kg的标准,低于中国限量,另外欧盟对未经处理直接用作食用的谷物也都做了更为严格的限量要求。
5 食品中AFB1的风险评估
5.1 AFB1危害描述
如上所述,AFB1主要通过形成环氧化物抑制细胞内生命物质(核酸、蛋白质等)发挥功能,从而具有较强致癌性、致畸性和致突变性。人体AFB1中毒的临床症状主要表现为恶心、高热、黄疸、下肢浮肿等,甚至暴发肝功能衰竭,更严重者可导致死亡。联合国粮农组织和世界卫生组织下设的食品添加剂联合专家委员会曾多次对AFB1的危害进行描述,得出了AFB1可诱发人体肝癌,以及AFB1与乙肝病毒具有协同致癌作用的结论[58]。在菲律宾、美国、泰国、肯尼亚和中国等地的研究也表明,肝癌发病率较高的地区居民食用的粮油食品中AFB1暴露水平也较高,两者有显著的正相关关系(P<0.05)[59];世界上多次发生人AFB1中毒的事件,如非洲发生的霉木薯饼中毒事件、印度和肯尼亚的霉玉米中毒事件等,其中报道的AFB1的暴露量最高可达4 400 μg/kg[5]。
饲料中AF的超标暴露,将直接威胁畜禽健康,造成畜牧生产上的经济损失,同时还间接威胁人们的饮食安全[60]:一方面,有研究表明霉菌的污染和繁殖可消耗饲料中的营养物质,如氨基酸、碳水化合物等,造成饲料营养价值的流失,还可造成饲料脂肪的变质,降低饲料蛋白的消化率,降低适口性,最终影响畜禽采食[61];另一方面,AFB1随饲料被畜禽摄入后主要攻击的靶器官是肝脏,并可引发肝脏、肠道炎症,肝细胞、肠细胞坏死,导致肝功能受损[24,62-63],其次攻击畜禽免疫器官,造成胸腺细胞凋亡比例增加,削弱畜禽对疾病的抵抗力,降低生产能力[64-65]。禽类尤其是雏鸡、雏鸭等,对AF较敏感[66]。禽类摄入含有AF的饲料后,可出现饲料转化率降低、产蛋量下降、畸形蛋比例增加、法氏囊、胸腺、脾脏等器官细胞凋亡、坏死、肠道炎症增加、肠道细胞周期阻滞等现象,并最终导致禽类病死率增加[64-69]。仔猪、犊牛、肥育猪、成年牛、绵羊对AF的敏感性依次减弱[70]。另外,畜禽食用含有AF的饲料后,会造成AF在畜产品如肉、蛋、奶等中的残留和蓄积,人们食用这种畜产品后将严重威胁健康。
5.2 AFB1的暴露评估
AF对人体的暴露途径主要有2 种,一种是膳食摄入被AF污染的食品,第二种是吸入或皮肤接触空气中含AF的粉尘,其中膳食摄入是人类暴露于AF的主要途径[7],也是暴露评估研究的重点。就食品暴露源来说,油料谷物及其油制品首当其冲。2016年Lee等[71]对过去10 年世界范围内报道的谷物及其衍生物中的霉菌毒素的暴露情况进行了统计,结果表明55%的生谷物中存在AFs,最高含量达到了1 642 µg/kg,加工后的谷物衍生品中AFs暴露频率有所降低。2016年浙江省质量检测科学研究院对我国主要食品中AFB1的暴露评估结果显示:面粉、糕点、菜籽油、山茶油等食品中AFB1检出率均为零;花生以及花生制品(花生油)等油脂含量高的食品,在所抽检的9 个城市中有2 个城市有检出,检出率分别为44.4%和21.4%,不合格率为22.2%和14.3%;各种谷物中大米检出率最高,9 个城市中有3 个城市有检出,不合格率均在5%左右[72]。2009—2013年,广州市疾病预防控制中心对市场上的粮油食品中AFB1含量进行调查,结果显示820 份样品中AFB1检出率高达31.71%,暴露范围为0.012~39.300 μg/kg,均值为2.675 μg/ kg,超标率为1.45%,其中玉米油、花生油的AFB1检出率较高[73]。2007年,中国疾病预防控制中心营养与食品安全所对我国居民AF膳食暴露量进行普查,结果显示我国成人AF平均膳食暴露量为665.43 ng/(人·d),2~6 岁儿童为415.39 ng/(人·d),城市居民为487.64 ng/(人·d),农村居民为749.14 ng/(人·d),其中玉米和大米的污染率较高,农村居民因AF的饮食暴露而罹患肝癌及相关疾病的风险高于城市居民[74]。
畜禽主要通过对饲料的摄入从而遭受AF的毒害,近年来研究者对饲料卫生情况进行监测,结果表明AF仍是主要的污染源之一,严重影响畜禽健康。百奥明公司对全球饲料受霉菌毒素污染情况的调查结果显示,南亚和东南亚地区的饲料中AF污染比率较高,检出率达到了78%和55%,平均含量达到了128 μg/kg和61 μg/kg[75]。2016年,韩小敏等[76]对从国内8 个省份采集来的饲用玉米原料样品进行检测,结果发现,36.2%的样品受到不同程度的AF污染,AFB1的含量最高(0.3~181.3 μg/kg),7.5%的样品AFB1含量超标。杜妮[77]2016年对我国部分地区饲料及饲用原料霉菌毒素污染情况的调查结果显示:采集的376 份饲料原料样品中,AFB1的阳性检出率达72.45%,含量的中值为0.9 μg/kg,其中麸皮样品AFB1检出率最高;采集的211 份饲料样品中,AFB1的阳性检出率为88.68%。这说明2016年饲料样品AF暴露率仍较高,且高于主要饲料原料,这主要是因为饲料原料在形成饲料时,可能在运输、储存、加工等环节再次被AF污染,这些都加剧了饲料成品中AF的暴露。
6 食品中AFB1的防控
基于对食品中AFB1污染规律及性质的了解,笔者认为现阶段对食品中AFB1的防控应该从农产品生产加工、科研与检测、监管与宣传3 个方面入手开展工作。
6.1 对于农产品生产者、加工者
农作物在田间生长以及后来的干燥、储存、运输等过程中都应该注意防控AF的污染。首先在种植农作物时,应该注意选择抗旱、抗病、抗虫以及抗霉菌的品系[6]。曲霉属真菌在生长期农作物中的存在和生长主要依赖于环境,农作物的健康生长也有助于抵抗霉菌感染,因此合适的灌溉措施以及病虫害的防控都是必须的[78-79]:如干旱天气时,应适当加强灌溉;病虫害高发季节,应适当施用杀虫剂;在田间接种一些不会代谢产生霉菌毒素的真菌菌株,如枯草芽孢杆菌、乳酸菌、假单胞菌等[80];施用木霉菌等可显著抑制花生感染AFB1(P<0.05),抑制效率可达20%~90%[78];储存之前应适当地干燥,挑拣淘汰明显霉变和损坏的谷粒;储存过程中注意防虫、防鼠;监测环境温湿度[9,79]。农产品加工者应选购符合卫生标准的谷物原料,加工设备在使用前要清洗彻底,加工过程中可选用适当的吸附手段吸附霉菌毒素,降低食品中霉菌毒素的暴露[81]。
6.2 对于相关科研及检测部门
随着科技的进步,越来越多的针对饲料、农产品等霉菌毒素的脱毒技术被开发出来,其中较常见的脱毒方法主要可分为物理方法、化学方法、生物方法等[60,82]:如利用AFB1的光敏感性,通过紫外辐照或γ射线辐照等可达到脱毒目的;乳酸、柠檬酸、水杨酸、氨等可将AFB1降解成低毒产物[44,83];一些乳酸菌品系可以通过非共价结合的方式移除谷物中的AFB1[84];一些真菌分泌的酶类可以起到降解AFB1的作用,还有研究表明臭氧处理对移除AFB1污染也有一定的作用[2,85];另外多种红球菌也可以降解AFB1[86]。在接下来的研究工作中,相关科研部门应致力于开发更实际简便的脱毒方法,加大从田间管理到加工过程对AF污染及控制手段的研究力度,为食品安全提供科技支撑,而检测部门应继续开发快速、经济、易行的分析检测方法,为监测部门提供实时、准确的分析数据。
6.3 对于监管部门与媒体
在食品安全问题上,霉菌毒素的污染比有害菌、有毒添加剂的污染风险更高,致病性更强。但一些民众由于对霉菌毒素的性质认识不清,往往忽略了膳食中的霉菌毒素的污染问题,这就迫切需要卫生部门和食品安全管理部门重视霉菌毒素的风险评估、监测预警等工作[60]。相关管理部门应该从食品的来源、加工、销售等环节入手,严防源头,严控加工,严格检测,严厉执法;定期开展监测普查工作,尤其应该加强对农村食品市场的监测,做到早发现、早公开、早解决。媒体宣传部门应做好对霉菌毒素的科普教育工作,正确解读国家相关标准法规,引导消费者购买安全、健康、绿色的食品。
7 结 语
“民以食为天”,食品是人类生存的基本需求,食品安全是全世界的热门话题。作为主食来源的粮油食品面临的AF污染问题更应该引起广泛关注。揭示AF的毒性机理,开发实用的检测技术,严格遵守国家限量标准,创新高效实用的脱毒方法,才能减少AF的污染隐患,确保粮油食品安全、健康。同时,笔者在调研时还发现:近来对AF毒性研究的热点集中在肠毒性、神经毒性、免疫毒性等方面,而对其他毒素、AF的遗传毒性的研究不多;另外,全球普遍存在AF与其他类型霉菌毒素在食品中共存的现象,联合毒性作用正在研究中,目前国际上缺乏对食品中毒素共存的限量标准,这些都将成为未来科研工作的重要方向。
参考文献:
[1] BHAT R, REDDY K R N. Challenges and issues concerning mycotoxins contamination in oil seeds and their edible oils:updates from last decade[J]. Food Chemistry, 2017, 215: 425-437.DOI:10.1016/j.foodchem.2016.07.161.
[2] AIKO V, MEHTA A. Occurrence, detection and detoxification of mycotoxins[J]. Journal of Biosciences, 2015, 40(5): 943-954.DOI:10.1007/s12038-015-9569-6.
[3] RICHARD J L. Some major mycotoxins and their mycotoxicoses:an overview[J]. International Journal of Food Microbiology, 2007,119(1/2): 3-10. DOI:10.1016/j.ijfoodmicro.2007.07.019.
[4] CARVAJAL-MORENO M. Metabolic changes of aflatoxin B1to become an active carcinogen and the control of this toxin[J]. Immunome Research,2015, 11(3): 2-14. DOI:10.4172/1745-7580.10000104.
[5] PROBST C, NJAPAU H, COTTY P J. Outbreak of an acute aflatoxicosis in Kenya in 2004: identification of the causal agent[J].Applied & Environmental Microbiology, 2007, 73(8): 2762-2764.DOI:10.1128/AEM.02370-06.
[6] ABRAR M, ANJUM F M, BUTT M S, et al. Aflatoxins: biosynthesis,occurrence, toxicity, and remedies[J]. Critical Reviews in Food Science and Nutrition, 2013, 53(8): 862-874. DOI:10.1080/10408398.2011.563154.
[7] WILLIAMS J H, PHILLIPS T D, JOLLY P E, et al. Human aflatoxicosis in developing countries: a review of toxicology, exposure,potential health consequences, and interventions[J]. The American Journal of Clinical Nutrition, 2004, 80(5): 1106-1122.
[8] PEROMINGO B, RODRÍGUEZ A, BERNÁLDEZ V, et al. Effect of temperature and water activity on growth and aflatoxin production by Aspergillus flavus and Aspergillus parasiticus on cured meat model systems[J]. Meat Science, 2016, 122: 76-83. DOI:10.1016/j.meatsci.2016.07.024.
[9] GALLO A, SOLFRIZZO M, EPIFANI F, et al. Effect of temperature and water activity on gene expression and aflatoxin biosynthesis in Aspergillus flavus on almond medium[J]. International Journal of Food Microbiology, 2016, 217: 162-169. DOI:10.1016/j.ijfoodmicro.2015.10.026.
[10] ESPESO E A, ARST H N. On the mechanism by which alkaline pH prevents expression of an acid-expressed gene[J]. Molecular and Cellular Biology, 2000, 20(10): 3355-3363. DOI:10.1128/MCB.20.10.3355-3363.2000.
[11] COTTY P J, JAIME-GARCIA R. Influences of climate on aflatoxin producing fungi and aflatoxin contamination[J]. International Journal of Food Microbiology, 2007, 119(1): 109-115. DOI:10.1016/j.ijfoodmicro.2007.07.060.
[12] BRYDEN W L. Mycotoxin contamination of the feed supply chain:implications for animal productivity and feed security[J]. Animal Feed Science and Technology, 2012, 173(1): 134-158. DOI:10.1016/j.anifeedsci.2011.12.014.
[13] ALSHANNAQ A, YU J H. Occurrence, toxicity, and analysis of major mycotoxins in food[J]. International Journal of Environmental Research & Public Health, 2017, 14(6): 632-638. DOI:10.3390/ijerph14060632.
[14] WOGAN G N. Chemical nature and biological effects of the aflatoxins[J]. Bacteriological Reviews, 1966, 30(2): 460-468.
[15] KELLER N P, TURNER G, BENNETT J W. Fungal secondary metabolism-from biochemistry to genomics[J]. Nature Reviews Microbiology, 2005, 3(12): 937-947. DOI:10.1038/nrmicro1286.
[16] KEW M C. Aflatoxins as a cause of hepatocellular carcinoma[J]. Journal of Gastrointestinal & Liver Diseases, 2013, 22(3): 305-310.
[17] HEINRICH M. IARC monographs on the evaluation of carcinogenic risks to humans: some traditional herbal medicines, some mycotoxins,naphthalene and styrene[J]. Journal of Ethnopharmacology, 2002,88(2): 299-300.
[18] VERHEECKE C, LIBOZ T, MATHIEU F. Microbial degradation of aflatoxin B1: current status and future advances[J]. International Journal of Food Microbiology, 2016, 237: 1-9. DOI:10.1016/j.ijfoodmicro.2016.07.028.
[19] KEW M C. Synergistic interaction between aflatoxin B1and hepatitis B virus in hepatocarcinogenesis[J]. Liver International, 2003, 23(6): 405-409. DOI:10.1111/j.1478-3231.2003.00869.x.
[20] LLOVET J M, BURROUGHS A, BRUIX J. Hepatocellular carcinoma[J].Journal of Hepatology, 2003, 362: 1907. DOI:10.1038/nrdp.2016.18.
[21] BBOSA G S, KITYA D, ODDA J, et al. Aflatoxins metabolism,effects on epigenetic mechanisms and their role in carcinogenesis[J].Health, 2013, 5(10A): 14-34.
[22] GRENIER B, APPLEGATE T J. Modulation of intestinal functions following mycotoxin ingestion: meta-analysis of published experiments in animals[J]. Toxins, 2013, 5(2): 396-430. DOI:10.3390/toxins5020396.
[23] KUMAGAI S. Intestinal absorption and excretion of aflatoxin in rats[J]. Toxicology and Applied Pharmacology, 1989, 97(1): 88-97.DOI:10.1016/0041-008X(89)90057-4.
[24] YUNUS A W, RAZZAZI-FAZELI E, BOHM J. Aflatoxin B1in affecting broiler’s performance, immunity, and gastrointestinal tract:a review of history and contemporary issues[J]. Toxins, 2011, 3(6):566-590. DOI:10.3390/toxins3060566.
[25] YUNUS A W, GHAREEB K, ABD-EL-FATTAH A A M, et al. Gross intestinal adaptations in relation to broiler performance during chronic aflatoxin exposure[J]. Poultry Science, 2011, 90(8): 1683-1689.DOI:10.3382/ps.2011-01448.
[26] KANA J R, TEGUIA A, TCHOUMBOUE J. Effect of dietary plant charcoal from Canarium schweinfurthii Engl. and maize cob on aflatoxin B1toxicosis in broiler chickens[J]. Advances in Animal Biosciences, 2010, 1(2): 462-463. DOI:10.1017/S2040470010000841.
[27] YIN Heng, JIANG Min, PENG Xi, et al. The molecular mechanism of G2M cell cycle arrest induced by AFB1in the jejunum[J]. Oncotarget,2016, 7(24): 35592-35606. DOI:10.18632/oncotarget.9594.
[28] KUMAR R, BALACHANDRAN C. Histopathological changes in broiler chickens fed aflatoxin and cyclopiazonic acid[J]. Veterinarski Arhiv, 2009, 79: 31-40.
[29] LEDOUX D R, ROTTINGHAUS G E, BERMUDEZ A J, et al.Efficacy of a hydrated sodium calcium aluminosilicate to ameliorate the toxic effects of aflatoxin in broiler chicks[J]. Poultry Science,1999, 78(2): 204-210. DOI:10.1093/ps/78.2.204.
[30] GAIKWAD S S, PILLAI M M. Effect of aflatoxin B1in gastrointestine of mice[J]. Journal of Ecophysiology and Occupational Health, 2004, 4(3): 153-159.
[31] PETERSON L W, ARTIS D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis[J]. Nature Reviews Immunology, 2014, 14(3): 141-153. DOI:10.1038/nri3608.
[32] ROMERO A, ARES I, RAMOS E, et al. Mycotoxins modify the barrier function of Caco-2 cells through differential gene expression of specific claudin isoforms: protective effect of illite mineral clay[J].Toxicology, 2016, 353: 21-33. DOI:10.1016/j.tox.2016.05.003.
[33] LYNCH S V, PEDERSEN O. The human intestinal microbiome in health and disease[J]. New England Journal of Medicine, 2016,375(24): 2369-2379. DOI:10.1056/NEJMra1600266.
[34] WANG Jincheng, TANG Lili, GLENN T C, et al. Aflatoxin B1induced compositional changes in gut microbial communities of male F344 rats[J]. Toxicological Sciences, 2015, 150(1): 54-63. DOI:10.1093/toxsci/kfv259.
[35] KUCUKCAKAN B, HAYRULAI-MUSLIU Z. Challenging role of dietary aflatoxin B1exposure and hepatitis B infection on risk of hepatocellular carcinoma[J]. Open Access Macedonian Journal of Medical Sciences, 2015, 3(2): 363-369. DOI:10.3889/oamjms.2015.032.
[36] QIAN Guoqing, TANG Lili, LIN Shuhua, et al. Sequential dietary exposure to aflatoxin B1and fumonisin B1in F344 rats increases liver preneoplastic changes indicative of a synergistic interaction[J].Food and Chemical Toxicology, 2016, 95: 188-195. DOI:10.1016/j.fct.2016.07.017.
[37] LU Xiaoyan, HU Bin, SHAO Li, et al. Integrated analysis of transcriptomics and metabonomics profiles in aflatoxin B1-induced hepatotoxicity in rat[J]. Food and Chemical Toxicology, 2013, 55:444-455. DOI:10.1016/j.fct.2013.01.020.
[38] ZHANG Limin, YE Yangfang, AN Yanpeng, et al. Systems responses of rats to aflatoxin B1exposure revealed with metabonomic changes in multiple biological matrices[J]. Journal of Proteome Research, 2010,10(2): 614-623. DOI:10.1021/pr100792q.
[39] SINGH K B, MAURYA B K, TRIGUN S K. Activation of oxidative stress and inflammatory factors could account for histopathological progression of aflatoxin-B1induced hepatocarcinogenesis in rat[J].Molecular and Cellular Biochemistry, 2015, 401(1/2): 185-196.DOI:10.1007/s11010-014-2306-x.
[40] LIU Yan, CHANG Chungchou, MARSH G M, et al. Population attributable risk of aflatoxin-related liver cancer: systematic review and meta-analysis[J]. European Journal of Cancer, 2012, 48(14): 2125-2136. DOI:10.1016/j.ejca.2012.02.009.
[41] YUAN Shibin, WU Bangyuan, YU Zhengqiang, et al. The mitochondrial and endoplasmic reticulum pathways involved in the apoptosis of bursa of Fabricius cells in broilers exposed to dietary aflatoxin B1[J]. Oncotarget, 2016, 7(40): 65295-65306. DOI:10.18632/oncotarget.11321.
[42] YANG He, JING Fang, XI Peng, et al. Effects of sodium selenite on aflatoxin B1-induced decrease of ileac T cell and the mRNA contents of IL-2, IL-6, and TNF-α in broilers[J]. Biological Trace Element Research, 2014, 159(1): 167-173. DOI:10.1007/s12011-014-9999-2.
[43] SHANK R C, WOGAN G N. Acute effects of aflatoxin B1on liver composition and metabolism in the rat and duckling[J]. Toxicology and Applied Pharmacology, 1966, 9(3): 468-476.
[44] JEBALI R, ABBÈS S, SALAHABBÈS J B, et al. Ability of lactobacillus plantarum MON03 to mitigate aflatoxins (B1and M1)immunotoxicities in mice.[J]. Journal of Immunotoxicology, 2015,12(3): 1-10. DOI:10.3109/1547691X.2014.973622.
[45] MEISSONNIER G M, PINTON P, LAFFITTE J, et al. Immunotoxicity of aflatoxin B1: impairment of the cell-mediated response to vaccine antigen and modulation of cytokine expression[J]. Toxicology& Applied Pharmacology, 2008, 231(2): 142-149. DOI:10.1016/j.taap.2008.04.004.
[46] HUSSEIN H S, BRASEL J M. Toxicity, metabolism, and impact of mycotoxins on humans and animals[J]. Toxicology, 2001, 167(2): 101-134. DOI:10.1016/S0300-483X(01)00471-1.
[47] CARVAJAL-MORENO M. Metabolic changes of aflatoxin B1to become an active carcinogen and the control of this toxin[J].Immunome Research, 2015, 11(3): 112-119. DOI:10.4172/1745-7580.10000104.
[48] LAI Hao, MO Xianwei, YANG Yang, et al. Association between aflatoxin B1occupational airway exposure and risk of hepatocellular carcinoma: a case-control study[J]. Tumor Biology, 2014, 35(10):9577-9584. DOI:10.1007/s13277-014-2231-3.
[49] MAGNUSSEN A, PARSI M A. Aflatoxins, hepatocellular carcinoma and public health[J]. World Journal of Gastroenterology, 2013, 19(10):1508-1512. DOI:10.3748/wjg.v19.i10.1508.
[50] HAMID A S, TESFAMARIAM I G, ZHANG Y, et al. Aflatoxin B1-induced hepatocellular carcinoma in developing countries: geographical distribution, mechanism of action and prevention[J]. Oncology Letters,2013, 5(4): 1087-1092. DOI:10.3892/ol.2013.1169.
[51] SOINI Y, CHIA S C, BENNETT W P, et al. An aflatoxin-associated mutational hotspot at codon 249 in the p53 tumor suppressor gene occurs in hepatocellular carcinomas from Mexico[J]. Carcinogenesis,1996, 17(5): 1007-1012. DOI:10.1093/carcin/17.5.1007.
[52] SHI Jiejun, HE Jiangtu, LIN Jing, et al. Distinct response of the hepatic transcriptome to aflatoxin B1induced hepatocellular carcinogenesis and resistance in rats[J]. Scientific Reports, 2016, 6: 31898-31905.DOI:10.1038/srep31898.
[53] XU Xiangru, HUANG Jian, XU Zhigang, et al. Insight into hepatocellular carcinogenesis at transcriptome level by comparing gene expression profiles of hepatocellular carcinoma with those of corresponding noncancerous liver[J]. Proceedings of the National Academy of Sciences,2001, 5(4): 15089-15094. DOI:10.1073/pnas.241522398.
[54] SCHMITT R. Regulations relating to mycotoxins in food[J]. Analytical and Bioanalytical Chemistry, 2007, 389(1): 147-157. DOI:10.1007/s00216-007-1317-9.
[55] JOHNSON J R, WILLIAMS G, PAZDUR R. End points and united states food and drug administration approval of oncology drugs[J].Journal of the American Society of Clinical Oncology, 2003, 21(7):1404-1411. DOI:10.1200/JCO.2003.08.072.
[56] 卫生部. 食品安全国家标准 食品中真菌毒素限量: GB 2761—2011[S].北京: 中国标准出版社, 2011: 2-4.
[57] CORDEIRO F, BAER I, ROBOUCH P, et al. Setting maximum limits for trace elements in baby food in European legislation[J]. Food Additives & Contaminants, 2013, 30(4): 678-686. DOI:10.1080/19440049.2013.775605.
[58] World Health Organization. Eightieth report of the joint FAO/WHO expert committee on food additives[J]. World Health Organization Technical Report, 2016, 7: 1-14.
[59] 李培武, 丁小霞, 白艺珍, 等. 农产品黄曲霉毒素风险评估研究进展[J]. 中国农业科学, 2013, 46(12): 2534-2542. DOI:10.3864/j.issn.0578-1752.2013.12.014.
[60] KUMAR P, MAHATO D K, KAMLE M, et al. Aflatoxins: a global concern for food safety, human health and their management[J].Frontiers in Microbiology, 2016, 7: 1-10. DOI:10.3389/fmicb.2016.02170.
[61] MAGAN N, ALDRED D. Post-harvest control strategies:minimizing mycotoxins in the food chain[J]. International Journal of Food Microbiology, 2007, 119(1): 131-139. DOI:10.1016/j.ijfoodmicro.2007.07.034.
[62] ZHANG Niya, QI Ming, GAO Xin, et al. Response of the hepatic transcriptome to aflatoxin B1in ducklings[J]. Toxicon, 2016, 111: 69-76. DOI:10.1016/j.toxicon.2015.12.022.
[63] MONSON M S, SETTLAGE R E, MCMAHON K W, et al.Response of the hepatic transcriptome to aflatoxin B1in domestic turkey (Meleagris gallopavo)[J]. PLoS ONE, 2014, 9(6): e100930.DOI:10.1371/journal.pone.0100930.
[64] THEUMER M G, LOPEZ A G, MASIH D T, et al. Immunobiological effects of AFB1and AFB1-FB1mixture in experimental subchronic mycotoxicoses in rats[J]. Toxicology, 2003, 186(1): 159-170.DOI:10.1016/S0300-483X(02)00603-0.
[65] PENG Xi, YU Zhengqiang, LIANG Na, et al. The mitochondrial and death receptor pathways involved in the thymocytes apoptosis induced by aflatoxin B1[J]. Oncotarget, 2016, 7(11): 12222-12234.DOI:10.18632/oncotarget.7731.
[66] MUGHAL M J, PENG X, KAMBOH A A, et al. Aflatoxin B1induced systemic toxicity in poultry and rescue effects of selenium and zinc[J].Biological Trace Element Research, 2017, 178: 1-9. DOI:10.1007/s12011-016-0923-9.
[67] JIANG Min, PENG Xi, FANG Jing, et al. Effects of aflatoxin B1on T-cell subsets and mRNA expression of cytokines in the intestine of broilers[J]. International Journal of Molecular Sciences, 2015, 16(4):6945-6959. DOI:10.3390/ijms16046945.
[68] YU Zhengqiang, WANG Fengyuan, LIANG Na, et al. Effect of selenium supplementation on apoptosis and cell cycle blockage of renal cells in broilers fed a diet containing aflatoxin B1[J]. Biological Trace Element Research, 2015, 168(1): 242-251. DOI:10.1007/s12011-015-0344-1.
[69] PENG Xi, ZHANG Keying, BAI Shiping, et al. Histological lesions,cell cycle arrest, apoptosis and T cell subsets changes of spleen in chicken fed aflatoxin-contaminated corn[J]. International Journal of Environmental Research & Public Health, 2014, 11(8): 8567-8580.DOI:10.3390/ijerph110808567.
[70] 彭凯, 吴薇, 龙蕾, 等. 饲料中霉菌毒素的危害及脱毒方法[J]. 饲料工业, 2015, 36(6): 58-61. DOI:10.13302/j.cnki.fi.2015.06.013.
[71] LEE H J, RYU D. Worldwide occurrence of mycotoxins in cereals and cereal derived food products: public health perspectives of their co-occurrence[J]. Journal of Agricultural and Food Chemistry, 2016,65(33): 7034-7051. DOI:10.1021/acs.jafc.6b04847.
[72] 黄建锋, 姜侃, 刘鹏鹏, 等. 我国主要食品中黄曲霉毒素B1的调查分析[J]. 食品工业, 2016(3): 295-297.
[73] 张维蔚, 何洁仪, 李迎月, 等. 2009-2013年广州市市售粮油食品黄曲霉毒素B1调查[J]. 中国食品卫生杂志, 2015, 27(3): 291-294.DOI:10.13590/j.cjfh.2015.03.015.
[74] 王君, 刘秀梅. 中国人群黄曲霉毒素膳食暴露量评估[J].中国食品卫生杂志, 2007, 19(3): 238-240. DOI:10.3969/j.issn.1004-8456.2007.03.012.
[75] PINOTTI L, OTTOBONI M, GIROMINI C, et al. Mycotoxin contamination in the EU feed supply chain: a focus on cereal byproducts[J]. Toxins, 2016, 8(2): 45-53. DOI:10.3390/toxins8020045.
[76] 韩小敏, 张宏元, 张靖, 等. 中国94 份玉米饲料原料中真菌及其毒素污染状况调查[J]. 中华预防医学杂志, 2016, 50(10): 907-911.DOI:10.3760/cma.j.issn.0253-9624.2016.10.013.
[77] 杜妮. 2016年我国部分地区饲料及饲用原料霉菌毒素污染调查报告[J]. 猪业科学, 2016, 33(2): 46-48. DOI:10.3969/j.issn.1673-5358.2016.02.017.
[78] BROWN R L, BHATNAGAR D. Foreword: aflatoxins in maize and other crops[J]. World Mycotoxin Journal, 2015, 8(2): 135-136.DOI:10.3920/WMJ2014.1766.
[79] BHATNAGAR-MATHUR P, SUNKARA S, BHATNAGARPANWAR M, et al. Biotechnological advances for combating Aspergillus flavus, and aflatoxin contamination in crops[J]. Plant Science, 2015, 234: 119-132. DOI:10.1016/j.plantsci.2015.02.009.
[80] ABBAS H K, ZABLOTOWICZ R M, BRUNS H A, et al. Biocontrol of aflatoxin in corn by inoculation with non-aflatoxigenic Aspergillus flavus isolates[J]. Biocontrol Science and Technology, 2006, 16(5):437-449. DOI:10.1080/09583150500532477.
[81] KARLOVSKY P, SUMAN M, BERTHILLER F, et al. Impact of food processing and detoxification treatments on mycotoxin contamination[J]. Mycotoxin Research, 2016, 32(4): 1-27.DOI:10.1007/s12550-016-0257-7.
[82] SHCHERBAKOVA L, STATSYUK N, MIKITYUK O, et al.Aflatoxin B1degradation by metabolites of phoma glomerata pg41 isolated from natural substrate colonized by aflatoxigenic Aspergillus flavus[J]. Jundishapur Journal of Microbiology, 2015, 8(1): e24324.DOI:10.5812/jjm.24324.
[83] UMESHA S, MANUKUMAR H M, CHANDRASEKHAR B, et al.Aflatoxins and food pathogens: impact of biologically active aflatoxins and their control strategies[J]. Journal of the Science of Food &Agriculture, 2016, 97: 1698-1707. DOI:10.1002/jsfa.8144.
[84] ABBÈS S, BEN S J, JEBALI R, et al. Interaction of aflatoxin B1and fumonisin B1in mice causes immunotoxicity and oxidative stress: possible protective role using lactic acid bacteria[J]. Journal of Immunotoxicology, 2015, 14: 46-54. DOI:10.3109/1547691X.2014.997905.
[85] AGRIOPOULOU S, KOLIADIMA A, KARAISKAKIS G, et al. Kinetic study of aflatoxins’ degradation in the presence of ozone[J]. Food Control, 2016, 61: 221-226. DOI:10.1016/j.foodcont.2015.09.013.
[86] CSERHÁTI M, KRISZT B, KRIFATON C, et al. Mycotoxindegradation profile of Rhodococcus strains[J]. International Journal of Food Microbiology, 2013, 166(1): 176-185. DOI:10.1016/j.ijfoodmicro.2013.06.002.

