植物食品原料中酚酸的生物合成与调控及其生物活性研究进展
陈志杰,吴嘉琪,马 燕,王 沛,顾振新,杨润强,*
酚酸是在高等植物中广泛分布的含有酚羟基和羧基的一类重要的次生代谢产物。植物体内酚酸作为信号分子在植物与微生物的共生、植物防御等方面起重要作用[1],如水杨酸是通过诱导产生的一种重要的防御化合物,作为信号分子参与植物的防御[2-3]。同时,酚酸类物质作为合成木质素的中间产物,对于植物结构的形成也具有重要作用,参与木质素合成的对香豆醇、松柏醇和芥子醇等木质醇单体物质分别由对香豆酸、阿魏酸和芥子酸等酚酸通过一系列生化反应最终形成。
植物食品原料中酚酸类物质在生物活性等方面的研究相对滞后,直到二十世纪八十年代初期,有研究者系统提出了植物食品原料中游离、酯化和结合酚酸的提取和纯化工艺后,酚酸类物质的鉴定及生物活性等方面的研究才开始蓬勃开展起来。以往普遍认为果蔬比谷物原料具有更好的抗氧化性,随着研究的深入,研究者发现谷物等食品原料中含有大量的结合酚类物质,其主要成分为酚酸。大量研究表明,阿魏酸是禾本科植物原料中最主要的酚酸,并且主要以结合态的形式广泛参与植物组织结构的形成[4-5]。目前已从植物中成功地分离、鉴定了1 000余种酚酸类化合物,并对其中一些酚酸及其衍生物开展了广泛的生物活性及药理方面的研究。研究表明,酚酸具有抗氧化[6-7]、抗菌[8]、抗癌[9]等一系列生物活性。虽然植物食品原料细胞壁上结合型酚酸在人体消化道内难以被消化吸收,并最终转运到结肠,但结肠上微生物群落分泌的相关酶能够使这些结合型组分大量释放,从而可以有效地降低结肠癌发生的几率[10]。研究植物食品原料中的酚酸,不仅有助于更加清楚地了解其组成及分布,同时对于进一步挖掘其功能营养价值具有重要的现实意义。基于此,本文对植物食品原料中酚酸的类型及其结构、生物合成与调控及生物活性等方面进行了综述。
1 酚酸类型及其结构
从植物中发现的酚酸类化合物主要有羟基苯甲酸和羟基肉桂酸两类。羟基苯甲酸类酚酸包括没食子酸、对羟基苯甲酸、原儿茶酸、水杨酸和香草酸等,这些化合物具有C6-C1型骨架,以苯甲酸为母核。羟基苯甲酸类酚酸在植物中主要以结合态形式存在,是一些复杂化合物如木质素和可水解单宁的结构成分,同时在植物中还能与糖类、有机酸结合形成各种酚酸衍生物[10]。羟基肉桂酸类酚酸包括对香豆酸、咖啡酸、阿魏酸、5-羟基阿魏酸和芥子酸等,这些化合物具有C6-C3型骨架,以肉桂酸为母核。羟基肉桂酸类酚酸在植物中也主要以结合态形式存在,通过醚健与木质素、酯键与细胞壁中结构碳水化合物和蛋白质等组分结合[10-11],植物细胞壁中酚酸与结构组分之间的交联见图1。常见酚酸化学结构见表1。
除上述两类酚酸以外,植物中还存在一些重要的具有生理活性的缩合酚酸,如绿原酸、丹酚酸等。绿原酸是由咖啡酸和奎尼酸通过酯键结合而形成,丹酚酸A是由1 分子丹参素与2 分子咖啡酸缩合而成,丹酚酸B由3 分子丹参素与1 分子咖啡酸缩合而成,它们的化学结构见图2。
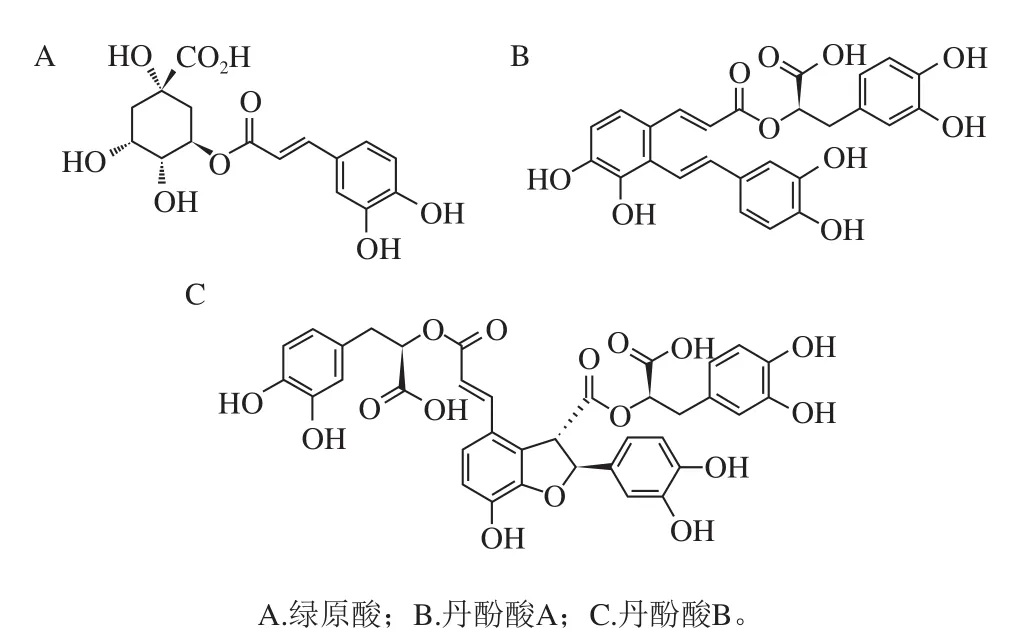
图2 缩合酚酸的化学结构Fig. 2 Chemical structures of condensed phenolic acids
2 酚酸合成途径及相关酶
植物酚类化合物生物合成前体物质主要来源于植物细胞中两个分解代谢过程:糖酵解和磷酸戊糖途径。糖酵解产生的磷酸烯醇式丙酮酸和磷酸戊糖途径产生的赤藓糖-4-磷酸通过莽草酸途径、苯丙烷类代谢途径最终形成包括酚酸在内的各种酚类化合物[12-13]。
2.1 莽草酸途径及相关酶
莽草酸途径是植物细胞中一条重要的代谢途径,该途径由磷酸烯醇式丙酮酸和赤藓糖-4-磷酸开始经过7 步酶促反应,最终反应生成分支酸,之后进一步合成色氨酸(Trp)、苯丙氨酸(Phe)和酪氨酸(Tyr)等芳香族氨基酸。莽草酸途径见图3。

图3 植物中莽草酸途径[13]Fig. 3 Synthesis pathway of shikimic acid in plants[13]
莽草酸途径最终产物分支酸通过分支酸变位酶作用进一步转化为预苯酸,随后预苯酸通过阿罗酸和苯丙酮酸/4-羟基苯丙酮酸两条途径转变为苯丙氨酸或酪氨酸。在阿罗酸途径中预苯酸通过预苯酸转氨酶转化为阿罗酸,阿罗酸在阿罗酸脱水酶的催化下脱水和脱羧形成苯丙氨酸,在阿罗酸脱氢酶的催化下脱氢和脱羧形成酪氨酸。研究表明,阿罗酸途径是植物中合成苯丙氨酸的主要途径[13-14]。
2.2 苯丙烷类代谢途径及相关酶
苯丙烷类代谢途径产生一系列苯丙烷类化合物,最终产物为对香豆酰辅酶A。对香豆酰辅酶A作为重要的前体物质进一步形成包括羟基肉桂酸、木质醇单体、黄酮、香豆素、芪类、原花青素和木质素等在内的多种酚类化合物[12]。苯丙烷类化合物在植物体内具有形成和诱导产生物理和化学屏障来抵御真菌和细菌的感染等功能,同时作为信号分子在植物发育和植物防御中发挥重要作用[15]。苯丙烷类代谢途径见图4。

图4 植物中苯丙烷类代谢途径Fig. 4 Metabolic pathway of phenylpropanes in plants
苯丙烷类代谢途径起始步骤是在PAL的催化下完成,L-苯丙氨酸通过脱氨基形成反式肉桂酸[16-18]。1961年,Koukol等[18]首次在大麦中发现该酶,并对PAL进行了纯化和相关酶学性质的研究。研究表明,PAL广泛存在于高等植物中,在真菌中也发现其存在,但在动物组织中还未发现其存在[19-21]。欧阳光察等[22]对水稻和小麦PAL的酶学特性进行了研究,结果表明:两种来源的PAL最适温度均为40 ℃,且水稻PAL的耐热性高于小麦;水稻PAL最适pH值为9.2,小麦为8.8,水稻PAL稳定的pH值范围比小麦更偏向于碱侧;水稻PAL的米氏常数(Km)为5.94×10-4mol/L,小麦Km有两个值,分别为0.625×10-4mol/L和3.100×10-4mol/L。同时这两种来源的PAL均能被N-乙基马来酰亚胺所抑制。
PAL由多基因家族编码,一些对应基因及其表达模式已被广泛地研究与分析。编码PAL的基因数量在不同植物中有所不同,例如荷兰芹中发现有4 个PAL基因,西红柿中有5 个PAL基因,马铃薯中有40~50 个PAL基因[23]。PAL是苯丙烷类代谢途径的关键酶与限速酶,PAL活性对植物苯丙烷类代谢产物的形成速率具有重要的影响。PAL活性受植物种类、个体发育阶段、环境条件等因素的影响[16]。生物化学、酶学、结构生物学和分子遗传学的研究结果表明,存在多种调控机制来控制植物细胞中PAL活性,这些调控机制包括产物抑制、转录与翻译的调控、翻译后失活与蛋白水解、酶组织和亚细胞定位及代谢物反馈调控[17]。
C4H属于细胞色素P450家族成员,编码该酶的基因C4H是植物中第一个被克隆出来的细胞色素基因,也是第一个确定功能的植物细胞色素基因[24]。C4H催化肉桂酸的羟基化形成对香豆酸,对香豆酸属于羟基肉桂酸类酚酸化合物。Russell[25]对豌豆苗中C4H的特性及其代谢与发育控制因素进行研究与分析,指出豌豆苗中C4H是一种微粒体混合功能氧化酶,催化过程中需要分子氧、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)和2-巯基乙醇共同参与,该酶的最适反应pH值为7.5,Km为1.7×10-5mol/L,催化形成的产物对其活性有很强的调控作用,CO对催化反应具有抑制作用;不同部位和生长阶段该酶活性有较大变化,顶芽中活性最高,且随着成熟度增加,活性急剧下降。在光照和黑暗生长条件下,研究玉米幼苗在早期生长期间C4H的活性变化,发现光照条件下生长的幼苗中嫩芽部位总酶活性在栽培的第5天达到最高,然后随着生长酶活性逐渐下降,并且酶活性受到放线菌酮的完全抑制;在黑暗生长条件下,在根和子叶中同样检测到该酶的活性,且C4H的活性在生长过程中先增加后降低[26]。从鸭儿芹克隆到1 条1 631 bp长的C4H基因CjC4H,该基因的开放阅读框长度为1 521 bp,可以编码506 个氨基酸,蛋白质分子质量为58.13 kDa,等电点为9.38;同时,通过实时定量聚合酶链式反应(polymerase chain reaction,PCR)检测了鸭儿芹中CjC4H基因在不同温度下的响应表达,38 ℃处理4 h,CjC4H基因表达量远高于10、18 ℃和30 ℃温度下处理[24]。Knobloch等[27]对大豆细胞悬浮培养中4CL的同工酶进行分离和纯化,并对其酶学特性进行了研究;结果表明,这两种同工酶具有相似的分子质量,它们对于底物的特异性具有显著区别。同时发现4CL在0 ℃以上时在缓冲溶液中极不稳定,可以通过添加一定浓度的多元醇使该酶的稳定性得到显著提高,并且两种同工酶分别在pH 8.3和pH 7.7时具有最大的酶催化活性。
2.3 羟基苯甲酸类酚酸生物合成及相关酶
2.3.1 没食子酸生物合成及相关酶
没食子酸是生物体内参与生成酯键最频繁的有机酸之一。对于没食子酸的生物合成研究已有近50 年的历史,也提出了许多不同的生物合成途径:1)通过莽草酸途径产生的中间代谢产物3-脱氢莽草酸直接脱氢合成;2)通过苯丙氨酸逐步合成3,4,5-三羟基肉桂酸,然后通过氧化酶作用合成;3)通过咖啡酸氧化生成原儿茶酸,再经羟化酶作用生成。其中3-脱氢莽草酸脱氢合成没食子酸途径被认为是植物中合成没食子酸的主要途径[28-33]。
2.3.2 水杨酸生物合成及相关酶
在植物中存在两种水杨酸生物合成途径,一种是起始于苯丙氨酸,由PAL催化形成肉桂酸,肉桂酸氧化为苯甲酸,然后通过苯甲酸-2-羟化酶C2位置的羟基化作用形成水杨酸。另一种是起始于莽草酸途径产生的分支酸,由异分支酸合酶催化形成异分支酸,再由丙酮酸裂解酶催化形成水杨酸。
2.4 羟基肉桂酸类酚酸生物合成及相关酶
目前,有关植物中羟基肉桂酸类酚酸合成途径的研究已取得较大进展,但仍有部分酚酸及其相关酶的特性还有待进一步研究。在植物中由对香豆酸生成其他羟基肉桂酸类酚酸(如咖啡酸、阿魏酸、5-羟基阿魏酸及芥子酸)的反应需要羟化酶和氧甲基转移酶的参与来完成。
2.4.1 咖啡酸生物合成及相关酶
对香豆酸-3-羟化酶(p-coumarate 3-hydroxylase,C3H)是一种细胞色素P450单加氧酶,是咖啡酸和木质素生物合成途径中的关键酶和限速酶。尽管在过去的几十年中,已有大量的研究者试图纯化和分析C3H,但是目前对于该酶的本质特征还未彻底阐述清楚[34]。先前的研究及推测普遍认为,C3H主要催化对香豆酸羟基化形成咖啡酸,而通过对木质素生物合成途径的进一步研究表明,C3H还能催化对香豆酰莽草酸和对香豆酰奎尼酸C3位置的羟基化反应分别生成咖啡酰莽草酸和咖啡酰奎尼酸[35-37]。Franke等[34]采用定位克隆方法分离了拟南芥降低表皮荧光突变体中的REF8基因,通过野生型基因在酵母中的表达证实该基因编码C3H,该酶除了以对香豆酸作为底物以外,还对其他对羟基化的底物也具有显著的活性。
2.4.2 阿魏酸生物合成及相关酶
咖啡酸氧甲基转移酶(caffeic acid O-methyltransferase,COMT)是一种依赖S-腺苷-L-甲硫氨酸的氧甲基转移酶,是合成阿魏酸的关键酶[38]。在单子叶和双子叶被子植物中已证实COMT能够分别催化咖啡酸和5-羟基阿魏酸的甲基化从而生成阿魏酸和芥子酸[38-40];然而在裸子植物中COMT被认为只能催化阿魏酸而不能催化5-羟基阿魏酸的转化[40]。COMT具有较广的催化特异性,COMT还能催化5-羟基松柏醛和5-羟基松柏醇的甲基化生成芥子醛和芥子醇[38],也能催化咖啡酰辅酶A和5-羟基阿魏酰辅酶A分别生成阿魏酰辅酶A和芥子酰辅酶A[40]。小麦苗组织中COMT对咖啡酸和5-羟基阿魏酸底物的催化具有特异性,根、芽、叶及胚芽鞘中的COMT活性(以咖啡酸为底物)在小麦苗生长到第3天时均达到最大值,其中根中的酶活性最高;在生长后期的根与芽中测得的以5-羟基阿魏酸为底物的COMT活性高于以咖啡酸为底物的酶活性。同时进一步推测,COMT在小麦苗生长早期优先催化咖啡酸形成阿魏酸,可能涉及到与阿拉伯木聚糖的酯化作用;而在生长晚期优先催化5-羟基阿魏酸形成芥子酸可能与木质醇单体的形成密切相关[39]。此外,阿魏酸在植物中还存在另外一条重要的合成途径,即由苯丙烷类代谢途径产生的对香豆酰辅酶A,进一步转化为对香豆醛、松柏醛等化合物,并最终通过松柏醛脱氢酶(coniferyl-aldehyde dehydrogenase,CAD)将松柏醛转化为阿魏酸。目前,银合欢[41]、黑麦草[42]和红麻[43]等多种植物中编码合成COMT的基因已被成功克隆与表达。阿魏酸生物合成及相关合成见图5。

图5 阿魏酸生物合成Fig. 5 Biosynthesis of ferulic acid
2.4.3 5-羟基阿魏酸生物合成及相关酶
阿魏酸-5-羟化酶(ferulic acid 5-hydroxylase,F5H)在植物体内催化阿魏酸C5位的羟基化反应生成5-羟基阿魏酸,也能够催化松柏醛及松柏醇的羟基化反应,并在羟基肉桂酸类酚酸的合成中发挥关键的调控作用[44]。植物中F5H经鉴定是一种细胞色素P450依赖性单加氧酶[45-46]。Grand[45]最早对植物中F5H的相关特性进行了研究,对其底物特异性研究表明,该酶除了以阿魏酸(Km=6.3×10-5mol/L)作为底物外,肉桂酸也能作为底物被催化形成对香豆酸(Km=1.9×10-5mol/L)。在黑暗及体积分数为10% CO环境条件下,F5H活性被抑制41%,光照条件能够减少对该酶的抑制作用,在空气条件下,光照对于F5H活性没有任何影响。
3 酚酸代谢调控
虽然植物食品原料中含有一定量的酚酸,但是可以通过营养物质的添加及非生物胁迫等方式的调控,使酚酸得以富集,进一步提高植物食品原料的营养价值。
3.1 氮素调控
氮是植物必需的营养元素之一,氮肥的合理施用是调控植物生长及改善其品质的重要方式。Kováčik等[47]研究表明,氮缺乏会提高植物中PAL活性,从而引起酚酸水平的提高,而且羟基苯甲酸类和羟基肉桂酸类酚酸的合成积累可能受不同方式的调控。不同的灌溉方式与施氮量对小麦籽粒中酚酸的形成也会产生影响,适当增加施氮量会提高阿魏酸、对香豆酸和香草酸的含量[48]。
3.2 盐胁迫调控
研究发现,糯米中总酚酸含量随着浸泡溶液NaCl质量浓度和温度的提高呈现增加的趋势,当糯米浸泡在30 g/L的NaCl溶液中时,得到最高的总酚含量;经NaCl溶液与高温浸泡后,糯米中原儿茶酸、对香豆酸和阿魏酸3 种酚酸的含量均有不同程度的增加[49]。75 mmol/L NaCl处理也能够显著增加马郁兰中没食子酸、咖啡酸、香草酸和反式-2-羟基肉桂酸等酚酸的含量[50]。
3.3 低温及渗透胁迫调控
研究发现低温胁迫对植物中酚酸含量也会产生影响,使葡萄种子在10 ℃低温胁迫条件下发芽,发芽种子中会含有更高的总酚、没食子酸和咖啡酸含量,而对香豆酸和阿魏酸含量会降低[51]。Swigonska等[52]在大豆发芽过程中采用低温与渗透胁迫处理,发现延长低温胁迫时间会导致大豆芽根中紫丁香酸、对香豆酸和阿魏酸含量的下降,而芥子酸含量会增加;在渗透胁迫下,大豆芽根中香草酸和芥子酸含量显著增加,并认为这可能与它们具有更强的抗氧化能力有关。
3.4 光照调控
中波紫外线(ultraviolet-B,UV-B)持续辐照会对植物的光合作用、蒸腾作用和授粉等产生不利的影响,还会造成细胞损伤和DNA改变。为了避免受到这些伤害,植物会诱导合成黄酮及酚酸类化合物,这些酚类化合物同时会吸收UV-B,并在表皮细胞积累,从而保护光合组织。刘景玲等[53]研究表明UV-B辐射与干旱单独处理对丹参中酚酸的积累均有促进作用,而且UV-B辐射相比干旱处理作用更加显著,两种因子复合处理对酚酸类物质积累表现为加强或交互抗性作用。此外,Liu Hongkai等[54]研究了不同光源对豌豆芽中酚酸类物质含量的影响,发现蓝色LED灯处理显著增加了绿原酸、没食子酸、咖啡酸、对香豆酸和阿魏酸的含量。
3.5 其他调控
植物激素是植物体内合成的一类对植物的生长发育具有显著调节作用的微量小分子有机化合物。Liang Zongsuo等[55]研究了3 种植物激素及它们之间的交互作用对丹参毛状根中酚酸含量的影响,分析表明脱落酸、赤霉素和乙烯均能有效地诱导丹参毛状根中咖啡酸、迷迭香酸和丹酚酸B的形成,而且赤霉素信号对于脱落酸和乙烯诱导的酚类产物是必需的。Kováčik等[56]采用不同浓度的铜和镉溶液来培养母菊,当采用120 μmol/L CuCl2处理时,母菊根中绿原酸含量比不添加任何化学物质的对照组提高了21 倍;高浓度的CuCl2和CdCl2处理,均能提高咖啡酸、阿魏酸和芥子酸的含量,而且CuCl2处理相比CdCl2处理对酚酸的积累更加有效,同时植物组织酚代谢网络产生的各类酚类物质能够有效地保护由过量金属元素导致的氧化应激。
4 酚酸的生物活性
酚酸类物质除具有较好的止血、止泻、抗炎镇痛和保护血管等作用外,还具有抗氧化、抗菌及抗癌等重要作用。
4.1 抗氧化作用
酚酸因其具有较强的抗氧化活性而成为当前研究的热点。酚酸通过其自身的羟基能够清除几乎所有类似自由基的氧化剂分子[57]。Sevgi等[57]采用4 种抗氧化活性评价方法对咖啡酸、绿原酸及阿魏酸等10 种酚酸的抗氧化活性进行了评价,结果表明,迷迭香酸具有最强的抗氧化活性,而原儿茶酸用β-胡萝卜素漂白法、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除法和螯合作用分析法测定时具有最弱的抗氧化活性。体外抗氧化研究表明,咖啡酸具有较强的DPPH自由基和2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基清除活性、铁离子还原能力,并极显著高于二丁基羟基甲苯[58]。阿魏酸能有效清除Fenton反应生成的·OH和次黄嘌呤-黄嘌呤氧化酶系统产生的O2-·以及DPPH自由基,对红细胞溶血和血清自氧化均具有保护作用,并能有效地抑制肝匀浆自发性和Fe2+诱导性脂质过氧化[59]。研究表明,稻米、燕麦和小麦等结合酚酸类提取物均具有较强的自由基清除能力[5,60-61]。
4.2 抗菌作用
Sánchez-Maldonado等[62]从结构与功能的关系等方面研究了6 种羟基苯甲酸和6 种羟基肉桂酸的抗菌作用,结果表明酚酸的抗菌活性随pH值的下降而增加,羟基苯甲酸类酚酸的抗菌效果随羟基基团数目的减少而增强,但羟基基团数目对羟基肉桂酸类酚酸影响较小;羟基苯甲酸类酚酸的抗菌效果伴随甲氧基基团取代羟基基团而增强,但羟基肉桂酸类酚酸则无此现象。Herald等[63]研究了咖啡酸、阿魏酸和对香豆酸3 种酚酸在不同pH值条件下对大肠杆菌、金黄色葡萄球菌和蜡状芽孢杆菌的抗菌效果,研究表明对香豆酸是最有效的抑菌剂,pH值下降会增加对大肠杆菌和金黄色葡萄球菌的抑制效果,而蜡状芽孢杆菌在较高的pH值条件下具有最大的抑菌效果。此外,对香豆酸能够破坏细菌的细胞膜,且能与DNA双螺旋结构中的磷酸根离子结合,从而抑制细胞的功能,并最终导致其细胞的凋亡[64]。
4.3 抗癌作用
癌症病原学指出,自由基对于癌症的发生起主要作用,因此饮食中抗氧化剂的摄入对于人体不良细胞的生长具有潜在抑制作用[65]。Fahrioğlu等[66]研究发现阿魏酸能够作为一种抗癌剂影响MIA PaCa-2人胰腺癌细胞的细胞周期、凋亡、侵袭及菌落形成等行为。研究表明,阿魏酸和咖啡酸的烷基酯类衍生物也具有抗癌活性,且在相同烷基基团取代条件下咖啡酸烷基酯相比阿魏酸烷基酯有更好的抗癌活性[67]。Roy等[68]通过细胞毒性实验揭示在一定的浓度范围内阿魏酸和对香豆酸这两种植物源酚酸能够有效地杀死结肠直肠癌细胞,当存在这两种酚酸时,表皮生长因子受体基因表达会下调。对没食子酸的研究也表明,它能够抑制胶质瘤细胞的活力与增殖,并减少胶质瘤细胞介导的血管生成,对于脑瘤的治疗可能具有重要的价值[69]。
4.4 其他生物活性
Jung等[70]通过评估米糠酚酸提取物及阿魏酸对2型糖尿病鼠降血糖作用,发现米糠酚酸提取物和阿魏酸均能够显著地降低血糖水平及增加血浆胰岛素水平,同时血浆中总胆固醇和低密度脂蛋白胆固醇浓度显著下降。结果表明,米糠酚酸提取物和阿魏酸能够通过提高葡萄糖激酶活性和肝糖原合成来调控血糖水平,对于2型糖尿病的治疗具有积极作用。相关研究还表明,绿原酸和咖啡酸能够改善脂质代谢及与肥胖相关的激素水平,从而具有潜在的抗肥胖作用[71]。
5 结 语
目前对于植物中主要酚酸的生物合成途径、代谢与调控及其生物活性有了一定的认识,已成功地克隆了部分酚酸合成途径中关键酶的基因,并研究了相关基因的功能,这为进一步阐明植物酚酸合成途径提供了理论依据。研究表明,羟基化与甲基化反应不仅仅发生在羟基肉桂酸类酚酸的水平上,而且还能发生在羟基肉桂酰酯类和醛类等化合物水平上,这表明了酚酸生物合成的复杂性。酚酸化合物种类繁多及合成代谢途径多样,使其代谢调控的研究也变得相对复杂与困难。尽管酚酸在植物结构形成和防御方面发挥重要作用,但是对于其形成方式与防御机理方面还知之甚少;酚酸对人体具有广泛的生理作用,但是酚酸(特别是结合酚酸)在人体内吸收和代谢的方式还有待深入研究。
参考文献:
[1] MANDAL S M, CHAKRABORTY D, DEY S. Phenolic acids act as signaling molecules in plant-microbe symbioses[J]. Plant Signaling &Behavior, 2010, 5(4): 359-368. DOI:10.4161/psb.5.4.10871.
[2] VERNOOIJ B, UKNES S, WARD E, et al. Salicylic acid as a signal molecule in plant-pathogen interactions[J]. Current Opinionin Cell Biology, 1994, 6(2): 275-279. DOI:10.1016/0955-0674(94)90147-3.
[3] MALAMY J, KLESSIG D F. Salicylic acid and plant disease resistance[J].The Plant Journal, 1992, 2(5): 643-654. DOI:10.1111/j.1365-313X.1992.tb00133.x.
[4] CHEN Z J, YU L L, WANG X K, et al. Changes of phenolic profiles and antioxidant activity in canaryseed (Phalaris canariensis L.) during germination[J]. Food Chemistry, 2016, 194: 608-618. DOI:10.1016/j.foodchem.2015.08.060.
[5] YU L L, BETA T. Identification and antioxidant properties of phenolic compounds during production of bread from purple wheat grains[J].Molecules, 2015, 20(9): 15525-15549. DOI:10.3390/molecules200915525.
[6] TERPINC P, ABRAMOVIČ H. A kinetic approach for evaluation of the antioxidant activity of selected phenolic acids[J]. Food Chemistry, 2010,121(2): 366-371. DOI:10.1016/j.foodchem.2009.12.037.
[7] WANG L Y, TANG Y P, LIU X, et al. Effects of ferulic acid on antioxidant activity in Angelicae Sinensis Radix, Chuanxiong Rhizoma,and their combination[J]. Chinese Journal of Natural Medicines, 2015,13(6): 401-408. DOI:10.1016/S1875-5364(15)30032-7.
[8] CUEVA C, MORENO-ARRIBAS M V, MARTÍN-ÁLVAREZ P J, et al.Antimicrobial activity of phenolic acids against commensal, probiotic and pathogenic bacteria[J]. Research in Microbiology, 2010, 161(5): 372-382.DOI:10.1016/j.resmic.2010.04.006.
[9] WENG C J, YEN G C. Chemopreventive effects of dietary phytochemicals against cancer invasion and metastasis: phenolic acids,monophenol, polyphenol, and their derivatives[J]. Cancer Treatment Reviews, 2012, 38(1): 76-87. DOI:10.1016/j.ctrv.2011.03.001.
[10] LIU R H. Whole grain phytochemicals and health[J]. Journal of Cereal Science, 2007, 46(3): 207-219. DOI:10.1016/j.jcs.2007.06.010.
[11] ACOSTA-ESTR. Synthesis of phenylpropanoids[J]. Molecular Plant,2015, 8(1): 17-27. DOI:10.1016/j.molp.2014.11.001.
[12] VOGT T. Phenylpropanoid biosynthesis[J]. Molecular Plant, 2010, 3(1):2-20. DOI:10.1093/mp/ssp106.
[13] MAEDA H, DUDAREVA N. The shikimate pathway and aromatic amino acid biosynthesis in plants[J]. Annual Review of Plant Biology,2012, 63: 73-105. DOI:10.1146/annurev-arplant-042811-105439.
[14] MAEDA H, SHASANY A K, SCHNEPP J, et al. RNAi suppression of arogenate dehydratase1 reveals that phenylalanine is synthesized predominantly via the arogenate pathway in petunia petals[J]. The Plant Cell, 2010, 22(3): 832-849. DOI:10.1105/tpc.109.073247.
[15] DIXON R A, ACHNINE L, KOTA P, et al. The phenylpropanoid pathway and plant defence: a genomics perspective[J]. Molecular Plant Pathology, 2002, 3(5): 371-390. DOI:10.1046/j.1364-3703.2002.00131.x.
[16] KOVÁČIK J, KLEJDUS B. Tissue and method specificities of phenylalanine ammonia-lyase assay[J]. Journal of Plant Physiology, 2012,169(13): 1317-1320. DOI:10.1016/j.jplph.2012.04.008.
[17] ZHANG X B, LIU C J. Multifaceted regulations of gateway enzyme phenylalanine ammonia-lyase in the biosynthesis of phenylpropanoids[J].Molecular Plant, 2015, 8(1): 17-27. DOI:10.1016/j.molp.2014.11.001.
[18] KOUKOL J, CONN E E. The metabolism of aromatic compounds in higher plants. IV. Purification and properties of the phenylalanine deaminase of Hordeum vulgare[J]. The Journal of Biological Chemistry,1961, 236(10): 2692-2698.
[19] HAVIR E A, HANSON K R. L-phenylalanine ammonia-lyase (maize and potato). Evidence that the enzyme is composed of four subunits[J].Biochemistry, 1973, 12(8): 1583-1591. DOI:10.1021/bi00732a019.
[20] VANCE C P, BANDONI R J, TOWERS G H N. Further observations on phenylalanine ammonia-lyase in fungi[J]. Phytochemistry, 1975, 14(7):1513-1514. DOI:10.1016/0031-9422(75)85341-6.
[21] D’CUNHA G B. Enrichment of phenylalanine ammonia lyase activity of Rhodotorula yeast[J]. Enzyme and Microbial Technology, 2005, 36(4):498-502. DOI:10.1016/j.enzmictec.2004.11.006.
[22] 欧阳光察, 应初衍, 沃绍根, 等. 植物苯丙氨酸解氨酶的研究: Ⅵ. 水稻、小麦PAL的纯化及基本特性[J]. 植物生理学报, 1985, 11(2): 204-214.
[23] APPERT C, LOGEMANN E, HAHLBROCK K, et al. Structural and catalytic properties of the four phenylalanine ammonia-lyase isoenzymes from parsley (Petroselinum crispum Nym.)[J]. European Journal of Biochemistry, 1994, 225(1): 491-499. DOI:10.1111/j.1432-1033.1994.00491.x.
[24] 谭国飞, 王枫, 王广龙, 等. 鸭儿芹肉桂酸4-羟化酶基因的克隆与不同温度下的表达分析[J]. 西北植物学报, 2014, 34(7): 1298-1304.DOI:10.7606/j.issn.1000-4025.2014.07.1298.
[25] RUSSELL D W. The metabolism of aromatic compounds in higer plants. X. Properties of the cinnamic acid 4-hydroxylase of pea seedlings and some aspects of its metabolic and developmental control[J]. The Journal of Biological Chemistry, 1971, 246(12): 3870-3878.
[26] ÔBA K, CONN E E. Induction of cinnamic acid 4-hydroxylase in developing maize seedlings[J]. Phytochemistry, 1988, 27(8): 2447-2450. DOI:10.1016/0031-9422(88)87010-9.
[27] KNOBLOCH K H, HAHLBROCK K. Isoenzymes of p-coumarate:CoA ligase from cell suspension cultures of Glycine max[J]. European Journal of Biochemistry, 1975, 52(2): 311-320. DOI:10.1111/j.1432-1033.1975.tb03999.x.
[28] DEWICK P, HASLAM E. Phenol biosynthesis in higher plants. gallic acid[J]. Biochemical Journal, 1969, 113: 537-542. DOI:10.1042/bj1130537.
[29] WERNER R A, ROSSMANN A, SCHWARZ C, et al. Biosynthesis of gallic acid in Rhus typhina: discrimination between alternative pathways from natural oxygen isotope abundance[J]. Phytochemistry,2004, 65(20): 2809-2813. DOI:10.1016/j.phytochem.2004.08.020.
[30] VERMERRIS W, NICHOLSON R. Phenolic compound biochemistry[M]. The Netherlands: Springer, 2006: 86-90.
[31] SAIJO R. Pathway of gallic acid biosynthesis and its esterification with catechins in young tea shoots[J]. Agricultural and Biological Chemistry,1983, 47(3): 455-460. DOI:10.1080/00021369.1983.10865673.
[32] MUIR R M, IBÁÑEZ A M, URATSU S L, et al. Mechanism of gallic acid biosynthesis in bacteria (Escherichia coli) and walnut(Juglans regia)[J]. Plant Molecular Biology, 2011, 75(6): 555-565.DOI:10.1007/s11103-011-9739-3.
[33] OSSIPOV V, SALMINEN J P, OSSIPOVA S, et al. Gallic acid and hydrolysable tannins are formed in birch leaves from an intermediate compound of the shikimate pathway[J]. Biochemical Systematics and Ecology, 2003, 31(1): 3-16. DOI:10.1016/S0305-1978(02)00081-9.
[34] FRANKE R, HUMPHREYS J M, HEMM M R, et al. The Arabidopsis REF8 gene encodes the 3-hydroxylase of phenylpropanoid metabolism[J]. The Plant Journal, 2002, 30(1): 33-45. DOI:10.1046/j.1365-313X.2002.01266.x.
[35] HUMPHREYS J M, CHAPPLE C. Rewriting the lignin roadmap[J].Current Opinion in Plant Biology, 2002, 5(3): 224-229. DOI:10.1016/S1369-5266(02)00257-1.
[36] VANHOLME R, DEMEDTS B, MORREEL K, et al. Lignin biosynthesis and structure[J]. Plant Physiology, 2010, 153(3): 895-905. DOI:10.1104/pp.110.155119.
[37] MOURA J C M S, BONINE C A V, DE OLIVEIRA FERNANDES VIANA J, et al. Abiotic and biotic stresses and changes in the lignin content and composition in plants[J]. Journal of Integrative Plant Biology,2010, 52(4): 360-376. DOI:10.1111/j.1744-7909.2010.00892.x.
[38] ECKARDT N A. Probing the mysteries of lignin biosynthesis:the crystal structure of caffeic acid/5-hydroxyferulic acid 3/5-O-methyltransferase provides new insights[J]. Plant Cell, 2002,14(6): 1185-1189. DOI:10.1105/tpc.140610.
[39] THI BACH TUYET L, IIYAMA K, STONE B A. Caffeic acid:O-methyltransferases and the biosynthesis of ferulic acid in primary cell walls of wheat seedlings[J]. Phytochemistry, 1996, 41(6): 1507-1510. DOI:10.1016/0031-9422(95)00810-1.
[40] MA Q H, XU Y. Characterization of a caffeic acid 3-O-methyltransferase from wheat and its function in lignin biosynthesis[J]. Biochimie, 2008,90(3): 515-524. DOI:10.1016/j.biochi.2007.09.016.
[41] DWIVEDI U N, GUPTA P, PANDEY V P, et al. Caffeic acid O-methyltransferase from Leucaena leucocephala: cloning, expression,characterization and molecular docking analyses[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 106: 63-70. DOI:10.1016/j.molcatb.2014.04.020.
[42] HEATH R, HUXLEY H, STONE B, et al. cDNA cloning and differential expression of three caffeic acid O-methyltransferase homologues from perennial ryegrass (Lolium perenne)[J]. Journal of Plant Physiology, 1998, 153(5/6): 649-657. DOI:10.1016/S0176-1617(98)80216-2.
[43] KIM J, CHOI B, CHO B K, et al. Molecular cloning, characterization and expression of the caffeic acid O-methyltransferase (COMT)ortholog from kenaf (Hibiscus cannabinus)[J]. Plant Omics, 2013, 6(4):246-253.
[44] KIM Y J, KIM D G, LEE S H, et al. Wound-induced expression of the ferulate 5-hydroxylase gene in Camptotheca acuminata[J].Biochimica et Biophysica Acta, 2005(2): 182-190. DOI:10.1016/j.bbagen.2005.08.015.
[45] GRAND C. Ferulic acid 5-hydroxylase: a new cytochrome P-450-dependent enzyme from higher plant microsomes involved in lignin synthesis[J]. FEBS Letters, 1984, 169(1): 7-11. DOI:10.1016/0014-5793(84)80278-1.
[46] MEYER K, CUSUMANO J C, SOMERVILLE C, et al. Ferulate-5-hydroxylase from Arabidopsis thaliana defines a new family of cytochrome P450-dependent monooxygenases[J]. Proceedings of the National Academy of Sciences, 1996, 93(14): 6869-6874. DOI:10.1073/pnas.93.14.6869.
[47] KOVÁČIK J, KLEJDUS B, BAČKOR M, et al. Phenylalanine ammonialyase activity and phenolic compounds accumulation in nitrogendeficient Matricaria chamomilla leaf rosettes[J]. Plant Science, 2007,172(2): 393-399. DOI:10.1016/j.plantsci.2006.10.001.
[48] MA D Y, SUN D X, LI Y G, et al. Effect of nitrogen fertilisation and irrigation on phenolic content, phenolic acid composition, and antioxidant activity of winter wheat grain[J]. Journal of the Science of Food and Agriculture, 2015, 95(5): 1039-1046. DOI:10.1002/jsfa.6790.
[49] THAMMAPAT P, MEESO N, SIRIAMORNPUN S. Effects of NaCl and soaking temperature on the phenolic compounds, α-tocopherol,γ-oryzanol and fatty acids of glutinous rice[J]. Food Chemistry, 2015,175: 218-224. DOI:10.1016/j.foodchem.2014.11.146.
[50] BAÂTOUR O, MAHMOUDI H, TARCHOUN I, et al. Salt effect on phenolics and antioxidant activities of Tunisian and Canadian sweet marjoram (Origanum majorana L.) shoots[J]. Journal of the Science of Food and Agriculture, 2013, 93(1): 134-141. DOI:10.1002/jsfa.5740.
[51] WEIDNER S, CHRZANOWSKI S, KARAMAĆ M, et al. Analysis of phenolic compounds and antioxidant abilities of extracts from germinating Vitis californica seeds submitted to cold stress conditions and recovery after the stress[J]. International Journal of Molecular Sciences,2014, 15(9): 16211-16225. DOI:10.3390/ijms150916211.
[52] SWIGONSKA S, AMAROWICZ R, KR L A, et al. Influence of abiotic stress during soybean germination followed by recovery on the phenolic compounds of radicles and their antioxidant capacity[J]. Acta Societatis Botanicorum Poloniae, 2014, 83(3): 209-218. DOI:10.5586/asbp.2014.026.
[53] 刘景玲, 齐志鸿, 郝文芳, 等. UV-B辐射和干旱对丹参生长和叶片中酚酸类成分的影响[J]. 生态学报, 2015, 35(14): 4642-4650.DOI:10.5846/stxb201311152735.
[54] LIU Hongkai, CHEN Yayun, HU Tingting, et al. The influence of lightemitting diodes on the phenolic compounds and antioxidant activities in pea sprouts[J]. Journal of Functional Foods, 2016, 25: 459-465.DOI:10.1016/j.jff.2016.06.028.
[55] LIANG Zongsuo, MA Yini, XU Tao, et al. Effects of abscisic acid,gibberellin, ethylene and their interactions on production of phenolic acids in Salvia miltiorrhiza Bunge hairy roots[J]. PLoS ONE, 2013, 8(9):1-9. DOI:10.1371/journal.pone.0072806.
[56] KOV Á ČIK J, KLEJDUS B. Dynamics of phenolic acids and lignin accumulation in metal-treated Matricaria chamomilla roots[J]. Plant Cell Reports, 2008, 27(3): 605-615. DOI:10.1007/s00299-007-0490-9.
[57] SEVGI K, TEPE B, SARIKURKCU C. Antioxidant and DNA damage protection potentials of selected phenolic acids[J]. Food and Chemical Toxicology, 2015, 77: 12-21. DOI:10.1016/j.fct.2014.12.006.
[58] 范金波, 蔡茜彤, 冯叙桥, 等. 咖啡酸体外抗氧化活性的研究[J].中国食品学报, 2015, 15(3): 65-73. DOI:10.16429/j.1009-7848.2015.03.009.
[59] 赵文红, 邓泽元, 范亚苇, 等. 阿魏酸体外抗氧化作用研究[J]. 食品科学, 2010, 31(1): 219-223. DOI:10.7506/spkx1002-6630-201001051.
[60] TI H H, ZHANG R F, ZHANG M W, et al. Dynamic changes in the free and bound phenolic compounds and antioxidant activity of brown rice at different germination stages[J]. Food Chemistry, 2014, 161: 337-344.DOI:10.1016/j.foodchem.2014.04.024.
[61] XU J G, TIAN C R, HU Q P, et al. Dynamic changes in phenolic compounds and antioxidant activity in oats (Avena nuda L.) during steeping and germination[J]. Journal of Agricultural and Food Chemistry,2009, 57(21): 10392-10398. DOI:10.1021/jf902778j.
[62] SÁNCHEZ-MALDONADO A, SCHIEBER A, GÄNZLE M. Structurefunction relationships of the antibacterial activity of phenolic acids and their metabolism by lactic acid bacteria[J]. Journal of Applied Microbiology, 2011, 111(5): 1176-1184. DOI:10.1111/j.1365-2672.2011.05141.x.
[63] HERALD P J, DAVIDSON P M. Antibacterial activity of selected hydroxycinnamic acids[J]. Journal of Food Science, 1983, 48(4): 1378-1379. DOI:10.1111/j.1365-2621.1983.tb09243.x.
[64] LOU Z, WANG H, RAO S, et al. p-Coumaric acid kills bacteria through dual damage mechanisms[J]. Food Control, 2012, 25(2): 550-554.DOI:10.1016/j.foodcont.2011.11.022.
[65] KUMAR N, PRUTHI V. Potential applications of ferulic acid from natural sources[J]. Biotechnology Reports, 2014, 4: 86-93. DOI:10.1016/j.btre.2014.09.002.
[66] FAHRIOĞLU U, DODURGA Y, ELMAS L, et al. Ferulic acid decreases cell viability and colony formation while inhibiting migration of MIA PaCa-2 human pancreatic cancer cells in vitro[J]. Gene, 2016, 576: 476-482. DOI:10.1016/j.gene.2015.10.061.
[67] LI W, LI N, TANG Y, et al. Biological activity evaluation and structureactivity relationships analysis of ferulic acid and caffeic acid derivatives for anticancer[J]. Bioorganic & Medicinal Chemistry Letters, 2012, 22(19):6085-6088. DOI:10.1016/j.bmcl.2012.08.038.
[68] ROY N, NARAYANANKUTTY A, NAZEEM P A, et al. Plant phenolics ferulic acid and p-coumaric acid inhibit colorectal cancer cell proliferation through EGFR down-regulation[J]. Asian Pacific Journal of Cancer Prevention, 2016, 17(8): 4019-4023.
[69] LU Y, JIANG F, JIANG H, et al. Gallic acid suppresses cell viability,proliferation, invasion and angiogenesis in human glioma cells[J].European Journal of Pharmacology, 2010, 641: 102-107. DOI:10.1016/j.ejphar.2010.05.043.
[70] JUNG E H, KIM S R, HWANG I K, et al. Hypoglycemic effects of a phenolic acid fraction of rice bran and ferulic acid in C57BL/KsJ-db/db mice[J]. Journal of Agricultural and Food Chemistry, 2007, 55(24): 9800-9804. DOI:10.1021/jf0714463.
[71] CHO A S, JEON S M, KIM M J, et al. Chlorogenic acid exhibits antiobesity property and improves lipid metabolism in high-fat diet-inducedobese mice[J]. Food and Chemical Toxicology, 2010, 48(3): 937-943.DOI:10.1016/j.fct.2010.01.003.

