规模化猪场伪狂犬病净化方案应用效果的研究
郭倩妤, 汤德元, 曾智勇, 黄 涛, 王 彬, 胡玲玲, 龙冬梅,叶 丽, 石远菊, 杨 伟, 廖少山, 刘巧玲
(贵州大学动物科学学院, 贵州 贵阳 550025)
猪伪狂犬病(PR))是由伪狂犬病病毒(PRV)引起的一种以发烧、繁殖障碍、脑脊髓炎等为主要临床症状的急性、高度接触性传染疫病,该病属于典型且极难防疫的自然疫源性疾病,且易与其他疫病混合感染,给猪养殖业带来了巨大的危害,该病被世界动物卫生组织(OIE)列为B 类动物疫病,为必须上报的动物传染病,我国农业部门也将其规定为Ⅱ类疫病。 目前,猪伪狂犬病已被列入《国家中长期动物疫病防治规则》(2012 -2015 年)重点优先防治的疾病,其控制目标是:到2015 年原种猪场达到净化标准,到2020 年全国所有种猪场达到净化标准。
随着规模化养猪业的不断发展,猪伪狂犬病的防控显得尤为重要。 世界各国都己纷纷开始实施猪伪狂犬病的净化工作,有的国家对该病的净化已经取得了明显的效果。 如20 世纪80 年代末英国和丹麦等发达国家首先宣布猪伪狂犬病净化成功,紧跟其后荷兰、比利时等欧洲国家也相继完成了猪伪狂犬病的净化工作[1]。 美国也于1989 年全面开始了伪狂犬病的净化工作,通过开展净化措施20 年以来,取得了阶段性的成果,已宣布净化成功国内已没有伪狂犬病。 在我国猪伪狂犬病在大、中型猪场的阳性率在30% ~50.85%之间,有50%左右的伪狂犬野毒呈阳性,中小规模猪场和散养户感染情况更高[2]。 国内外对规模化猪场伪狂犬病的净化方法存在一定的差异,但其思路基本一致。即扑杀、隔离、疫苗免疫及生物安全防控。 有的仅仅通过扑杀、隔离以及严格地对猪群进行全群检疫监测;有的则应用伪狂犬病基因缺失疫苗结合相应的血清学鉴别诊断方法对猪伪狂犬病进行野毒感染猪只的淘汰清除等[3]。 我国学者经过多年的研究和探索,在猪伪狂犬病的综合防控措施及诊断技术方面取得了飞速的发展,特别是应用伪狂犬病基因缺失疫苗免疫和gB-ELISA 和gEELISA 检测技术在猪场伪狂犬病的净化工作中已经获得了较好的效果[4-5],为猪伪狂犬病的净化创造了良好的条件。
1 材料与方法
1.1 样品来源 样品来源于贵州省安顺市实施猪伪狂犬病净化方案的某规模化种猪场4 次采集的1 837 份全血和扁桃体样品。
1.2 试剂 猪伪狂犬病gB、gE 蛋白ELISA 检测试剂盒,购自武汉科前生物科技公司;LA Taq Enzyme、DNA Marker DL 2 000、TaKaRa MinBEST Viral DNA/RNA Extraction Kit Ver. 5.0、2 × 1 Step Buffer、10 mmol/L dNTPs、Taq DNA 聚合酶、RNase Free H2O,均购自TaKaRa 公司;PCR 上、下游引物由上海英潍捷基生物技术有限公司合成。 其他常用试剂均为进口或国产分析纯产品。
1.3 伪狂犬病净化的方案 研究通过应用伪狂犬病基因缺失疫苗免疫并对其抗体进行gE/gB-ELISA监测(GB/T 18641 -2002)区别猪群野毒和疫苗毒感染及其疫苗免疫效果,结合本实验室已建立的猪伪狂犬病野毒与疫苗毒病原学监测的多重PCR 方法、合理的净化免疫程序及健全生物安全体系4 个方面开展猪伪狂犬病得净化研究,其净化方案的具体技术路线如图1 所示。
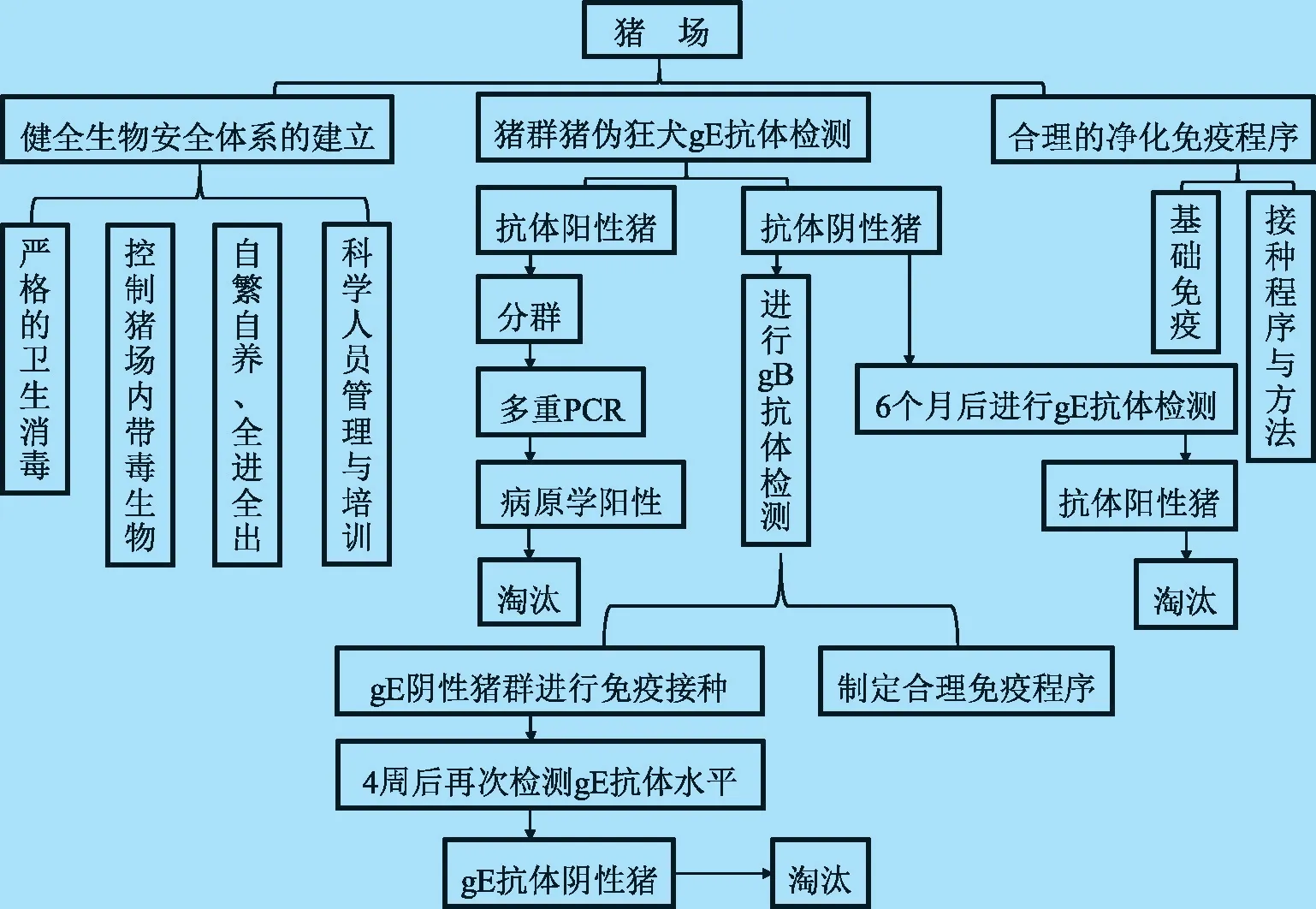
图1 规模化猪场伪狂犬病净化技术总路线图
1.4 规模化猪场伪狂犬病的免疫方案 合理的免疫程序是伪狂犬病净化的前提,采用伪狂犬病基因缺失疫苗免疫并对其抗体采用gE/gB-ELISA 监测,可以区别猪群野毒和疫苗毒感染及其疫苗免疫效果。
1.4.1 猪伪狂犬病的免疫程序 免疫体系的建立在整个猪场生物安全体系构建中占据着重要的位置,猪场应结合自身实际建立合理的免疫程序,这是控制猪伪狂犬病的关键,按时免疫接种是控制本病最有效的措施之一。 在免疫方面,猪群使用Bartha-K61 株(gE¯/gI¯双基因缺失疫苗株)、SA215 株(gE¯/gI¯/TK¯三基因缺失疫苗株)、HB -98 株(gE¯/gG¯/TK¯)或鄂A 株(TK¯/gE¯/gI¯三基因缺失疫苗株)接种免疫,以防止潜伏感染和降低野毒感染阳性率[6]。 需要注意的是在同一个猪场内最好使用相同的基因缺失疫苗,避免不同基因缺失疫苗毒株之间可能发生的基因重组和毒力变异。 但是,没有证据表明,基因缺失疫苗会与野毒发生的基因重组,因而使用基因缺失的弱毒疫苗是安全的[7-8]。仔猪56 日龄1 头份,感染压力较大时,可进行滴鼻免疫克服母源抗体干扰,受伪狂犬病威胁较大的猪场:仔猪出生后滴鼻0.5 头份/头,3 ~4 周龄再滴一次1 头份/头,7 ~9 周龄肌肉注射1 ~2 头份/头;或3 ~4 周龄滴鼻1 次,7 ~8 周龄肌肉注射1 次,留种猪只16 周龄再肌肉注射1 次。 受伪狂犬病威胁小的猪场:仔猪在14 周龄时用弱毒疫苗接种1 次;后备猪170 日龄1 头份,配种前接种1 次(2 头份),间隙3 ~4 周再接种1 次;母猪产前25 ~30 d 接种1次;母猪每年免疫3 次,2 头份/次(新转入种猪15日内免疫过不再免疫);公猪每年免疫3 次,2 头份/次。 基于以上免疫日龄同时需结合抗体的检测,并根据监测结果进一步调整适合场内的免疫程序。对于猪伪狂犬加强仔猪选种关,对于使用基因缺失活疫苗种猪所产仔猪,应进行早期断奶,保育期间对留种用的仔猪做一次野毒感染监测,野毒感染抗体阴性的仔猪作种用,阳性仔猪则淘汰[9]。
1.4.2 伪狂犬病免疫效果监测和净化 对于规模化猪场进行猪伪狂犬病的净化,其种猪和后备猪监测比例为100%,其中种公猪1 次/半年,生产母猪1次/季度引进种猪混群前全免,育肥猪30 头/群(与生产母猪同步检),监测淘汰必须在一次或两次以上。 采用gB 免疫抗体和gE 野毒抗体监测技术路线如图2 所示进行。

图2 gB 免疫抗体和gE 野毒抗体监测技术路线
按照gB/gE-ELISA 试剂盒操作说明书进行抗体检测:gE 抗体ELISA 监测其野毒感染,其原理是:现在许多猪场采用的是猪伪狂犬疫苗是gE(gI)单基因或多基因缺失疫苗,缺失了gE(gI)基因就不能产生相应的gE(gI)抗体,若gE 抗体是阳性,说明野毒感染,用此方法很容易将PRV 野毒与隐性带毒的猪群鉴别出来以便淘汰及净化,通过实施猪场的净化程序后,追踪猪群中阳性率的变化,以达到猪伪狂犬病净化目的[10]。
gB 抗体ELISA 监测其免疫保护情况,根据gBELISA 抗体检测为阴性说明不受保护,对初次免疫后为gB 阴性的猪群再次进行gB 抗体ELISA 检测,并制定合理的免疫程序方案,再次免疫接种伪狂犬疫苗,4 周后进行gB 抗体ELISA 检测,仍为阴性的进行直接淘汰。
1.5 PRV 病原的PCR 监测 鉴别猪伪狂犬病野毒和疫苗毒感染的三重PCR 方法的建立:参照NCBI中PRV TK (AF080571)、 gB (GQ325658) 和gE(JX417716)等基因序列,应用多重PCR 引物设计系统Mpprimer 和多因素引物特异性评估系统MFEprimer 设计三重PCR 引物,用于扩增目的基因片段,引物序列见表3 ~表1。 引物由Invitrogen 公司合成,PAGE 级,OD 值为2.0,分别取500 μL 伪狂犬病病毒Guizhou -DY 株、弱毒疫苗Bartha -K61 株及三基因缺失疫苗SA215 株接种Vero 细胞,30 h 后分别将接毒细胞悬液反复冻融3 次,4 000 r/min(室温)离心5 min,按TaKaRa 公司核酸提取试剂盒说明书,各取200 μL 细胞悬液提取DNA,进行PCR 扩增,反应条件为:94 ℃5 min;94 ℃1 min,58 ℃1 min,72 ℃45 s,35 个循环;72 ℃10 min 进行PCR,结果成功建立了鉴别猪伪狂犬病野毒感染和疫苗毒感染的三重PCR 方法,并将其组装成试剂盒。 可用于区分目前使用的Bartha-K61 株、SA215 株、HB-98株和PRV 野毒感染。 该研究可快速诊断临床血液样品、组织样本和拭子样品猪伪狂犬病病毒野毒感染。 研究方法是利用本实验室已建立的一步法从病原学区分PR 野毒与疫苗毒的多重PCR(mPCR)方法进行病原学检测[10],引物如表1。

表1 引物序列及片段大小
对于流产死胎、组织样本、拭子样品和PRV-gE蛋白ELISA 检测阳性样本与PRV-gB 蛋白ELISA 检测阴性样本进行病原学多重PCR 检测,按照TaKa-Ra DNA 提取试剂盒说明书进行,利用本实验室建立的鉴别PRV 野毒与疫苗毒的3 重PCR 方法。 当PCR 扩增产物电泳结果出现3 个片段的条带时为PRV 野毒感染,当电泳结果出现281 bp 与549 bp两片段时为PR 疫苗株Bartha-K61 时,当为PR 疫苗株SA215 时仅出现单独549 bp 一个片段,以此来区分PRV 野毒与疫苗毒感染[11]。
1.6 生物安全措施的建立 猪场还应加强建立生物安全措施,主要包括:(1)猪场设立门卫制度并在外围设置防护网,严格限制人员、动物和运输工具进入养殖场并杜绝外来人员的参观;(2)对猪舍、栏圈、发病饲养场的内外环境、用具以及运输工具和其他一切有可能被污染的场所和设施、设备进行彻底消毒;(3)对饲料和水源进行严格的控制,禁止饲喂变质的饲料,饮水每年检测2 次以监测大肠杆菌等细菌数;(3)坚持“自繁自养”( 最好建立SPF 猪群) ,坚持“全进全出”生猪调入调出前后用不同的消毒药物彻底清洗消毒栏舍,并建立隔离检疫舍;(4)禁止在猪场内饲养其他动物,并在场内实施灭鼠、驱虫措施;(5)对病、死猪、死胎、流产物进行无害化处理;(6)制定科学的消毒程序,并严格执行;(7)对于出栏的猪做好严格的管理:A. 明确脏区和净区,猪只严格按照净区-脏区单向流动,生产区工作人员禁止进入脏区;B.应保证冲洗污水不能回流到出猪台;C. 要有防鸟网和防鼠措施;D. 保证每次使用后能够及时彻底冲洗消毒。
2 结果
对该规模化猪场2016 年3 月至2017 年4 月以来进行的4 次检测数据共计1 837 份,进行整理归纳得出相应的结果并对结果展开讨论和分析以便得出更加准确的研究结论。
2.1 PRV-gB/gE 抗体阳性率第1 次检测结果 本次研究于2016 年3 月初对安顺某规模化猪445 份不同阶段(种猪、后备猪、保育猪、育肥猪)猪群第1次进行PRV-gE/gB ELISA 抗体检测,得到PRV-gB抗体阳性率为84.04%(374/445),PRV-gE 抗体阳性率为6.29%(28/445)。 检测后对PRV-gB 抗体阴性的猪进行加强免疫并于免疫后28 d 后抽血重测,PRV-gE 抗体阳性的猪直接淘汰。 具体检测结果如表2。

表2 2016 年3 月第1 次PRV-gB/gE 抗体检测结果
2.2 PRV-gB/gE 抗体阳性率第2 次检测结果2016 年8 月进行第2 次gE/gB ELISA 监测,共检测不同阶段猪群样本492 份。 发现PRV -gB 抗体阳性率相比较第1 次有所上升,PRV-gE 抗体阳性率有所下降,分别为91.67% (451/492)、3.87% (19/492),检测后对PRV-gB 抗体阴性的猪进行加强免疫并于免疫后28 d 后抽血重测,PRV-gE 抗体阳性的猪直接淘汰。 结果见表3。
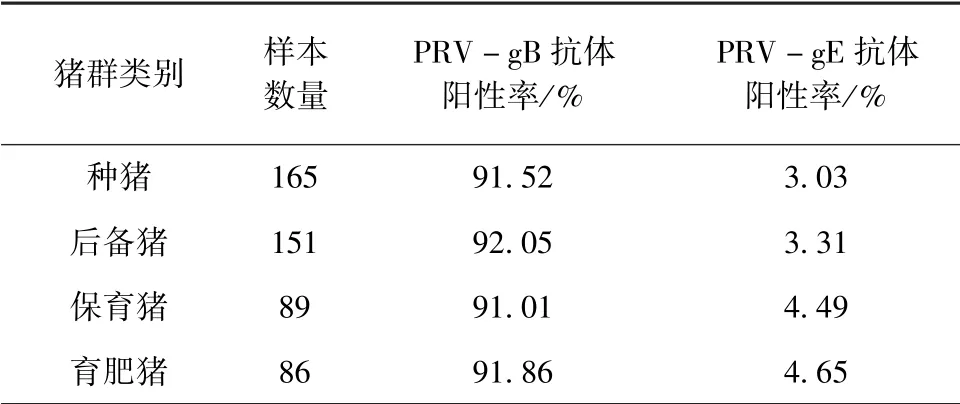
表3 2016 年8 月第2 次PRV-gB/gE 抗体检测结果
2.3 PRV-gB/gE 抗体阳性率第3 次检测结果2016 年12 月进行第3 次gE/gB ELISA 监测,共检测452 份样品。 结果显示,PRV-gB 抗体阳性率任然呈增长趋势,PRV-gE 抗体阳性率继续下降,分别为94.25% (426/452)、2. 21% (10/452、),检测后对PRV-gB 抗体阴性的猪进行加强免疫并于免疫后28 d后抽血重测,PRV-gE 抗体阳性的猪直接淘汰。结果见表4。
2.4 PRV-gB/gE 抗体阳性率第4 次检测结果2017 年4 月完成了此次试验的最后1 次gE/gB ELISA 监测。 对不同阶段(种猪、后备猪、保育猪、育肥猪)猪只样本共448 份进行检测,本次检测可以明显的看出,PRV-gB 抗体阳性率较2016 年3 月第一次检测时高出许多,PRV-gE 抗体阳性率下降显著,分别为97.99%(439/448)、0%(0/448),相关数据如表5 所示。
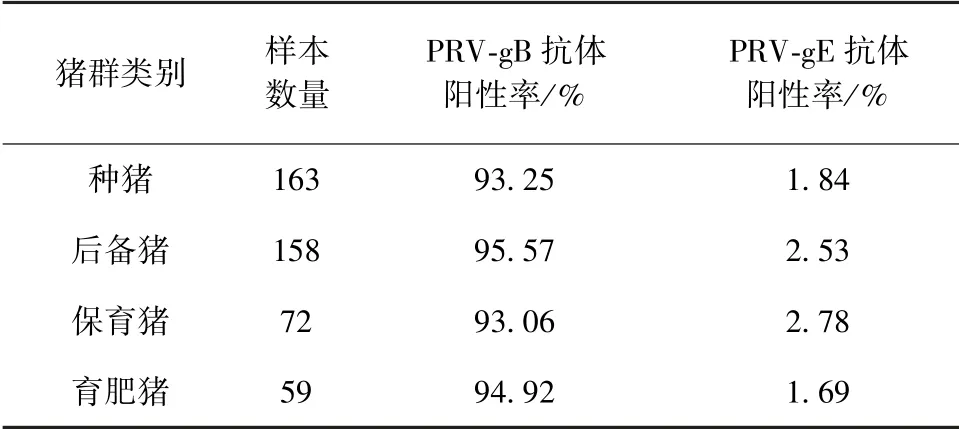
表4 2016 年12 月第3 次PRV-gB/gE 抗体检测结果

表5 2017年4月第4 次PRV-gB/gE 抗体检测结果
2.5 PRV 抗原阳性率检测结果 在进行的4 次PRV-gB/gE 抗体检测中,将流产死胎、发病死亡的仔猪组织样本和PRV-gE ELISA 检测为阳性血液样品和拭子样本进行PCR 病原学检测其抗原阳性率,4 次检测的结果整合如表6 所示。

表6 PRV-gB/gE 抗体检测以及PRV 抗原检测结果汇总表
3 讨论
将上述4 次检测结果及相关表格进行汇总共1 837 份样品对其进行统计学分析,以Y 轴表示各项检测项目(PRV-gB 抗体/PRV-gE 抗体/PRV 抗原阳性率),X 轴对应4 次检测时间及猪种(种猪、后备猪、保育猪、育肥猪和种猪)。 通过对图表的观察和分析发现:安顺某规模化猪场2016 年3 月进行第1 次检测PRV-gB 抗体阳性率为84. 04% (374/445),明显低于之后的3 次检测,而PRV-gE 抗体阳性率和PRV 抗原阳性率分别为6.29%(28/445)和2.70%(12/445),都高于其余3 次。 这说明该规模化猪场刚开始开展净化工作,净化效果还不是很理想。 检测后对PRV-gB 抗体阴性的猪进行加强免疫并于免疫后28 d 后抽血重测,对于PRV-gE 抗体阳性的猪直接淘汰。
2016 年8 月进行第2 次检测,此次检测表明,PRV-gB 抗体阳性率比第一次检测有所提高,PRVgE 抗体阳性率及PRV 抗原阳性率均有所下降,分别为91.67%(451/492)、3.87%(19/492)、1.02%(5/492),说明继续开展伪狂犬病的净化工作在该规模化猪场取得了初步的成效。 在进行的第3 次和第4 次检测中,都可明显的看出PRV-gB 抗体阳性率在不断增长,PRV-gE 抗体阳性率及PRV 抗原阳性率直线下降。 两次检测结果分别为94. 25%(426/452)、2. 21% (10/452、)、0. 22% (1/452)和97.99% (439/448)、0. 00% (0/448)、0. 00% (0/448),说明继续使用本实验室建立的规模化猪场伪狂犬病净化方案取得了较好的应用效果,有助于该场早日完成伪狂犬病的净化工作。
如封二彩版图3 所示,通过对柱状图和其趋势线的观察分析,发现该猪场PRV 的每个检测项目之间在一定的差异,可以很明显的发现,在该规模化猪场实施本实验室建立的伪狂犬病净化以来,PRVgB 抗体阳性率呈明显的上升趋势,说明该场猪群在接种PRV 疫苗后受猪伪狂犬病抗体的保护得到了加强:PRV-gE 抗体阳性率以及PRV 抗原阳性率明显呈下降的趋势,这说明该规模化猪场伪狂犬病野毒带毒下降,对规模化猪场PRV 野毒取得了有效的控制作用。
通过上述统计学图表进行分析讨论,得出结论为,在第4 次检测结果中种猪、后备猪、保育猪、育肥猪的PRV-gB 抗体阳性率分别为98.73%、98.64%、95.89%、97.14%,说明本实验室建立的净化方案的免疫已达到合格,在该规模化猪场起到了很好地免疫保护作用;在所进行的4 次PRV 抗体及抗原检测中,该规模化猪场PRV 抗原阳性率分别为2.70%(12/445)、1.02%(5/492)、0.22%(1/452)、0.00%(0/448),明显呈下降趋势,说明自开展净化工作以来,该规模化猪场的猪伪狂犬病病原得到了较好的控制。 4 次检测结果综合表明,安顺某规模化猪场在开展净化工作之后的猪PRV-gB 抗体水平均达到90%,PRV-gE 抗体阳性率及PRV 抗原阳性率均降为0,表明所开展的净化方案对规模化猪场猪伪狂犬病的净化工作有明显的效果,但想要彻底的消灭猪伪狂犬病还需进一步对各规模化猪场进行全方位监控,通过以基因缺失疫苗全面免疫并配合血样检测淘汰野毒抗体阳性猪的方法,首先将生产公猪群净化,然后将生产母猪群中野毒抗体阳性猪逐步淘汰,更新的后备猪群严格进行血液检查,逐步形成良性循环的更新淘汰机制,最终使生产种公母猪全部净化为阴性猪群。 同时,做好消毒灭源,保护好健康猪群,最终实现种猪猪伪狂犬净化与根除的目标。 种猪场、生猪人工授精站的粪尿要及时清理和处理,猪场的死胎、流产物、弱仔猪要高温处理,及时清除猪场存在的传染源;并严格实施净化方案,不断地探讨和完善此净化方案。

