土壤微生物对紫茎泽兰与我国西南当地植物生长的影响
刘 潮, 韩利红, 宋培兵, 张亚萍
(曲靖师范学院云南高原生物资源保护与利用研究中心/生物资源与食品工程学院/云南省高校云贵高原动植物多样性及生态适应性进化重点实验室,云南曲靖 655011)
土壤微生物是土壤中生理、生化等各种反应的参与者和推动者,在植物凋落物的降解、养分循环与平衡、土壤理化性质改善中起重要作用。根际微生物的物质转化作用,直接促进或抑制根的营养吸收和生长,也影响根际土壤中碳、氮、磷、硫等物质的转化。不同植物根系分泌物的化学组成及根周转速率的差异,导致土壤微生物多样性的改变[1];外来植物根系对土壤物质输入的改变,影响土壤微生物的种类和数量[2-3];外来植物凋落物构成的变化也会影响土壤微生物的结构和功能[4]。此外,外来植物可通过改变入侵地土壤的水分状况及土壤团粒结构等物理特性,间接地影响土壤微生物的多样性[2]。外来种的入侵改变了土壤肥力、群落结构和动态,这些因素的改变又会作用于依赖其生长的生物。因此,植物-土壤生物-土壤之间存在着相互依赖、相互作用的复杂关系。
紫茎泽兰(Eupatoriumadenophorum)是我国危害最严重的外来入侵植物之一,对入侵地的生态系统以及农、林、牧业造成严重危害。为了解紫茎泽兰定植多年后,土壤中微生物对紫茎泽兰生长及其与我国西南当地植物竞争的反馈作用,本研究通过采集紫茎泽兰入侵群落下土壤,分别对其进行灭菌处理、添加杀真菌剂处理并设对照处理,采用紫茎泽兰单种与其他3种伴生西南当地地植物马唐(Digitariasanguinalis)、拔毒散(Sidaszechuensis)和青蒿(Artemisiacarvifolia)分别混种的方式,来验证不同土壤微生物类群在紫茎泽兰入侵过程中的作用,以期为紫茎泽兰的控制管理和入侵地生态恢复提供借鉴。
1 材料与方法
1.1 试验材料
2005年6月从云南省澜沧县迷古吗草场采集紫茎泽兰群落下土壤,收集表层15 cm矿质土,去掉所有的凋落物和植被,过5 mm筛(不会影响微生物群落)。土壤的pH值为 5.37,有机质含量为118.37 g/kg,全氮含量为4.52 g/kg,全磷含量为1.73 g/kg,全钾含量为8.45 g/kg,水解氮含量为345.6 mg/kg,有效磷含量为0.5 mg/kg,速效钾含量为 95.2 mg/kg。选取紫茎泽兰和3种伴生西南当地植物马唐、拔毒散和青蒿为植物材料。
1.2 试验方法
试验土壤分别设灭菌(Ⅰ)、对照(Ⅱ)、添加杀真菌剂(Ⅲ)3个处理。灭菌处理,土壤于121 ℃条件下高压灭菌1 h;对照处理为2/3灭菌土壤和1/3对照土壤的混合物,以减少灭菌造成的肥力影响;添加杀真菌剂处理,土壤处理同对照,但定期向土壤中添加杀真菌剂。向所有处理土壤中添加活性炭以消除化感影响[5-6]。2005年7月,选取高度一致的单株实生幼苗,采用盆栽法栽培。为保持土壤湿润,每3 d浇无菌水1次,所有处理定期加Hoagland’s营养液。在添加杀真菌剂处理的试验中,每20 d加1次杀真菌剂苯菌灵(Benomyl)。
每15 d用直尺(精确度1 mm)测定1次株高,计算株高相对生长速率。4个月后分别收获植株地上和地下部分,并于80 ℃条件下烘48 h,用电子天平(精确度0.000 1 g)分别称根、茎、叶干质量。
1.3 统计方法
使用SPSS 12.0(SPSS Inc. Chicago,Illinois,USA)进行数据统计,使用Sigma Plot 8.0(SPSS Inc. Chicago,Illinois,USA)进行绘图分析。采用One-way ANOVA对不同单种、混种处理下植株生长参数进行比较,使用S-N-K(Student Newman-Keuls)检验进行各均值的多重比较。
2 结果与分析
2.1 受试植物单种时株高相对生长率比较
由图1可知,处理Ⅰ中紫茎泽兰在各生长阶段的相对生长率均较高,马唐、拔毒散和青蒿生长缓慢,其中拔毒散有较严重的虫咬现象,且在105 d后全部死亡。与处理Ⅱ和Ⅲ相比,处理Ⅰ中各植物(除马唐)相对生长率均较低。与处理Ⅰ相比,处理Ⅱ和处理Ⅲ中青蒿的相对生长率更高,拔毒散的相对生长率也有所提高,处理Ⅱ、处理Ⅲ的青蒿生长至75 d时的相对生长率超过了紫茎泽兰。马唐在3种处理中的相对生长率增长得较慢。种植45 d后,处理Ⅱ的紫茎泽兰表现出快速增长趋势。各处理对拔毒散的影响明显,处理Ⅱ和处理Ⅲ的拔毒散在种植60 d后,相对生长率高于处理Ⅰ,且处理Ⅲ在种植105 d后明显高于处理Ⅱ。处理Ⅱ和处理Ⅲ中青蒿的相对生长率之间没有明显差异。
2.2 受试植物单种时生物量比较
由图2可知,3种土壤处理方式对各植物根、茎、叶生物量影响不同。处理Ⅲ紫茎泽兰的根、茎生物量显著高于处理Ⅰ和处理Ⅱ,叶生物量显著高于处理Ⅱ;处理Ⅲ马唐的根、茎、叶生物量显著高于处理Ⅰ和处理Ⅱ;处理Ⅲ拔毒散的茎生物量高于处理Ⅱ,而叶生物量却相反,根生物量没有明显差别;处理Ⅱ和处理Ⅲ青蒿的根、茎生物量均显著高于处理Ⅰ。
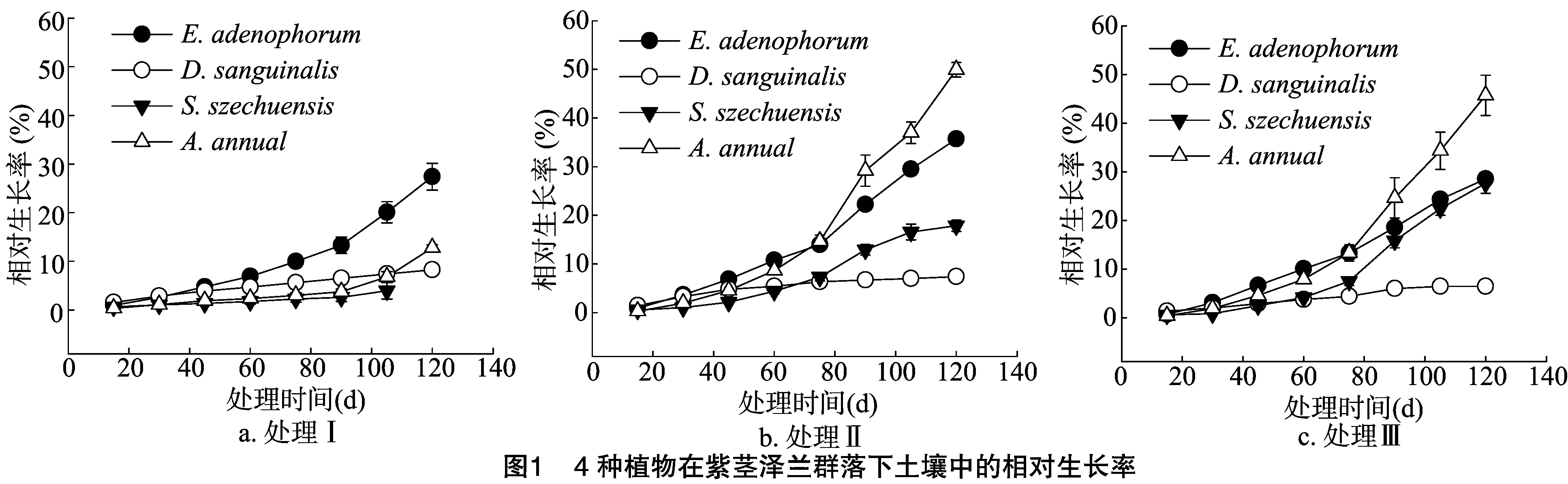
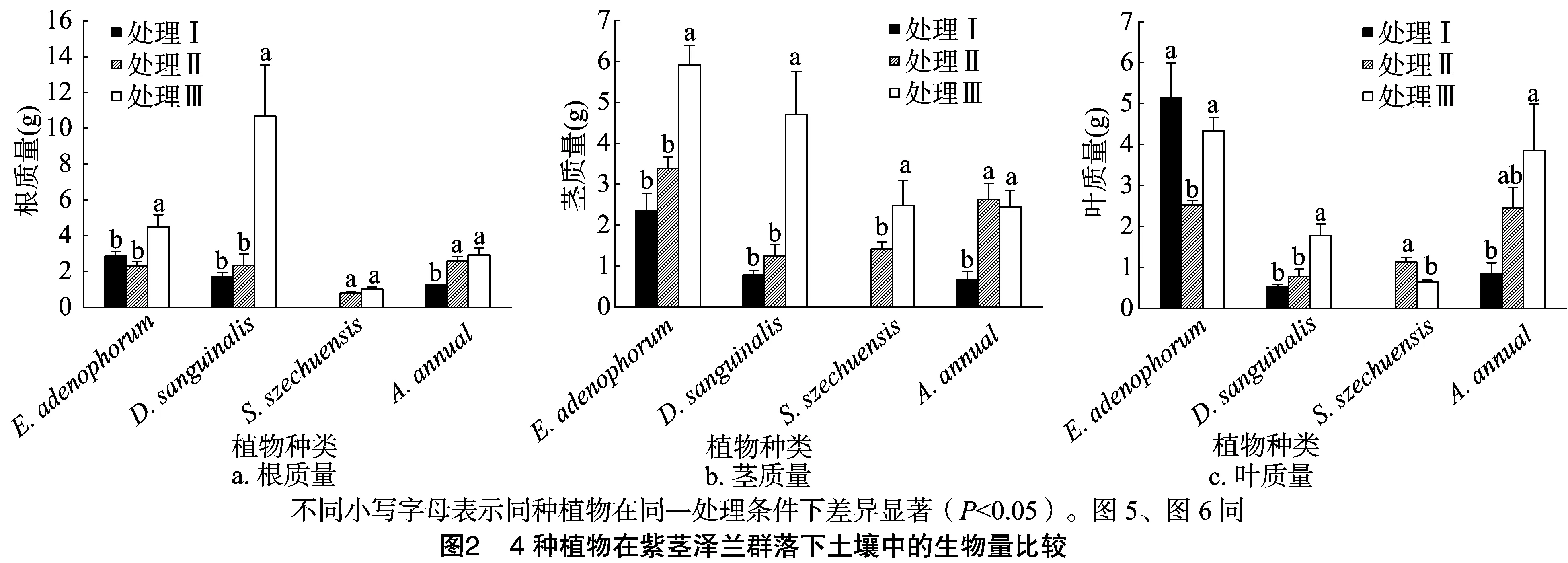
2.3 受试植物混种时株高相对生长率比较
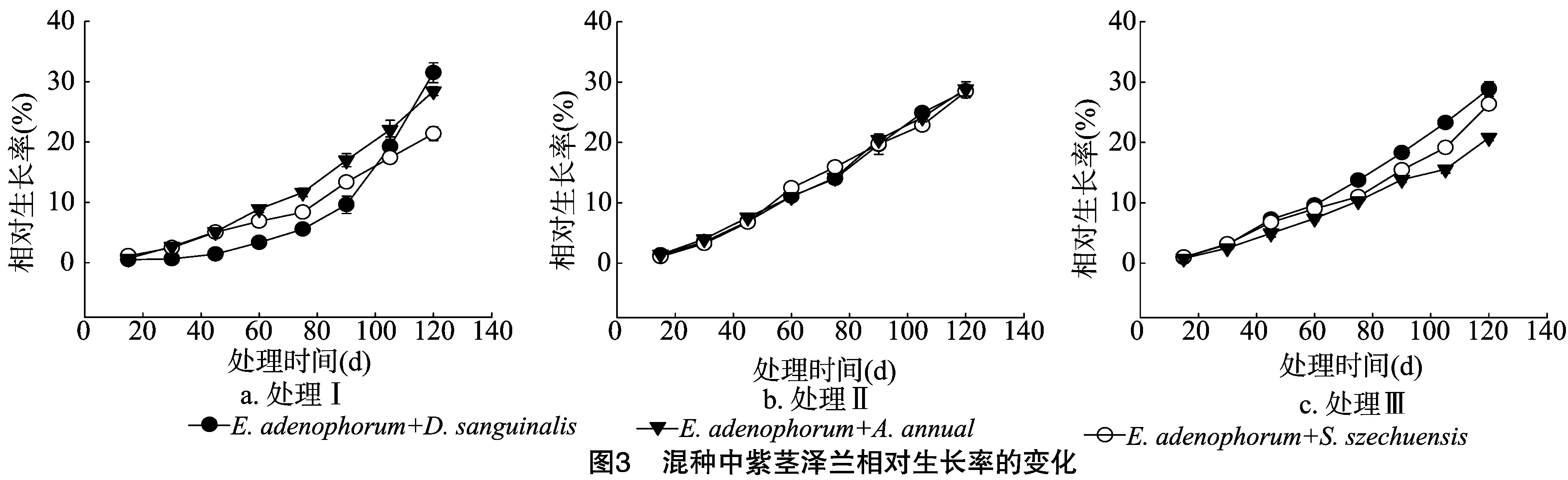
由图3可知,处理Ⅰ中与拔毒散和青蒿混种的紫茎泽兰相对生长率在种植前90 d明显高于与马唐混种的紫茎泽兰,而与马唐混种的紫茎泽兰在种植90 d后相对生长率快速增加,至收获前其相对生长率达到最高值。处理Ⅱ中3种混种处理间紫茎泽兰的相对生长率差别不大。处理Ⅲ中,各混种处理的紫茎泽兰在前60 d没有明显差异,之后与青蒿混种的紫茎泽兰株高相对生长率增加变缓,而与马唐混种处理的明显增加。
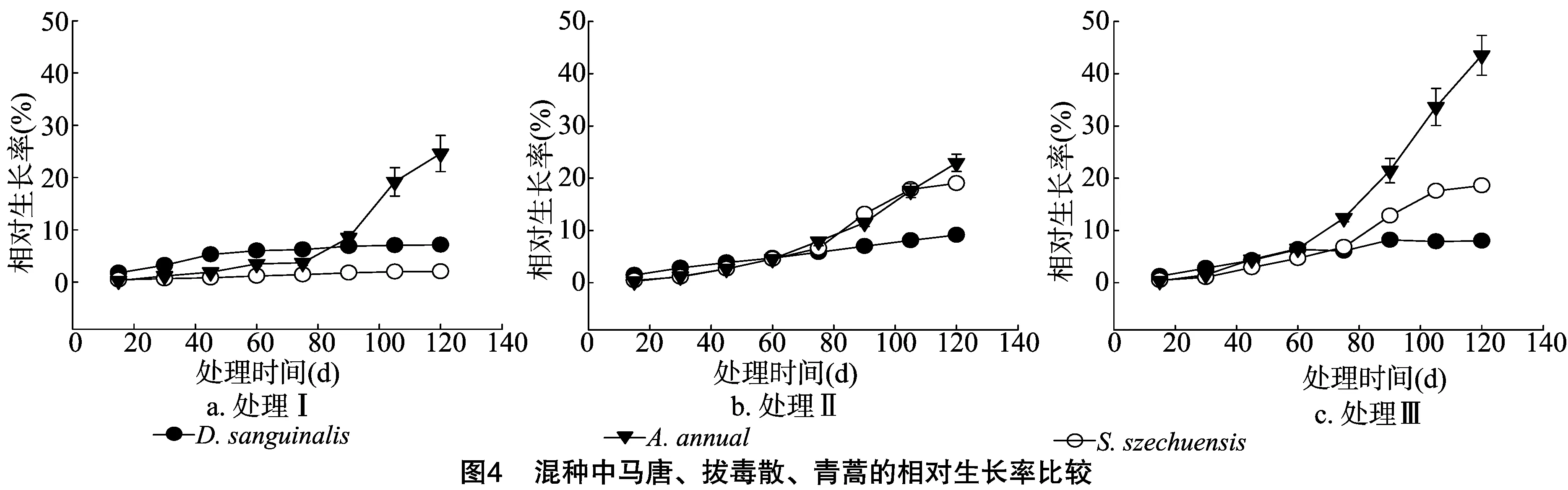
由图4可知,混种种植60 d后处理Ⅲ中的青蒿和拔毒散快速生长,而马唐的相对生长率仍较低。种植75 d后,3种土壤处理方式中混种条件下青蒿的相对生长率表现为处理Ⅲ明显大于处理Ⅰ和处理Ⅱ,拔毒散表现为处理Ⅲ与处理Ⅱ差异不大,但均明显高于处理Ⅰ,马唐在3种土壤中差异不大。
2.4 受试植物混种时生物量比较
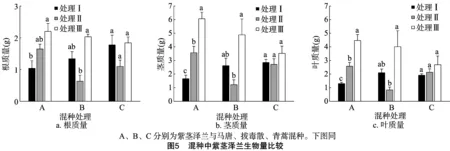
由图5可知,处理Ⅰ紫茎泽兰根、茎、叶生物量均是与马唐混种时最低;处理Ⅱ紫茎泽兰根、茎、叶生物量均为与马唐混种时最高,与青蒿混种次之,与拔毒散混种时最低;处理Ⅲ紫茎泽兰根、茎、叶生物量均较处理Ⅰ、处理Ⅱ高,紫茎泽兰与青蒿混种的根、茎、叶生物量均低于其他2种混种处理。与马唐混种的紫茎泽兰根、茎、叶生物量均表现为处理Ⅲ>处理Ⅱ>处理Ⅰ;与拔毒散混种的紫茎泽兰根、茎、叶生物量均表现为处理Ⅲ>处理Ⅰ>处理Ⅱ;与青蒿混种的紫茎泽兰根、茎、叶生物量在3种土壤处理下没有显著差异。
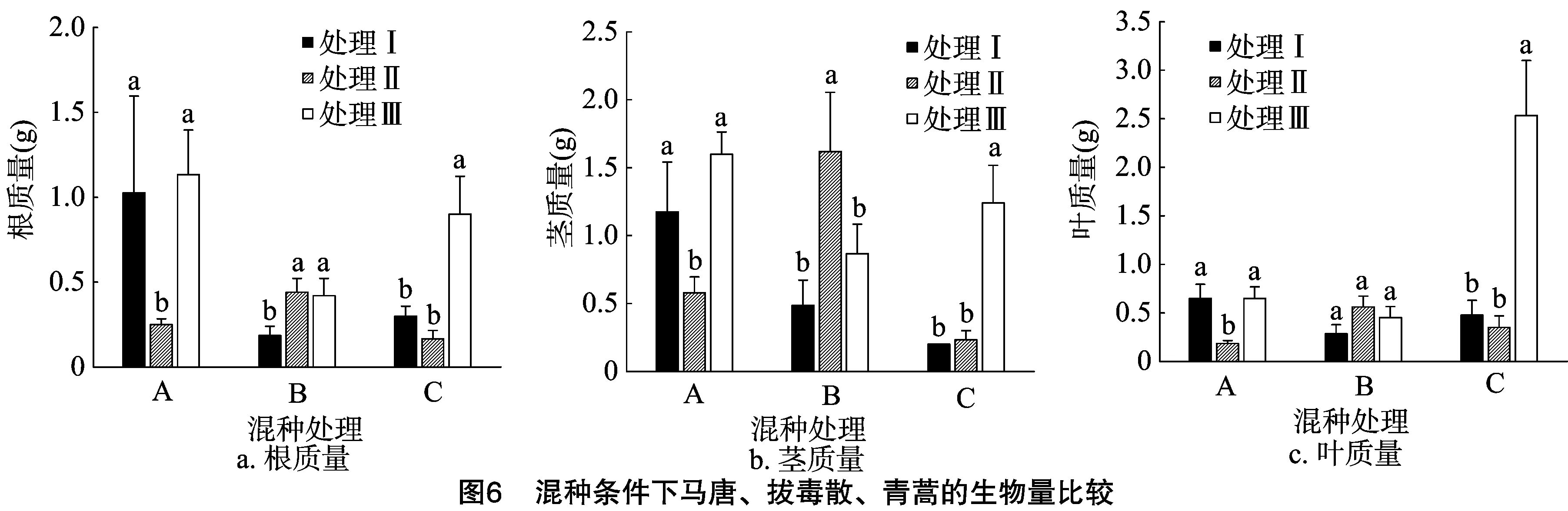
由图6可知,在与紫茎泽兰混种时,处理Ⅰ和处理Ⅲ马唐根、茎、叶生物量没有显著差异,但显著高于处理Ⅱ;处理Ⅱ拔毒散茎生物量显著高于处理Ⅰ和处理Ⅲ;处理Ⅰ和处理Ⅱ青蒿根、茎、叶生物量没有显著差异,但显著低于处理Ⅲ。
3 讨论
植物的形态和生长指标可能与入侵性有关,研究土壤微生物对植物生长速率的影响对探讨植物入侵性具有重要的意义。在单种中,灭菌处理可明显降低植物的相对生长率,其中对青蒿和拔毒散生长速率影响相对较大,对紫茎泽兰和马唐生长的影响相对较小,说明土壤中的微生物群落对植物的生长存在较大的反馈作用[7]。在混种中,灭菌处理下紫茎泽兰早期生长较慢,后期与对照处理相当,添加杀真菌剂处理紫茎泽兰相对生长率略低于对照处理,说明土壤微生物对紫茎泽兰的生长有促进作用,且真菌可在一定程度上促进紫茎泽兰的生长。紫茎泽兰在入侵定植过程中,可改变土壤中真菌成分,影响当地植物的生长[3]。
研究表明,土壤微生物可提高外来植物的竞争优势,影响外来植物和本地植物的种间关系[8-10]。外来植物可通过改变入侵地土壤微生物群落来阻碍当地植物的生长和更新[3,8,11-12],实现对土壤生态系统和地上植物群落组成的改变。在单种中,添加杀真菌剂处理下紫茎泽兰根、茎生物量均显著高于灭菌和对照处理;与灭菌处理相比,添加杀真菌剂处理的3种我国西南当地植物的相对生长速率及其根、茎、叶生物量整体上较高,说明土壤中的微生物对植物的生长有促进作用,但部分真菌类群可在一定程度上抑制我国西南当地植物的生长。土壤菌根真菌通过菌丝连接不同植物来促进寄主植物对营养物质的吸收,抑制伴生植物的生长,实现植物群落的演替[8-9]。添加杀真菌剂处理下,与马唐混种的紫茎泽兰生物量略高于与拔毒散和青蒿混种的紫茎泽兰;对照处理下,与马唐混种的紫茎泽兰生物量高于灭菌处理,而对照处理下马唐的生物量显著低于灭菌处理,说明土壤微生物可促进紫茎泽兰对马唐的竞争作用,但土壤中的真菌类群可能对紫茎泽兰和马唐的生长有抑制作用。对照处理下,与拔毒散混种的紫茎泽兰生物量明显低于其他2种处理,拔毒散根生物量显著高于灭菌处理,茎生物量显著高于灭菌处理和添加杀真菌剂处理,说明土壤微生物抑制了紫茎泽兰对拔毒散的竞争作用,可考虑将拔毒散选作紫茎泽兰的替代植物。与对照处理相比,灭菌处理与青蒿混种的紫茎泽兰生物量及青蒿生物量均无显著差异,只是添加杀真菌剂处理下的青蒿生物量显著高于灭菌和对照处理,说明土壤微生物在紫茎泽兰与青蒿的竞争生长中作用不显著,土壤中的真菌类群可抑制青蒿的生长。本研究认为,土壤中某些微生物类群可在紫茎泽兰与我国西南当地植物的竞争生长中发挥了作用,但具体起作用的是哪些微生物,作用机制如何,还有待进一步研究。
多种机制参与了外来入侵植物的扩张过程[12-14],紫茎泽兰通过影响土壤化感物质积累、微生物群落组成[15-17]和土壤肥力水平[18],创造有利于其入侵的土壤环境,促进了其快速占据生态位。紫茎泽兰与土壤的正反馈作用可能是其成功入侵的重要原因。
致谢:中国科学院西双版纳热带植物园生物入侵生态学创新研究组为本研究提供了试验条件,在此谨表谢忱。
参考文献:
[1]Coleman M D,Dickson R E,Isebrands J G. Contrasting fine-root production,survival and soil CO2efflux in pine and poplar plantations[J]. Plant and Soil,2000,225(1/2):129-139.
[2]Kourtev P S,Ehrenfeld J G,Huang W Z. Enzyme activities during litter decomposition of two exotic and two native plant species in hardwood forests of New Jersey[J]. Soil Biology & Biochemistry,2002,34(9):1207-1218.
[3]Niu H B,Liu W X,Wan F H,et al. An invasive aster (Ageratinaadenophora) invades and dominates forest understories in China:altered soil microbial communities facilitate the invader and inhibit natives[J]. Plant and Soil,2007,294(1/2):73-85.
[4]Saggar S,Mcintosh P D,Hedley C B,et al. Changes in soil microbial biomass,metabolic quotient,and organic matter turnover underHieracium(H.pilosellaL.)[J]. Biology and Fertility of Soils,1999,30(3):232-238.
[5]Callaway R M,Aschehoug E T. Invasive plants versus their new and old neighbors:a mechanism for exotic invasion[J]. Science,2000,290(5491):521-523.
[6]Ridenour W M,Callaway R M. The relative importance of allelopathy in interference:the effects of an invasive weed on a native bunchgrass[J]. Oecologia,2001,126(3):444-450.
[7]肖 博,周 文,刘万学,等. 紫茎泽兰入侵地土壤微生物对紫茎泽兰和本地植物的反馈[J]. 中国农业科技导报,2014,16(4):151-158.
[8]Reinhart K O,Callaway R M. Soil biota facilitate exoticAcerinvasions in Europe and North America[J]. Ecological Applications,2004,14(6):1737-1745.
[9]Callaway R M,Thelen G C,Rodriguez A,et al. Soil biota and exotic plant invasion[J]. Nature,2004,427(6976):731-733.
[10]Klironomos J N. Feedback with soil biota contributes to plant rarity and invasiveness in communities[J]. Nature,2002,417(6884):67-70.
[11]Marler M J,Zabinski C A,Callaway R M. Mycorrhizae indirectly enhance competitive effects of an invasive forb on a native bunchgrass[J]. Ecology,1999,80(4):1180-1186.
[12]钟军弟,周宏彬,刘锴栋,等. 3种菊科入侵植物白花鬼针草、胜红蓟和假臭草的种子生物学特性比较研究[J]. 杂草学报,2016,34(2):7-11.
[13]丁 丹,陈 超. 红毛草(Rhynchelytrumrepens)入侵特性、地理分布和风险评估[J]. 杂草学报,2016,34(2):29-33.
[14]张卫华,陈 超,孙 寅. 斑地锦(Euphorbiamaculata)入侵特征、地理分布和风险评估[J]. 杂草学报,2017,35(1):42-47.
[15]杨 琼,梁 羽,杨 剑,等. 入侵植物薇甘菊的根际土壤微生物特征[J]. 生态科学,2015,34(2):148-155.
[16]赵晓红,杨殿林,王 慧,等. 黄顶菊入侵对不同地区土壤氮循环及微生物量的影响[J]. 草业学报,2015,24(2):62-69.
[17]张丽娜,王桔红,陈 文,等. 红毛草不同程度入侵区土壤微生物群落结构和部分理化指标的比较及其相关性分析[J]. 植物资源与环境学报,2016,25(2):33-40.
[18]刘 潮,冯玉龙,田耀华. 紫茎泽兰入侵对土壤酶活性和理化因子的影响[J]. 植物研究,2007,27(6):729-735.

