大孔树脂对红心火龙果茎多糖脱色除蛋白及抗氧化活性的影响
马若影 李幼梅 邓志勇 陈逸婷 邢燕妮 白新鹏

摘 要 为了提高红心火龙果茎多糖的纯度,并了解大孔树脂处理对多糖抗氧化活性的影响,本研究以多糖脱色除蛋白的效果和多糖保留率为评价指标,从6种大孔树脂中筛选出最佳脱色效果的树脂,以单因素试验为基础通过正交试验设计对大孔树脂脱色除蛋白工艺条件进行优化,并进行抗氧化活性研究。结果表明,AB-8树脂效果最佳,最佳工艺条件为:树脂用量0.6 g/mL,温度60 ℃,pH为5,时间2 h。此条件下得到的脱色率、蛋白去除率和多糖保留率分别为76.51%、88.29%和83.47%。抗氧化活性实验结果表明,火龙果茎多糖具有一定的抗氧化能力,大孔树脂处理后其抗氧化活性有所提高。
关键词 红心火龙果茎;多糖;大孔树脂;脱色;除蛋白;抗氧化活性
中圖分类号 TQ281 文献标识码 A
Abstract In order to improve the purity of polysaccharide, six kinds of resins were uesd in this study. Based on the decolorization and deproteinization rate, a suitable resin was selected and process parameters were optimized. The effect of macroporous resin on the antioxidant activity of polysaccharides was studied. AB-8 was better than the other five resins. Decolorization and deproteinization experiments were carried out by single factor and orthogonal experiments. The optimum technological conditions are as follows: liquid/solid ratio 0.6 g/mL, temperature 60℃, pH 5.0 , and time 2.0 h . Under the conditions the polysaccharide retention, the decolorization rate and the deproteinization rate was 86.46%, 93.39% and 98.32%, respectively. The antioxidant activity of polysaccharide was enhanced after decoloring by macroporous resin.
Keywords red pitaya stem; polysaccharide; macroporous resin; decolorization; deproteinization; antioxidative activity
DOI 10.3969/j.issn.1000-2561.2018.07.006
火龙果(Hylocereus undatus)又称红龙果、仙蜜果等,属仙人掌科,起源于美洲,富含糖、有机酸、蛋白质、维生素等营养物质,是一种具有高营养保健价值的热带水果[1-3]。因此,火龙果作为功能成分的来源,提供可能预防相关疾病的营养素,有利于改善消费者的身心健康[4]。目前我国关于红心火龙果的研究屡见不鲜,但火龙果茎的研究较少,其产业仍处于起步阶段,有着广阔的发展前景。据相关文献报道,火龙果茎中含丰富的植物性多糖,具有美白、保湿、抗氧化等多种活性作用[5-6]。
火龙果茎经提取后,获得的粗多糖仍含有少量杂质,如蛋白质、色素等。传统的除蛋白脱色的方法有盐析法、等电点沉淀法、有机溶剂法、酶解法等;脱色方法有活性炭吸附、过氧化氢脱色和透析等,这些方法各具特点,但易破坏多糖结构,影响其活性,且不可应用于食品级多糖的生产[7]。大孔树脂拥有稳定的理化性质和良好的吸附效果,操作和再生简易,价格便宜,且保留多糖基本性质,因此被广泛应用于天然产物的分离纯化[8-9]。大孔树脂已被应用于木糖等单糖的生产纯化过程[10]。蓝海波等[11]关于龙眼多糖脱色除蛋白的研究中,采用D301-R树脂进行优化试验获得较高的多糖保留率(93.37%)。赵肖通等[12]筛选出D3520树脂对姬松茸多糖脱色,脱色率可高达88.5%。古静燕等[13]筛选出LS-46D树脂去除金针菇粗多糖中的蛋白,使多糖纯度从22.4%提高到58.3%。本研究筛选出火龙果茎多糖纯化的理想大孔树脂,以单因素试验为基础,通过正交试验优化得到最佳脱色除蛋白工艺条件,并比较大孔树脂处理前后火龙果茎多糖的抗氧化活性,既有助于进一步研究火龙果茎多糖,也给工业化生产提供一定技术参考。
1 材料与方法
1.1 材料
火龙果茎(冻干粉)是由海南省东方市北纬十八度果业有限公司提供的大红二号果实果茎;大孔树脂:南开大学化工厂、沧州宝恩化工有限公司,试验中用到的其他常规试剂均为分析纯。
GL-20G-II型高速冷冻离心机,上海安亭科学仪器厂;85-1恒温磁力搅拌器,常州澳华仪器有限公司;SHZ-B水浴恒温震荡器,上海龙跃仪器设备有限公司;FDU-2100冷冻干燥机,埃朗科技国际贸易(上海)有限公司;RE52CS旋转蒸发仪,上海亚荣生化仪器厂;723PC可见分光光度计,上海奥普勒仪器有限公司;EL204型电子天平,梅特勒-托利多仪器(上海)有限公司;亚临界装置,实验室自主研制。
1.2 方法
1.2.1 多糖的提取 采用亚临界装置提取火龙果茎多糖[14]:火龙果茎冻干粉按料液比1:50加入蒸馏水复水20 min,140 ℃提取25 min,离心后取上清液旋蒸浓缩并加入无水乙醇至乙醇体积分数为80%,4 ℃静置沉淀12 h,然后于6 000 r/min的条件下离心5 min,保留沉淀,冻干后按实验需要进行复溶备用。
1.2.2 大孔树脂的预处理 用去离子水溶胀后去除浮在水表的大孔树脂,将筛选出的大孔树脂浸泡于5%HCl 24 h,水洗至pH为7后置于70%乙醇中24 h,去离子水洗至无白色浑浊现象后转移到浓度为700 mg/L的NaOH中静置24 h,水洗至中性后室温下干燥,备用[15]。
1.2.3 分析方法 多糖保留率:计算公式为多糖保留率=(CT1–CR1)/(CT0–CR0)×100%,式中,CT0、CT1分别为吸附前后的总糖含量(mg/g);CR0、CR1分别为吸附前后的还原糖含量(mg/g)。采用苯酚硫酸法测总糖含量[16],采用3,5-二硝基水杨酸法测还原糖含量[17]。
蛋白质去除率:采用考马斯亮蓝法测定蛋白质含量[18]。蛋白质去除率=(No1–No2)/No1×100%,式中,No1和No2分别为吸附前后的蛋白质含量(mg/g)。
脱色率测定:多糖溶液pH调节至6.5±0.1,8 000 r/min离心15 min后抽滤,420 nm处测定OD值。脱色率=(OD前–OD后)/OD前×100%,式中,OD前和OD后分别为吸附前后溶液的光密度值。
1.2.4 大孔树脂效果评价 以多糖保留率、蛋白质去除率、脱色率3项指标进行加权求和[19]。得到公式:u=0.4x+0.3y+0.3z,式中,x表示多糖保留率(%),y表示蛋白质去除率(%),z表示脱色率(%)。
1.2.5 筛选最佳大孔树脂 称量20.0 g树脂与40 mL粗多糖加入100 mL锥形瓶混匀,放置在38 ℃、150 r/min条件下的摇床中2 h,抽滤,蒸馏水洗涤,滤液收集在一起,50 mL容量瓶定容。测多糖保留率、蛋白质去除率和脱色率,参照第1.2.4节进行评分。
1.2.6 单因素试验
1.2.6.1 吸附溫度的确定 称取经预处理干燥后的树脂6 g于100 mL三角瓶中,加入10 mL火龙果茎多糖提取液,调节pH为5,分别在30、40、50、60、70 ℃振摇2 h,采用第1.2.3节方法测定多糖保留率、蛋白质去除率、脱色率。
1.2.6.2 pH的确定 称取经预处理干燥后的树脂6 g于100 mL三角瓶中,加入10 mL火龙果茎多糖提取液,分别调节pH为3.0、4.0、5.0、6.0、7.0,40 ℃振摇2 h,采用第1.2.3节方法测定多糖保留率、蛋白质去除率、脱色率。
1.2.6.3 树脂用量的确定 分别称取经预处理干燥后的树脂2 、4 、6 、8 、10 g 于100 mL三角瓶中,加入10 mL火龙果茎多糖提取液,调节pH值为5,40 ℃振摇2 h,采用第1.2.3节方法测定多糖保留率、蛋白质去除率、脱色率。
1.2.6.4 吸附时间的确定 称取经预处理干燥后的树脂6 g于100 mL三角瓶中,加入10 mL火龙果茎多糖提取液,调节pH为5,40 ℃分别振摇1.0 、2.0 、3.0 、4.0 、5.0 h,采用第1.2.3节方法测定多糖保留率、蛋白质去除率、脱色率。
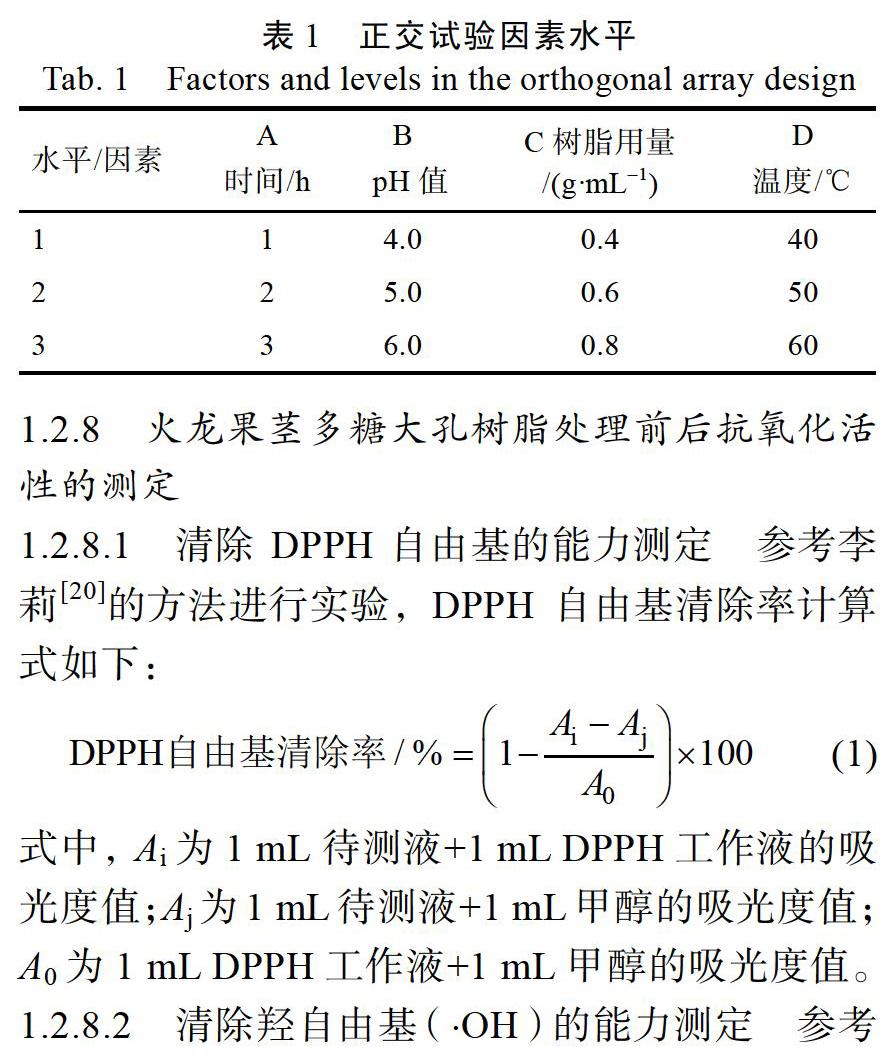
1.2.7 正交试验设计 以单因素试验结果为基础,选择吸附温度、pH值、树脂用量、吸附时间4个因素,如表1所示,进行L9(34)正交试验,每组试验做3次平行。
1.2.8 火龙果茎多糖大孔树脂处理前后抗氧化活性的测定
1.2.8.1 清除DPPH自由基的能力测定 参考李莉[20]的方法进行实验,DPPH自由基清除率计算式如下:
式中,Ai为1 mL待测液+1 mL DPPH工作液的吸光度值;Aj为1 mL待测液+1 mL甲醇的吸光度值;A0为1 mL DPPH工作液+1 mL甲醇的吸光度值。
1.2.8.2 清除羟自由基(OH)的能力测定 参考封燕[21]的方法进行实验,羟自由基清除率计算式如下:
式中,Ai为多糖待测液的吸光度值;Aj为蒸馏水作空白试验的吸光度值;A0为蒸馏水代替过氧化氢溶液的吸光度值。
1.2.8.3 总抗氧化能力和还原力的测定 参考Smirnoff等[22]和刘晓鹏等[23]的方法进行实验。
1.3 数据分析
每组数据至少进行3次平行实验和2次重复实验,取平均值。统计学分析采用DPS数据处理系统,正交试验结果采用正交助手进行分析,用Origin 9.0作图。
2 结果与分析
2.1 筛选最佳大孔树脂
火龙果茎多糖提取液中的主要杂质是色素与蛋白质,杂质含量过高会影响下一步的分离纯化及性质测定。不同型号大孔树脂的吸附性能对火龙果茎多糖纯化过程中脱色除蛋白效果影响很大,树脂的极性、比表面积和空间结构是影响吸附性能的重要因素[24]。试验选取NKA-9、DM301、D101、HPD700、S-8、AB-8这6种分子极性和颗粒理化性质不同的大孔树脂进行比较。其中,极性树脂:NKA-9和S-8;弱极性树脂:AB-8;中极性树脂:HPD700和DM301;非极性树脂:D101。这6种树脂吸附后结果如表2所示。由表2可知,树脂NKA-9、DM30、HPD700脱色效果较好,AB-8、HPD700蛋白质去除率较高,AB-8蛋白质去除率最高,且其多糖保留率也相对较高,综合评分最高为(79.72±0.04)%。综上所述,筛选AB-8树脂作为后续实验的树脂。
2.2 单因素试验
选择吸附温度、pH值、树脂用量、吸附时间四个因素对火龙果茎多糖脱色除蛋白效果的影响进行单因素试验,结果如图1~4所示。
2.2.1 时间 由图1可知,多糖保留率随着吸附时间的延长而逐渐降低,蛋白去除率和脱色率逐渐升高。当吸附时间超过2.0 h时,蛋白去除率和脱色率增加不显著,但对多糖的吸附明显增多。综合上述因素,确定AB-8脱色除蛋白的最佳吸附时间为2.0 h。
2.2.2 pH值 由图2可知,pH值的变化对脱色除蛋白效果有明显的影响。在一定pH值范围内,随着pH值的增大,蛋白去除率和脱色率逐渐降低。然而低pH值条件下容易导致多糖性质发生变化,使得多糖保留率急剧降低。综合上述因素,确定AB-8脱色除蛋白的适宜pH值为5。
2.2.3 树脂用量 如图3所示,随着树脂用量的增加,蛋白去除率和脱色率逐渐升高,当树脂用量超过0.6 g/mL时,蛋白质去除率和脱色率增加缓慢,但增加了对多糖的吸附。综合上述因素,确定AB-8脱色除蛋白的树脂适宜用量为0.6 g/mL。
2.2.4 温度 如图4所示,吸附温度在30~50 ℃时,多糖保留率、蛋白去除率和脱色率随着温度的增加而逐渐提高,当温度高于50 ℃时,三者增长趋势均趋于平缓。综合上述因素,确定AB-8脱色除蛋白的温度为50 ℃。
2.3 正交试验结果
由表3直观分析表明,以多糖保留率、蛋白去除率和脱色率为评价指标,按照第1.2.4节的评价方法综合评分,大孔树脂脱色除蛋白的最佳工艺组合为A2B2C2D3,即吸附时间1 h,吸附pH值为5,树脂用量0.6 g/mL,吸附温度60 ℃,各个因素对大孔树脂脱色除蛋白的影响程度依次是树脂用量>吸附时间>吸附温度>pH值。
2.4 验证实验
在正交试验确定的最佳提取条件下,进行多次验证实验,多糖保留率为(83.47±1.21)%,蛋白去除率为(88.29±1.56)%,脱色率为(76.51±1.63)%,综合评分为(82.83±1.14)%,有较佳的脱色除蛋白效果,由此证明该工艺具有可行性。
2.5 抗氧化活性
由于不同抗氧化剂测定的理论基础不同,单一的抗氧化活性研究难以真正反映样品的抗氧化能力。因此,本研究采用4种方法来反映火龙果茎多糖的抗氧化活性,结果如图5~8所示。
2.5.1 DPPH自由基清除能力 DPPH自由基是一种稳定的自由基,能接受电子或氢自由基,形成稳定的反磁性分子,抗氧化剂对DPPH自由基的清除原理,是基于它的供氢能力[25]。如图5所示,在一定质量浓度范围内,火龙果茎多糖的质量浓度与DPPH自由基清除率成量效关系。纯化前后火龙果茎多糖对DPPH自由基清除能力的IC50值分别为4.20 mg/mL和3.81 mg/mL,说明经树脂纯化后的多糖较纯化前对DPPH自由基的清除能力增强,这可能是因为经大孔树脂处理后的火龙果茎多糖得到了纯化和富集。
2.5.2 OH清除能力 如图6所示,在一定质量浓度范围内,火龙果茎多糖质量浓度与其OH清除率成量效关系。纯化前后火龙果茎多糖对OH清除能力的IC50值分别为3.80 mg/mL和3.51 mg/mL,说明经树脂纯化后的多糖较纯化前对OH的清除能力略有增强。
2.5.3 总还原能力 如图7所示,在一定质量浓度范围内,火龙果茎多糖的质量浓度与总还原能力成量效关系。纯化前后火龙果茎多糖均有较好的还原能力,且纯化后較纯化前略有提高。
2.5.4 总抗氧化能力 如图8所示,在一定的火龙果茎多糖的质量浓度范围内,其总抗氧化能力与质量浓度成量效关系。纯化前后火龙果茎多糖均有较好的总抗氧化能力,且纯化后较纯化前略有提高。
3 讨论
大孔树脂具有可再生、吸附快、选择性好等特点,广泛应用于多糖脱色除蛋白中[26]。方婷等[27]通过研究猪肚菇粗多糖脱色除蛋白工艺,表明采用酶法和sevag及大孔树脂联合的方法可以有效脱色除蛋白,罗玺等[28]采用D303树脂对灵芝多糖进行脱色除蛋白,脱色率高达91.89%。综上所述,采用大孔树脂对红心火龙果茎多糖脱色除蛋白的方法具有可行性。本研究将脱色除蛋白前后的多糖性质进行比较,初步证实了粗多糖的抗氧化活性是多糖的性质,不受其他杂质的影响,能在原来的基础上适当提高其抗氧化活性。
本研究通过比较6种树脂对火龙果茎多糖静态吸附后的脱色除蛋白效果,确定AB-8为理想树脂。通过单因素和正交试验设计,以多糖保留率、蛋白去除率和脱色率为评价指标筛选出最佳脱色除蛋白条件:树脂用量0.6 g/mL,温度60 ℃,pH为5,时间2 h,此条件下得到的脱色率、蛋白去除率和多糖保留率分别为76.51%、88.29%和83.47%。
对火龙果茎多糖进行纯化前后抗氧化对比实验。结果表明,纯化前的粗多糖本身具有较好的抗氧化活性,且抗氧化能力与它们的浓度有明显的量效关系。经过AB-8树脂处理后,其抗氧化活性有所提高,为火龙果茎多糖的纯化奠定基础。
参考文献
[1] 张桂春, 刘玉静, 李延敏, 等. 火龙果果皮中可溶性膳食纤维的提取方法[J]. 植物学报, 2017, 52(5): 622-630.
[2] Castro J C, Endo E H, Souza M R D, et al. Bioactivity of essential oils in the control of Alternaria alternata, in dragon fruit (Hylocereus undatus Haw.)[J]. Industrial Crops & Products, 2017, 97: 101-109.
[3] 王 彬, 郑 伟, 蔡永强. 火龙果果实发育期间营养元素含量的变化[J]. 热带作物学报, 2015, 36(7): 1 242-1 246.
[4] Wichienchot S, Jatupornpipat M, Rastall R A. Oligosaccharides of pitaya (dragon fruit) flesh and their prebiotic properties[J]. Food Chemistry, 2010, 120(3): 850-857.
[5] 王文康. 浅析火龙果丰产栽培技术[J]. 农民致富之友, 2016 (16): 191.
[6] 李 鹏. 火龙果茎凝胶汁、多糖的初步研究[D]. 北京: 首都师范大学, 2009.
[7] 刘 芳, 朱学慧, 刘 玫, 等. 冬凌草多糖脱蛋白和脱色方法的研究[J]. 中药材, 2008, 31(5): 751-753.
[8] 龚 敏, 赵德前, 孙慧洁. 大孔吸附树脂对药桑多糖的脱色及抗氧化活性影响[J]. 中国农学通报, 2016, 32(33): 147-150.
[9] 刘晓庚, 贾红圣, 曹崇江. 大孔吸附树脂分离纯化女贞子原花青素的动力学和热力学研究[J]. 中国粮油学报, 2009, 24(1): 124-128.
[10] 丁胜华, 欧仕益. 活性炭和大孔离子树脂对蔗渣低聚木糖的脱色效果研究[J]. 食品科技, 2010, 35(7): 107-110.
[11] 蓝海波, 温亚州, 杨光美, 等. 龙眼多糖树脂脱色除蛋白工艺优化[J]. 热带作物学报, 2016, 37(8): 1 558-1 566.
[12] 赵肖通, 解军波, 潘炳成, 等. 响应面分析法优化姬松茸多糖的脱色工艺[J]. 食品工业科技, 2016, 37(9): 207-212.
[13] 古静燕, 李新胜, 马 超, 等. 大孔吸附树脂去除金针菇粗多糖中蛋白的研究[J]. 食品工业, 2016, 37(3): 51-53.
[14] 马若影, 杨慧强, 李国胜, 等. 亚临界水提取红心火龙果茎多糖及其抗氧化活性[J]. 食品工业科技, 2017, 38(10): 286-290.
[15] 李幼梅, 周 楷, 白新鹏, 等. 大孔树脂吸附纯化番木瓜籽总三萜研究[J]. 食品安全质量检测学报, 2015, 6(6): 2 171-2 178.
[16] Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[17] 赵 凯, 许鹏举, 谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008, 29(8): 534-536.
[18] 王文平, 郭祀远, 李 琳, 等. 考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J]. 食品研究与开发, 2008, 29(1): 115-117.
[19] 蓝海波, 温亚州, 杨光美, 等. 龙眼多糖树脂脱色除蛋白工艺优化[J]. 热带作物学报, 2016, 37(8): 1 558-1 566.
[20] 李 莉. 文蛤多糖的提取纯化、结构分析及抗氧化、免疫活性初步研究[D]. 无锡: 江南大学, 2015.
[21] 封 燕. 金蝉花多糖的结构特征及免疫活性初步研究[D]. 镇江: 江苏大学, 2016.
[22] Smirnoff N, Cumbes Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1 057-1 060.
[23] 刘晓鹏, 张俊霞, 姜 宁, 等. 响应面试验优化超声辅助提取连钱草多糖工艺及其体外抗氧化活性[J]. 食品科学, 2016, 37(4): 13-19.
[24] 王旭苹, 杨 磊, 杨小兰, 等. 大孔树脂纯化酒花多酚及其组成分析[J]. 食品科学, 2013, 34(22): 15-20.
[25] Blois M S. Antioxidant determinations by the use of a stable free radical[J]. Nature, 1958, 181(4617): 1 199-1 200.
[26] 王躍生, 王 洋. 大孔吸附树脂研究进展[J]. 中国中药杂志, 2006, 31(12): 961-965.
[27] 方 婷, 曾红亮, 陈晓垚, 等. 猪肚菇粗多糖脱蛋白脱色工艺优化研究[J]. 热带作物学报, 2015, 36(6): 1 166-1 172.
[28] 罗 玺, 唐庆九, 张劲松, 等. 灵芝多糖树脂法脱色工艺优化[J]. 食品科学, 2011, 32(16): 5-10.

