Cu2+对多粘类芽孢杆菌增殖及其转化人参皂苷的影响
肖茹雪,臧 埔*,郜玉钢*,赵 岩,祝洪艳,何忠梅,杨 鹤,刘双利,张连学
(吉林农业大学中药材学院,吉林 长春 130118)
人参内生多粘类芽孢杆菌中含有多种生物活性物质,包括固氮酶、植物激素、多糖、水解酶类、抗生素等[1-3],在生物固氮、促进植物生长、研制新型抗生素、防治植物病害等方面具有重大应用价值[4-8]。随着环境污染的日趋严重和人们对食品及健康安全要求的提高,微生物农药受到越来越多的重视。本研究采用人参内生多粘类芽孢杆菌菌株是从人参植株中分离获得的,该菌株的发酵液对人参黑斑病菌(Alternaria panax Whetz.)、人参锈腐菌(Cylindrocarpon destructans Zinns.)、人参菌核病菌(Sclerotinia schinseng Wang.)、人参立枯病菌(Rhizoctonia solani Kuhn.)、人参根腐病菌(Fusarium solani App.)及人参细菌性软腐病(Erwinia carotovora subsp.)等病原菌具有明显的防病效果[9],表现了良好的生防前景,因此如何寻找一种低成本、高效快捷的多粘类芽孢杆菌及其制剂工业化放大培养方式已成为研究的热点。
人参皂苷为人参主要药效成分,但其含量较低,特别是稀有人参皂苷,主要是通过微生物产生的,如酶水解C20上的β-(1-6)-糖苷键以及C3上β-(1-2)-葡萄糖苷键,继而生成Rd→F2或Rg3→C-K或Rh2→二醇型人参皂苷元[10]。20世纪70年代日本Koda等[11]发现用土壤菌的发酵液转化人参皂苷可得到稀有皂苷C-K;90年代日本Yosioka等[12]发现经肠道微生物转化后,人参皂苷Rb1、Rg1可形成易于人体吸收的苷元;2006年Su Jinhuan等[13]从土壤中分离出菌株Fusarium proliferatum ECU2042,该菌能水解人参皂苷Rg3成为Rh2,转化率为60.3%。Yousef等[14]利用畸雌腐霉菌发酵转化二醇类人参皂苷Rb1、Rb2、Rc、Rd等为F2。2007年,成乐琴等[15]从土壤中筛选到一株新细菌Microbacterium esteraromatium GS514,发酵产酶转化Rb1为Rd、Rg3、F2及C-K。佟心等[16]对德式乳杆菌保加利亚亚种研究表明,其转化人参总皂苷时可以得到人参稀有皂苷Rh2。2011年,杨元超等[17]利用串珠镰孢菌Fuasarium moniliforme转化三七茎叶总皂苷Rb1、Rd为C-K。Cu2+通过与蛋白质或其他有机基团结合,形成了酶、激素等生物大分子,适量浓度的Cu2+可促进微生物的生长[18],可见Cu2+可提高微生物的增殖。2013年本实验室用多粘类芽孢杆菌转化人参,提高了Rd等人参皂苷单体含量,人参皂苷的转化离不开次生代谢途径的关键酶催化,可见人参皂苷的转化酶活性对皂苷转化起主要作用[19-21],Cu2+是多种酶的活性中心,可能提高其转化酶的活性[22]。因此本研究系统开展了Cu2+对多粘类芽孢杆菌增殖及其转化人参皂苷影响的研究,旨在为利用该菌株进行植物病害的生物防治生产无公害人参食品,并提高人参中人参皂苷含量提供参考。
1 材料与方法
1.1 材料与试剂
人参(Panax ginseng C. A. Mey.),经吉林农业大学中药材学院郜玉钢教授鉴定为4 a生人参,产地为吉林省抚松县;多粘类芽孢杆菌来自本实验室,已保存在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号CGMCC:No.7250。
人参皂苷对照品Rg1、Re、Rg2、Rg3、Rg5、Rf、F1、F2、Rc、Rd、Rb1、Rb2、Rb3、Rh2、compound K、20(R)-Rh1、Rk3、Rh4、原人参二醇及原人参三醇质量分数均在98%以上,批号分别为201511、201523、201545、201506、201524、201537、201549、201521、201536、201579、201501、201551、201518、201543、201520、201515、201562、201571、201519、201513,来自吉林大学天然药物化学实验室;葡萄糖、CuSO4·5H2O 北京化学工业集团有限责任公司;甲醇、乙腈(均为色谱纯) 德国默克公司;纯净水杭州娃哈哈公司;其余试剂为分析纯。
1.2 仪器与设备
CHA-S型气浴往返恒温振荡培养箱 江苏省金坛市大地自动化仪器厂;Tecan Infinite®200 Pro型多功能酶标仪 上海迪奥生物科技有限公司;LC-2010A高效液相色谱仪(配有LC-2010A型液相色谱泵、LC-2010A型自动进样器、CLASS-VP色谱工作站)、AUY220电子分析天平 日本岛津公司;KQ-250DV超声波清洗器 昆山舒美超声仪器有限公司。
1.3 方法
1.3.1 Cu2+对多粘类芽孢杆菌增殖的影响
无菌条件下,向每个灭菌试管中分别加入5 mL含Cu2+质量浓度分别为0、10、30、50、100、500、1 000、5 000 mg/L的PDB培养基[23],每个质量浓度处理设3 次重复,再向每个试管中分别接种0.05 mL活化的OD600nm值为0.5的多粘类芽孢杆菌菌液,置于28 ℃、120 r/min条件下恒温振荡培养。分别于0、12、24、36、48、60、72、84、96、108、120 h取样测定OD600nm值。
1.3.2 Cu2+对多粘类芽孢杆菌转化人参皂苷的影响
准确称取过20目人参粉末10.0 g于100 mL玻璃三角瓶中,置于烘箱80 ℃干热灭菌2 h,冷却后,无菌条件下,再向玻璃三角瓶中加入灭菌的含Cu2+质量浓度为10~5 000 mg/L的PDB培养基30 mL,再接种OD600nm为0.5的人参内生多粘类芽孢杆菌菌液0.03 mL,转速为120 r/min振荡培养,培养温度为28 ℃,培养时间为7 d,室温真空干燥,得人参内生多粘类芽孢杆菌转化产物,4 ℃贮存备用。精确称取各待测样品0.5 g于10 mL离心管中,分别加入5.0 mL色谱甲醇溶液,密封,超声提取45 min,静置过夜,再超声45 min,离心,取上清液,用0.45 μm滤膜滤过,备用。色谱条件参照本实验室建立的同时测定20种人参皂苷含量的方法[24]。
1.4 统计分析
所得数据应用SPSS 23.0软件进行统计分析。
2 结果与分析
2.1 Cu2+对多粘类芽孢杆菌增殖的影响
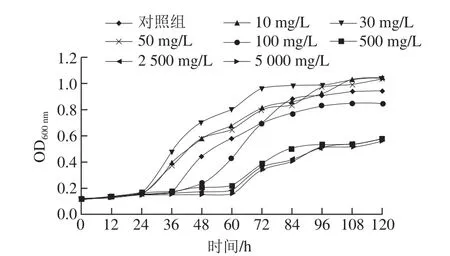
图1 不同质量浓度Cu2+培养条件下多粘类芽孢杆菌的生长曲线Fig. 1 Growth curve of Paenibacillus polymyxa at different Cu2+ concentrations
由图1可见,在本实验设计范围内,当Cu2+质量浓度为10、30、50 mg/L时,与对照组相比多粘类芽孢杆菌增殖的延迟期缩短,对数期提前;当Cu2+质量浓度为30 mg/L时,延迟期缩短12 h左右,对数期提前24 h左右;适宜质量浓度的Cu2+对多粘类芽孢杆菌增殖有一定的促进作用,其中Cu2+质量浓度为30 mg/L时,对多粘类芽孢杆菌促进作用最强。但当Cu2+质量浓度大于100 mg/L时,对多粘类芽孢杆菌增殖有一定的抑制作用,随着质量浓度的增加抑制作用增强。
2.2 Cu2+对多粘类芽孢杆菌转化人参皂苷的影响
2.2.1 色谱峰归属

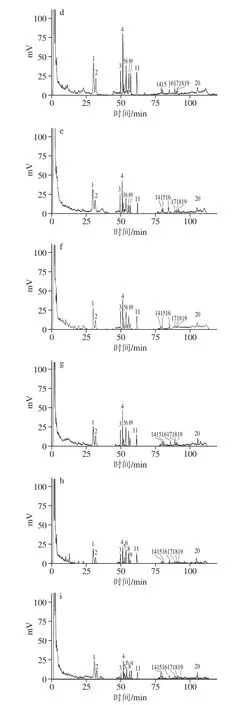
图2 混标及样品高效液相色谱图Fig. 2 HPLC profiles of mixed reference solution and samples
对照品与样品色谱图见图2。20种人参皂苷单体均得到良好分离。
2.2.2 线性关系考察结果
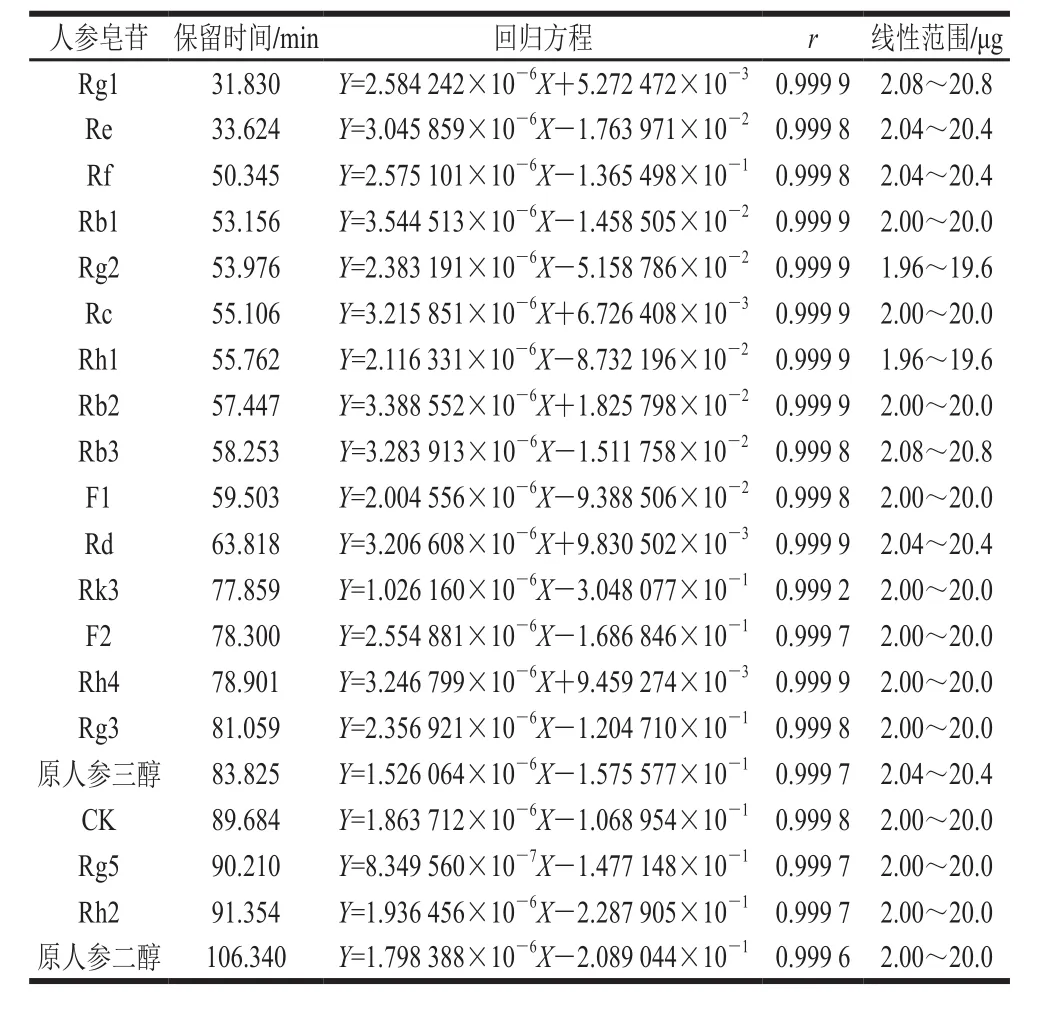
表1 人参皂苷单体回归方程Table 1 Regression equations with correlation coefficients for ginsenosides
以进样中人参皂苷质量(Y)对峰面积积分值(X)作图,得到线性回归方程,见表1。20 种人参皂苷单体Rg1、Re、Rf、Rb1、Rg2、Rc、Rh1、Rb2、Rb3、F1、Rd、Rk3、F2、Rh4、Rg3、原人参三醇、Compound K、Rg5、Rh2、原人参二醇在0.5~40 μg范围内呈良好的线性关系(r>0.999,n=6)。
2.2.3 Cu2+对多粘类芽孢杆菌转化人参皂苷含量的影响
如表2所示,转化体系中Cu2+质量浓度为10 mg/L时,人参皂苷Rg1、Re、Rf、Rb1、Rb3、Rd、原人参三醇、Compound K、原人参二醇同对照组相比含量显著增加(P<0.05);转化体系中Cu2+离子质量浓度为30 mg/L时,转化产物中15 种人参皂苷单体Rg1、Re、Rf、Rb1、Rg2、Rb2、Rb3、Rd、Rg3、原人参三醇、Compound K、Rg5、Rh2、原人参二醇含量均显著增加(P<0.05);转化体系中Cu2+质量浓度为50 mg/L时,人参皂苷Rg1、Rf、Rb1、Rb2、Rb3、Rd、原人参三醇、Compound K、Rh2含量显著高于对照组(P<0.05)。但是,转化体系中Cu2+质量浓度100 mg/L时,Rg1、Rb1、Rb2及20 种人参皂苷加和值均低于对照组(P<0.05);转化体系中Cu2+质量浓度500 mg/L时,Rg1、Rf、Rb2及20种人参皂苷加和值均低于对照组(P<0.05);转化体系中Cu2+质量浓度为2 500 mg/L时,Rg1、Rf、Rb1、Rg2、Rb2、Compound K及20 种人参皂苷加和值均低于对照组(P<0.05);转化体系中Cu2+质量浓度5 000 mg/L时,Rg1、Re、Rf 、Rb1、Rg2、Rb2、Rh4、Rg3及20种人参皂苷加和值均低于对照组(P<0.05)。综上可见,转化体系中Cu2+质量浓度为10~50 mg/L时,促进多粘类芽孢杆菌转化人参皂苷,转化体系中Cu2+质量浓度为30 mg/L时,多粘类芽孢杆菌转化人参皂苷能力最强;但转化体系中Cu2+质量浓度超过100 mg/L,Cu2+反而抑制多粘类芽孢杆菌转化人参皂苷,并且随Cu2+质量浓度增大而抑制作用增强。
3 讨 论
多粘类芽孢杆菌作为美国食品药品监督管理局批准的可用于食品的益生菌,也是我国免于安检的菌株,该菌表现了良好的生防前景,对于降低食品原料的农药残留有重要意义,因此其应用及开发逐年增多[25-27]。如何高效培养多粘类芽孢杆菌已成为研究的热点。本研究发现Cu2+质量浓度为10、30、50 mg/L时,可以相对缩短其延迟期,促进菌体对数期繁殖速度并提高其增殖数量,Cu2+质量浓度为30 mg/L时,效果最好;但Cu2+质量浓度超过100 mg/L时,对菌株增殖有明显的抑制作用。本研究证明适宜质量浓度的Cu2+有利于多粘类芽孢杆菌增殖,对用该菌株进行植物病害的生物防治,从而生产无公害人参食品有一定的参考价值。在多粘类芽孢杆菌实际生产中要考虑微量元素适宜质量浓度范围,研究表明微量元素对菌株的增殖有显著影响,与其他文献报道的结果相一致[28-31]。
本实验室已证明多粘类芽孢杆菌可显著提高人参皂苷含量[18-20],但鲜见用 Cu2+促进多粘类芽孢杆菌转化人参皂苷的方法报道,也鲜见Cu2+促进多粘类芽孢杆菌转化人参皂苷适宜质量浓度的报道。本研究证明Cu2+质量浓度为10~50 mg/L时,可促进多粘类芽孢杆菌转化人参皂苷,转化体系中Cu2+质量浓度为30 mg/L时,多粘类芽孢杆菌转化人参皂苷能力最强,总皂苷加和值为对照组1.64 倍,为微生物转化稀有人参皂苷或提高其产量提供了理论参考。但转化体系中Cu2+质量浓度超过100 mg/L,Cu2+反而抑制多粘类芽孢杆菌转化人参皂苷,并且随Cu2+质量浓度增大而抑制作用增强。分析认为这是由于适宜质量浓度的Cu2+促进多粘类芽孢杆菌对脂肪酸等营养物质的吸收,从而促进其增殖[32],而过高质量浓度的Cu2+,反而与巯基结合,破坏细胞合成酶的活性使细胞丧失分裂增殖的能力[33];适宜质量浓度的Cu2+提高了多粘类芽孢杆菌的数量及糖基转移酶的活性,从而促进了多粘类芽孢杆菌对人参皂苷转化,其作用机制有待于进一步研究[34]。
参考文献:
[1]刘振华, 井长勤, 周晨妍. 生防细菌多粘类芽孢杆菌多糖研究进展[J]. 上海农业学报, 2015(4): 146-150. DOI:10.15955/j.issnlooo-3924.2015.04.29.
[2]苍桂璐, 张付云, 杨阳, 等. 多粘类芽孢杆菌的研究进展[J]. 安徽农业科学,2013, 41(2): 487-489. DOI:10.13989/j.cnki.0517-6611.2013.02.105.
[3]王刘庆, 王秋影, 廖美德. 多粘类芽孢杆菌生物特性及其机理研究进展[J]. 中国农学通报, 2013(11): 158-163. DOI:10.3969/j.issn.1000-6850.2013.11.031.
[4]ÇAKMAKÇI R, KANTAR F, ALGUR Ö F. Sugar beet and barley yields in relation to Bacillus polymyxa and Bacillus megaterium var.phosphaticum inoculation[J]. Journal of Plant Nutrition & Soil Science,2015, 162(4): 437-442. DOI:10.1002/(SICI)1522-2624(199908)1622:4<437::AID-JPLN437>3.0.CO.
[5]KAVITHA S, SENTHILKUMAR S, GNANAMANICKAM S, et al. Isolation and partial characterization of antifungal protein from Bacillus polymyxa, strain VLB16[J]. Process Biochemistry, 2005,40(10): 3236-3243. DOI:10.1016/j.procbio.2005.03.060.
[6]GAO Y, LIU Q, ZANG P, et al. An endophytic bacterium isolated from Panax ginseng C.A. Meyer enhances growth, reduces morbidity, and stimulates ginsenoside biosynthesis[J]. Phytochemistry Letters, 2015,11: 132-138. DOI:10.1016/j.phytol.2014.12.007.
[7]徐桑尔, 卢鹏, 金莉萍, 等. 多粘类芽孢杆菌防治铁皮石斛细菌性叶斑病及促生效果[J]. 浙江农业科学, 2016, 57(12): 2033-2034.DOI:10.16178/j.issn.0528-9017.20161233.
[8]扈进冬, 吴远征, 李纪顺, 等. 拮抗性多粘类芽孢杆菌PB-2及其制剂对葡萄霜霉病的防效测定[J]. 山东科学, 2014, 27(3): 30-33.DOI:10.3976/j.issn.1002-4026.2014.03.006.
[9]郜玉钢, 张连学, 臧埔, 等. 一种人参内生多粘类芽孢杆菌生物防治菌剂制备方法: CN103250741A[P/OL]. 2013-08-21[2017-04-24].http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCPD&dbn ame=SCPD2013&filename=CN103250741A.
[10]郜玉钢, 张连学, 臧埔, 等. 一种人参内生多粘类芽孢杆菌转化人参皂苷的方法: CN103255193A[P/OL]. 2013-08-21[2017-04-24]. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCPD&dbname=SCPD2013&filename=CN103255193A&uid.
[11]KODA H, TANAKA O. Enzymic hydrolysis of ginseng saponins and their related glycosides[J]. Yakugaku Zasshi, 1975, 95(2): 246.DOI:10.1248/yakushi1947.95.2_246.
[12]YOSIOKA I, SUGAWARA T, IMAI K, et al. Soil bacterial hydrolysis leading to genuine aglycone. V. on ginsenosides-Rb_1, Rb_2, and Rc of the ginseng root saponins[J]. Chemical & Pharmaceutical Bulletin,2008, 20(11): 2418-2421. DOI:10.1248/cpb.20.2418.
[13]SU J H, XU J H, LU W Y, et al. Enzymatic transformation of ginsenoside Rg 3, to Rh 2, using newly isolated Fusarium proliferatum ECU2042[J]. Journal of Molecular Catalysis B Enzymatic, 2006,38(2): 113-118. DOI:10.1016/j.molcatb.2005.12.004.
[14]YOUSEF L F, BERNARDS M A. In vitro metabolism of ginsenosides by the ginseng root pathogen Pythium irregulare[J]. Phytochemistry,2006, 67(16): 1740-1749. DOI:10.1016/j.phytochem.2005.06.030.
[15]成乐琴, 金瑜真, 梁德春. 微生物酶催化制备人参皂苷20(S)-Rg2,20(S)-Rh1和20(S)-PPT[J]. 高等学校化学学报, 2011, 32(1): 67-73.
[16]佟心, 陈凯千. 一种人参皂苷Rh2的制备方法: CN102154428A[P/OL].2011-08-17[2017-04-24]. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?d bcode=SCPD&dbname=SCPD2011&filename=CN102154428A&uid.
[17]杨元超, 王英平, 闫梅霞, 等. 人参皂苷compound K转化菌株的筛选[J]. 中国中药杂志, 2011, 36(12): 1596-1598. DOI:10.4268/cjcmm20111210.
[18]陈琳. Cu、Cd对农业废弃物发酵过程中微生物和酶活性的影响[D].杨凌: 西北农林科技大学, 2012: 18-24.
[19]李学. 内生细菌转化人参皂苷的研究[D]. 长春: 吉林农业大学,2013: 33-40.
[20]姬庆. 多粘类芽孢杆菌转化人参产物抗肿瘤活性及其机理初探[D].长春: 吉林农业大学, 2016: 35-39.
[21]JI Q, GAO Y, ZHAO Y, et al. Determination of ginsenosides by Bacillus polymyxa, conversion and evaluation on pharmacological activities of the conversion products[J]. Process Biochemistry, 2015,50(6): 1016-1022. DOI:10.1016/j.procbio.2015.03.013.
[22]林红梅. 生态因子对人参皂苷含量及其生物合成关键酶基因表达的影响[D]. 长春: 吉林农业大学, 2016: 51-73.
[23]费镛. 常用培养基的配制[J]. 食品工业科技, 1986, 7(4): 48-54.DOI:10.13386/j.issn1002-0306.1986.04.012.
[24]杨艳文, 孟凡双, 郜玉钢, 等. 高效液相色谱法同时测定人参制剂中20种人参皂苷方法的建立[J]. 食品科学, 2016, 37(22): 131-135.DOI:10.7506/spkx1002-6630-201622019.
[25]徐匆, 马锞, 李艳芳, 等. 多粘类芽孢杆菌复合生物保鲜剂对桂味荔枝的保鲜效果[J]. 广东农业科学, 2016(7): 105-109. DOI:10.16768/j.issn.1004-874X.2016.07.017.
[26]SHINTU P V, JAYARAM K M. Phosphate solubilising bacteria(Bacillus polymyxa): an effective approach to mitigate drought in tomato (Lycopersicon esculentum Mill.)[J]. Tropical Plant Research,2015, 2(1): 17-22.
[27]罗远婵, 李淑兰, 刘盼西, 等. 防治植物细菌性和真菌性土传病害及叶部病害的新型、高效微生物杀菌剂—多粘类芽孢杆菌和海洋芽孢杆菌系列产品的创制及产业化[C]//中国植物保护学会2015年学术年会论文集, 2015: 3.
[28]王瑶, 刘玉香, 安华, 等. 金属离子对粪产碱杆菌C16的脱氮和亚硝酸盐积累的影响[J]. 微生物学通报, 2014, 41(11): 2254-2263.DOI:10.13344/j.microbiol.china.140122.
[29]孙淑静, 单书凯, 李钊锋, 等. 不同微量元素对斑玉蕈菌丝生长及酶活的影响[J]. 福建农林大学学报(自然科学版), 2015, 44(6): 639-645.DOI:10.13323/j.cnki.j.fafu(nat.sci.).2015.06.014.
[30]HE Y, CHEN Z, LIU X, et al. Influence of trace elements mixture on bacterial diversity and fermentation characteristics of liquid diet fermented with probiotics under air-tight condition[J]. PLoS ONE,2014, 9(12): e114218. DOI:10.1371/journal.pone.0114218.
[31]MAHMOOD M. Trace elements for growth and bulbiformin production by Bacillus subtilis[J]. Journal of Applied Bacteriology,2010, 35: 1-5. DOI:10.1111/j.1365-2672.1972.tb03668.x.
[32]宋秋瑾. 区域尺度下农田土壤微生物对重金属和土壤特性的响应与定向变异[D]. 杭州: 浙江大学, 2015: 59-68.
[33]张志军. 铜配合物抑菌作用的研究及几种化学修饰电极的制备[D].武汉: 武汉理工大学, 2012: 43-51.
[34]陈欣, 薛轶, 刘吉华, 等. 人参毛状根糖基转移酶的分离纯化及酶学性质研究[J]. 药物生物技术, 2009(1): 50-54.

