鲜莲结合酚的提取及其抗氧化活性分析
王振宇,葛胜晗,周阿容,孔子浩,曾绍校,郑宝东,林少玲*,胡嘉淼*
(福建农林大学食品科学学院,福建 福州 350002)
莲是一个重要的特色农产品,在中国已有几千年历史,被广泛栽培和食用,主要分布在浙江、江苏、江西、湖南、湖北、河北、福建[1],以湖南湘莲、福建建莲、浙江衢莲为上品。莲的多种组织器官如花、胚、胚乳、子房、叶片等富含多种对人体有益的营养物质,如氨基酸、活性多糖、多酚类物质以及矿物质等,可对人类的心血管疾病、糖尿病、肥胖和肿瘤等的产生起防治作用[2],多酚类化合物作为植物特有的功能性成分,在国内外虽已有大量研究报道,但大部分考虑了水溶性有机溶剂体系中提取的部分,而残渣没有进行分析,而这些残渣已被发现含有大量的结合酚[3-4]。这些酚类成分多与纤维素、蛋白、木质素、葡萄糖、酒石酸等以结合态的形式存在于植物细胞的初生壁和次生壁中,有机溶剂无法将其萃取出来[5]。Pérez等[6]研究表明在水果中结合态多酚所占比60%~90%,Wang Bini等[7]研究表明枣籽中结合态多酚含量是游离态的3 倍多,此外,众多的体外抗氧化实验表明,与自由酚相比,不溶性的结合酚则表现出较高的抗氧化能力[8],说明结合态多酚在植物多酚分析中的重要性。当前结合酚的提取方法主要有碱法(氢氧化钠溶液)[9],以及酸法(盐酸、硫酸)加热水解萃取[10],其中以碱法最为常用,可避免高温带来的结合酚损失。
建宁鲜莲作为福建特色产品,课题组前期对其进行了大量研究,结果表明鲜莲中不仅含有丰富的碳水化合物、蛋白质、维生素等常规营养物质,而且还含有水溶性多糖、生物碱、类黄酮和超氧化物歧化酶等功能性成分[11]。此外,课题组还对建宁干莲中游离态多酚的提取、抗氧化能力、组分鉴定以及抑菌机理进行了探索,结果表明干莲中含有一定量的多酚类物质且具有较强的抑菌效果[12],但目前为止有关鲜莲中结合酚的研究鲜见报道,本实验以建宁鲜莲为原料,比较不同酸、碱溶剂对鲜莲结合酚的提取效果,确定提取溶剂并优化提取工艺参数,以期得到适合鲜莲结合酚的最优提取方法,另外,结合不同极性有机溶剂萃取结合酚提取物,比较其抗氧化活性,为全面评价鲜莲中结合酚含量及鲜莲的高效利用提供了实验支撑。
1 材料与方法
1.1 材料与试剂
建宁速冻鲜莲(各成分质量分数为水分46.20%、脂肪1%、膳食纤维3%、碳水化合物5%、蛋白质8%、钙2%、铁3%、VC 2%)由绿源(福建)食品有限公司提供,样品真空冷冻干燥至含水率4%以下,粉碎过40 目筛,取筛上物备用。
正己烷、甲醇、氢氧化钠、盐酸、硫酸、乙酸乙酯、氯仿、正丁醇、碳酸钠、没食子酸标准品均为市售分析纯;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、福林-酚试剂、α-淀粉酶(40 000 U/g)、木瓜蛋白酶(800 000 U/g)、羟自由基测定试剂盒、总抗氧化能力测试盒 南京建成生物科技有限公司。
1.2 仪器与设备
卤素快速水分测定仪 深圳市冠亚电子科技有限公司;真空冷冻干燥机 北京博医康实验仪器有限公司;高速粉碎机 浙江红景天有限公司;电子天平梅特勒-托利多仪器(上海)有限公司;多功能搅拌器、数显恒温水浴锅 国华电器有限公司;恒温水浴振荡器苏州培英实验设备有限公司;旋转蒸发器 上海亚荣生化仪器厂;高速离心机 长沙湘仪离心机仪器有限公司;纯氮 福州华鑫达工业气体有限公司;紫外分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1 结合酚的提取[13-14]
将鲜莲真空冷冻干燥,研磨成粉,加入蛋白酶4 mg/g、α-淀粉酶60 U/g,81.6 ℃加水振荡酶解3 h,酶解结束后,再加无水乙醇至乙醇体积分数为50%,继续搅拌2.45 h,随后离心(4 000 r/min,10 min),弃去上清液,残渣用同样方法提取2 次,滤出上清液,残渣冻干。称2 g鲜莲残渣置于加有磁力搅拌器的三角瓶,加入提取试剂,室温边搅拌边氮气消化10 min,橡胶塞密封,继续搅拌至所需时间,待结束后将所得水解液冷却,用6 mol/L的HCl溶液调节pH值至中性,离心(10 000 r/min,5 min),弃去残渣,所得上清液定容,测定结合酚含量。
1.3.2 不同极性结合酚的分离
参照向乐进等[15]分离方法,略有改动。取离心后鲜莲结合酚粗提液,进行浓缩,再分别用氯仿、乙酸乙酯、正丁醇以体积比1∶1将浓缩液萃取5 次,萃取工艺如图1所示,萃取液55 ℃旋转蒸发至浸膏状,不同极性分离液分别进行真空冷冻干燥,所得粉末贮存在-80 ℃,使用时用水溶解,分别测定不同相的结合酚含量和抗氧化能力。
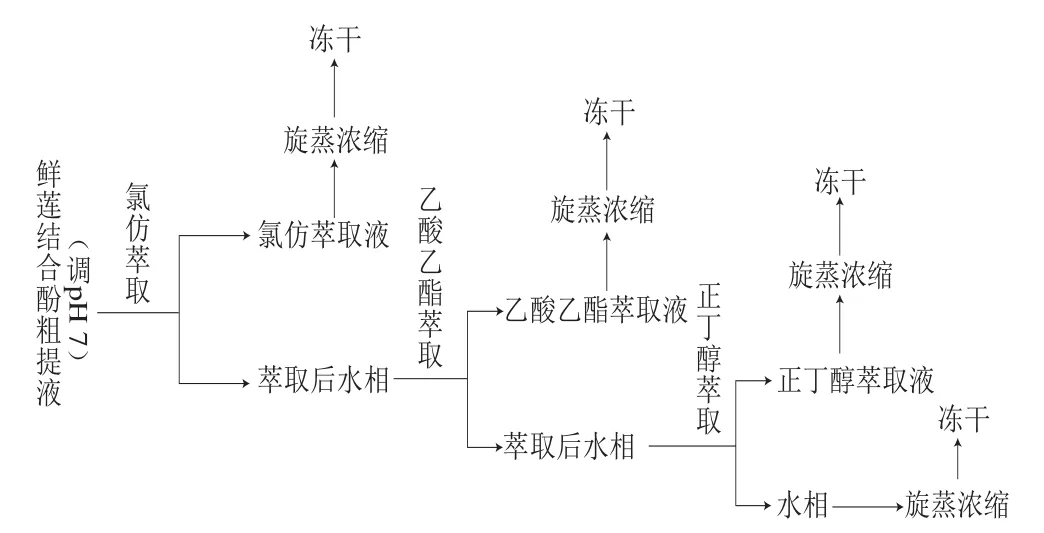
图1 不同极性结合酚的萃取分离Fig. 1 Extraction and separation of bound polyphenols with solvents of different polarities
1.3.3 不同试剂对鲜莲结合酚得率的比较
按照上述工艺,固定条件为提取试剂浓度1 mol/L、料液比1∶20(g/mL)、提取时间1 h,分别使用浓度均为1 mol/L的NaOH溶液、HCl溶液、H2SO4溶液3 种不同的试剂提取鲜莲结合酚,比较不同试剂对鲜莲结合酚得率影响。
1.3.4 单因素试验
以NaOH溶液为提取试剂,各因素基本条件固定为NaOH溶液浓度1 mol/L、料液比1∶20(g/mL)、提取时间1 h。改变其中一个条件,分别考察其余条件对提取液中结合酚得率影响。各因素试验范围为NaOH溶液浓度1、2、3、4、5 mol/L,料液比1∶10、1∶15、1∶20、1∶25、1∶30(g/mL),提取时间1、2、3、4、5、6 h。
1.3.5 中心组合优化试验
在单因素试验基础上,采用Box-Behnken设计以NaOH溶液浓度(A)、料液比(B)、提取温度(C)为自变量,结合酚得率(Y)为响应值进行3因素3水平的中心组合试验,具体因素与水平见表1。
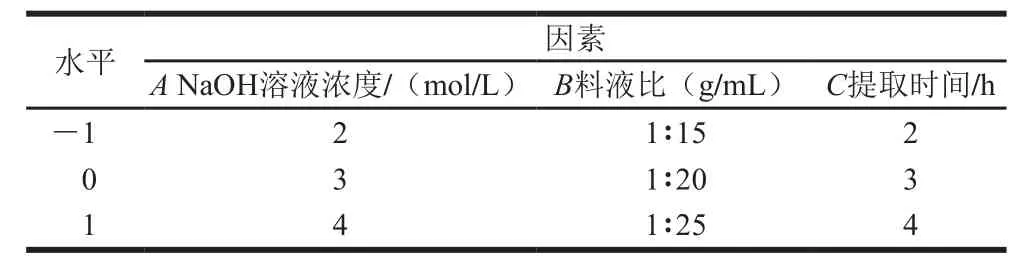
表1 中心组合试验因素与水平Table 1 Code and level of independent variables used in central composite experiments
1.3.6 鲜莲结合酚得率的测定
1.3.6.1 标准曲线的绘制
参照卜彦花等[16]的测定方法,略有改动。准确称取0.500 0 g没食子酸溶于蒸馏水中,定容至100 mL,取原液5 mL稀释定容至100 mL,即得质量浓度为250 μg/mL的没食子酸标准溶液,继续稀释得质量浓度分别为200、150、100、50、15 μg/mL的没食子酸标准溶液。吸取0.1 mL没食子酸标准溶液,加入1.5 mL稀释10倍的福林-酚试剂混匀,静置5 min后加入1.5 mL 6 g/100 mL Na2CO3溶液,再将混合液置于70 ℃恒温水浴中保温10 min。随后立即将溶液置于冰浴中冷却至室温,于725 nm波长处测定吸光度,重复3 次。根据没食子酸溶液质量浓度和吸光度,绘制标准曲线,得到的回归方程为Y=0.004 9X+0.065(R2=0.999 1)。
1.3.6.2 样品结合酚得率的测定
取0.1 mL的样品溶液,加入1.5 mL稀释10 倍的福林-酚试剂混匀,静置5 min后加入1.5 mL 6 g/100 mL Na2CO3溶液,再将混合液置于70 ℃恒温水浴锅中保温10 min。随后立即将溶液至于冰浴中冷却至室温,于725 nm波长处测定吸光度,重复3 次。利用公式(1)计算样品中结合酚得率:
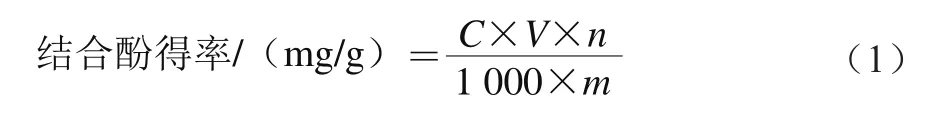
式中:C为没食子酸溶液质量浓度/(μg/mL);V为溶液体积/mL;n为稀释倍数;m为鲜莲子渣质量(干质量)/g。
1.3.7 萃取相结合酚含量及抗氧化活性测定
1.3.7.1 萃取相结合酚含量的测定
取冻干后各萃取相粉末1 g,加水溶解配制成100 mg/mL的溶液,参考1.3.6节方法进行不同极性部分中结合酚含量的测定,其结果以每克萃取物中结合酚质量计。
1.3.7.2 DPPH自由基清除率的测定[17-18]
将不同相冻干后所得结合酚粗品,用水溶解并稀释成不同质量浓度(3.125、6.25、12.5、25、50 mg/mL),取各质量浓度稀释液1 mL,加入3 mL用甲醇溶解的DPPH(0.1 mmol/L),室温下避光静置30 min,于517 nm波长处测定其吸光度As,以甲醇代替样品液为空白测定其吸光度Ac,重复3 次。按式(2)计算DPPH自由基清除率:
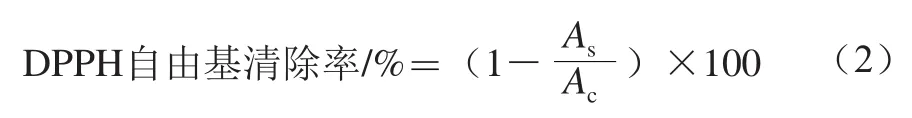
式中:As为1 mL样品溶液+3 mL DPPH溶液的吸光度;Ac为1 mL甲醇溶液+3 mL DPPH溶液的吸光度。
1.3.7.3 总抗氧化能力的测定
按总抗氧化能力检测试剂盒要求准备工作液。取1 mL各极性部分萃取物稀释液置于试管中,加入检测试剂2.0 mL,混合均匀,于37 ℃恒温水浴箱反应30 min,于520 nm波长处测定吸光度。定义37 ℃每分钟每毫升样品液反应体系的吸光度每增加0.01时为一个抗氧化能力单位[19],按式(3)进行计算:
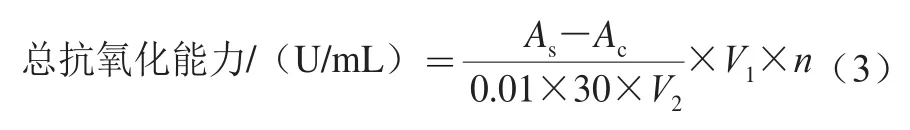
式中:As为样品的吸光度;Ac为空白组吸光度;V1为反应液总体积/mL;V2为取样体积/mL;n为稀释倍数。
1.3.7.4 羟自由基清除率的测定
按羟自由基测试盒说明书加样、混匀,最后室温放置20 min,双蒸水调零,测定体系550 nm波长处的吸光度。按式(4)计算鲜莲结合酚对羟自由基清除率:
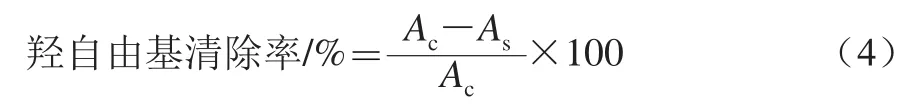
式中:As为样品的吸光度;Ac为空白组吸光度。
1.4 数据处理
单因素试验数据使用Excel 2016、Origin 8.5软件进行处理,差异显著性分析使用DPS9.5软件进行,P小于0.05为具有统计学意义,中心组合法试验数据使用Design Expert 8.0.5软件进行处理。
2 结果与分析
2.1 不同提取试剂对鲜莲结合酚得率的影响
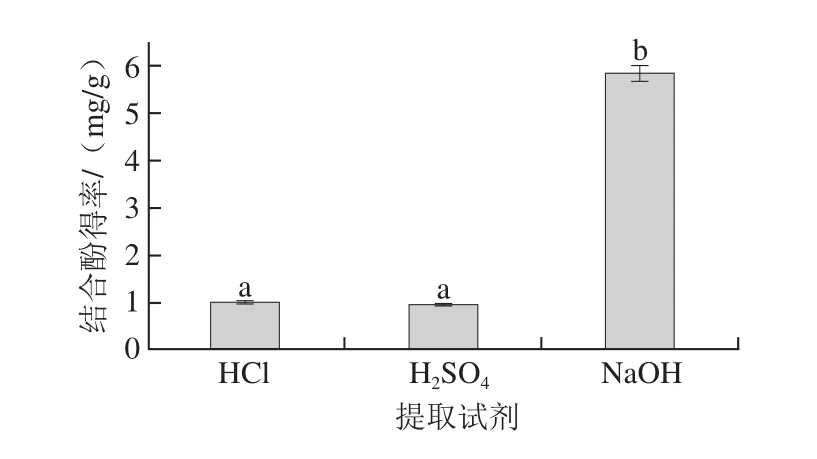
图2 提取试剂对鲜莲结合酚得率的影响Fig. 2 Effects of solvents on extraction of bound polyphenols from fresh lotus seeds
由图2可以看出,NaOH溶液作为提取试剂所得鲜莲结合酚得率远远大于HCl和H2SO4所得得率,符合Kim等[20]研究结论:与酸法相比,碱法更适合结合酚的提取,可显著提高结合酚的含量。因为虽然酸处理可以有效地破坏糖苷键,而对酯键的破坏力微乎其微,采用碱水解却可使酚酸与细胞壁相连的酯键断裂,使酚类化合物得以从多酚-多糖等复合物中释放出来[21],因此选择NaOH溶液作为提取试剂。
2.2 单因素试验结果
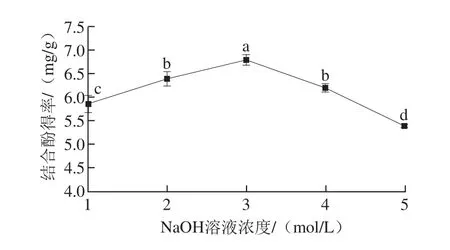
图3 NaOH溶液浓度对鲜莲结合酚得率的影响Fig. 3 Effect of NaOH concentration on extraction of bound polyphenols from fresh lotus seeds
如图3所示,NaOH溶液浓度对结合酚得率影响显著(P<0.05),NaOH溶液浓度在1~3 mol/L范围内,随着NaOH溶液浓度的增加,结合酚得率呈增加趋势,适当碱液浓度能够水解酚类化合物与细胞壁之间的醚键和酯键,促进结合酚的释放,但随着NaOH溶液浓度的继续增加,结合酚得率逐渐降低,可能是由于碱液浓度过高,造成提取液黏度增大,不利于过滤、离心,影响结合酚得率[22],另外,酚类化合物在苯环上具有羟基,处于强碱环境中易发生电离现象,也会造成结合酚的损失[23]。White等[24]研究证明有效的释放结合酚类物质NaOH溶液浓度为1~4 mol/L。故选NaOH溶液浓度为3 mol/L。
由图4可见,结合酚得率随提取试剂用量的增加差异显著(P<0.05),在1∶20(g/mL)时达到最大值,随后逐渐减小最后趋于稳定。可能原因是结合酚类物质与蛋白质、多糖、生物碱等大分子通过共价键进行结合,而碱液可以起到破坏结合键的作用,释放出结合酚,因而在一定范围内,通过增加溶剂的用量可以促进结合酚的溶出[21,25]。但随着溶剂的用量增大,溶液浓缩时能耗也增大,同时释放出的酚类物质在后续处理过程中更易受到氧化,再者,蛋白质、糖等水溶性物质易大量溶出,黏度增大,阻碍酚酸的水解分离,降低得率,而当溶剂用量达到一定程度,多酚的溶出此时也已达极限,这时结合酚得率将保持相对稳定状态[26-27]。故选料液比为1∶20(g/mL)。

图4 料液比对鲜莲结合酚得率的影响Fig. 4 Effect of solid-to-solvent ratio on extraction of bound polyphenols from fresh lotus seeds
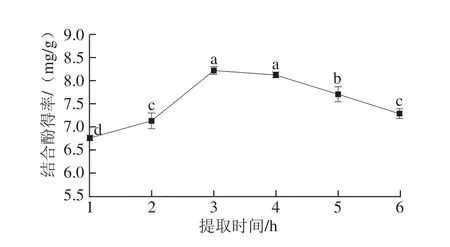
图5 提取时间对鲜莲结合酚得率的影响Fig. 5 Effect of extraction times on the rate of bound polyphenols from fresh lotus seeds
图5显示:随着提取时间的延长,结合酚得率逐渐增加,当提取时间达到3 h时,结合酚得率达到最大值;此后随着提取时间的继续延长,结合酚得率又呈下降趋势。这可能是由于过短的提取时间不能使与结合酚相连的化学键完全断裂,而提取时间过长,又会使部分结合酚被氧化,能耗量增大,杂质大量溶出,不利于分离提取[22,28]。故选取提取时间为3 h。
2.3 中心组合试验结果
2.3.1 中心组合试验设计与结果
回归模型的建立及显著性检验分别以结合酚得率为指标,对表2数据进行二次多元回归拟合得到鲜莲结合酚的提取工艺的数学模型回归方程:Y=8.09-0.34A+0.45B+0.43C-17.500×10-4AB-0.14AC+0.060BC-1.08A2-0.16B2-0.37C2,其中Y为结合酚得率/(mg/g),A、B、C分别为NaOH溶液浓度、料液比、提取时间。回归模型经方差分析进行显著性及拟合度检验如表3所示。
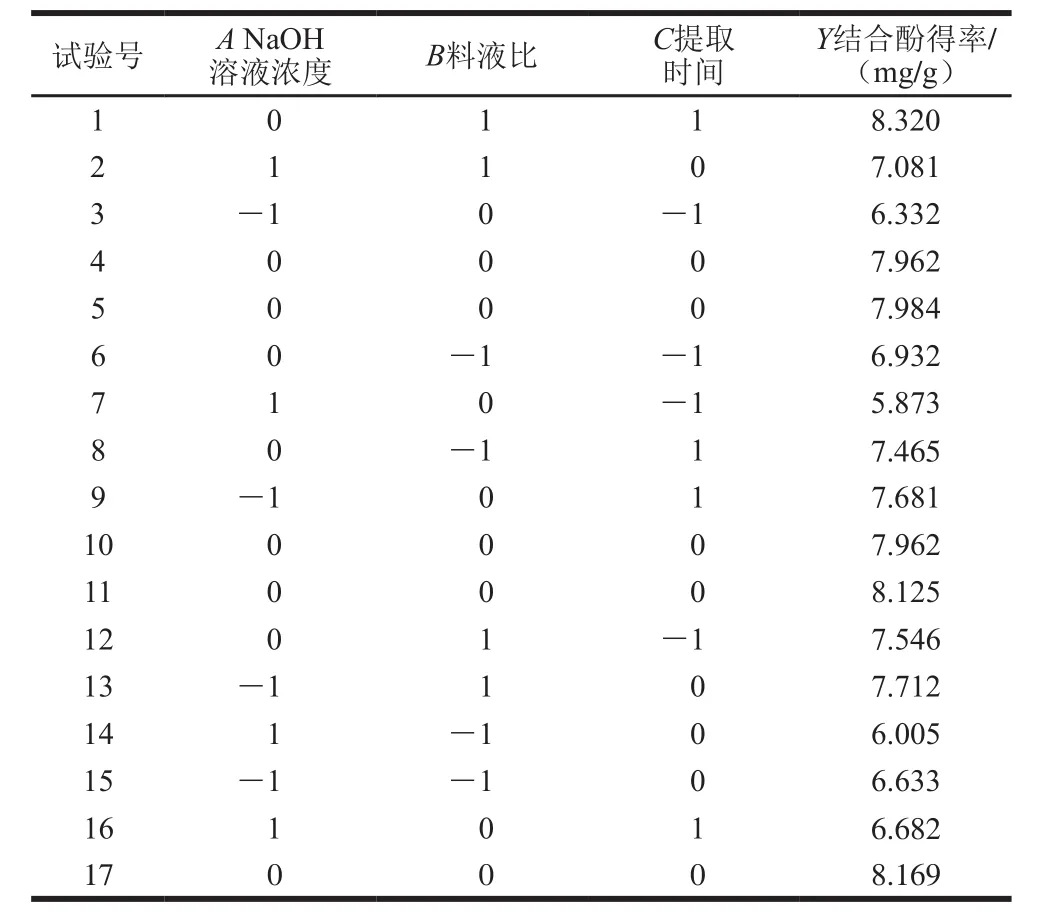
表2 中心组合试验设计与结果Table 2 Central composite design with response variable
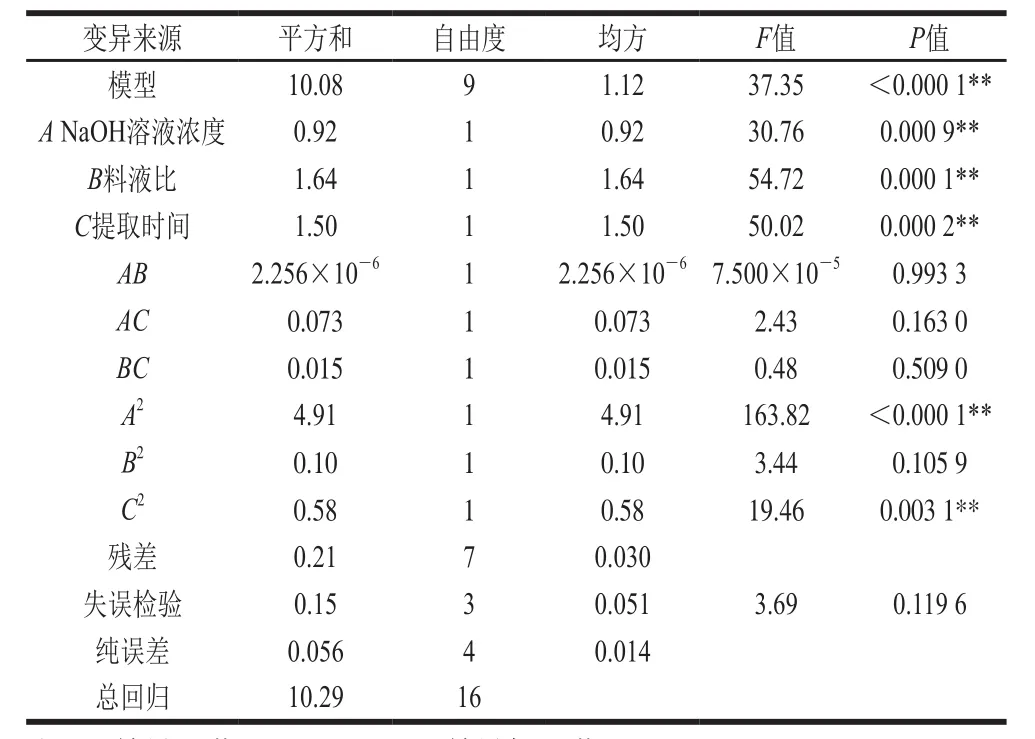
表3 结合酚得率回归模型方差分析Table 3 Analysis of variance of regression model
由表3可知,结合酚得率的回归模型P值小于0.000 1达到极显著水平,失拟项P值为0.119 6不显著,决定系数R2值为0.979 6,说明该方程与实际情况相符,可以充分地反映出各因素与响应值的真实关系,NaOH溶液浓度(A)、料液比(B)和提取时间(C)都达到极显著水平,说明各因素对鲜莲结合酚得率有着显著影响,而AB、AC、BC影响都不显著,这说明各因素之间交互作用很小。
2.3.2 交互作用分析
通过所得回归方程,考察拟合响应面的形状,绘制出响应面立体分析图和相应等高线图。从图6a可以看出,结合酚得率与料液比和NaOH溶液浓度具有明显的二次抛物线关系,随着料液比和NaOH溶液浓度的增加,结合酚得率呈现先增加后开始有所下降的趋势,这可能是由于结合酚的萃取已达到饱和,增加NaOH溶液的量不会提高结合酚的萃取量,而溶液pH值过高对多酚的结构产生了一定影响[29]。当NaOH溶液浓度和料液比向峰值方向移动时,料液比等高线密度明显变小,取料液比小时等高线密度较稀疏,当料液比达到1∶20(g/mL)以上时,响应面变陡,等高线密度变密,表明较高料液比对响应值的影响显著,NaOH溶液浓度则取较小值时曲面较陡,等高线密度较密,表明NaOH溶液浓度取较小值时对鲜莲结合酚影响显著。图6b显示料液比处于零水平时,NaOH溶液浓度和提取时间的交互作用。在较低的因子水平时,随着NaOH溶液浓度的增加和提取时间的延长,结合酚得率逐渐升高,当NaOH溶液浓度为3 mol/L,提取时间为3 h左右,结合酚得率达到较大值,但超过一定范围,随着提取时间的延长结合酚得率逐渐减少,这可能是由于结合酚部分结构因搅拌时间过长被破坏[30]。由图6c可知,随着提取时间的延长和料液比的增加,结合酚的得率有所提高,但总体曲面图的曲线表现较为平缓,二者交互作用并不明显。
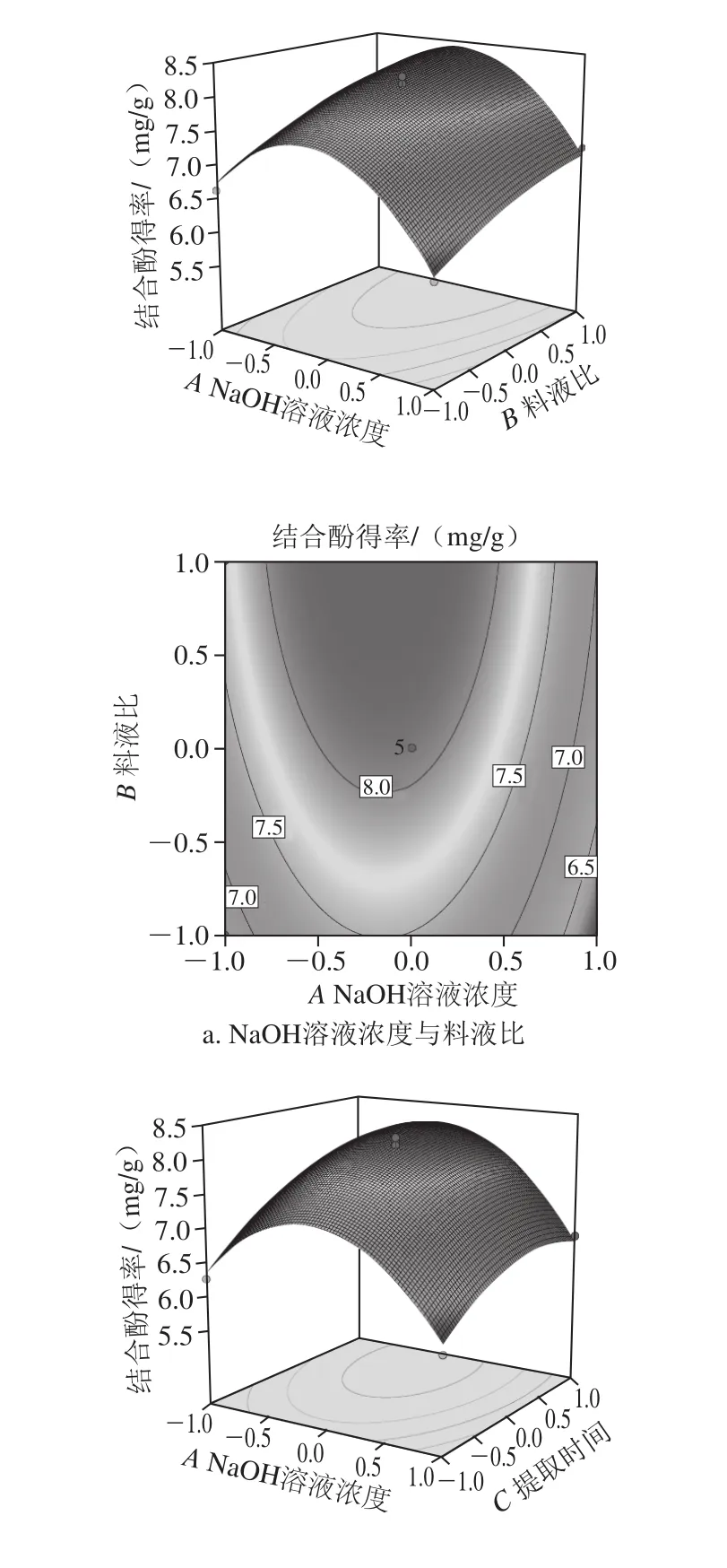
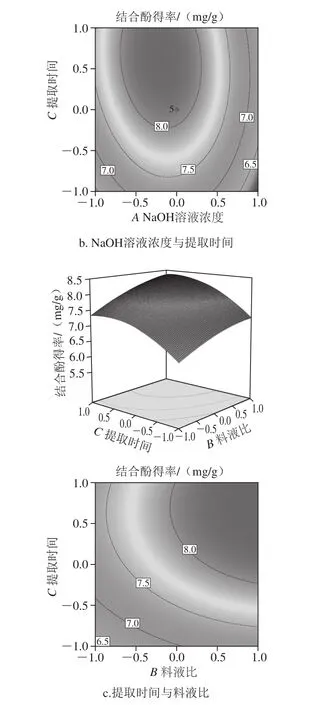
图6 各因素对结合酚得率的交互影响Fig. 6 Interactive effects of various factors on extraction of bound polyphenols
2.3.3 最优工艺验证实验
通过Design Expert 8.0.5软件的优化功能,在回归模型的基础上得出鲜莲中结合酚得率最优工艺参数为NaOH溶液浓度2.8 mol/L、料液比1∶25(g/mL)、提取时间3.7 h时,室温提取所得结合酚得率理论值为(8.598±0.170)mg/g。在此工艺条件下进行验证实验,实际所得结合酚得率为(8.483±0.063)mg/g,这与预测结合酚得率基本一致,说明本优化工艺具有可行性。
2.4 萃取相结合酚含量及抗氧化能力分析
2.4.1 萃取相结合酚含量
鲜莲结合酚的不同极性部分的结合酚含量存在显著性差异(P<0.05),如图7所示。其中以正丁醇萃取相结合酚含量最高,为1.62 mg/g,其次为氯仿萃取相(1.57 mg/g),但两者无显著性差异,而水相的结合酚含量最低,为0.98 mg/g,但与乙酸乙酯相结合酚含量所得结果(1.04 mg/g)也无显著性差异。由于结合酚存在着极性差异,通过不同有机溶剂中能被选择性萃取,使不同萃取相所含结合酚含量有所差别。
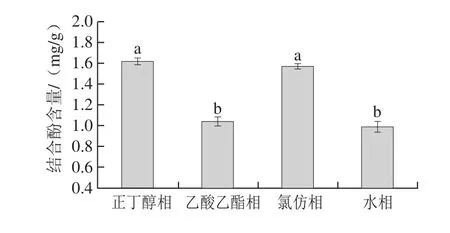
图7 鲜莲中不同极性提取物结合酚含量Fig. 7 Contents of different polar bound polyphenols in fresh lotus seeds
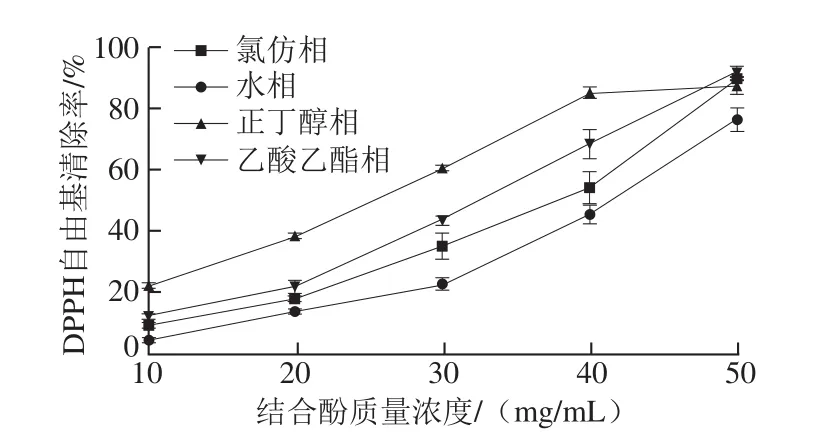
图8 鲜莲不同极性提取物中结合酚对DPPH自由基的清除能力Fig. 8 DPPH scavenging effects of different polar bound polyphenols from fresh lotus seeds
2.4.2 DPPH自由基清除率由图8可知,正丁醇层、乙酸乙酯层、氯仿层以及水层莲子渣结合酚对DPPH自由基均具有较强的清除效果,且随其结合酚质量浓度的增加而不断增强。但它们的清除能力又不完全相同,正丁醇相的抗氧化能力相对较强,其次为乙酸乙酯相,而水相相对较弱。50%清除率时,水相结合酚质量浓度最大,乙酸乙酯相结合酚质量浓度其次,而正丁醇相结合酚质量浓度最小。由此可见,正丁醇相结合酚的抗氧化力最强。
2.4.3 总抗氧化能力
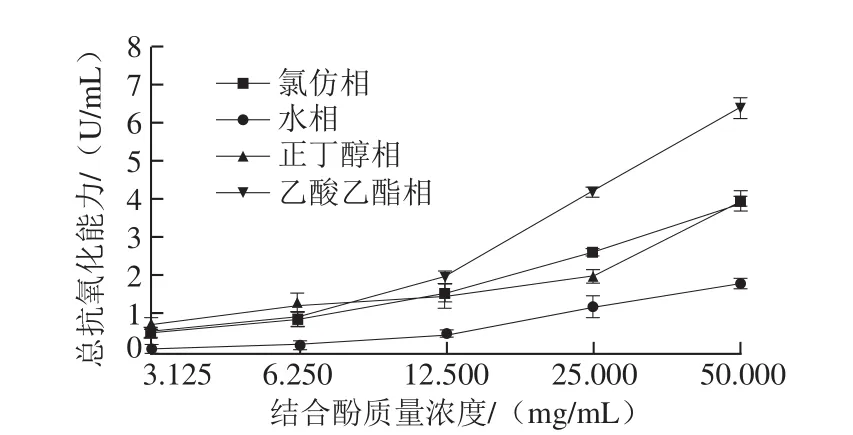
图9 鲜莲不同极性提取物中结合酚总抗氧化能力Fig. 9 Total antioxidant capacity of different polar bound polyphenols from fresh lotus seeds
由图9可知,随着结合酚质量浓度的增加,各萃取相的总抗氧化能力逐步加强,其中以水相的总抗氧化能力最弱,当结合酚质量浓度低于6.25 mg/mL时,以正丁醇相的总抗氧化能力最强,氯仿相与乙酸乙酯相次之,两者之间并无显著性差异(P<0.05),当结合酚质量浓度高于12.5 mg/mL,乙酸乙酯相的总抗氧化能力显著上升,最大,其次为氯仿相、正丁醇相。
2.4.4 羟自由基清除能力
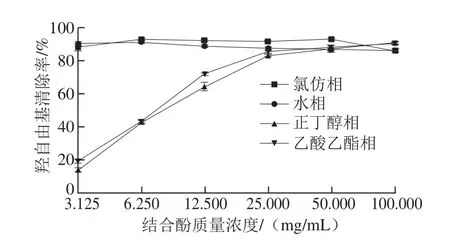
图10 鲜莲不同极性提取物中结合酚对羟自由基的清除能力Fig. 10 Hydroxyl radical scavenging effects of different polar bound polyphenols from fresh lotus seeds
由图10可知,氯仿相与水相在结合酚低质量浓度下对羟自由基具有较强的清除能力,清除率一直保持90%左右,这可能由于羟自由基具有极强的得电子能力,而水相和氯仿相可能含有较多的酸性酚如水杨酸、槲皮素及阿魏酸等,这些成分在水中易发生电离,失去电子,因此对羟自由基具有强清除能力[31]。正丁醇相与乙酸乙酯相低质量浓度下清除能力很弱,但随着样品中结合酚质量浓度的增加,清除能力逐渐增强,最终4相保持相当的清除能力。
3 结 论
不同试剂对鲜莲结合酚提取的比较实验表明,NaOH水解得到的结合酚得率显著高于H2SO4和HCl(P<0.05),说明碱法提取效果优于酸法。中心组合优化鲜莲结合酚提取工艺参数为NaOH溶液浓度2.8 mol/L、料液比1∶25(g/mL)、提取时间3.7 h,此工艺下所得鲜莲结合酚提取液中实际结合酚得率达(8.483±0.063)mg/g。
抗氧化活性实验表明,鲜莲渣各萃取液可清除多种自由基,在一定质量浓度范围呈量效关系,其中以乙酸乙酯、正丁醇萃取相的抗氧化能力较强,同时采用3 种方法测定各萃取液的抗氧化能力,可达到综合评价鲜莲渣提取物中结合酚的抗氧化活性。研究结果将为鲜莲作为保健食品的深入开发以及鲜莲结合酚进一步开发和利用提供了科学依据,避免资源浪费。
参考文献:
[1]GUO H B. Cultivation of lotus (Nelumbo nucifera, Gaertn. ssp.nucifera) and its utilization in China[J]. Genetic Resources and Crop Evolution, 2009, 56(3): 323-330. DOI:10.1007/S10722-008-9366-2.
[2]MANI S S, SUBRAMANIAN I P, PILLAI S S, et al. Evaluation of hypoglycemic activity of inorganic constituents in Nelumbo nucifera seeds on streptozotocin-induced diabetes in rats[J]. Biological Trace Element Research, 2010, 138(1): 226-237. DOI:10.1007/S12011-010-8614-4.
[3]WANG W, GUO J, ZHANG J, et al. Isolation, identification and antioxidant activity of bound phenolic compounds present in rice bran[J]. Food Chemistry, 2015, 171: 40-49. DOI:10.1016/J.foodchem.2014.08.095.
[4]齐岩, 檀昕, 程安玮, 等. 葡萄皮和籽中游离酚和结合酚组成及抗氧化活性比较[J]. 核农学报, 2017, 31(1): 104-109. DOI:10.11869/j.issn.100-8551.2017.01.0104.
[5]LEE J, CHAN B L S, MITCHELL A E. Identification/quantification of free and bound phenolic acids in peel and pulp of apples (Malus domestica) using high resolution mass spectrometry (HRMS)[J]. Food Chemistry, 2017, 215: 301-310. DOI:10.1016/j.foodchem.2016.07.166.
[6]PÉREZ-JIMÉNEZ J, DÍAZ-RUBIO M E, SAURA-CALIXTO F.Non-extractable polyphenols, a major dietary antioxidant: occurrence,metabolic fate and health effects[J]. Nutrition Research Reviews,2013, 26(2): 118-129. DOI:10.1017/S0954422413000097.
[7]WANG B N, LIU H F, ZHENG J B, et al. Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J].Journal of Agricultural & Food Chemistry, 2011, 59(4): 1288-1292.DOI:10.1021/jf103982q.
[8]CHANDRASEKARA A, SHAHIDI F. Content of insoluble bound phenolics in millets and their contribution to antioxidant capacity[J].Journal of Agricultural & Food Chemistry, 2010, 58(11): 6706-6714.DOI:10.1021/jf100868b.
[9]MADHUJITH T, SHAHIDI F. Antioxidant potential of barley as affected by alkaline hydrolysis and release of insoluble-bound phenolics[J]. Food Chemistry, 2010, 117(4): 615-620. DOI:10.1016/j.foodchem.2009.04.055.
[10]徐菲, 杨希娟, 党斌, 等. 酸法提取青稞麸皮结合酚工艺优化[J]. 农业工程学报, 2016, 32(17): 301-308. DOI:10.11975/j.issn.1002-6819.2016.17.040.
[11]郑宝东. 中国莲子(Nympheaceae Nelumbo Adans)种质资源主要品质的研究与应用[D]. 福州: 福建农林大学, 2004. DOI:10.7666/d.y629125.
[12]黄素英. 莲子多酚提取及其抗氧化抑菌活性的研究[D]. 福州: 福建农林大学, 2010. DOI:10.7666/d.y1748395.
[13]SHI J, SHAN S, LI Z, et al. Bound polyphenol from foxtail millet bran induces apoptosis in hct-116 cell through ros generation[J]. Journal of Functional Foods, 2015, 17: 958-968. DOI:10.1016/j.jff.2015.06.049.
[14]牛鹏飞, 仇农学, 杜寅. 苹果渣中不同极性多酚的分离及体外抗氧化活性研究[J]. 农业工程学报, 2008, 24(3): 238-242.
[15]向进乐, 李志西, 李欢, 等. 枳椇果梗不同极性多酚及抗氧化活性研究[J]. 食品科学, 2011, 32(15): 25-29.
[16]卜彦花, 周娜娜, 王春悦, 等. 福林酚试剂法和紫外分光光度法测定冬枣多酚含量的比较研究[J]. 中国农学通报, 2012, 28(1): 212-217.DOI:10.3969/j.issn.1000-6850.2012.01.041.
[17]JIA N, XIONG Y L, KONG B, et al. Radical scavenging activity of black currant (Ribes nigrum L.) extract and its inhibitory effect on gastric cancer cell proliferation via induction of apoptosis[J].Journal of Functional Foods, 2012, 4(1): 382-390. DOI:10.1016/J.JFF.2012.01.009.
[18]YASIR M, SULTANA B, NIGAM P S, et al. Antioxidant and genoprotective activity of selected cucurbitaceae seed extracts and LCESIMS/MS identification of phenolic components[J]. Food Chemistry,2015, 199: 307-313. DOI:10.1016/j.foodchem.2015.11.138.
[19]GUO L, GUO J, ZHU W, et al. Optimized synchronous extraction process of tea polyphenols and polysaccharides from Huaguoshan Yunwu tea and their antioxidant activities[J]. Food & Bioproducts Processing, 2016, 100: 303-310. DOI:10.1016/j.fbp.2016.08.001.
[20]KIM K H, TSAO R, YANG R, et al. Phenolic acid profiles and antioxidant activities of wheat bran extracts and the effect of hydrolysis conditions[J]. Food Chemistry, 2006, 95(3): 466-473. DOI:10.1016/j.foodchem.2005.01.032.
[21]KRYGIER K, SOSULSKI F, HOGGE L. Free, esterified, and insoluble-bound phenolic acids. 1. extraction and purification procedure[J]. Journal of Agricultural & Food Chemistry, 1982, 30(2):330-334. DOI:10.1021/jf00110a028.
[22]丁岩, 唐世云, 侯汉学, 等. 小麦麸皮中酚酸提取方法的研究[J]. 中国食物与营养, 2012, 18(6): 52-58. DOI:10.3969/j.issn.1006-9577.2012.06.014.
[23]易谷洋. 碳纳米管固相萃取-高效液相色谱法测定水中酚类化合物[D].上海: 东华大学, 2012.
[24]WHITE B L, HOWARD L R, PRIOR R L. Release of bound procyanidins from cranberry pomace by alkaline hydrolysis[J].Journal of Agricultural & Food Chemistry, 2010, 58(13): 7572-7575.DOI:10.1021/jf100700p.
[25]PENG H, LI W, LI H, et al. Extractable and non-extractable bound phenolic compositions and their antioxidant properties in seed coat and cotyledon of black soybean (Glycine max (L.) merr)[J]. Journal of Functional Foods, 2017, 32: 296-312. DOI:10.1016/j.jff.2017.03.003.
[26]胡铮瑢, 刘玉环, 阮榕生, 等. 阿魏酸、对香豆酸碱法制备及应用研究进展[J]. 食品科学, 2009, 30(21): 438-442. DOI:10.3321/j.issn:1002-6630.2009.21.102.
[27]TORRE P, ALIAKBARIAN B, RIVAS B, et al. Release of ferulic acid from corn cobs by alkaline hydrolysis[J]. Biochemical Engineering Journal, 2008, 40(3): 500-506. DOI:10.1016/j.bej.2008.02.005.
[28]NACZK M, SHAHIDI F. Extraction and analysis of phenolics in food[J]. Journal of Chromatography A, 2004, 1054(1/2): 95-111.DOI:10.1016/j.chroma.2004.08.059.
[29]FRIEDMAN M, JÜRGENS H S. Effect of ph on the stability of plant phenolic compounds[J]. Journal of Agricultural & Food Chemistry,2000, 48(6): 2101-2110. DOI:10.1021/jf990489j.
[30]李春阳, 许时婴, 王璋. 从葡萄废弃物中提取分离多酚类生物活性物质[J]. 食品科技, 2004(6): 88-93. DOI:10.3969/j.issn.1005-9989.2004.06.028.
[31]房玉林, 孟江飞, 张昂, 等. 罐储时间对赤霞珠葡萄酒中酚类化合物及抗氧化活性的影响[J]. 食品科学, 2011, 32(11): 14-20.

