生猪养殖环境及猪肉中金黄色葡萄菌肠毒素基因分布研究
金黄色葡萄球菌(Staphylococcusaurues,S.aureus)广泛分布于自然界,也存在于人和动物的体表、鼻腔和消化道等部位,是一类共生的人兽共患条件致病菌[1]。在兽医临床上可广泛引起疾病,降低动物生产力,严重危害家畜健康。猪养殖场、生猪屠宰过程和市售生猪肉虽受到严格的卫生安全控制,但还有一定程度的金黄色葡萄球菌污染,生猪肉生产链中污染的金黄色葡萄球菌及其分泌的毒素可能会引起人的感染或食物中毒。据美国疾病预防控制中心报告,金黄色葡萄菌引起的食物中毒事件在细菌性食物中毒事件中高达33%,仅次于大肠杆菌,而在加拿大此比例可高达45%[2]。在我国,细菌性食物中毒主要由沙门氏菌和副溶血弧菌引起,而金黄色葡萄球菌引起的食物中毒事件仅次于前两者位居第三[3]。
金黄色葡萄球菌能够分泌肠毒素(staphylococcal enterotoxins, SEs)、溶血毒素(haemolysins)、脱皮毒素(exfoliative toxins,ETs)和杀白细胞素(paton-valentine leucocidin,Pvl)等多种外毒素[4-7]。肠毒素是一种高耐热、具有超抗原活性的外毒素,它是引发食物中毒或食源性疾病暴发的主要致病因子[8]。目前已发现的肠毒素有18种,分为sea、seb、sec、sed、see5种传统型肠毒素基因和seg、seh、sei、sej、sek、sel、sem、sen、seo、sep、seq、ser、seu13种新型肠毒素基因,其中引起食物中毒主要以sea或seb基因为主[5]。溶血素是金黄色葡萄球菌的一种重要致病因子,分为α、β、γ、δ 4 种类型,可引起人和动物败血症等疾病,以α-溶血素对人的致病性为主[8]。脱皮毒素和杀白细胞素在金黄色葡萄球菌的分布不高,约由5%的金黄色葡萄球菌产生,脱皮毒素能够引发皮肤损伤等皮肤炎症反应,而杀白细胞素除能引发皮肤炎症外,还能引发软组织感染和肺炎等疾病[9-11]。
近年来,国内外关于猪肉、鸡肉和牛肉等肉类食品中金黄色葡萄球菌污染状况及其毒力基因携带状况的研究较多[12-16],但国内外较少有关于生猪肉生产链中金黄色葡萄球菌的污染状况及其毒力基因携带状况的报道。生鲜肉类食品,尤其是生鲜猪肉食品已成为我国人们的主要肉食消费品,生鲜猪肉食品安全的监控必不可缺,鉴于生鲜猪肉生产链中存在一定的金黄色葡萄球菌污染,因此检测污染的金黄色葡萄球菌中毒力基因的分布状况具有重要意义。本研究采用PCR方法对养殖场和市售生鲜猪肉分离的130株金黄色葡萄球菌进行肠毒素基因检测,初步了解金黄色葡萄球菌中肠毒素基因的分布情况,对生鲜猪肉生产链的卫生安全提供理论依据。
1 材料与方法
1.1菌株来源 实验所用的金黄色葡萄球菌是在2014年某养殖场、超市和农贸市场采集样品中分离检出的菌株,其中养殖场样本中分别是从养殖环境(土壤、猪栏门、猪鼻拭子)、屠宰车间生鲜猪肉、生产车间肉制品及豆干成品中检出29株、62株和9株,共计检出100株;超市和农贸市场样本是从生鲜猪肉中检出30株。本实验所用的金黄色葡萄球菌共130株,且均被确定为革兰氏阳性和血浆凝固酶阳性。
1.2仪器与设备 GeneAmp PCR system 2700,美国Applied Biosystems公司;Gel Doc EQ凝胶成像系统,美国BIO-RAD公司;核酸电泳仪,美国BIO-RAD公司;高速离心机,美国Thermo公司;恒温培养箱,德国Binder公司。
1.3培养基和主要试剂 脑心浸出液肉汤(BHI),广州环凯微生物科技有限公司;细菌基因组DNA快速提取试剂盒,北京博迈德生物技术有限公司;Taq DNA聚合酶(5 U/μL)、dNTPs、2000 bp DNA marker、琼脂糖,日本TaKaRa公司;溶菌酶,德国Sigma公司。
1.4菌株的活化及DNA的提取 将保存于实验室-80 ℃的菌株划线接种至BHI琼脂平板,在37 ℃的恒温培养箱中过夜培养,然后挑取单菌落至液体BHI培养基中,37 ℃培养10~16 h后,采用北京博迈德生物技术有限公司DNA提取试剂盒说明进行金黄色葡萄球菌DNA的提取。
1.5PCR扩增及引物的选择 根据参考文献[12-17]执行毒力基因引物的合成和扩增条件。引物均由上海生工生物股份有限公司合成。引物序列及片段长度如表1所示。
2 结 果
2.1肠毒素基因的检测结果及分布情况 通过PCR检测18个毒力基因在130株金黄色葡萄球菌的检出率如图1和表2所示。在130株金黄色葡萄球菌中,有123株菌检测出肠毒素基因,携带率为94.6%。各肠毒素基因中seb的检出率最高,占60.8%,其次为sem占53.8%,seg占43.1%,而sed、sej、seo、sep、seq、ser、seu均未检出。其他肠毒素基因的检出情况如表2所示。在130株金黄色葡萄球菌中,18个肠毒素基因的分布情况如表3所示。在传统型肠毒素基因中,sea和see只在生猪肉和豆干样品分离株中检出,在超市和农贸市场的生猪肉样品分离株中sea和see的检出率高于养殖场屠宰车间生猪肉样品分离株。seb在养殖场样品和超市及农贸市场样品分离株中的检出率相当,且均高于其他肠毒素基因。在新型肠毒素基因中,seg和sem的检出率较高,且主要分布在养殖场样品分离株中。seh和sek只在养殖场屠宰车间生猪肉样品分离株中检出,其它菌株均为检出。sei、sel、sen只在养殖样品分离株中有检出,而在超市和农贸市场生猪肉样品分离株中未检出。
表1 金黄色葡萄球菌毒力基因引物及序列
Tab.1 Target genes, primer sequences and pcr conditions

基因引物序列(5′—3′)产物长度/bp退火温度/℃seasea⁃FGGATATTGTTGATAAATATAAAGGGAAAAAAG43952sea⁃RGTTAATCGTTTTATTATCTCTATATATTCTTAATAGTsebseb⁃FAGATTTAGCTGATAAATACAAAGATAAATACG49454seb⁃RTCGTAAGATAAACTTCAATCTTCACATCTsecsec⁃FAGATTTAGCAAAGAAGTACAAAGATG49053sec⁃RAAGGTGGACTTCTATCTTCACACTTsedsed⁃FAGATTTAGCAAAGAAGTACAAAGATG48154sed⁃RCTACTTTTCATATAAATAGATGTCAATATGseesee⁃FGGGAAAAAAGTAGACTTATATGGTG34852see⁃RATCATAACTTACCGTGGACCsegseg⁃FTGCTATCGACACACTACAACC70455seg⁃RCCAGATTCAAATGCAGAACCsehseh⁃FTGATTTAGCTCAGAAGTTTAAAAATAAAAATG46652seh⁃RTTTCTTAGTATATAGATTTACATCAATATGseisei⁃FGACAACAAAACTGTCGAAACTG60355seiRCCATATTCTTTGCCTTTACCAGsejsej⁃FATGAAAAAAACAATATTTATACTGATTTTCTCCC80755sej⁃RTCTACAGAACCAAAGGTAGACTTATTAATACseksek⁃FATGAATCTTATGATTTAATTTCAGAATCAA54551sek⁃RATTTATATCGTTTCTTTATAAGAAATATCGselsel⁃FATGAAAAAAAGATTATTATTTGTAATTGTTATTAC72352sel⁃RATCATCTTTTTGAAATTTCGACATCTAGsemsem⁃FATGAAAAGAATACTTATCATTGTTGTTTTATTG72053sem⁃RCTTCAACTTTCGTCCTTATAAGATATTTCsensen⁃FATAAAAAATATTAAAAAGCTTATGAGATTGTTC77751sen⁃RACTTAATCTTTATATAAAAATACATCAATATGseoseo⁃FTATGTAGTGTAAACAATGCATATGCA68553seo⁃RTCTATTGTTTTATTATCATTATAAATTTGCAAATsepsep⁃FTTAGACAAACCTATTATCATAATGGAAGT61853sep⁃RTATATAAATATATATCAATATGCATATTTTTAGACTseqseq⁃FGGAAAATACACTTTATATTCACAGTTTCA54253seq⁃RATTTATTCAGTTTTCTCATATGAAATCTCserser⁃FAGCGGTAATAGCAGAAAATG36355ser⁃RTCTTGTACCGTAACCGTTTTseuseu⁃FAATGGCTCTAAAATTGATGG21555seu⁃RATTTGATTTCCATCATGCTC
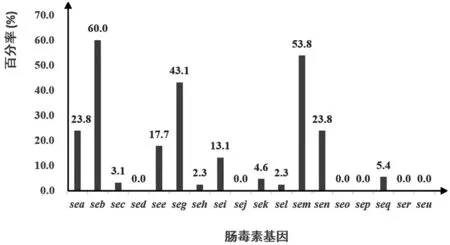
图1 18种肠毒素基因在130株金黄色葡萄球菌的阳性检出率Fig.1 Positive rate of 18 enterotoxin genes among 130 S. aureus based on PCR
2.2肠毒素基因型别的分布情况 金黄色葡萄球菌主要的肠毒素基因型别如表3所示。通过PCR扩增18个肠毒素基因发现,同一菌株中最多携带5种肠毒素基因,占6.2%(8/130),且这8株菌均为养殖场分离株,携带3种及以上肠毒素基因的菌株为65株,占50%。130株金黄色葡萄球菌中肠毒素基因型sea+seb+see的比例最高,占9.2%(12/130)。其次seb+seg+sem+sen、seg+sem的比例均为6.2%(12/130),seg+sei+sem+sen、seb+seg+sem、seg+sem+sen的比例均为5.4%(7/130)。
3 讨 论
表2 肠毒素基因在130株金黄色葡萄菌中的分布情况
Tab.2 Distribution of staphylococcal enterotoxin or SE-like genes in 130 S.aureus strains

菌株来源菌株数传统肠毒素基因新型肠毒素基因seasebsecsedseesegsehseiseljselksellselmselnseloselpselqserselu养殖场猪鼻拭子22011(50.0)00022(100)08(36.4)00020(90.9)19(86.4)00000 环境样705(71.4)0007(100)000007(100)5(71.4)00000 生猪肉629(14.5)35(56.5)2(3.2)05(8.1)23(37.1)3(4.8)9(14.5)02(3.2)2(3.2)29(46.8)6(9.7)00000 豆干91(11.1)4(44.4)1(11.1)01(11.1)3(33.3)00001(11.1)5(55.6)1(11.1)00000超市和农贸市场 生猪肉3021(70.0)24(80.0)1(3.3)017(56.7)1(3.3)0003(10.0)09(30.0)000000总计13031(23.8)79(60.8)4(3.1)023(17.7)56(43.1)3(2.3)17(13.1)05(3.8)3(2.3)70(53.8)31(23.8)00000
注:括号内为百分比
表3 主要的金黄色葡萄球菌肠毒素基因型别
Tab.3 Prevalence of S.aureus enterotoxin toxin genotypes in this study

毒力基因型养殖场市场猪鼻拭子(n=22)环境样品(n=7)生猪肉(n=62)豆(n=9)生猪肉(n=30)总计(n=130)sea+seb+see003(2.3)09(6.9)12(9.2)seb+seg+sem+sen2(1.5)06(4.6)1(0.8)08(6.2)seg+sem5(3.8)3(2.3)0008(6.2)seg+sei+sem+sen4(3.1)03(2.3)007(5.4)seb+seg+sem1(0.8)2(1.5)3(2.3)01(0.8)7(5.4)seg+sem+sen4(3.1)2(1.5)01(0.8)07(5.4)seb+seg+sei+sem+sen4(3.1)02(1.5)006(4.6)sea+seb+see+sem3(2.3)00003(2.3)sea+seb+sek002(1.5)01(0.8)3(2.3)表3(续)毒力基因型养殖场市场猪鼻拭子(n=22)环境样品(n=7)生猪肉(n=62)豆(n=9)生猪肉(n=30)总计(n=130)sea+seb00003(2.3)3(2.3)sea+see+sem00002(1.5)2(1.5)sec+sel+sem00002(1.5)2(1.5)seb+see00002(1.5)2(1.5)sea+seb+see+seg+sem001(0.8)001(0.8)seb+seg+sei+sem001(0.8)001(0.8)seg+seh+sei+sem001(0.8)001(0.8)sec+seg+sel+sem+sen001(0.8)001(0.8)sea+seb+sec+see00001(0.8)1(0.8)sea+seb+sek+sem00001(0.8)1(0.8)
注:括号内为百分比
金黄色葡萄球菌是一种重要的人兽共患病致病菌,其分泌的毒素严重威胁了人兽健康,在养殖业和食品安全中要严格监控。本研究对在猪养殖场和市售生鲜猪肉中分离的金黄色葡萄球菌进行肠毒素毒力基因检测。汪永碌等[17]对不同来源分离的金黄色葡萄球菌肠毒素基因(sea~sej)研究表明,肠毒素基因的检出率为68.6%,seb基因的检出率最高,其中食品样品72.5%,食物中毒样品58.3%,腹泻患者样品50.0%,传统型肠毒素基因(sea~see)的检出率为88.5%。沈玄艺等[18]对分离自食物中毒和食品样品的金黄色葡萄菌肠毒素基因(sea~see)研究发现,肠毒素基因的检出率为27.3%,其中食物中毒样品100%,食品样品16.7%,肠毒素基因中seb的检出率最高。而沈伟伟等[19]通过多重PCR的方法对2005-2010年台州市食品中分离的金黄色葡萄球菌18种肠毒素基因(sea~seu)研究表明,肠毒素基因的检出率为52.4%,sea基因的检出率最高,传统型肠毒素(基因sea~see)的检出率为33.3%。本研究中肠毒素基因(sea~seu)的检出率为94.6%(123/130),其中养殖场分离株中肠毒素基因携带率最高的是seb和seg,均为55%(55/100),市售生鲜猪肉分离株中肠毒素基因携带率最高的是seb,占80%(24/30),肠毒素基因中seb检出率最高,与汪永碌和沈玄艺的研究结果一致,但检出率有一定的差异。此外,本研究中养殖场分离株以肠毒素基因seb、seg和sem为主,而市售生猪肉分离株则以肠毒素基因seb、sea和see为主。这可能与菌株来源不同、不同样品的处理方式、样品环境中工作人员携带情况的不同和地区不同等因素有关,进一步说明了不同地区、不同样品中金黄色葡萄球菌的肠毒素基因流行性情况有所差异。
本研究通过采用PCR的方法对130株金黄色葡萄球菌进行18个肠毒素基因的分布研究,但肠毒素基因可能存在不表达的情况,尤其是易引起食物中毒的肠毒素基因的表达。目前现有方法中对肠毒素的检测仅限于传统肠毒素SEA、SEB、SEC、SED和SEE,而越来越多的研究表明新型肠毒素基因(seg~seu)表达的肠毒素也能引起食物中毒[2, 20]。本研究通过采用PCR方法不仅能够鉴定传统肠毒素基因(sea~see)的存在,而且能够鉴定新型肠毒素基因(seg~seu)的存在,初步判定可能存在的肠毒素引发的食物中毒风险。
本实验通过对养殖场猪鼻拭子、屠宰车间生鲜猪肉和市售生鲜猪肉分离的金黄色葡萄球菌肠毒素基因检测发现,不同样品来源的分离株毒力基因的分布情况有所差别,说明在生鲜猪肉生产和售卖过程中均有可能存在不同的金黄色葡萄球菌污染源,进一步说明生鲜猪肉生产中可能存在一定的安全隐患。猪肉作为我国人民的主要肉食消费品,其安全性必须引起足够的关注和重视。相关企业应按照国家标准严格生产,同时相关部门也应大力监督,保障我国肉类食品的消费安全。
参考文献:
[1] Crombe F, Argudin MA, Vanderhaeghen W, et al. Transmission dynamics of methicillin-resistantStaphylococcusaureusin pigs[J]. Front Microbiol, 2013, 4 (57):1-21.DOI:10.3389/fmicb.2013.00057
[2] Kadariya J, Smith TC, Thapaliya D.Staphylococcusaureusand staphylococcal food-borne disease: an ongoing challenge in public health[J]. Biomed Res Int, 2014, 4(2014):1-9. DOI: 10.1155/2014/827965
[3] 陈彬,黄晓蓉,汤敏英,等.基因探针法快速检测食品中金黄色葡萄球菌的研究[J]. 现代预防医学杂志, 2014, 34(6): 1017-1020.
[4] Lawrynowicz-Paciorek M, Kochman M, Piekarska K, et al. The distribution of enterotoxin and enterotoxin-like genes inStaphylococcusaureusstrains isolated from nasal carriers and food samples[J]. Int J Food Microbiol, 2007,117(3):319-323. DOI: 10.1016/j.ijfoodmicro.2007.03.009
[5] Wu S, Duan N, Gu H, et al. A review of the methods for detection ofStaphylococcusaureusenterotoxins[J].Toxins, 2016, 8(7):176. DOI: 10.3390/toxins8070176
[6] Akineden O, Annemuller C, Hassan AA, et al. Toxin genes and other characteristics ofStaphylococcusaureusisolates from milk of cows with mastitis[J]. Clin Diagn Lab Immunol, 2001, 8(5):959-964. DOI: 10.1128/CDLI.8.5.959-964.2001
[7] Kot B, Szweda P, Frankowska-Maciejewska A, et al. Virulence gene profiles inStaphylococcusaureusisolated from cows with subclinical mastitis in eastern Poland[J]. J Dairy Res, 2016, 83(2):228-235. DOI: 10.1017/S002202991600008X
[8] 魏志恒,于宏伟,李宁,等. 金黄色葡萄球菌溶血素基因分布的研究[J]. 中国食品学报, 2009,9(6):152-156.
[9] Nishifuji K, Sugai M, Amagai M. Staphylococcal exfoliative toxins: "molecular scissors" of bacteria that attack the cutaneous defense barrier in mammals[J]. J Dermatol Sci, 2008, 49(1):21-31. DOI: 10.1016/j.jdemsci.2007.05.007
[10] Ruzickova V, Voller J, Pantucek R, et al. Multiplex PCR for detection of three exfoliative toxin serotype genes inStaphylococcusaureus[J]. Folia Microbiol (Praha), 2005, 50(6):499-502. DOI: 10.1007/BF02931437
[11] Koop G, Vrieling M, Storisteanu DM, et al. Identification of LukPQ, a novel, equid-adapted leukocidin ofStaphylococcusaureus[J]. Sci Rep, 2017,1(7):1-10. DOI: 10.1038/srep40660
[12] Argudin MA, Tenhagen BA, Fetsch A, et al. Virulence and resistance determinants of GermanStaphylococcusaureusST398 isolates from nonhuman sources[J]. Appl Environ Microbiol, 2011, 77(9):3052-3060. DOI;10.1128/AEM.02260-10
[13] Lovseth A, Loncarevic S, Berdal KG. Modified multiplex PCR method for detection of pyrogenic exotoxin genes in Staphylococcal isolates[J]. J Clin Microbiol, 2004, 42(8):3869-3872. DOI: 10.1128/JCM.42.8.3869-3872.2004
[14] Tristan A, Ying L, Bes M, et al. Use of multiplex PCR to identifyStaphylococcusaureusadhesins involved in human hematogenous infections[J]. J Clin Microbiol, 2003, 41(9):4465-4467. DOI: 10.1128/JCM.41.9.4465-4467.2003
[15] Peacock SJ, Moore CE, Justice A, et al. Virulent combinations of adhesin and toxin genes in natural populations ofStaphylococcusaureus[J]. Infect Immun, 2002, 70(9):4987-4996. DOI: 10.1128/IAI.70.9.4987-4996.2002
[16] Moore P, Lindsay JA. Genetic variation among hospital isolates of methicillin-sensitiveStaphylococcusaureus: Evidence for horizontal transfer of virulence genes[J]. J Clin Microbiol,2001, 39(8):2760-2767. DOI:10.1128/JCM.39.8.2760-2767.2001
[17] 汪永禄,张萍,陶勇,等.不同来源金黄色葡萄球菌肠毒素及耐药性检测分析[J].实用预防医学, 2014, 21(4):488-491.
[18] 沈玄艺,宋启发,徐景野,等. 食源性金黄色葡萄球菌肠毒素基因型分布研究[J].中国食品卫生杂志, 2012, 24 (5):427-429.
[19] 沈伟伟,裘丹红,徐佳,等. 台州市食源性金黄色葡萄球菌的主动监测及肠毒素基因分布研究[J]. 中国卫生检验杂志, 2011, 21 (11):2674-2676.
[20] 章乐怡,李毅,马雪莲.食物中毒及食品中金黄色葡萄球菌的肠毒素及基因的研究[J].中国卫生检验杂志, 2009, 19(12):2851-2853.

