分子印记聚合物仿生抗体用于酶联免疫吸附法检测恩诺沙星
吕春晖,刘 皓,方国臻,王 硕
(1.天津现代职业技术学院,天津 300350;2.天津科技大学,天津 300222)
恩诺沙星(ENRO)是氟喹诺酮类药物中第一个畜禽专用兽药,具有广谱抗菌性,体内分布广、消除速率慢、组织渗透力强、高效价廉,被广泛应用于畜禽产品,各国均对动物性食品中恩诺沙星的最大残留限量有严格规定[1-2]。目前用于食品中恩诺沙星残留检测的方法有微生物法[3-4]、高效液相色谱法[5-6]、液相色谱-质谱联用法[7-8]、毛细管电泳法[9]、免疫分析法[10-12]等。与其它方法相比,免疫分析法不需要复杂的样品前处理,不需昂贵仪器设备、操作简便省时,易于推广,适用于现场进行兽药残留的快速筛选检测。但是由于抗体本身存在缺点,如制备繁琐、需要牺牲动物、对温度、湿度等环境敏感、不可重复利用等,影响免疫分析的广泛应用。针对这种现实情况,开发建立一种准确、灵敏、快速、经济的仿生免疫分析方法检测恩诺沙星对于我国食品安全管理与指导畜牧业生产养殖合理用药具有重要的现实意义。将分子印迹聚合物(MIP)作为人工抗体取代生物抗体已有研究[13-16],其与生物抗体相比制备简单、不需牺牲动物、有更好的稳定性和耐用性等优点。
本文采用表面印迹法,在96孔酶标板表面直接合成恩诺沙星分子印迹聚合物膜,并将其用于恩诺沙星的检测,旨在建立一种准确、灵敏、快速、经济的仿生酶联免疫分析法检测恩诺沙星,进一步开拓分子印迹免疫分析技术在兽药残留检测领域中的应用。
1 材料与方法
1.1 材料与仪器
恩诺沙星 纯度≥99.9%,中国食品药品检定研究院;鸡胸肉 市购;甲基丙烯酸(MAA) 分析纯,天津市北方天医化学试剂厂;乙二醇二甲基丙烯酸酯(EDMA) 分析纯,美国Sigma公司;N,N-二甲基甲酰胺(DMF) 分析纯,天津市北方天医化学试剂厂;辣根过氧化氢酶(HRP) 酶活≥250 U/mg色谱纯,美国Roche公司;N-羟基琥珀酰亚胺(NHS),纯度≥99%、偶氮二异丁腈(AIBN) 化学纯,Sigma-Aldrich公司;N,N′-二环己基碳二亚胺(DCC) 纯度≥98%,Sigma-Aldrich公司。
Thermo Labsystems,Multiskan Specbium酶标仪 美国Thermo公司;1575型微孔板清洗器 美国BIO-RAD公司;单道微量可调移液器和8道微量可调移液器 法国Gilson公司;QL-901型振荡器 海门市其林贝尔仪器制造有限公司;RE-3000旋转蒸发器 上海亚荣生化仪器厂;LC-20A高效液相色谱仪 RF-10AXL荧光检测器 日本岛津公司;C18色谱柱(4.6 mm×150 mm) 日本岛津公司。
1.2 实验方法
1.2.1 恩诺沙星分子印迹聚合物膜的制备 准确称取0.36 g(1 mmol)恩诺沙星,均匀溶解于溶剂(甲醇/甲苯,3∶1,V/V)中,缓慢滴加340 μL(4 mmol)功能单体 MAA,室温下磁力搅拌2 h以使模板分子与功能单体充分自组装形成模板分子-功能单体复合物,随后缓慢滴加3 mmol交联剂EDMA,磁力搅拌30 min后,加入50 mg引发剂AIBN,待其完全溶解,将圆底烧瓶放入超声清洗器中脱气5 min。用微量移液器将预聚合溶液加入到96孔酶标板表面,每孔50 μL,置于真空干燥箱中45 ℃热引发聚合12 h,连续超声振荡洗脱12 h(换三次洗脱液)至洗脱液中检测无恩诺沙星即为洗脱干净,经37 ℃干燥,即得到恩诺沙星分子印迹聚合物(MIP)膜[17]。见图1所示合成路线。
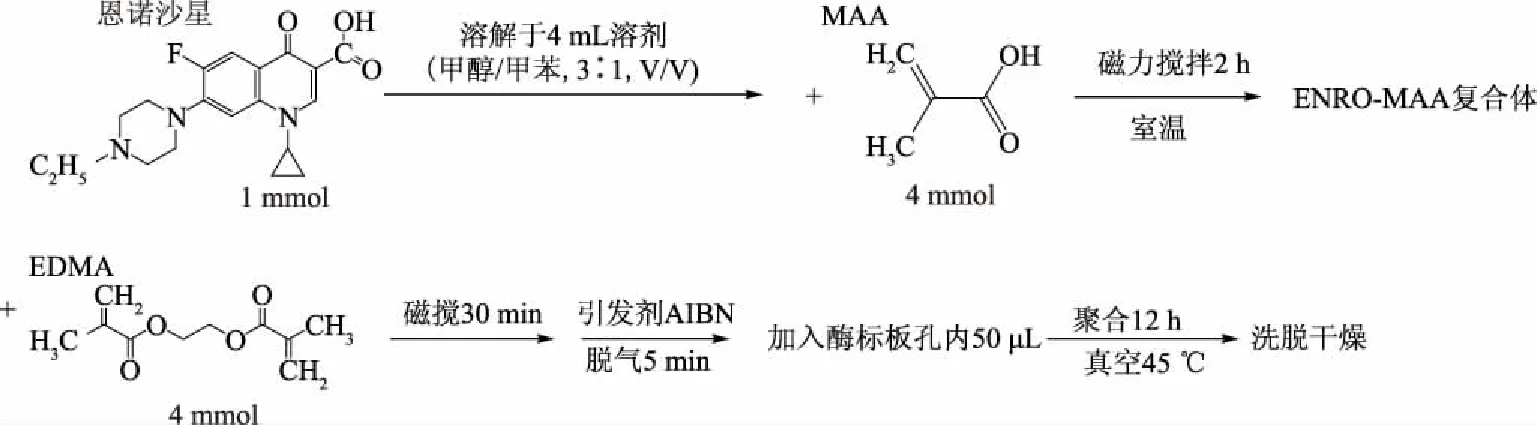
图1 恩诺沙星分子印记聚合物膜的合成路线
作为对照,非印迹聚合物(NIP)膜在与1.2.1同样的制备条件与步骤下合成,不添加模板分子恩诺沙星。
1.2.2 恩诺沙星分子印迹聚合物膜的表征及结合性能实验 参见吕春晖等[18]方法进行红外光谱分析及电镜扫描结构分析,确定印迹聚合物膜的合成,进行吸附平衡结合实验与吸附动力学实验,并采用Scatchard分析来评价分子印迹聚合物对模板分子的结合特性,并确定平衡键合常数以及键合位点数目。结果表明,合成的聚合物膜可以应用于竞争性免疫吸附分析。
1.2.3 酶标记半抗原的合成 采用传统活化酯法。根据王忠斌[19]的方法进行酶标抗原的合成:精确称取恩诺沙星8.9 mg溶于150 μL DMF,加入3.5 mg NHS和12.4 mg DCC,混合溶液室温下缓慢轻搅8 h,离心除去沉淀。冰浴条件下,将上层清液(活化酯溶液)缓慢滴加到溶有10 mg HRP的碳酸氢钠(3 mL,130 mmol/L,pH=8.1)溶液中,4 ℃下搅拌反应过夜,之后将反应液于4 ℃在磷酸缓冲盐溶液(pH=9.3,PBS)中透析(截留分子量14000 Da)3 d。收集透析后的酶标溶液,加入等体积的甘油,置于-20 ℃冰箱内保存备用。
1.2.4 酶标抗原稀释度的选择 将连接好的酶标抗原原液从1∶500开始进行3 倍梯度稀释,每孔加入100 μL 酶标稀释液,室温孵育1 h。1 h 后弃去酶标稀释液,用磷酸盐缓冲溶液(PBST:由pH=7.5的PBS配制)洗板5 次。每孔再加入150 μL 底物显色液,显色30 min。30 min 后每孔加入50 μL 终止液。每孔吸出150 μL 显色后的溶液立即在双波长方式(450~650 nm)下用酶标仪读取吸光度值读数。选择对应的吸光度值在0.8~1.2 之间的酶标稀释度就是后续直接竞争反应所用的酶标溶液稀释倍数。
1.2.5 标样稀释度pH的确定 分别在pH为4.5、5.5、6.5、7.5、8.5的PBS中进行竞争免疫反应,计算IC50以评价灵敏度,以适应辣根过氧化物酶的最适pH。
1.2.6 直接竞争仿生ELISA方法步骤 直接将恩诺沙星标准溶液或样品提取液添加到各孔中,每孔添加100 μL,再加入100 μL稀释后的酶标抗原溶液,以不含恩诺沙星的PBS溶液或样品提取液的孔作为空白,室温下置于水平振荡器上振摇1 h,进行竞争反应,用洗涤液洗板5次,每孔分别加入150 μL配制好的底物溶液,显色30 min后,加入50 μL终止液终止反应,立即将样液在双波长(450~650 nm)方式下用酶标仪测定吸光度值。
1.2.7 ELISA标准曲线的建立 用PBS(pH=7.5)溶液将恩诺沙星储备液稀释为10000、1000、100、10、1、0.1 μg/L标准溶液。按1.2.4步骤进行直接竞争反应得到一系列吸光度值。
按照公式(1)计算出不同浓度的恩诺沙星标准溶液在竞争反应中的抑制率值:
式(1)
式中:IC(%)-恩诺沙星对抗原抗体结合反应的抑制率;A对照-仅加酶标溶液的平均吸光度值;A样品-恩诺沙星标准溶液或样品提取液的平均吸光度值;A空白-不加酶标及恩诺沙星标准溶液的平均吸光度值。
以抑制率为纵坐标,恩诺沙星标准溶液浓度的对数值为横坐标绘制标准曲线,每次实验前均需重新绘制。
1.2.8 样品添加回收实验及液相验证 准确称取三份各2.0 g鸡胸肉组织样品,分别加入0.5 mg/L恩诺沙星标准溶液300、60、10 μL,涡旋振荡5 min,充分混匀后静置10 min。加入提取液10 mL,涡旋振荡5 min,于4 ℃条件下4000 r/min离心15 min,将上清液转移至50 mL离心管中,重复上述提取步骤,合并两次上清液进行液液萃取,加入10 mL正己烷萃取3 min,静置分层取下层清液,重复萃取两次,50 ℃下旋转蒸干,用1 mL PBS(pH=7.5)复溶,过0.45 μm滤膜过滤,4 ℃下保存待测。
三份猪尿样也分别加入0.5 mg/L恩诺沙星标准溶液300、60、10 μL,涡旋混匀后,直接经0.45 μm滤膜过滤,4 ℃下保存待测。
色谱条件为:色谱柱:C18(150 mm×4.6 mm,5 μm);柱温箱温度:30 ℃;检测器:荧光检测器;激发波长:280 nm;检测波长:450 nm;流动相:0.05 mol/L磷酸溶液∶乙腈(80∶20,V/V);流速:0.8 mL/min;进样量:20 μL。
1.3 数据处理
选择8种恩诺沙星的结构类似物分别进行仿生ELISA分析,通过计算出的交叉反应率(CR%)(见公式2)来评价方法的选择性,交叉率越小说明方法选择性越好、特异性越强。
CR(%)=[IC50(恩诺沙星)/IC50(恩诺沙星结构类似物)]×100
式(2)
所有的测量数据都重复测量三次,结果用平均值和标准偏差来表示。制作ELISA标准曲线,以抑制率为15%时对应的恩诺沙星标准溶液浓度评价方法检出限,抑制率为50%时对应的恩诺沙星标准溶液浓度评价方法灵敏度。
2 结果与分析
2.1 酶标浓度的选择
将合成好的酶标探针从1∶500的比例开始进行梯度稀释,其中以不加酶标探针溶液为空白,其余各行分别加入不同稀释度的酶标探针溶液,以PBS代替恩诺沙星标准溶液进行免疫反应。为了使检测结果准确灵敏,选择吸光度值在0.8~1.2之间的酶标稀释度作为直接竞争仿生ELISA方法的酶标溶液稀释度数,即以1∶4000的比例作为酶标溶液稀释度数。
2.2 标样稀释液pH的确定
不同pH下的IC50结果如图2,在pH为7.5时,IC50最小,即方法灵敏度最高。在此pH溶液中,恩诺沙星(pKa1=5.94±0.09,pKa2=8.70±0.44)[20]能够保持两性离子状态,既有利于恩诺沙星的羧基与MAA形成氢键,也有利于喹啉环上的胺基与MAA进行离子交换。
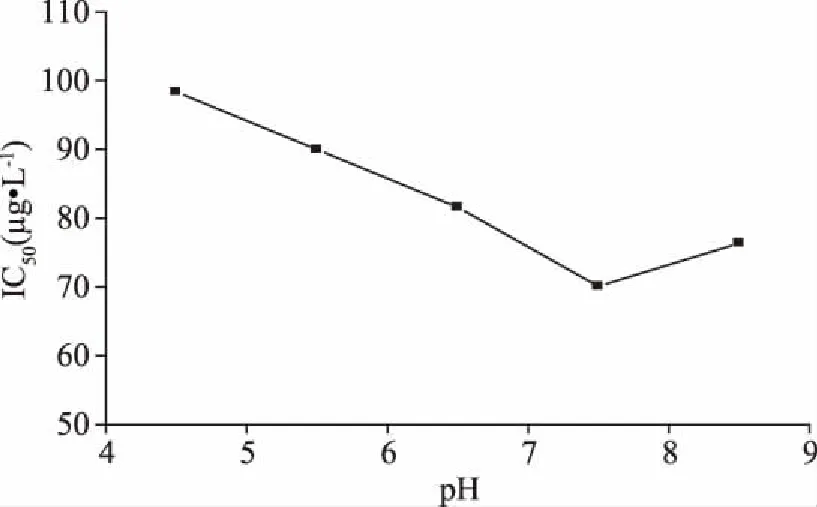
图2 不同标样稀释液pH与ELISA方法IC50值对应曲线
2.3 直接竞争仿生ELISA方法的特征量分析
2.3.1 直接竞争仿生ELISA方法的灵敏度与检出限 以制备的恩诺沙星印迹聚合物膜作为仿生抗体,按照上述优化条件建立直接竞争仿生ELISA,在0.1~10000 μg/L的恩诺沙星标准溶液浓度范围内建立标准曲线。如图3,印迹聚合物(MIP)的最高抑制率达到76%,而非印迹聚合物(NIP)的最高抑制率只有45%。方法检出限以MIP的IC15表示为0.80 μg/L,灵敏度以MIP的IC50表示为65.93 μg/L,与王忠斌[19]合成的恩诺沙星多克隆抗体建立的直接竞争ELISA方法(IC15=0.02 μg/L;IC50=0.35 μg/L)相比,检出限与IC50较高,但是与分子印迹聚合物应用于固相萃取进行的HPLC检测恩诺沙星分析方法相比,有更好的检出限与灵敏度,而且检出限已满足中国、欧盟、日本等国家规定的检测标准。方法线性分析范围为1~1000 μg/L,与多克隆抗体相比有很大提高,这是由吸附位点的异质性所决定的[21]。
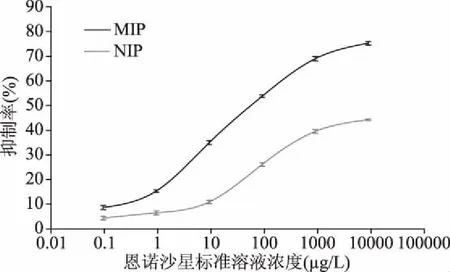
图3 恩诺沙星印迹聚合物膜与非印迹聚合物膜作为仿生抗体建立的ELISA标准曲线
这种直接竞争仿生ELISA分析方法,由于其不需要抗体包被和牛血清白蛋白的封闭过程,而节约了分析时间。综上所述,合成MIP膜比在动物体内生成抗体更加省时经济。因此,非常适合于大量样品中恩诺沙星残留的快速筛选。
2.3.2 直接竞争仿生ELISA方法的精密度 方法精密度结果分析见表1,板间变异均大于板内变异,且变异系数随着恩诺沙星标准溶液浓度的减小而呈递增趋势,但是变异系数均小于20%,说明所建立的方法具有较高的精密度。
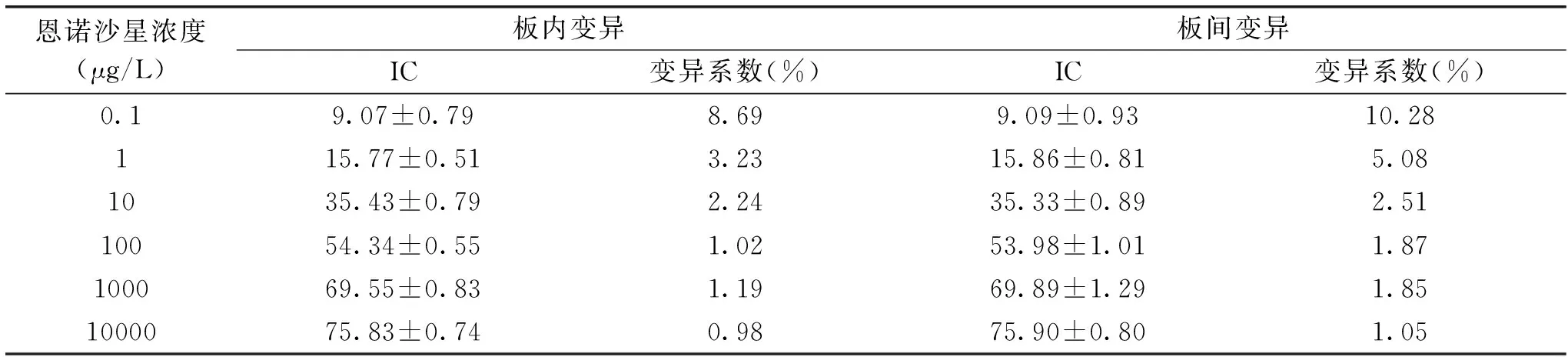
表1 直接竞争仿生ELISA 板内变异与板间变异(%)
2.3.3 直接竞争仿生ELISA方法的选择性 由表2可知,聚合物对环丙沙星等6种氟喹诺酮类药物几乎均有交叉反应,而对氟甲喹、西诺沙星没有交叉反应,由此可见,哌嗪环作为药物结构之间的主要差别,在聚合物膜识别过程中起了较大作用。环丙沙星作为恩诺沙星在动物体内的代谢物,与恩诺沙星有十分相似的结构,更容易被特异性吸附位点识别并进入孔穴,因此交叉反应率最大。此外,由于各种喹诺酮类物质的解离常数有所不同,在溶剂中的状态有所偏差,也会影响它们对印迹位点的吸附结合。
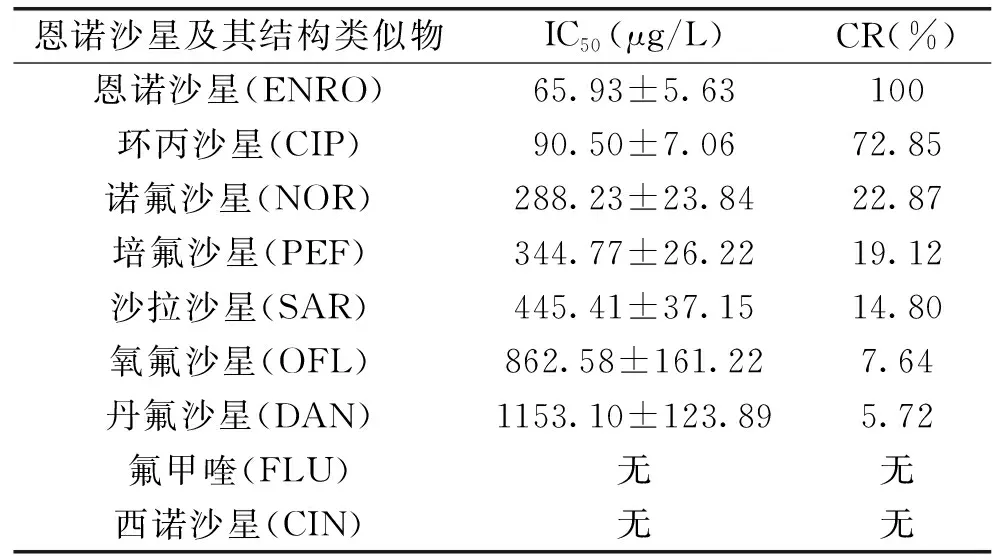
表2 恩诺沙星及其结构类似物的IC50值和交叉反应率(CR%)
总体来讲,所建立的直接竞争仿生ELISA方法有较高的选择性,这种选择性源于分子印迹聚合物膜的印迹效果,识别位点的特异性取决于孔穴结构的形状、大小,官能基团的空间排列,以及吸附溶液的种类性质,在实际应用中本方法可以进行同时检测恩诺沙星及其代谢物环丙沙星。
2.4 样品添加回收实验及液相验证
由表3可知,所建立的仿生ELISA法有较好的添加回收率,两种样品不同浓度的添加回收率均在90%~105%之间,其中鸡肉组织样品的添加回收率为97.30%~103.56%,猪尿样品的添加回收率为94.48%~96.53%。所建立的仿生ELISA方法与HPLC方法对于不同ENRO添加浓度的鸡肉组织样品和猪尿样品的回收率均值无显著性差异(p>0.05),说明两种方法有较好的一致性。
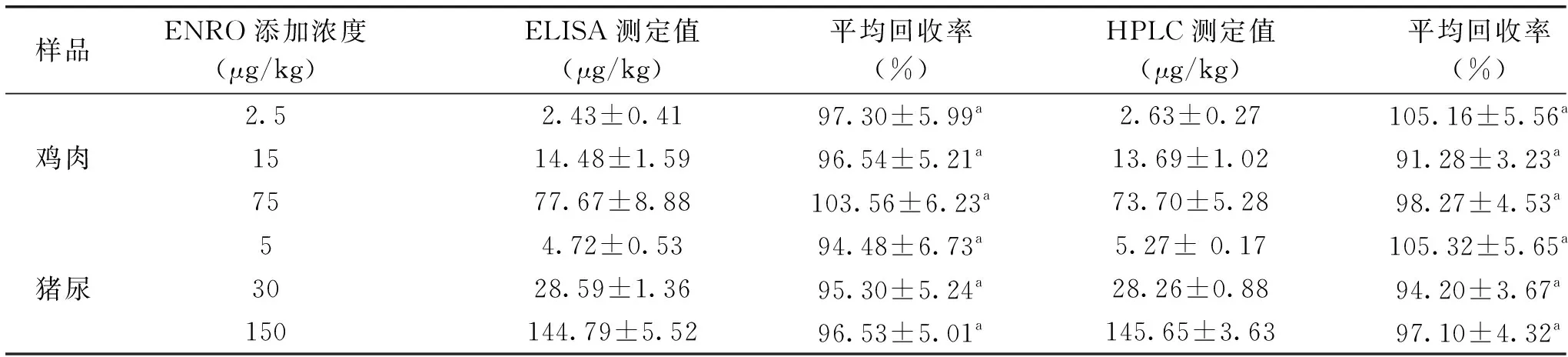
表3 仿生ELISA法在鸡肉、猪尿样品中恩诺沙星的添加回收率(n=3)
3 结论
本文以聚苯乙烯酶标板为载体,利用表面分子印迹技术合成恩诺沙星印迹聚合物膜,得益于表面印迹的优势,吸附位点位于或靠近聚合物膜表面,大分子酶标探针更易于识别结合吸附位点,有利于印迹聚合物膜应用于仿生ELISA检测方法。另外,通过对直接竞争仿生ELISA方法条件的优化,成功的建立了一种快速、准确、灵敏、经济的方法检测恩诺沙星。在聚苯乙烯酶标板表面直接合成的对恩诺沙星具有吸附特异性的印迹聚合物膜能够作为仿生抗体应用于ELISA检测实际样品中的恩诺沙星。
[1]Withdrawal of approval of the new animal drug application for enrofloxacin in poultry(Docket No. 2000N-1571)[S]. Department of Health and Human Services,U.S. Food and Drug Administration,USA,28 July 2005,p. 22.
[2]EU Commission Regulation No. 37/2010,off. J. Eur. Communities[S]. European Communities,2010.
[3]胡鲲,李怡,朱泽闻,等.微生物显色法快速检测水产品中恩诺沙星残留[J].上海海洋大学学报,2009,18(4):472-47.
[4]Dang P K,Degand G,Danyi S,et al.Validation of a two-plate microbiological method for screening antibiotic residues in shrimp tissue[J].Analytical Chimica Acta,2010,672:30-39.
[5]徐刚,王周芹,宋禾,等. 猪排泄物中恩诺沙星和环丙沙星含量的HPLC检测方法[J].中国畜牧兽医,2016(4):1058-1065.
[6]Evaggelopoulou E N,Samanidou V F.HPLC confirmatory method development for the determination of seven quinolones in salmon tissue(SalmosalarL.)validated according to the European Union Decision 2002/657/EC[J].Food Chemistry,2013,136(2):479-484.
[7]赵建,吕燕,许秀琴,等.超高效液相色谱-串联质谱法测定饲料中6大类50种药物[J]. 分析实验室,2014,33(6):713-718.
[8]李洪波,许小友,黄志伟,等. 超高效液相色谱-串联质谱法测定饲料中的恩诺沙星和喹乙醇药物的含量[J].饲料工业,2016,37(22):53-37.
[9]Xu X Y,Liu L H,Jia Z M,et al. Determination of enrofloxacin and ciprofloxacin in foods of animal origin by capillary electrophoresis with field amplified sample stacking-sweeping technique[J].Food Chemistry,2015,176:219-225.
[10]Wang Z H,Zhang H Y,Ni H J,et al. Development of a highly sensitive and specific immunoassay for enrofloxacin based on heterologous coating aptens[J]. Analytica Chimica Acta,2014,820:152-158.
[11]Yu F,Yu S C,Yu L L,et al. Determination of residual enrofloxacin in food samples by a sensitive method of chemiluminescence enzyme immunoassay[J]. Food Chemistry,2014,149:71-75.
[12]徐逍,杨彩根,付监贵,等. ELISA 法检测不同条件下中华绒螯蟹中恩诺沙星的残留量[J]. 江苏农业科学,2015(11):399-403.
[13]文永佳,张峰,杜幸洁,等. 呋喃唑酮代谢物分子印迹聚合物的合成及其酶联免疫吸附检测方法的建立[J]. 应用化工,2013,42(7):1347-1350.
[14]彭丽芳,李桦. 缩胆囊素神经肽分子印迹膜的制备及荧光免疫分析应用[J]. 分析科学学报,2017,33(1):1-5.
[15]Ge C,Mao J J,Peng F D,et al. A sensitive chemiluminescence enzyme immunoassay based on molecularly imprinted polymers solid-phase extraction of parathion[J]. Analytical Biochemistry,2017,530:87-93.
[16]Jie L,Ju X L,Xu G Q,et al. A study on biomimetic immunoassay-capillary electrophoresis method based on molecularly imprinted polymer for determination of trace trichlorfon residue in vegetables[J]. Food Chemistry,2017,221:1285-1290.
[17]Fang G Z,Lu J P,Pan M F,et al. Substitution of antibody with molecularly imprinted film in enzyme-linked immunosorbent assay for determination of trace ractopamine in urine and pork samples[J]. Food Analytical Methods,2011,4(4):590-597.
[18]吕春晖,方国臻,王硕,等. 恩诺沙星分子印迹聚合物膜的制备及吸附性能研究[J]. 现代食品科技,2017,33(11):1-6.
[19]王忠斌. 食品中恩诺沙星残留免疫学检测方法的研究[D]. 天津:天津科技大学,2007
[20]Liondo M,Pons M,Gallardo M,et al. Physicochemical properties of enrofloxcin[J]Journal of Pharmaceutical and Biomedical Analysis,1997,15:1845-1849.
[21]Mosbach K,Ramstrom O. The emerging technique of molecular imprinting and its future impact on biotechnology[J]. Biotechnology,1996,14:163-170.

