猕猴桃果实对模拟运输振动的生理和品质响应
谢丹丹,茅林春,卢文静,韩雪源,魏肖鹏
(浙江大学生物系统工程与食品科学学院,浙江杭州310012)
猕猴桃果实风味独特,维生素C含量高,含有丰富的矿物质和多种人体必需的氨基酸,具有良好的营养和经济价值[1],受到国内外市场的普遍欢迎。猕猴桃属呼吸跃变型果实,采后硬度下降快,成熟和衰老过程十分迅速[2]。运输过程的振动是造成采后果蔬机械损伤的重要原因[3]。目前已有的果蔬振动研究主要是果实与果实之间、果实与包装材料之间的摩擦、碰撞和挤压导致的果实碰伤、压伤、擦伤、刺伤等伤害,受伤后一般表现为果实软化、营养成分及品质变化[4-6]。振动造成的碰撞、挤压等机械损伤加速了草莓的腐败[7]。振动使苹果在运输过程中擦伤、碰伤等损伤加剧,且不同包装不同层数的苹果损伤情况不一[8]。严格意义上讲,这些研究的果实损伤和品质变化并不是振动本身造成的,而是由振动过程中的次级效应引起的后果。振动本身对果蔬生理和品质影响的研究很少,在猕猴桃果实上还未有报道。
徐斌等[9]研究了振动14 d内不同堆高对哈密瓜硬度、内聚性、胶黏性、咀嚼性、弹性模量等质地品质的影响。陈豫等[10]研究发现摇床振动处理茵红李20 h内果实的呼吸强度、可溶性固形物、可滴定酸及多酚氧化酶活性等生理生化指标有所变化。本课题主要探究在猕猴桃不受摩擦、碰撞、挤压等机械损伤的条件下,比较不同振动强度对猕猴桃果实硬度、细胞膜透性、可溶性固形物、呼吸强度、乙烯生成量和超微结构的作用,研究振动引起的生理和品质响应,分析振动对果实货架期品质和生理的影响,为果实振动生理研究和物流保鲜技术开发提供理论基础。
1 材料和方法
1.1 材料与试剂
猕猴桃品种为徐香(Actinidia deliciosa cv.Xuxiang),于2016年10月29日采自浙江省富阳市,选择果色均匀、大小和成熟度相近(80%成熟度)并且没有破伤的果实作为试验样品。将果实分为3组,每组5 kg,约100个果实,分别以5、10、20 Hz 3种频率进行振动处理,以没有振动处理的果实作为对照,室温贮藏。戊二醛、缓冲液、乙醇、丙酮、柠檬酸铅、亚甲基蓝:国药集团化学试剂公司;锇酸、Spurr包埋剂、醋酸双氧铀:SPI-CHEM公司。
1.2 仪器与设备
电动振动试验系统(D-200-3):江苏苏试试验仪器股份有限公司;电子天平(TB1001D型):金诺天平仪器有限公司;质构仪(TA-XT2i):英国SMS公司;手持袖珍折射仪(PAL-1型):爱拓ATAGO公司;电导率仪(Seven Easy S30型):梅特勒-托利多仪器上海有限公司;O2、CO2测定仪(Check Mate 3):丹麦丹圣有限公司;气相色谱仪(岛津GC-2014C型):日本岛津;透射电镜(Hitachi H-7650型):日本日立高新技术有限公司。
1.3 方法
1.3.1 振动处理
模拟运输振动试验系统构成如图1。
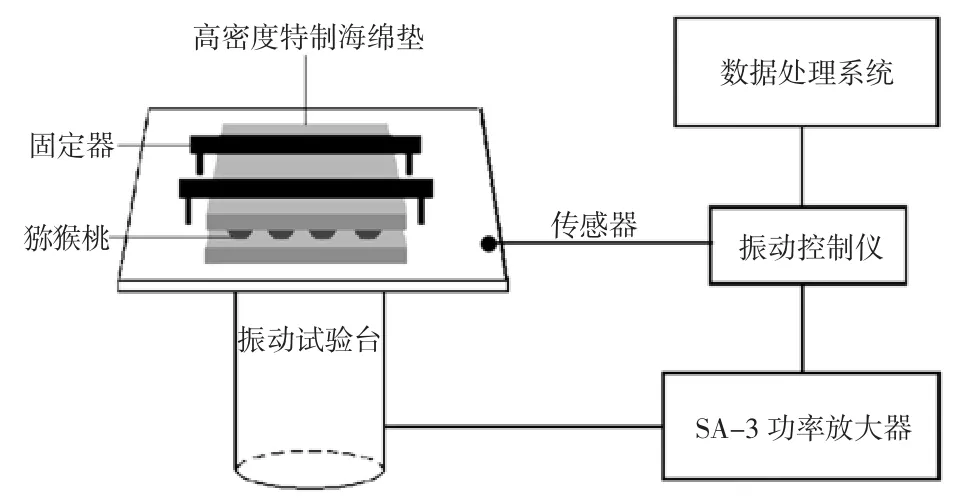
图1 D-200-3电动振动试验系统Fig.1 Schematic layout of the D-200-3 system used for the vibration analysis
为了避免在模拟运输过程中产生摩擦、碰撞、挤压等振动引起的次级效应,采用高密度特制海绵材料对猕猴桃果实进行固定。将猕猴桃果实放在两块30 mm厚的高密度特制海绵垫之间,每块海绵垫有16个浅凹槽,猕猴桃果实置于凹槽中,海绵垫固定在振动平台上。根据车辆的实际振动情况[11-12],参考GB 4857.23-2012《包装运输包装件基本试验第23部分:随机振动试验方法》[13]对振动频率加强倍,加强后的振动频率为5、10、20 Hz 3种频率,分别对应沥青路面、水泥混凝土路面、无铺路面的实际运输振动情况[14]。振动时间设置为8 h,相当于实际公路运输时长约40 h[15],期间每隔2小时取样一次。果实振动处理以后,在25℃常温环境中贮藏48 h,以未振动处理的果实作为对照(CK)。
1.3.2 失重率
用电子天平称量,每次取6个果实称重,利用差重法计算失重率。
1.3.3 硬度
采用TA-XT2i质构仪测定猕猴桃赤道部位硬度,每次取3个猕猴桃去皮测定,每个果实重复4次,取最大值,最后取3个果实平均值作为试验结果。测定探头直径为5 mm,测试深度为15 mm,贯入速度为1 mm/s。
1.3.4 可溶性固形物
采用手持袖珍折射仪测定,每组3个果实,打碎后迅速过滤取果浆进行测定。
1.3.5 相对电导率
参照曹健康等[16]的方法测定,用打孔器和切片机将猕猴桃赤道部位果肉切成大小、形状一致的圆片,取4 g放入盛有20 mL去离子水烧杯中,抽真空10min(压力为0.5 MPa)后,立即用电导仪测定浸提液电导率,再将浸提液加热煮沸10min,冷却后再次测定其电导率。以浸提液加热前后电导率比值即相对电导率表示其细胞通透性。
1.3.6 呼吸强度
采用O2、CO2测定仪测定呼吸强度。
1.3.7 乙烯生成量
参照千春录等[17]的方法测定,每组取约180 g果实置于密闭容器中,放置在20℃下黑暗环境中,2小时后取2 mL气样,用气相色谱仪测定乙烯释放率,以标准乙烯气体(10.0 μL/L)作为标气对照。
1.3.8 超微结构
参照程曦等[18]的方法测定,取振动处理前及振动8 h的样品,选择果实赤道部位外果皮部位切片,在2.5%的戊二醛溶液中4℃固定过夜,然后按下列步骤处理样品:用 0.1 mol/L,pH7.0 的磷酸缓冲液漂洗样品3次,每次15min;用1%的锇酸溶液固定样品2 h;用0.1 mol/L,pH7.0 的磷酸缓冲液漂洗样品 3 次,每次15min;用梯度浓度(包括30%,50%,70%,80%,90%和95%6种浓度)的乙醇溶液对样品进行脱水处理,每种浓度处理15min,再用100%的乙醇处理两次,每次20min。用乙醇与醋酸异戊酯的混合液(体积比=1∶1)处理样品30min,再用纯醋酸异戊酯处理样品放置过夜。临界点干燥、镀膜后的样品在透射电镜中观察
1.3.9 数据统计和分析
采用Excel 2013软件统计数据,采用SPSS 20.0对数据进行差异显著性分析,对差异显著性(p=0.05)进行分析比较,p<0.05认为具有显著差异性;并用Origin 8.0软件绘制作图。
2 结果与分析
2.1 果实品质变化
2.1.1 失重率
采后猕猴桃失重主要是由于蒸腾失水和呼吸消耗,其中主要是水分的散失[19]。当猕猴桃失重率达到4%~5%时会有皱缩现象,并且可能改变代谢方式、加速果实成熟甚至导致产品品质下降[20-22]。不同振动频率的猕猴桃失重率见图2。
如图2可知,猕猴桃在振动过程中失重率呈上升趋势,振动8 h后,对照和5、10、20 Hz振动的猕猴桃失重率分别 0.50%、0.90%、1.50%和 3.10%(p<0.05)。由此可以看出振动频率越大,失重率越大,说明水分散失越快,加速果实皱缩现象。
2.1.2 硬度
不同振动频率的猕猴桃硬度见图3。
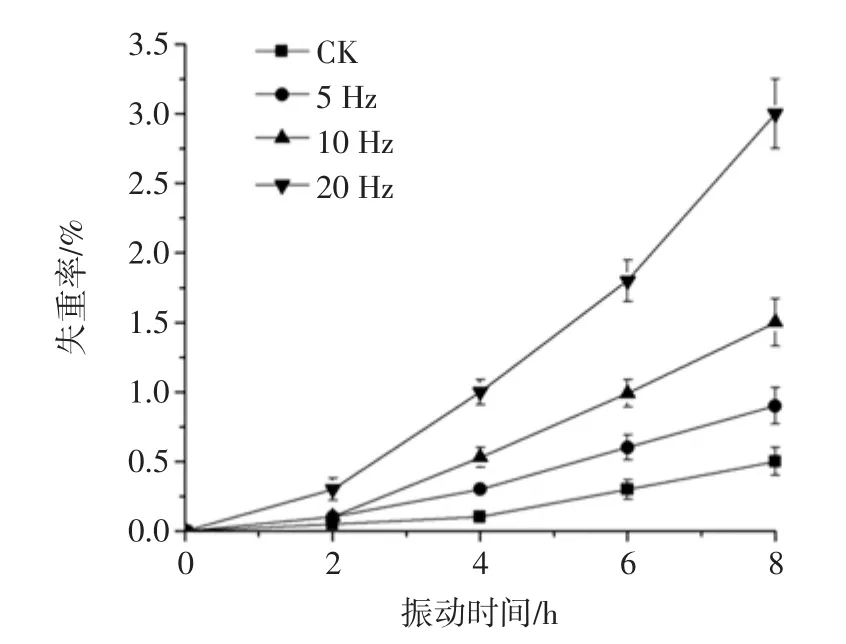
图2 不同振动频率的猕猴桃失重率Fig.2 Weight loss rate of kiwifruits vibrated at different frequencies of vibration
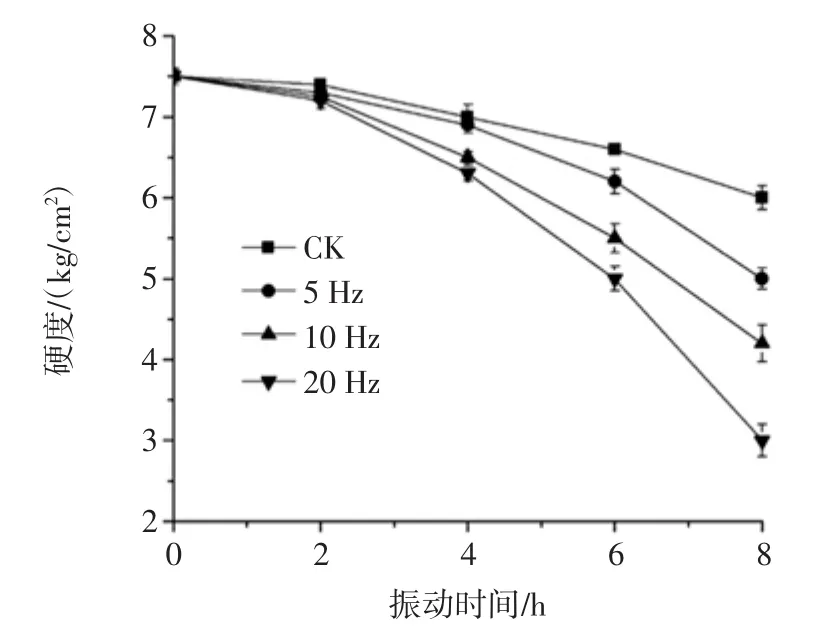
图3 不同振动频率的猕猴桃硬度Fig.3 Firmness of kiwifruits vibrated at different frequencies of vibration
由图3可知,猕猴桃在振动过程中硬度呈下降趋势,振动8 h后与初始值相比,对照和5、10、20 Hz振动的猕猴桃硬度分别下降了 1.50、2.60、3.30 和4.50 kg/cm2(p<0.05)。其中 20 Hz振动的硬度下降了60%,是对照组的3倍,说明振动会加速猕猴桃果实硬度下降,加速其软化速度。这与李正国等[23]、Massantini等[24]得出的振动强度越大,果实软化越快的研究结果一致。振动加速猕猴桃硬度降低,可能是由于振动引起有关降解细胞壁酶活性的增加,导致细胞壁的降解[25],同时刺激了呼吸强度及乙烯生成增加,从而引起软化加速[26-27]。
2.1.3 可溶性固形物含量
可溶性固形物指果实汁液中溶质的百分含量,主要由可溶性糖和有机酸等营养成分组成,是衡量水果品质的一个重要指标[28]。不同振动频率的猕猴桃可溶性固形物见图4。
由图4可知,猕猴桃在振动过程中可溶性固形物含量呈上升趋势,振动8 h后与初始值相比,对照和经5、10、20 Hz振动的猕猴桃可溶性固形物含量分别上升了 1.20%、1.90%、2.60%和 2.80%(p<0.05)。振动频率越大,可溶性固形物含量越高。但是,张哲等[29]的研究认为,20 Hz振动的果实硬度较高、可溶性固形物含量较低,其原因可能是低频振动能量集中,果实相互间以及果实与包装间碰撞挤压严重。本试验则不存在果实相互间以及果实与包装间碰撞、挤压与摩擦。此外,20 Hz振动的果实可溶性固形物含量在6 h时上升至17.50%,随后下降了0.9%,原因可能是高强度振动加速细胞代谢速度,大量消耗内部糖酸等营养物质[30]。
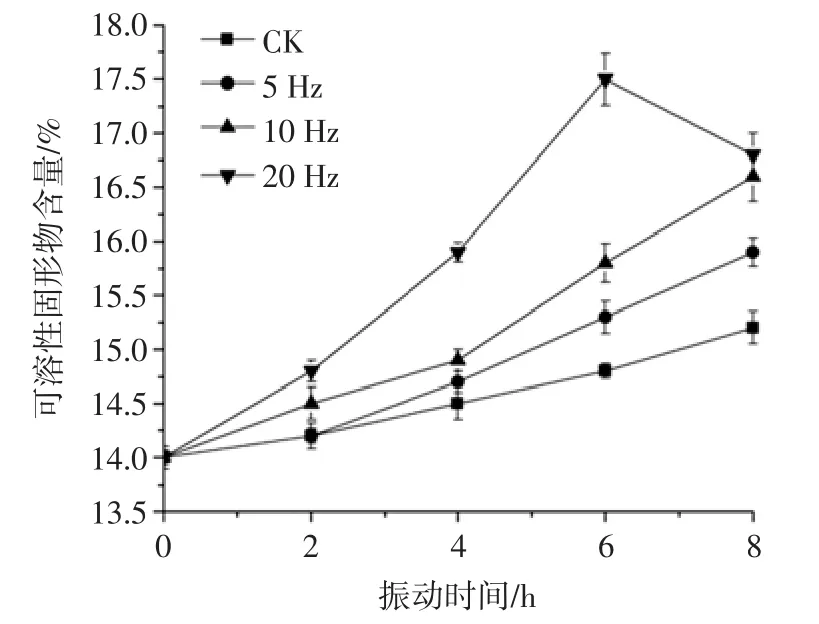
图4 不同振动频率的猕猴桃可溶性固形物Fig.4 Soluble solid content of kiwifruits vibrated at different frequencies of vibration
2.2 果实生理响应
2.2.1 细胞膜透性
细胞膜的损伤表现为失去选择透性,电解质漏泄增大,细胞膜透性可以用相对电导率大小来衡量[31]。不同振动频率的猕猴桃细胞膜透性见图5。
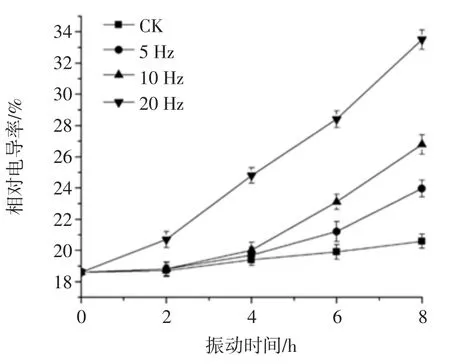
图5 不同振动频率的猕猴桃细胞膜透性Fig.5 Cell membrane permeability of kiwifruits vibrated at different frequencies of vibration
如图5所示,猕猴桃在振动过程中相对电导率呈上升趋势,振动8 h后与初始值相比,对照和经5、10、20 Hz振动的猕猴桃可溶性固形物含量分别上升了1.98%、5.36%、8.18%和 14.9%(p<0.05)。振动 8 h 后,20 Hz振动频率的猕猴桃相对电导率是对照组的1.63倍。由此可以看出,振动频率越大,相对电导率越高,说明振动破坏了细胞膜结构,细胞液外渗,导致相对电导率迅速上升。程曦[18]和茅林春等[32]在杏和无花果果实的研究也报道了相似的结果。
2.2.2 呼吸强度
猕猴桃是典型的呼吸跃变型果实,呼吸作用是其采收后进行的重要生理活动,呼吸强度作为果实新陈代谢强弱的一个重要指标,也是影响贮藏效果的重要因素。不同振动频率的猕猴桃呼吸强度见图6。
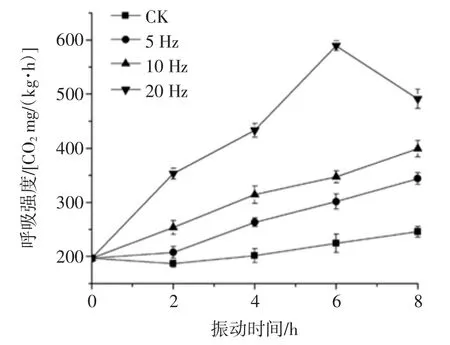
图6 不同振动频率的猕猴桃呼吸强度Fig.6 Respiratory rate of kiwifruits vibrated at different frequencies of vibration
猕猴桃在振动过程中呼吸速率呈上升趋势(图6),振动8 h后与初始值相比,未受振和经5、10、20 Hz振动的猕猴桃呼吸强度分别上升了 49.12、147.36、202.77、294.71CO2mg/(kg·h)(p<0.05)。经5、10、20 Hz振动的猕猴桃呼吸强度是对照的 3.0、4.1 倍和 6.0 倍。这一现象与李正国[23]和应铁进等[33]的研究报道基本一致。此外,20 Hz振动频率的呼吸强度在6 h时上升至589.42 CO2mg/(kg·h),随后开始下降,说明高振动强度促使呼吸跃变提前。呼吸强度的应激增强是对抗逆境的一种自我保护机制[34]。
2.2.3 乙烯释放量
乙烯是一种气体植物激素,在植物生长发育及应对胁迫的防御反应中起重要调控作用,可以作为判断果实成熟度及生理状态的重要指标[35]。猕猴桃是乙烯敏感性植物,乙烯释放量增大会引起猕猴桃果实的呼吸增强[36]。不同振动频率的猕猴桃乙烯生成量见图7。
由图7可知,猕猴桃在振动过程中乙烯释放量呈上升趋势,振动8 h后与初始值相比,对照组和5、10、20 Hz振动的猕猴桃乙烯生成量分别上升了2.54、18.32、48.02、106.97 μL/(kg·h)(p<0.05)。试验结果与曹森等[37]对猕猴桃模拟运输时乙烯变化情况一致。
2.2.4 细胞壁超微结构
细胞壁超微结构的变化会导致组织细胞功能衰弱甚至丧失等一系列变化,引起果实质地变化,从而进一步加速细胞衰老解体[38-41]。用透射电镜观察到猴猴桃果肉细胞壁只有初生壁,没有次生壁。相邻两细胞的细胞壁由胞间层连接。因此,相邻两细胞所共有的壁为3层,即中间的胞间层与两侧的初生壁[42]。不同振动频率的猕猴桃细胞壁超微结构见图8。
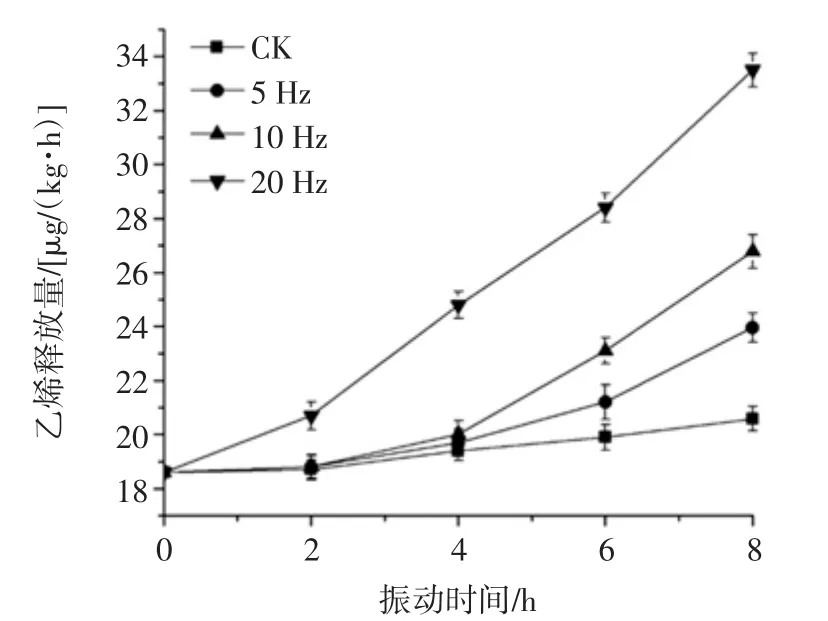
图7 不同振动频率的猕猴桃乙烯生成量Fig.7 Ethylene production of kiwifruits vibrated at different frequencies of vibration
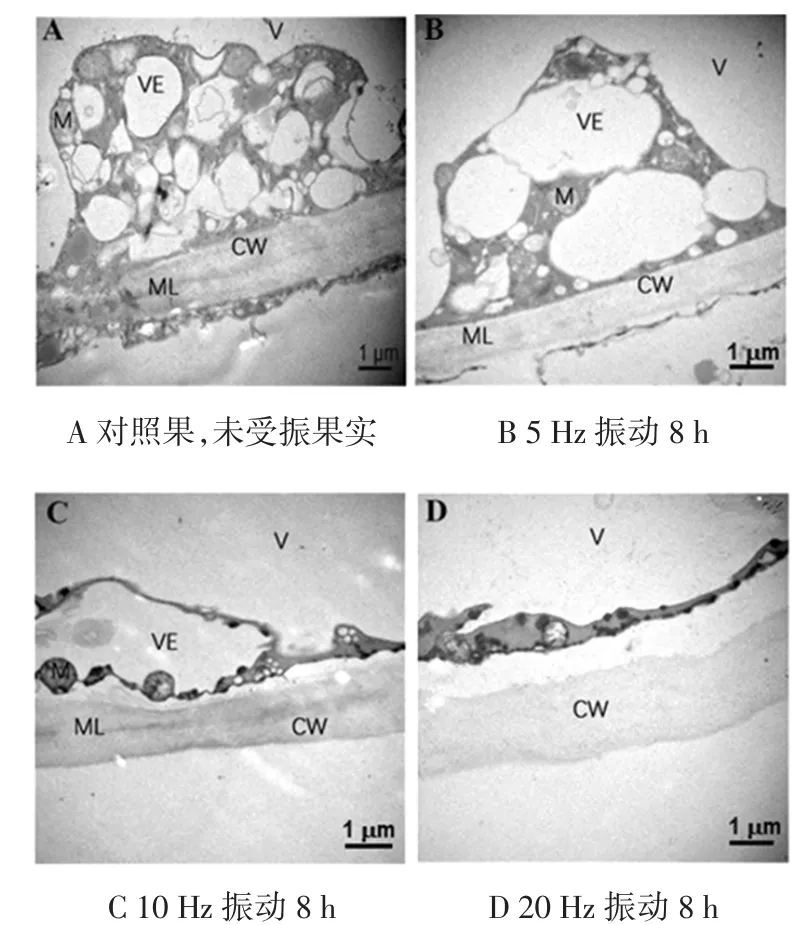
图8 不同振动频率的猕猴桃细胞壁超微结构Fig.8 Ultrastructure of cell wall of kiwifruits vibrated at different frequencies of vibration
从图8可以看出,对照果实的果肉细胞壁结构均匀且完整,初生壁和中胶层紧密结合,胞间层为一薄的高电子密度的暗层,均匀而连续,细胞壁呈明-暗-明区域结构;细胞质与其内含物紧贴细胞壁,囊泡、线粒体等细胞器结构完整形态饱满(图8A)。5 Hz振动8 h的猕猴桃细胞壁结构均匀且完整,胞间层较明显,但致密度降低,开始出现降解;细胞质与其内含物紧贴细胞壁,囊泡、线粒体等细胞器结构完整形态饱满(图8B)。10 Hz振动8 h的猕猴桃细胞壁开始发生变形但未发现降解,胞间层较清晰,细胞壁呈明-暗-明区域结构;果肉细胞开始液泡化,细胞质与其内含物开始减少,呈稠密状态,出现质壁分离现象,此外液泡膜开始出现破损(图8C)。20 Hz振动8 h的猕猴桃细胞壁弯曲变形,部分细胞壁模糊,胞间层已分解,明暗分区不明显,说明胶质液化,细胞壁形成絮状空隙,细胞间的粘合力丧失;细胞质与其内含物大量消失,呈稠密状态,出现质壁分离现象,细胞内明显液泡化(图8D)。细胞壁超微结构图说明振动胁迫能够加速细胞壁降解与变形,产生质壁分离现象,这加速了果实软化,与果实硬度变化的规律(图3)基本一致。
振动降低猕猴桃硬度的主要原因在于振动胁迫破坏了果实细胞结构,细胞壁中果胶质、纤维素等多糖类物质在细胞壁水解酶的作用下大量水解,导致细胞壁网络状结构解体,从而促进了果实的软化。振动也破坏了细胞膜结构,增加了细胞膜透性,因此,在果实硬度下降的同时,可溶性固形物含量也相应增加。
2.3 果实货架期品质和生理
猕猴桃经过8 h振动处理以后再贮藏48 h后的失重率、硬度、细胞膜透性、可溶性固形物含量、呼吸强度及乙烯生成量见图9。
由图9可知,货架贮藏48 h后,5 Hz和10 Hz振动处理的果实与对照组在重量变化、硬度、细胞膜透性、可溶性固形物含量、呼吸强度及乙烯生成量等指标没有显著性差异(p>0.05)。而20 Hz振动处理后的果实失重率达3.57%,明显高于对照及5 Hz和10 Hz振动处理组(图9A),硬度显著低于其它果实(p>0.05)(图9B),细胞膜透性不断增大(图9C),可溶性固形物含量下降至14.7%(图9D),在呼吸跃变后呼吸强度持续下降(图9E),乙烯生成量上升至109.12 μL/(kg·h)(图9F)。
猕猴桃对不同强度的振动会产生不同程度应激反应,低强度振动结束后,猕猴桃应激反应也相应停止,货架期间逐渐恢复正常水平,但高强度振动严重破坏猕猴桃细胞结构且在振动结束后也无法修复,因而导致货架品质劣变加速。货架贮藏48 h后,对照组与5、10 Hz振动8 h的猕猴桃在品质和生理变化上没有显著性差异,但20 Hz振动处理的果实品质变化明显。经过贮藏48 h后,经5、10 Hz振动处理的猕猴桃经过一系列生理生化变化后恢复正常状态,而20 Hz振动处理对猕猴桃产生不可逆影响,加速其品质变化。康维民等[43]则报道,振动频率越小,梨越容易产生损伤,其原因在于果实与果实、果实与塑料箱的接触部位发生了较为严重的损伤。Yang等[44]研究发现,低频率机械振动后会刺激果蔬的生理反应,并对猕猴桃愈伤组织的生长和细胞壁、细胞膜的流动性起促进作用,从而使果实细胞快速增长和分化。但是,当振动频率超出一定范围时,猕猴桃细胞产生不可修复的破坏,会加速贮藏期间猕猴桃生理变化,使果实货架品质快速劣变。周然等[11]研究发现,过高强度的运输振动造成黄花梨硬度、水解酶活性、果胶含量明显变化,最终导致黄花梨快速软化。
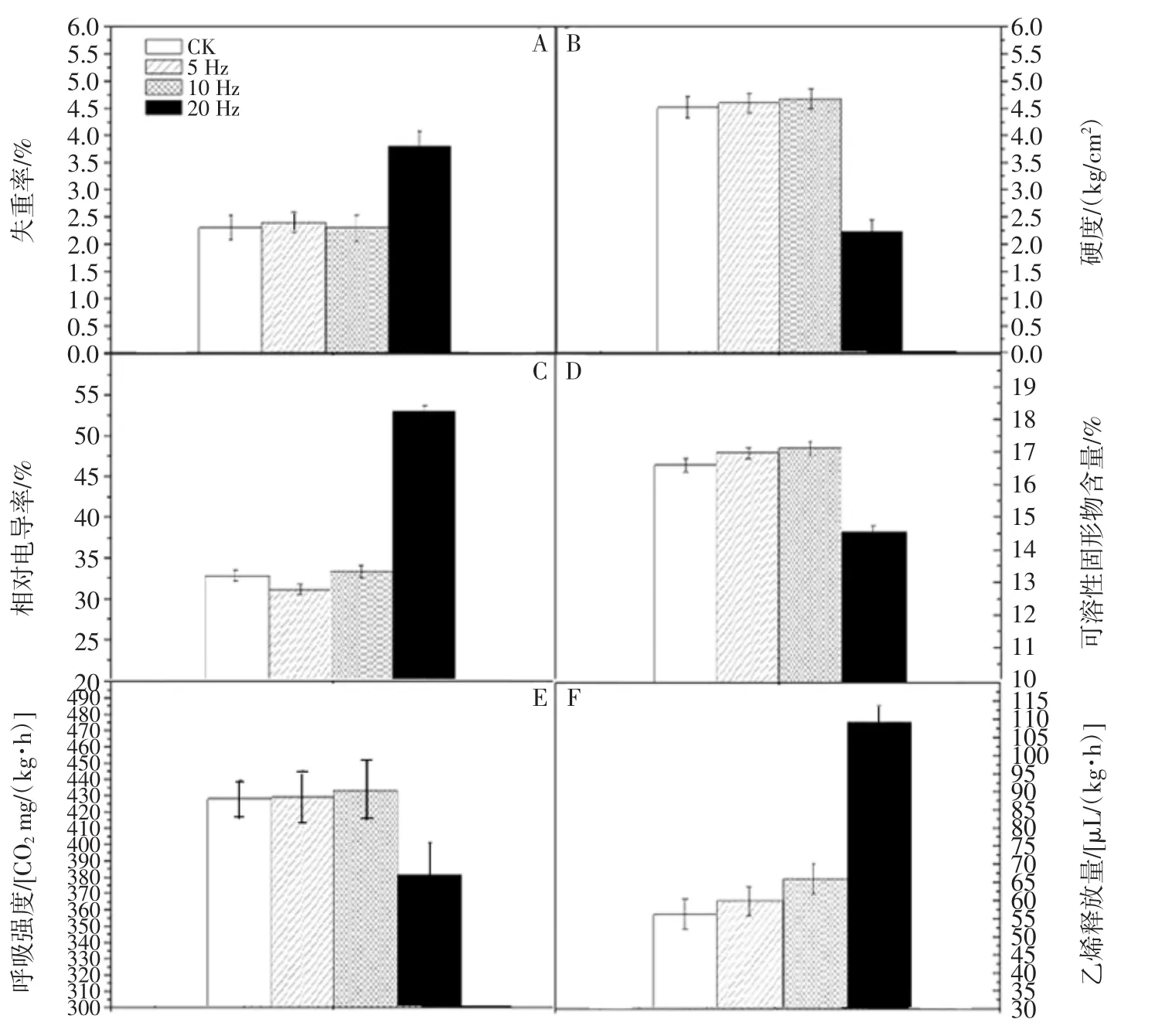
图9 不同振动频率的猕猴桃货架期品质和生理Fig.9 Shelf qualitiy and physiology of kiwifruits vibrated at different frequencies of vibration
3 结论
果实贮藏性能及保鲜效果的重要评判依据通常为果实采后品质及生理变化。本试验在没有摩擦、碰撞、挤压等机械损伤的条件下,以未振动处理的猕猴桃果实为对照,采用5、10 Hz和20 Hz 3种振动频率模拟沥青路面、水泥混凝土路面和无铺路面的运输振动,测定猕猴桃在振动过程中生理及品质变化,并研究不同振动强度对猕猴桃货架期品质的影响。试验结果表明,振动刺激了猕猴桃生理及品质响应,表现为失重率、可溶性固形物含量、细胞膜透性、呼吸强度和乙烯生成量的升高,猕猴桃硬度的降低,细胞壁降解与变形,细胞液泡化和质壁分离现象。振动强度越大,各项生理及品质响应变化越明显,20 Hz振动频率下还会造成果实呼吸跃变提前,细胞结构严重受损。与对照果实相比,低频率振动(5 Hz~10 Hz)的猕猴桃货架期品质和生理变化上没有显著性差异,但高频率振动(20 Hz)的果实品质明显变化。因此在实际运输过程中应避免高频率振动强度造成的果实损伤,以减少猕猴桃果实运输过程的损耗。
[1]王井田,刘达富,余良水,等.套袋对猕猴桃果实腐烂病的防治效果及果实品质的影响[J].浙江林业科技,2017,37(1):55-58
[2]李正国,苏彩萍,王贵禧.振动胁迫对猕猴桃果实成熟衰老生理的影响[J].农业工程学报,2000(4):142-143
[3]李萍,王若伊,林顿,等.果蔬运输振动损伤及其减振包装设计[J].食品工业科技,2013,34(5):353-357
[4]吴琼,周然.运输振动对水果贮藏品质影响的研究进展[J].食品工业科技,2017,38(11):356-362,368
[5]Li Z,Thomas C.Quantitative evaluation of mechanical damage to fresh fruits[J].Trends in food science&technology,2014,35(2):138-150
[6]Van Zeebroeck M,Ramon H,De Baerdemaeker J,et al.Impact damage of apples during transport and handling[J].Postharvest biology and technology,2007,45(2):157-167
[7]La Scalia G,Aiello G,Miceli A,et al.Effect of vibration on the quality of strawberry fruits caused by simulated transport[J].Journal of Food Process Engineering,2016,39(2):140-156
[8]Fadiji T,Coetzee C,Chen L,et al.Susceptibility of apples to bruising inside ventilated corrugated paperboard packages during simulated transport damage[J].Postharvest Biology and Technology,2016,118:111-119
[9]徐斌,车凤斌,潘俨,等.模拟运输振动对不同堆高哈密瓜果实质地品质的影响[J].新疆农业科学,2017,54(2):243-253
[10]陈豫,胡伟,王宇,等.模拟运输振动胁迫对宜宾茵红李生理生化变化的影响[J].食品工业科技,2017,38(11):309-313
[11]周然,李云飞.不同强度的运输振动对黄花梨的机械损伤及贮藏品质的影响[J].农业工程学报,2007(11):255-259
[12]Jarimopas B,Singh S P,Saengnil W.Measurement and analysis of truck transport vibration levels and damage to packaged tangerines during transit[J].Packaging Technology and Science,2005,18(4):179-188
[13]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 4857.23-2012包装运输包装件基本试验第23部分:随机振动试验方法[S].北京:中国标准出版社,2013
[14]曾毅.基于平整度指标的路面结构动态力学特性研究[D].长沙:湖南大学,2016
[15]刘劲,赵延伟.包装测试技术[M].长沙:湖南大学出版社,1989
[16]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007
[17]千春录,陶蓓佩,陈方霞,等.1-MCP对猕猴桃果实品质和细胞氧化还原水平的影响[J].保鲜与加工,2012,12(2):9-13
[18]程曦.振动胁迫对杏果实采后后熟软化影响的研究[D].乌鲁木齐:新疆农业大学,2015
[19]李琳,罗安伟,苏苗,等.CPPU处理和失重对猕猴桃品质和电学特性的影响[J/OL].食品科学:1-9(2017-09-27).http://kns.cnki.net/kcms/detail/11.2206.TS.20170927.1606.196.html.
[20]Montanaro G,Dichio B,Xiloyannis C,et al.Light influences transpiration and calcium accumulation in fruit of kiwifruit plants(Actinidia deliciosa var.deliciosa)[J].Plant Science,2006,170(3):520-527
[21]Adato I,Gazit S.Water-deficit stress,ethylene production,and ripening in avocado fruits[J].Plant physiology,1974,53(1):45-46
[22]李正国,苏彩萍,王贵禧.振动胁迫对猕猴桃果实成熟衰老生理的影响[J].农业工程学报,2000(4):142-143
[23]Massantini R,Lanzarotta L,Botondi R,et al.Ripening of kiwifruit following simulated brushing with commercial brushes[J].Hort Science,1995,30(3):566-569
[24]Jun W,Kuichuan S.Variations in firmness and sugar content in‘Huanghua’pear(Pyrus pyrifolia‘Nakai’)[J].The Journal of Horticultural Science and Biotechnology,2005,80(3):307-312
[25]Miller A R,Dalmasso J P,Kretchman D W.Mechanical Stress,Storage Time,and Temperature Influence Cell Wall-degrading Enzymes,Firmness,and Ethylene Production by cucumbers[J].J Amer SocHortSci,1987,12(4):666-671
[26]Lee E,Sargent S A,Huber D J.Physiological changes in Roma-type tomato induced by mechanical stress at several ripeness stages[J].HortScience,2007,42(5):1237-1242
[27]张旭伟,徐明磊,李红艳,等.番茄果实可溶性固形物的作用及研究概况[J].科技资讯,2011(15):160-161
[28]张哲,张治权,毛力,等.运输过程中机械振动对猕猴桃贮藏品质的影响[J].食品与机械,2017,33(1):104-109
[29]黎春红,周宏胜,张雷刚,等.不同内包装方式对模拟运输过程中水蜜桃品质的影响[J/OL].现代食品科技,2017(12):1-7(2017-10-11).http://kns.cnki.net/kcms/detail/44.1620.TS.20171011.1128.016.html.
[30]王艳颖,胡文忠,庞坤,等.机械损伤对富士苹果酶促褐变的影响[J].食品科学,2008(4):430-434
[31]茅林春,叶立扬.无花果果实对非外伤性振动的生理反应[J].浙江大学学报(农业与生命科学版),2000(4):80-83
[32]应铁进,郑永华,茅林春,等.振动胁迫对桃果实衰老的影响[J].园艺报,1997(2):34-37
[33]潘俨,车凤斌,董成虎,等.模拟运输振动对新疆杏呼吸途径和品质的影响[J].农业工程学报,2015,31(3):325-331
[34]李文阳,马梦迪,郭红卫.植物激素乙烯作用机制的最新进展[J].中国科学:生命科学,2013,43(10):854-863
[35]牛远洋,罗安伟,刘焕军,等.臭氧耦合低温处理对猕猴桃贮藏品质和生理生化指标的影响[J].西北农林科技大学学报(自然科学版),2017(11):76-84
[36]曹森,王瑞,钱波,等.1-MCP对“贵长”猕猴桃模拟运输后货架品质影响研究[J].食品工业科技,2016,37(6):335-340,350
[37]Pomeroy M K,Andrews C J.Ultrastructural changes in shoot apex cells of winter wheat seedlings during ice encasement[J].Canadian Journal of Botany,1978,56(7):786-794
[38]张玉,许向阳,李景富.番茄成熟突变体果实贮藏过程中细胞超微结构的变化[J].园艺学报,2005(4):707-709
[39]任亚梅,刘兴华,徐春雅,等.不同处理对猕猴桃采后生理和细胞超微结构的影响[J].农业工程学报,2008(7):217-221
[40]张鹏龙,陈复生,杨宏顺,等.果实成熟软化过程中细胞壁降解研究进展[J].食品科技,2010,35(11):62-66
[41]王仁才,熊兴耀,谭兴和,等.美味猕猴桃果实采后硬度与细胞壁超微结构变化[J].湖南农业大学学报(自然科学版),2000(6):457-460
[42]康维民,肖念新,蔡金星,等.稳定振动条件下梨的振动损伤研究[J].农业机械学报,2004,35(3):105-108
[43]Yang X C,Wang B C,Liu Y Y,et al.Biological effects of Actinidia chinensis callus on mechanical vibration[J].Colloids and Surfaces B:Biointerfaces,2002,25(3):197-203

