Sirt3蛋白对体外培养子宫颈癌细胞脂质代谢作用研究
徐丽秀,亚尔艾力·阿卜拉,亚迪卡尔·艾合买提,阿仙姑·哈斯木
(新疆医科大学基础医学院病理学教研室,乌鲁木齐 830011)
Sirt3蛋白对体外培养子宫颈癌细胞脂质代谢作用研究
徐丽秀,亚尔艾力·阿卜拉,亚迪卡尔·艾合买提,阿仙姑·哈斯木
(新疆医科大学基础医学院病理学教研室,乌鲁木齐830011)
摘要:目的探讨沉默信息调节因子2 相关酶3(Sirt3)蛋白对宫颈癌细胞脂质代谢的作用。方法应用qRT-PCR和Western blotting技术检测Sirt3基因在宫颈癌SiHa和 C33a细胞中的转录与蛋白本底表达情况,采用基因过表达和RNA干扰技术分别上调和下调子宫颈癌 SiHa和 C33a细胞中Sirt3 的表达;Western blotting技术检测Sirt3蛋白水平变化。油红O染色技术检测转染Sirt3低表达和高表达慢病毒前后宫颈癌细胞脂质水平的变化情况。结果与C33a细胞相比,SiHa细胞中Sirt3 的mRNA与蛋白的表达水平均下降(P<0.05),故选用SiHa细胞转染Sirt3过表达慢病毒,C33a细胞转染Sirt3低表达慢病毒。SiHa细胞转染过表达慢病毒后,Sirt3蛋白表达水平明显增高(P<0.05),与正常对照组和阴性对照组比,转染Sirt3高表达慢病毒的细胞内脂质含量有所增加。C33a细胞转染Sirt3低表达慢病毒后,Sirt3蛋白表达水平明显降低(P<0.05),与正常对照组和阴性对照组比,转染Sirt3低表达慢病毒的细胞内脂质含量降低。结论Sirt3蛋白的表达参与宫颈癌细胞内的脂质代谢,具体调控机制尚待研究。
关键词:宫颈癌;脂质代谢;Sirt3
中图分类号:R737.33
文献标识码:A
文章编号:1009-5551(2018)05-0528-06
doi:10.3969/j.issn.1009-5551.2018.05.002
基金项目:国家自然科学基金(81360332);新疆医科大学研究生创新项目(CXCY2017009)
作者简介:徐丽秀(1992-),女,在读硕士,研究方向:肿瘤分子生物学。
通信作者:阿仙姑·哈斯木,女,博士,教授,博士生导师,研究方向:妇科肿瘤,E-mail:axiangu75@126.com。
本文引用:徐丽秀,亚尔艾力·阿卜拉,亚迪卡尔·艾合买提,等.Sirt3蛋白对体外培养子宫颈癌细胞脂质代谢作用研究[J].新疆医科大学学报,2018,41(5):528-533.doi:10.3969/j.issn.1009-5551.2018.05.002
TheeffectofSirt3onlipidmetabolismofcervicalcancercellsinvitro
XUlixiu,YaerailiAbula,YadikaerAiermaiti,AxianguHasimu
(DepartmentofPathology,SchoolofPre-clinicalMedicine,XingjiangMedicalUniversity,Urumqi830011,China)
Abstract :ObjectiveTo explore the effect of Sirt3 protein expressions on Lipid Metabolism of Cervical Cancer Cells.MethodsmRNA and the protein of Sirt3 were detected in normal cervical cancer SiHa and C33a cell by qRT-PCR and Western blotting.The Sirt3 expression was down-regulated in C33a cell by RNA interferencing technology,while the Sirt3 gene was up-regulated in SiHa cell through gene overexpression technology.After transfected lentiviral vector,the Sirt3 protein expression was detected by Western blotting.Oil red O staining was used to evaluate the changing of lipid levels in cervical cancer cells infected lentiviral vector and the control transfected cells and normal cervical cancer cells.ResultsThe mRNA and protein level of Sirt3 in SiHa cell were significantly lower than that in C33a cell(P<0.05),so SiHa cell was transfected with SIRT3 overexpression lentiviru,and C33a cell was transfected with SIRT3 siRNA lentiviru.The expression of Sirt3 protein and the content of intracellular lipid were significantly increased in SiHa cells after transfected with overexpression lentiviru compared to the control and normal cell(P<0.01).While the level of Sirt3 protein was significantly decreased(P<0.01)and reduced the content of intracellular lipid in C33a cell transfected with siRNA lentivirus than the control and normal cell.ConclusionThe expression of Sirt3 protein participates in lipid metabolism in cervical cancer cells,but the specific regulation mechanism remains to be investigated.
Keywords:cervical cancer;lipid metabolism;Sirt3
脂肪酸合成对恶性肿瘤细胞的细胞膜形成、能量储备以及信号转导分子的产生等多个生物学过程起关键作用。研究证实,脂肪酸代谢通路中代谢物的变化对肿瘤细胞的增殖和迁移也有促进作用[1]。本课题组前期进行了宫颈癌血液及组织中的代谢组分分析及代谢网络调控研究,鉴别出17种宫颈癌差异小分子代谢物和18条关键代谢通路,主要涉及到宫颈癌患者体内的脂肪酸代谢、糖酵解和谷氨酰胺氧化代谢紊乱[2-5]。
沉默信息调节因子2相关酶3(Sirt3)是调控物质代谢的重要因子,其主要通过调节线粒体代谢限速酶的乙酰化水平来改变线粒体功能,控制脂肪酸、氨基酸和酮体进入三羧酸循环,对调控线粒体的代谢反应起到关键作用,从而维持细胞能量代谢稳定,是一种能量感受器[6-7]。由于很多学者普遍认为肿瘤是一种代谢疾病,而线粒体又处于能量代谢的中心地位,Sirt3 作为细胞线粒体内重要的去乙酰化酶,则必然与肿瘤代谢有一定的联系。目前报道证实Sirt3在食道鳞状细胞癌、口腔黏膜鳞状细胞癌和乳腺癌细胞中高表达,其异常高表达与肿瘤细胞增殖速度加快,凋亡受限相关[8-10];也有研究显示 Sirt3 是抑癌基因,目前 Sirt3 在肿瘤中的作用尚存在争议[11]。本研究旨在探索随着宫颈癌细胞中Sirt3的表达水平改变对细胞内脂质含量的影响,进一步揭示宫颈癌的发生与脂质代谢异常之间的联系,为宫颈癌发生提供理论依据。
1 材料与方法
1.1材料
1.1.1细胞系人子宫颈癌C33a和SiHa细胞株均购自上海细胞库。
1.1.2主要仪器 手动单道移液器(Axyge),酶标仪(Bio-Rad),PCR扩增仪(Thermo),蛋白转膜仪(Bio-Rad),Real Time PCR instrument(ABI),化学发光成像仪(上海勤祥公司 Chemiscope 3000)。
1.1.3主要试剂胎牛血清、DEME(高糖)、青霉素-链霉素双抗、0.25%胰酶均购自以色列Biological industries公司,Sirt3兔抗人单克隆抗体(美国Abcam公司),GADPH鼠抗人多克隆抗体(武汉奥博森公司),Maxima SYBR Green qPCR Master Mix(美国Thermo公司),BCA蛋白定量试剂盒(美国Thermo公司),Western blotting试剂盒(美国Thermo公司),Sirt3低表达慢病毒、SIRT3高表达慢病毒均购自上海吉凯基因公司。
1.2方法
1.2.1细胞中mRNA的提取及qRT-PCR技术检测取≥1×106的细胞,加入1mL Trizol,在室温下静置5~10min,随后加入200μL氯仿,室温静置2min,4℃,12 000 r/min,离心15min后取上清,加入等体积异丙醇,涡旋充分混匀,静置10min,4℃,12 000 r/min,离心10min后弃上清,向沉淀中加入1mL75%乙醇充分混匀,离心弃上清后保留沉淀,室温充分干燥后,用DEPC水溶解 RNA沉淀,随后检测RNA纯度和浓度。Sirt3 cDNA引物:正义链:5′-CGTCTCAAAACAAAACAAAAC-3′,反义链:5′-AAAATCCAAAGCCAAACTG-3′。GADPH cDNA引物:正义链:5′-GGACCTGACCTGCCGTCTAG-3′,反义链:5′-GTAGCCCAGGATGCCCTTGA-3′。将GADPH作为内参照,利用Maxima SYBR Green qPCR Master Mix试剂盒检测Sirt3基因的表达情况。反应的总体积为25μL,反应条件为:95℃预变性10min,95℃变性15s,60℃延长60 s,扩增共进行40 个循环。采用相对定量公式 2-△△ct计算SIRT3基因mRNA的相对表达量。本次试验数据重复3次实验所得。
1.2.2Western blotting法检测取≥1×106的细胞,加入 100μL RIPA裂解液,1μL PMSF,充分混匀。冰上裂解30min,4℃,12 000 r/min,离心15min,收集上清,BCA蛋白定量试剂盒测定细胞内总蛋白浓度。蛋白在Tris base凝胶上进行90min电泳分离后,在100 V稳压电压下电转至PVDF膜上,随后封闭液室温封闭30min,一抗孵育,4℃过夜(SIRT3的抗体稀释比为1∶500,GADPH抗体稀释比为1∶1000),二抗孵育30min后,采用AP法显色,使用化学发光仪进行拍照、蛋白灰度值扫描,与内参β-actin进行比较,计算出Sirt3蛋白的相对表达量。数据重复3次实验所得。
1.2.3Sirt3低表达慢病毒转染C33a细胞C33a 细胞生长至贴壁80%~90%时准备慢病毒转染,胰酶消化,接种于6孔板,孵育24h。实验选取siRNA的靶序列为 5′-GCTGTACCCTGGAAACTAC-3′。按照说明书进行转染,将Sirt3 低表达慢病毒、空载慢病毒、Enhance Infection、polybrene共同加入到不含抗生素的完全培养基的细胞中,12 h后将液体吸出,换成正常完全培养基继续培养,72 h后在荧光倒置显微镜下观察荧光表达,以正常生长的C33a细胞作为正常对照组,以空载慢病毒转染的C33a细胞为阴性对照组,以转染Sirt3低表达慢病毒的C33a细胞作为Sirt3低表达组,然后进行转染Sirt3 低表达病毒后的其他实验步骤。
1.2.4SIRT3高表达慢病毒转染SiHa细胞SiHa细胞生长至80%~90%贴壁时进行慢病毒转染,实验选用高表达的靶序列为5′-GATGGGCTTGAGAGAGTGTC-3′。取1×105个/孔的细胞在6孔板中培育24h后,按照说明书指导进行转染,将Sirt3高表达慢病毒、空载慢病毒、Enhance Infection、polybrene加到无抗生素培养基的细胞中,12 h后弃掉废液,换成含有抗生素的完全培养基并在CO2孵育箱中37℃培育72 h,在显微镜下观察荧光表达丰度。以正常生长的SiHa细胞作为正常对照组,以空载慢病毒转染的SiHa细胞为阴性对照组,以转染Sirt3高表达慢病毒的SiHa细胞作为Sirt3高表达组,然后进行Sirt3高表达慢病毒转染后的后续检测步骤。
1.2.5油红O染色检测细胞内脂肪合成情况取1×105个细胞,4%多聚甲醛固定细胞30min,随后每孔加入1mL油红O染色30min,迅速用PBS清洗2遍,60%异丙醇冲洗5s,10×显微镜下观察,拍照。本次实验重复3次。

2 结果
2.1宫颈癌SiHa和C33a细胞中Sirt3的mRNA及蛋白表达在宫颈癌SiHa、C33a 2种细胞中Sirt3 mRNA的相对表达量分别为(1.183±0.203 7)、(2.12±0.208 8)(图1)。蛋白表达水平分别为(0.097 32±0.035 93)、(1.030±0.202 3)(图2)。其中,SiHa细胞中Sirt3 mRNA、蛋白的表达均低于C33a细胞中的表达(P<0.05),故选用宫颈癌SiHa细胞转染Sirt3过表达慢病毒,宫颈癌C33a细胞转染Sirt3 低表达慢病毒。
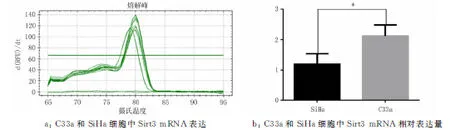
注:SiHa细胞比较,*P<0.05。
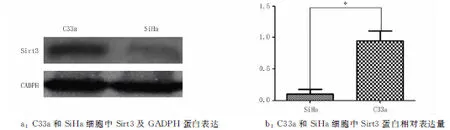
注:SiHa细胞比较,*P<0.05。
2.2宫颈癌SiHa和C33a细胞慢病毒转染Sirt3过表达慢病毒和转染Sirt3低表达慢病毒后蛋白水平的检测Western blotting结果显示,在SiHa细胞中,Sirt3 低表达蛋白的表达量为(0.773 4±0.182 2),明显低于阴性对照组(1.067 5±0.143 15)和正常对照组(1.223 7±0.250 05)(P<0.05),见图3。Sirt3高表达蛋白的表达量为(1.070 6±0.137 77),高于阴性对照组(0.311 5±0.103 53)和正常对照组(0.474±0.199 12)(P<0.05),见图4。
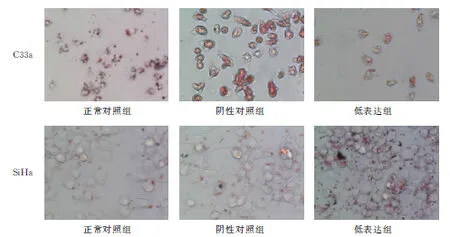
2.3Sirt3蛋白表达促进宫颈癌细胞脂质合成转染Sirt3 低表达组与阴性对照组和正常对照组相比,细胞内脂肪合成水平明显减少;转染Sirt3高表达组与阴性对照组和正常对照组相比,细胞内脂肪合成水平明显增加(图5)。

注:与正常对照组比较,*P<0.05;与阴性对照组比较,△P<0.05。
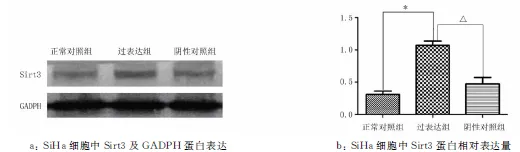
注:与正常对照组比较,*P<0.05;与阴性对照组比较,△P<0.05。
3 讨论
快速增殖是恶性肿瘤细胞的重要特征,为了满足其增殖需要需要消耗大量的原料和能量来调整自身能量短缺状态,因此肿瘤细胞的能量代谢方式可能会发生一系列的变化[12]。脂质代谢的异常为恶性肿瘤细胞的侵袭转移、免疫逃避和抵制细胞凋亡提供了微环境[13]。主要表现为脂肪酸的从头合成明显增加,同时当肿瘤细胞缺乏葡萄糖时,通过增强脂肪酸β-氧化来满足细胞对能量的需求。研究证实,脂质代谢紊乱可以提高食管癌、乳腺癌等肿瘤患癌的风险。其中,前列腺癌细胞通过增强脂肪酸氧化维持自身的生物合成[14];研究者在高脂食物喂养的p48-Kras小鼠模型中,增强脂肪酸氧化关键调控因子乙酰辅酶A羧化酶(acetyl-CoA carboxylation,ACC)和肉碱酯酰转移酶1(Carnitine palmitoyltransferase,CPT-1)的表达,从而加强了脂肪酸β-氧化能力,最终促进肿瘤的生长[15]。Sirt3在多种实体肿瘤如肝癌和乳腺癌中表达上调,并通过增加脂肪酸的合成促进肿瘤的生长。
目前已知有3条细胞凋亡信号通路:线粒体通路、死亡受体通路和内质网通路,其中线粒体通路是凋亡的最主要途径[16]。线粒体是体内多种生物合成代谢的主要场所,而Sirt3是线粒体上的一种脱乙酰化酶,参与多种线粒体代谢,包括:脂肪酸氧化、氧化磷酸化、三羧酸(TCA)循环。但SIRT3在不同肿瘤组织表达及作用存在争议,在一些肿瘤组织中表达上调,如口腔鳞癌、膀胱癌和乳腺癌[8]等,抑制其表达后,促进细胞的生长和增殖作用。但是也有研究报道,如肝癌和胃癌[17-18]等中表达下调,抑制其增殖和凋亡。
本研究中,通过对人宫颈癌SiHa和C33a 2株细胞分别转染Sirt3高表达和SIRT3 高表达慢病毒,来检测细胞内脂质含量的改变情况。结果表明,随着SIRT3水平的增加,细胞内脂质水平也相应增加,提示Sirt3可能通过促进脂肪酸合成影响宫颈癌的发生发展。在宫颈癌脂质代谢的相关研究中,发现芹菜素刺激细胞后,与阴性对照组细胞比较,宫颈癌SiHa、C33a、HeLa和Caski细胞中的脂质氧化水平增加,进而促进宫颈癌细胞的侵袭和转移[19];与淋巴结转移相关的lncRNA(LNMICC)通过加强脂肪酸代谢,促进宫颈癌的淋巴结转移[20]。但还未有研究探讨Sirt3对宫颈癌的侵袭、转移的影响,在其他一些研究中发现,Sirt3通过不同的作用机制调控肿瘤侵袭和转移,在乳腺癌细胞系中通过Sirt/FOXO/SOD2轴调控细胞的侵袭和迁移[21]。在前列腺癌细胞系中通过PI3K/Akt信号通路调控细胞的侵袭和迁移[22]。AP-1可以结合Sirt3增强子区域,通过诱导AP-1表达从而激活Sirt3的转录,促进癌细胞的侵袭和迁移[23]。
肿瘤细胞不同程度地利用代谢性信号传导分子及转录因子微调脂肪合成和脂肪分解以满足快速增殖的肿瘤细胞对脂质的需求。因此,研究肿瘤细胞脂肪酸代谢重编程在肿瘤复发转移中的作用,对揭示肿瘤发生、复发及转移的分子机制具有重要作用。本课题组后期将进一步分析Sirt3对脂肪酸合成通路关健酶ACC和脂肪酸β-氧化的关键酶CPT-1调控分子机制进行深入研究,力求为揭示Sirt3对宫颈癌脂质代谢重编程的作用机制,及其对宫颈癌发生、复发及转移中的作用。
[收稿日期:2018-02-27]
(本文编辑杨晨晨)

