球霰石碳酸钙微球的合成及其机理
,(,, )
1 前 言
碳酸钙是自然界中广泛存在的一种无机矿物原材料,同时也是一种重要的化工填料,在涂料、橡胶、 造纸等领域具有广泛的应用前景[1]。碳酸钙有三种晶型:方解石、文石和球霰石,其中方解石是热力学最稳定的晶型,其次是文石,而球霰石是最不稳定的晶型,极易转化为热力学稳定的方解石或文石[2]。当向反应体系中加入某种晶型控制剂时,能得到高文石相的针状碳酸钙和单一方解石相立方形貌的纳米碳酸钙[3-4]。而与上述两种晶型的碳酸钙相比,球霰石碳酸钙具有独特的球形形貌、单分散性好、较高的孔隙率和大的比表面积等优点,已受到国内外研究者的广泛关注[5-6]。然而,由于球霰石碳酸钙的热力学不稳定性使其在自然界中很是少见,有研究表明,特殊的添加剂或反应条件能稳定球霰石碳酸钙,并延缓其转化[7-8]。
目前,仿生矿化是制备球霰石碳酸钙的有效途径之一,通过添加各种有机添加剂对碳酸钙晶型、形貌、尺寸等结构进行调控,从而制备出有机-无机复合材料[9]。Yuming Gao等[10]以不同氨基酸为添加剂,成功制备了不同形貌的球霰石碳酸钙。G. W. Yan等[11]以三嵌段共聚物F127和阴离子表面活性剂SDS为添加剂,制备出不同形貌结构的球霰石碳酸钙,但所得球霰石的含量较低。Qiang Shen等[12]以PVP和SDS为添加剂,合成出具有球霰石和方解石混合晶型的碳酸钙微球,并探讨了碳酸钙微球在PAA-SDS体系中的粒子结晶和聚集行为,然而制备的碳酸钙球霰石含量偏低,并且比表面积也小。
本文采用复分解法,以PAA和SDBS为有机添加剂,成功制备出粒径分布均匀、单分散性好、比表面积大、高球霰石含量的碳酸钙微球。然后,研究了PAA和SDBS浓度对碳酸钙微球形貌和晶型的影响,在此基础上探讨了球霰石碳酸钙微球的形成机理。
2 实 验
2.1 实验材料
无水碳酸钠(Na2CO3)、无水氯化钙(CaCl2)、聚丙烯酸(Mn=5000)、十二烷基苯磺酸钠、无水乙醇(C2H5OH),以上试剂均为分析纯;去离子水:实验室自制。
2.2 实验过程
2.2.1样品制备 预先准确制备0.1mol/L 的Na2CO3溶液、0.1mol/L的CaCl2溶液和一定浓度的PAA溶液。取出两份PAA(25mL)溶液,分别加入Na2CO3溶液(100mL)和CaCl2溶液(100mL)中,低速搅拌0.5 h。将一定浓度的SDBS溶液加入装有Na2CO3和PAA的混合溶液的三口烧瓶中,然后调转速为200r/min,将CaCl2和PAA混合溶液快速倒入此三口烧瓶中,在60℃、转速为200r/min的条件下,保持反应1h。所得的CaCO3产物经过滤,用去离子水和无水乙醇各洗涤3次后,放入80℃的真空干燥箱干燥24h后,所得的白色粉末即为球霰石碳酸钙微球。
2.2.2样品表征 采用S-2400型扫描电子显微镜(SEM)观察样品的形貌与结构;采用D/Max2500型转靶X射线多晶衍射仪(XRD)对样品进行物相分析,扫描范围在10°~80°;采用Nicolet 6700型傅里叶红外光谱仪(FT-IR)对样品进行官能团分析,以KBr压片,检测样品在500~4000cm-1范围的产物官能团结构;采用NETZSCH STA449F3型热重-差示扫描量热仪(TG-DSC),在空气气氛中,升温速率10℃/min,温度范围20~1000℃,分析产物的热稳定性及其表面吸附的有机物。
3 结果与讨论
3.1 样品表征
3.1.1样品形貌分析 当反应温度为60℃、PAA浓度为1.0g/L、SDBS浓度为2.5mmol/L时,所得球霰石碳酸钙微球的形貌如图1所示。从图1(a)可以看出,所得的碳酸钙微球均为球形,且大小分布均匀,表面光滑,图1(b)是放大的SEM图,从中观察到其粒径范围大约在5~8μm之间。
3.1.2样品物相分析 碳酸钙微球的XRD谱图如图2所示。由图可见,衍射角2θ=24.90°主要对应于球霰石的(110)晶面,衍射角2θ=29.40°主要对应于方解石的(104)晶面,除了球霰石和方解石的衍射峰,其他杂质衍射峰的强度可忽略,这表明产品纯度较高;而图中各衍射峰尖锐,表明样品的结晶性良好。通过以下公式[13]可以计算出样品中球霰石和方解石晶型的含量:

图1 球霰石碳酸钙微球的SEM照片Fig.1 SEM micrographs of vaterite calcium carbonate microspheres
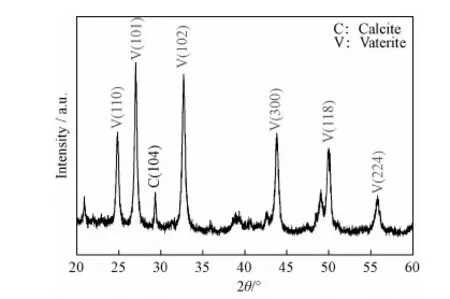
图2 球霰石碳酸钙微球的XRD谱图Fig.2 XRD pattern of vaterite calcium carbonate microspheres
(1)
XC=1-XV
(2)

3.2 PAA浓度对碳酸钙结晶和聚集行为的影响
在沉淀反应体系中,不同的PAA浓度会诱导形成不同结构和形貌的碳酸钙,图3是不同PAA浓度条件下所得碳酸钙的SEM图像。由图可见,当不添加PAA时,所得样品为不规则形貌的碳酸钙微球,而后随着PAA用量的增加,所得的碳酸钙形貌由不规则的球状逐渐变为粒径均匀的微球,且在1.0g/L时形成良好的碳酸钙微球,当PAA浓度过高时,所形成的微球会有少量裂痕出现。图4是不同PAA浓度下所得产物的XRD图谱,从中可以看出,若不添加PAA,样品主要是由方解石晶型组成,在反应中加入适量PAA后,球霰石晶型的碳酸钙成为主要成分,然而PAA浓度对球霰石碳酸钙含量的影响不大。表1是不同PAA浓度下碳酸钙产物的晶型特征,从中可知,当PAA浓度大于0.5g/L时,球霰石碳酸钙已占主要部分,结合SEM图可以看出,当PAA浓度为1.0g/L时,能得到粒径均匀、高球霰石含量的碳酸钙微球。

图3 不同PAA浓度所得碳酸钙的SEM图像(a.0g/L; b.0.5g/L; c.1.0g/L; d.2.0g/L) Fig.3 SEM images of calcium carbonate with different concentrations of PAA (a.0g/L; b.0.5g/L; c.1.0g/L; d.2.0g/L)

表1 不同PAA浓度所得碳酸钙产物的晶型特征Table 1 Polymorph properties of CaCO3 at various concentration of PAA

图4 不同PAA浓度所得碳酸钙微球的XRD图谱Fig.4 XRD patterns of the obtained CaCO3 with different PAA concentrations sample a: 0g/L; sample b: 0.5g/L; sample c: 1.0g/L; sample d: 2.0g/L
3.3 SDBS浓度对碳酸钙结晶和聚集行为的影响
在反应体系中,由于不同SDBS浓度在溶液中的存在方式不同,从而影响碳酸钙最终的形貌与晶型。图5为不同实验条件下制得的SEM图像,随着SDBS浓度的增加,碳酸钙形貌由花簇状逐渐变为不规则立方状,然后生成单分散性好的球状,但当SDBS的浓度过高时,却得到团聚严重的类球状。XRD图谱(图6)则表明当SDBS的浓度为0~1.0moml/L之间时,样品主要是由方解石碳酸钙组成;而后随着SDBS浓度增加,球霰石含量逐渐增加,当SDBS浓度超过2.5moml/L后,样品中绝大部分是球霰石碳酸钙,方解石碳酸钙只占极小一部分。图7中FT-IR分析也表明了样品晶型随SDBS浓度的变化。由图7可知,712cm-1处是方解石的特征吸收峰,745cm-1、1084cm-1处是球霰石的特征吸收峰[14],随着SDBS浓度的增加,712cm-1处方解石的特征吸收峰逐渐消失,745cm-1、1084cm-1处球霰石的特征吸收峰逐渐增强,当其浓度超过2.5moml/L时,712cm-1处方解石的特征吸收峰几乎消失,表明样品绝大部分由球霰石碳酸钙组成,这与XRD分析结果相一致。表2是不同SDBS浓度下碳酸钙产物的晶型特征,由表2可知,SDBS的浓度对于碳酸钙微球的形貌和晶型有很大影响,当SDBS浓度为2.5moml/L时,能得到粒径分布均匀、高球霰石含量的碳酸钙微球。

图5 不同SDBS浓度所得碳酸钙的SEM图像(a.0mmol/L; b.1.0mmol/L; c.2.5mmol/L; d.4.0mmol/L)Fig.5 SEM images of calcium carbonate with different concentration of SDBS(a.0mmol/L; b.1.0mmol/L; c.2.5mmol/L; d.4.0mmol/L)

表2 不同SDBS浓度下碳酸钙产物的晶型特征Table 2 Polymorph properties of CaCO3 at various concentrations of SDBS
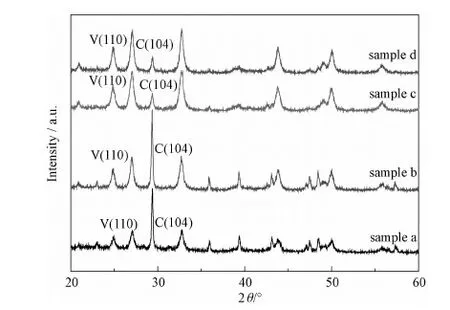
图6 不同SDBS浓度所得碳酸钙微球的XRD图谱Fig.6 XRD patterns of the obtained CaCO3 with different SDBS concentrations sample a: 0mmol/L; sample b: 1.0mmol/L; sample c: 2.5mmol/L; sample d: 4.0mmol/L

图7 不同SDBS浓度所得碳酸钙微球的FT-IR图谱Fig.7 FT-IR spectra of the obtained CaCO3 with different SDBS concentrations sample a: 0mmol/L; sample b: 1.0mmol/L; sample c: 2.5mmol/L; sample d: 4.0mmol/L
3.4 球霰石碳酸钙微球的形成机理
从上述实验结果可知,若单独加入PAA或者SDBS时,所得产物主要为方解石碳酸钙,得不到球霰石碳酸钙微球。只有加入适量的PAA和SDBS浓度,才能制备出粒径分布均匀、高球霰石含量的碳酸钙微球。


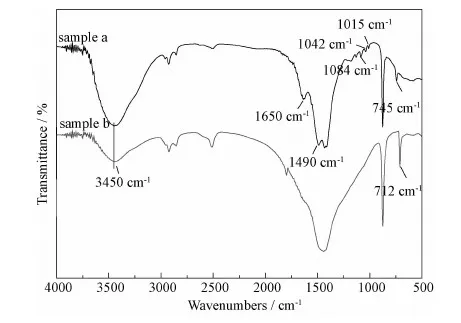
图8 添加PAA和SDBS(sample a)以及不添加PAA和SDBS(sample b)所得碳酸钙的FT-IR图谱Fig.8 FT-IR spectra of the obtained samples in the presence (sample a) and absence (sample b) of PAA and SDBS

图9 添加PAA和SDBS(sample a)以及不添加PAA和SDBS(sample b)所得碳酸钙的XRD图谱Fig.9 XRD patterns of the obtained samples in the presence (sample a) and absence (sample b) of PAA and SDBS
由于亚稳态的球霰石晶型先由无定形碳酸钙前驱体形成,然后再逐渐转化为热力学更稳定的文石或方解石晶型,而PAA-SDBS复合物在球霰石结晶过程中至关重要,它吸附在特定的晶面上降低了晶体表面能或是增加了晶型转化活化能。图10中的TG-DSC曲线分析了这种球形模板的表面吸附行为。从图10(a)的TG曲线中可以看出有三个失重阶段。第一失重阶段发生在50℃~420℃,失重量为3.6%,这主要是样品中PAA的分解与燃烧;第二失重阶段5.0%的失重量发生在420~650℃,这主要是SDBS的分解与燃烧;第三失重阶段发生在650~810℃,主要是碳酸钙的热分解,对应于DSC曲线上802℃的吸热峰。此外,在DSC曲线上还有两个弱峰,在100℃附近的吸热峰是水的蒸发吸热,在403℃的放热峰则是球霰石向方解石的转相放热。相反地,图10(b)是没有添加PAA和SDBS的TG-DSC曲线,在50~650℃范围内1.1%的失重仅仅是水份的蒸发。同时,在403℃附近,DSC曲线上没有放热峰,说明这种条件下得到的碳酸钙没有发生晶型转化,仍然是方解石,这与上述FT-IR、XRD分析相吻合,表明得到的球霰石碳酸钙是以PAA-SDBS复合物为模板的有机-无机复合材料。

图10 (a)添加PAA和SDBS所得碳酸钙的TG-DSC曲线;(b)不加PAA和SDBS所得碳酸钙的TG-DSC曲线Fig.10 (a)TG-DSC curves of precipitated CaCO3 in the presence of PAA and SDBS; (b) TG-DSC curves of precipitated CaCO3 in the absence of PAA and SDBS
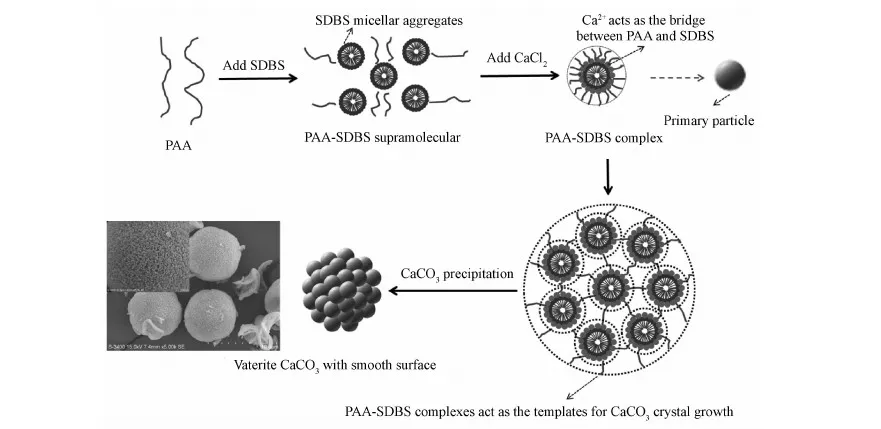
图11 球霰石碳酸钙结晶过程机理示意图Fig.11 Schematic model of the formation mechanism of vaterite CaCO3
图11是球霰石碳酸钙微球的结晶机理示意图。整个结晶过程可以分为以下三个阶段。第一阶段,SDBS与PAA在溶液中通过疏水作用(吸引力)形成PAA-SDBS超分子结构。第二阶段,钙离子作为连接PAA和SDBS的桥梁,使其形成PAA-SDBS复合物,为碳酸钙粒子的结晶生长提供了球形模板,这种球形模板能够降低形成球霰石碳酸钙所需的表面能,从而稳定球霰石碳酸钙,并阻止其向热力学稳定的方解石型转化。第三阶段,稳定存在的球霰石相纳米颗粒在生长过程中通过PAA分子链的相互链接作用,聚集形成一个5~8μm的球形球霰石碳酸钙微球。
4 结 论
1.以碳酸钠和氯化钙为原料,以PAA和SDBS为添加剂,成功合成单分散性良好、粒径分布窄、高球霰石含量的碳酸钙微球。
2.在反应过程中PAA、SDBS与Ca2+相互作用方式的不同影响了碳酸钙的聚集行为和晶型形貌,在此基础上提出了一种球霰石碳酸钙微球的形成机理,并对其进行了详细的探讨。
3.研究发现,PAA和SDBS的浓度对碳酸钙的形貌结构有重要影响,过高或过低的PAA和SDBS浓度都不利于球霰石碳酸钙微球的形成。实验结果表明:球霰石碳酸钙微球的最佳合成工艺条件为反应温度T=60℃,PAA浓度为1.0g/L,SDBS浓度为2.5mmol/L,反应时间为1 h。
[1] Kim S, Park C B. Dopamine-Induced Mineralization of Calcium Carbonate Vaterite Microspheres[J]. Langmuir, 2010, 26(18): 14730~14736.
[2] Zhenxuan Zhao, Lei Zhang, Hongxing Dai, et al. Surfactant-assisted Solvo-or Hydrothermal Fabrication and Characterization of High-surface-area porous Calcium Carbonate with Multiple Morphologies[J]. Microporous & Mesoporous Materials, 2011, 138(138): 191~199.
[3] 马俊,刘华彦,梁锦,陈银飞. 两种重要形貌的碳酸钙的可控合成及生长机理探讨[J]. 材料科学与工程学报, 2011, 29(2): 227~232.
[4] 成居正,陈雪梅,邓捷. NaHCO3对纳米碳酸钙粉末形貌的修饰作用[J]. 材料科学与工程学报, 2013, 31(3): 404~408.
[5] Gopal K, Lu Z, Villiers MM D, Lvov Y. Composite Phospholipid-calcium Carbonate Microparticles: Influence of Anionic Phospholipids on the Crystallization of Calcium Carbonate[J]. Journal of Physical Chemistry B, 2006, 110(6): 2471~2474.
[6] Song R Q, Cölfen H, Xu A W, et al. Polyelectrolyte-directed Nanoparticle Aggregation: Systematic Morphogenesis of Calcium Carbonate by Nonclassical Crystallization[J]. ACS Nano, 2009, 3(3): 1966~1978.
[7] Udrea I, Capat C, Olaru E A, et al. Vaterite Synthesis Via Gas-liquid Route under Controlled pH Conditions[J]. Ind.Eng.Chem.Res, 2012, 51(24): 8185~8193.
[8] Yue L, Zheng Y, Jin D. Spherical Porous Framework of Calcium Carbonate Prepared in the Presence of Precursor PS-PAA as Template[J]. Microporous & Mesoporous Materials, 2008, 113(1): 538~541.
[9] Lai Y, Chen L, Bao W, et al. Glycine-mediated, Selective Preparation of Monodisperse Spherical Vaterite Calcium Carbonate in Various Reaction Systems[J]. Crystal Growth & Design, 2015, 15(3): 1194~1200.
[10] Guo Y, Wang F, Zhang J, et al. Biomimetic Synthesis of Calcium Carbonate with Different Morphologies under the Direction of Different Amino Acids[J]. Research on Chemical Intermediates, 2012, 39(6): 2407~2415.
[11] Yan G W, Huang J H, Zhang J F, Qian C J. Aggregation of hollow CaCO3Spheres by Calcite nanoflakes[J]. Materials Research Bulletin, 2008, 43(8~9): 2069~2077.
[12] Shen Q, Wei H, Wang L, et al. Crystallization and Aggregation Behaviors of Calcium Carbonate in the Presence of Poly(vinylpyrrolidone) and Sodium Dodecyl Sulfate[J]. Journal of Physical Chemistry B, 2005, 109(39): 18342~18347.
[13] Chen J, Xiang L. Controllable Synthesis of Calcium Carbonate Polymorphs at Different Temperatures [J]. Powder Technology, 2009, 189(1): 64~69.
[14] Vagenas N V, Gatsouli A, Kontoyannis C G. Quantitative Analysis of Synthetic Calcium Carbonate Polymorphs using FT-IR Spectroscopy[J]. Talanta, 2003, 59(4): 831~836.
[15] Nudelman F, Sonmezler E, Bomans P H, et al. Stabilization of Amorphous Calcium Carbonate by Controlling its Particle Size[J]. Nanoscale, 2010, 2(2): 2436~2439.
[16] Michel F M, Macdonald J, Feng J, et al. Structural Characteristics of Synthetic Amorphous Calcium Carbonate[J]. Chemistry of Materials, 2008, 20(14): 4720~4728.
[17] Raiteri P, Gale J D. Water is the Key to Nonclassical Nucleation of Amorphous Calcium Carbonate[J]. Journal of the American Chemical Society, 2010, 132(49): 17623~34.
[18] 王琼,王栋,卜芳.SDBS胶束体系热力学性质的研究[J]. 环境科学与技术, 2009, 32(9): 77~80.
[19] 王新红,戴兢陶,顾云兰. SDS和SDBS在N,N-二甲基甲酰胺中的临界胶束浓度测定及热力学分析[J]. 实验技术与管理,2011, 28(3): 39~41.
[20] Wei H, Shen Q, Zhao Y, et al. Effect of Anionic Surfactant-polymer Complexes on the Crystallization of Calcium Carbonate [J]. Journal of Crystal Growth, 2004, 264(1~3): 424~429.

