不同种类可同化氮素对黄酒酵母产高级醇能力的影响
李智慧,金建顺,唐雅凤,刘双平,3,周志磊,毛 健,4,*
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏无锡 214122; 2.会稽山绍兴酒股份有限公司,浙江绍兴 312000; 3.江苏省产业技术研究院食品生物技术研究所(如皋江大食品生物 技术研究所有限公司),江苏南通 226500; 4.江南大学(如皋)食品生物技术研究所,江苏如皋 226500)
高级醇又称作杂醇油,是黄酒酿造中不可避免的副产物。高级醇以异丙醇、异丁醇、正戊醇、异戊醇、β-苯乙醇为主[1]。高级醇是构成黄酒风味的主要成分,适量的高级醇可使酒体丰满圆润、口感柔和协调;黄酒中高级醇含量过高,除饮用时会觉有异杂味外,还会产生较强的致醉性[2]。
可同化氮素是指在酒精发酵中酵母优先利用的氮素,包括无机氮(铵态氮等)、有机氮(游离α-氨基酸和小分子多肽等)[3]。可同化氮素与高级醇的形成密切相关,在发酵液中添加可同化氮素会对发酵产物中高级醇的最终形成产生很大的影响[4]。苑振宇等[5]研究表明随着不断增加碳酸氢铵的添加量,高级醇生成量逐步减少。HERNáNNDEZ-ORTE P等[6]结果表明,高级醇的含量随着硫酸铵的添加降低,发酵前向合成培养基中添加硫酸铵,高级醇含量降低的效果更加明显。Manuel M Losada等[7]表明可同化氮素的添加对高级醇、乳酸乙酯有重要影响。徐姗娜等[8]研究结果表明,随着增大蜂蜜酒培养基中氮素浓度,蜂蜜酒中高级醇的含量都增大。相对于添加无机氮素的蜂蜜酒,添加有机氮素的蜂蜜酒高级醇的含量更高。R N Greenshields[9]研究表明白酒酿造中,通过向发酵醪或培养基中添加氮素,高级醇(主要指异丁醇和异戊醇)明显受到抑制,最大降低率达50%~70%。汪江波等[10]发现调整适宜的麦汁α-氨基氮是降低高级醇的重要工艺措施。甄会英等[11]研究了葡萄汁中添加亮氨酸对高级醇生成量影响最为显著,甘氨酸对高级醇生成量基本无影响。Diego Torrea等[12]研究氮素添加结果表明,无机氮素相对于有机氮素降低高级醇更有优势。Rubén Martínez-Moreno等[13]研究表明氮素种类的添加时间影响杂油醇的生成。Espinosa Vidal E等[14]研究表明氮素营养充足时,高级醇的生成主要是Ehrlich途径,而氮素营养缺乏时,高级醇的生成主要是Harris途径。T Clement等[15]根据氮素和高级醇之间的关系,通过调节氮素来调控高级醇的含量。
目前国内外研究可同化氮素添加主要集中在葡萄酒中高级醇,而不同种类可同化氮素之间,不同酒类之间研究较少,而国内外关于可同化氮素的添加对黄酒高级醇的研究也相对较少。本文通过在发酵体系中添加不同可同化氮素,对两种酿酒厂酵酒酵母进行发酵过程中生物量、乙醇以及高级醇的含量检测,探讨不同可同化氮素对不同种类黄酒酵母的产高级醇能力的影响,以期为降低黄酒中高级醇含量提供新思路,提高黄酒品质。
1 材料与方法
1.1 材料与仪器
酿酒酵母RWBL Y1739 LZH 上海某酿酒厂提供;酿酒酵母RWBL Y1615 ZC 浙江某酿酒厂提供;粳米 无锡米市;麦曲 上海某酿酒公司提供;胰蛋白胨;牛肉膏;酵母膏;葡萄糖;硫酸;无水乙醇;异丙醇;异丁醇;正戊醇;异戊醇;β-苯乙醇;2-辛醇;铵态氮(磷酸氢二铵;碳酸氢铵;硫酸铵;氯化铵;尿素);氨基氮(缬氨酸;亮氨酸;苯丙氨酸;精氨酸;谷氨酸) 国药集团化学试剂有限公司。
RJ-LDL-50G低速大容量多管离心机 无锡瑞江分析仪器有限公司;Waters e2695HPLC 沃特世科技(上海)有限公司;GC-MS 赛默飞世尔科技有限公司;SHP-250隔水式恒温培养箱 上海双旭电子有限公司;7230G可见分光光度计 上海精密仪器仪表有限公司;SW-CJ-1C超净台 上海双旭电子有限公司;EL3002电子天平 瑞徽电子有限公司;立式压YXQ-LS力蒸汽灭菌锅 上海屹利科学仪器有限公司。
1.2 实验方法
1.2.1 实验培养基 平板培养基(YEPD):葡萄糖20 g/L,蛋白胨20 g/L,酵母膏10 g/L,琼脂20 g/L,pH自然,115 ℃灭菌20 min。种子培养基(YPD):葡萄糖20 g/L,蛋白胨20 g/L,酵母膏10 g/L,pH自然,115 ℃灭菌20 min。酿酒原料糖液:取100 g蒸熟米饭,加入400 g水和液化酶(酶活35000 CU/mL)200 μL、糖化酶(酶活500 AGU/mL)100 μL和生麦曲10 g,60 ℃水浴4 h。过滤取上清液,调节糖度为14 °Bx,进行分装,在115 ℃杀菌20 min,作为发酵模拟液。
1.2.2 种子活化及培养 在超净台中将酿酒酵母菌种接种于YEPD培养基,30 ℃培养24 h;用接种环取YEPD上的单个菌落一环,接种于YPD培养基中培养,30 ℃培养24 h,200 r/min;待用。
1.2.3 可同化氮素的添加 各称取200 mgN/L磷酸氢二铵、碳酸氢铵、硫酸铵、氯化铵、尿素、L-苯丙氨酸、缬氨酸、亮氨酸、精氨酸、谷氨酸进行氮素添加实验,对照组不添加可同化氮素,随同YPD中培养好酵母菌(5%)一同加入酿酒原料糖液中,在28 ℃条件下培养5 d,15 ℃条件下培养5 d。
1.2.4 酵母生长OD值的测定 取发酵过程中的不同氮源添加组,发酵时间为0、6、12、24、36、48、60、72、96 h的发酵液,适当稀释于比色皿中,在600 nm波长条件下使用可见分光光度计进行检测,测定其OD值,并根据测定结果,绘制生长曲线。
1.2.5 发酵结束时乙醇含量的测定 发酵结束时,取不同氮素添加组发酵液进行5000 r/min离心5 min,离心后取上清液并经0.45 μm的水系滤膜过滤,放置于样品瓶中。采用HPLC进行乙醇含量的测定,检测方法参照文献[15],并略有改动。HPLC检测条件:2414示差检测器,色谱柱型号SH1011,柱温50 ℃,流速1 mL/min,流动相0.01 mol/L的硫酸水溶液,进样量10 μL。
1.2.6 发酵结束时高级醇含量测定 样品的预处理参照文献[16],并略有改动。将黄酒酒精度稀释至6% vol,取6 mL稀释后黄酒液,加到20 mL顶空瓶中,加2.5 g NaCl,30 μL内标(210 mg/L 2-辛醇)。使用50 μm PDMS萃取头(使用前250 ℃老化30 min),50 ℃下吸附45 min,250 ℃解吸8 min,用于GC-MS测定。GC条件:色谱柱:TG-WAXMS(30 m×0.25 μm×0.25 mm)。进样口温度:250 ℃。程序升温:40 ℃保持3 min;6 ℃/min升温至100 ℃;10 ℃/min升温至230 ℃,保持7 min。载气:高纯氦气(>99.999%),不分流,流速为1.0 mL/min。
1.3 数据处理及分析
显著性分析采用SPSS Statistics 22.0软件进行数据处理和分析,方差显著性在p<0.05水平上进行ANOVA检验,结果以均值±标准差形式表示;其他数据采用Excel 2013、Origin 9.0处理。
2 结果与分析
2.1 不同种类可同化氮素对酵母生长的影响
可同化氮素是黄酒发酵中酵母所需的重要营养物质之一,可同化氮素含量低不仅导致酵母菌数量低,还增加发酵延缓和中止的危险性。不同可同化氮素添加条件下的酵母生长情况如图1、图2所示。

图1 不同种类氮素条件下RWBL Y1739 LZH生长变化Fig.1 Growth changes of RWBL Y1739 LZH under different nitrogen conditions

图2 不同种类氮素条件下RWBL Y1615 ZC生长变化Fig.2 Growth changes of RWBL Y1615 ZC under different nitrogen conditions
从整体结果来看,在发酵过程添加不同的可同化氮素,酵母的生长有着相同的生长趋势,但是酵母RWBL Y1615 ZC比RWBL Y1739 LZH具有更好的涨势,这取决于酵母自身的发酵特性。而对于RWBL Y1739 LZH,在磷酸氢二铵、碳酸氢铵、尿素条件下,酵母表现出更好的生长趋势,其余组别无明显差距。对于RWBL Y1615 ZC,除硫酸铵、氯化铵外,其余组别无明显差距。分析原因可能是由于不同酿酒酵母对可同化氮素的嗜好性不同,优先利用的氮素更有利于酵母的生长。
2.2 不同种类可同化氮素对乙醇含量的影响
可同化氮素的添加,对发酵体系中酿酒酵母产乙醇的含量有着重要影响。不同种类可同化氮素条件下的发酵液中的乙醇含量如图3、图4所示。

图3 不同种类氮素条件下RWBL Y1739 LZH乙醇含量Fig.3 Content of RWBL Y1739 LZH in different nitrogen conditions注:图中不同字母之间表示差异显著(p<0.05), 相同字母之间表示差异不显著(p>0.05),图4同。

图4 不同种类氮素条件下RWBL Y1615 ZC乙醇含量Fig.4 Content of RWBL Y1615 ZC in different nitrogen conditions
由实验结果可知,不同可同化氮素条件下酒精的产生存在着较大的差异。首先,对于两种酿酒酵母,RWBL Y1739 LZH的乙醇产量要优于RWBL Y1615 ZC,适用于整个实验组。其次,就RWBL Y1739 LZH发酵实验结果(图3)来看,随着可同化氮素的添加,乙醇含量均呈现增加趋势,除碳酸氢铵、缬氨酸、精氨酸外,均与对照组显著差异(p<0.05);在磷酸氢二铵和尿素条件下,发酵结束乙醇生成量占优,远高于对照组,与吕欣等[17]发现与尿素相比硫酸铵是较好的无机氮源,发酵终了酒精浓度最高,结论相符。而杨士春[18]研究了尿素对酒精发酵的影响,发现其对酵母菌发酵生成酒精最佳添加浓度为9.6 g/L。但是RWBL Y1615 ZC组内表现趋势与RWBL Y1739 LZH存在差异,图4中添加硫酸铵和尿素后乙醇呈现减少趋势,与对照组存在显著差异(p<0.05),这与RWBL Y1739 LZH的乙醇变化呈现相反的结果,此外就添加可同化氮素而言,RWBL Y1615 ZC乙醇含量并没有起到提升的作用。分析其原因,可能是酵母RWBL Y1615 ZC的氮源利用嗜好性不同于RWBL Y1739 LZH。且硫酸铵与尿素的添加量抑制了乙醇的代谢,这说明酵母的生长需要适当的氮素浓度,且不同酵母利用氮素的优先顺序不同,针对特定酵母菌添加优先利用的氮素,更有利于乙醇的产生。
2.3 不同种类可同化氮素对高级醇含量的影响
2.3.1 高级醇标准曲线 通过GC-MS测定结果表明,在实验条件下异丙醇、异丁醇、正戊醇、异戊醇、β-苯乙醇都呈现出较好的线性关系(表1)。发酵液中高级醇在色谱图中呈现出较好的峰型(图5)。

表1 不同高级醇标准曲线Table 1 Standard curves of different higher alcohol
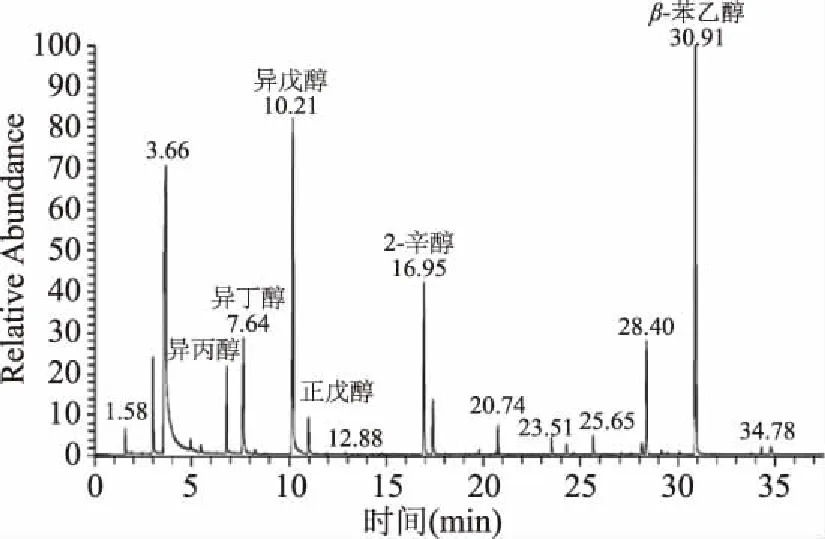
图5 发酵液中高级醇GC-MS分析色谱图Fig.5 GC-MS analysis chromatogram in fermentation liquid of higher alcohols
2.3.2 发酵液中不同种类高级醇含量变化 不同种类的可同化氮素是影响高级醇产量的重要因素,不同种类高级醇之间的含量变化如图6、图7所示。

图6 不同种类氮素条件下RWBL Y1739 LZH各高级醇含量Fig.6 Higher alcohols content of RWBL Y1739 LZH under different nitrogen conditions
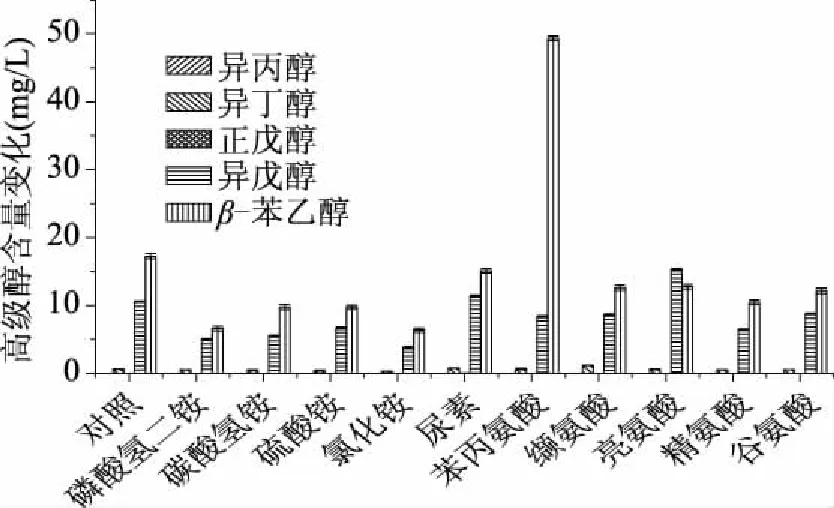
图7 不同种类氮素条件下RWBL Y1615 ZC各高级醇含量Fig.7 Higher alcohols content of RWBL Y1615 ZC under different nitrogen conditions
由图6、图7实验结果可知,不同酿酒酵母产高级醇组成基本相同,对于RWBL Y1739 LZH和RWBL Y1615 ZC产异丁醇、异戊醇、β-苯乙醇含量占据了高级醇的大部分,但是不同酵母发酵产生的高级醇含量存在着明显的差异,RWBL Y1739 LZH产异戊醇高于β-苯乙醇的含量,而RWBL Y1615 ZC 产β-苯乙醇的含量高于异戊醇的含量,原因可能是RWBL Y1615 ZC的β-苯乙醇代谢途径要强于RWBL Y1739 LZH的β-苯乙醇的代谢途径,同样异戊醇的代谢途径也存在着相同的关系,与陈双等[19]研究不同地区的酵母产β-苯乙醇具有类似的结果。添加氮素后异丙醇的产生有很大的变化,RWBL Y1739 LZH产异丙醇含量对照组(0.06 mg/L),铵盐组(0.11~0.18 mg/L)和氨基酸组(0.06~0.08 mg/L)。而RWBL Y1615 ZC异丙醇和异戊醇并无明显变化,这与GARDE-CERDáN T等[20]通过向氮素缺陷性菌株中添加铵盐和不同含量的氨基酸,结果发现氨基酸的添加对高级醇含量的影响不显著的结果一致。
由实验结果可知,可同化铵盐类的添加均有利于高级醇的降低,而氨基酸类的氮素添加却表现出不同的结果,其中L-苯丙氨酸、缬氨酸、亮氨酸的添加分别使得β-苯乙醇、异丁醇、异戊醇增高,这与韩涛等[21]研究亮氨酸对高级醇生成的影响最为显著,缬氨酸次之,甘氨酸的影响最小等结果类似。与HERNáNDEZ-ORTE P等[22]研究了可同化氮素对三种酵母菌种发酵的影响,铵态氮添加使异戊醇的含量降低,氨基酸的添加显著增大了葡萄酒中异丁醇的含量结果相符。LOSADA M M等[7]研究发现随着向葡萄汁中添加的铵盐或氨基酸含量的增加,异戊醇的含量显著降低,也存在相似的结果。
2.3.3 发酵液中总高级醇含量变化 在发酵过程中可同化氮素的添加,对酿酒酵母产高级醇有着重要的影响。不同种类的可同化氮素对总高级醇产生的影响如表2所示。
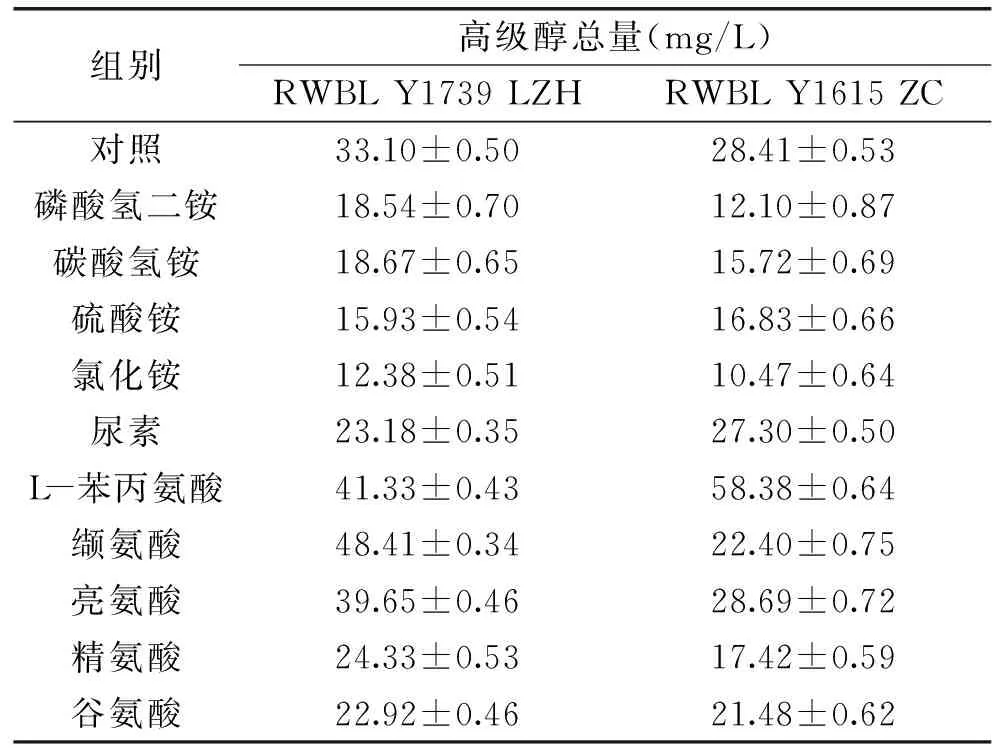
表2 不同种类可同化氮素条件下高级醇总量Table 2 Total high alcohol under different kinds of assimilation nitrogen
由表2可知,RWBL Y1739 LZH、RWBL Y1615 ZC发酵结束后,铵盐类降低高级醇效果明显,而氨基酸类的添加后,高级醇则表现出不同的形式。但是对于RWBL Y1739 LZH 铵盐降低高级醇效果大小顺序(氯化铵、硫酸铵、磷酸氢二铵、碳酸氢铵、尿素)与RWBL Y1615 ZC铵盐效果顺序(氯化铵、磷酸氢二铵、碳酸氢铵、硫酸铵、尿素)存在差别,这说明酵母种类也是产生高级醇的关键因素。RWBL Y1739 LZH发酵结束后除L-苯丙氨酸、缬氨酸、亮氨酸外,相对于对照组可同化氮素的添加降低高级醇效果明显,铵盐的添加有助于降低高级醇含量。这与徐姗娜等[8]研究铵盐高级醇含量低于有机氮素;Torrea D等[23]通过向葡萄发酵酒液添加铵态氮降低了高级醇的含量;Vidal E E等[24]将铵态氮添加于可同化氮素含量低的甘蔗汁中后发现高级醇的含量降低;结果一致。其中氯化铵添加后高级醇降低了62.60%,但是L-苯丙氨酸添加后高级醇增加了0.25倍,缬氨酸添加后高级醇增加了0.46倍,亮氨酸添加高级醇增加了0.20倍。这可能是特定氨基酸的添加,促使Ehrlich转化途径增强。RWBL Y1615 ZC发酵结束后除L-苯丙氨酸、亮氨酸外,均有降低高级醇的效果,但是铵盐类优势更加明显,这与RWBL Y1739 LZH具有相同结论。其中氯化铵的添加后高级醇降低了63.15%,而添加L-苯丙氨酸后高级醇增加了1.05倍,说明L-苯丙氨酸的添加,能显著增加高级醇的含量。这与林朴[25]研究随氨基氮的增多,高级醇的生成量表现为先降低后升高的变化趋势的结果不一致,分析结果可能是高级醇的含量,与培养基的氮源浓度相关。
3 结论与展望
降低高级醇手段通常是改变酵母的高级醇代谢基因,而可同化氮素添加策略报道相对较少。可同化氮素的添加,具有简单、快捷、稳定等特点。对发酵液中酵母的生长趋势无显著影响,磷酸氢二铵、碳酸氢铵、尿素能提高RWBL Y1739 LZH的酵母数量。尿素的添加能提高RWBL Y1615 ZC的酵母数量,硫酸铵、氯化铵并没有起到促进作用。在黄酒发酵液中,可同化氮素的添加能提高RWBL Y1739 LZH乙醇产量,但是对RWBL Y1615 ZC的乙醇产量作用不明显。黄酒发酵中铵盐的添加是降低高级醇的有效途径,对于RWBL Y1739 LZH、RWBL Y1615 ZC,氯化铵降低高级醇分别为62.60%,63.15%。这是酿制清爽型黄酒的新思路。在Ehrlich高级醇代谢途径中,特定氨基酸的添加能提高高级醇的含量,这为黄酒发酵中提高某些特定的高级醇,提供好的方法。此外,研究发现RWBL Y1739 LZH产异戊醇更强,而RWBL Y1615 ZC产β-苯乙醇能力更强,无论是对照组,还是实验组,都表现出相同的结论。
虽然已经有部分学者进行黄酒发酵过程中降低高级醇的研究。但多数研究是针对黄酒酿酒酵母的研究,通过基因改造来降低黄酒中的高级醇,但是降低高级醇的效果并不是很理想。而可同化氮素的添加是降低黄酒高级醇的一个有效途径,目前并没有在黄酒产业上进行大规模的应用,黄酒发酵的基础技术研究仍然显得薄弱,整体的生产技术与水平与啤酒、葡萄酒仍然存在差距。黄酒作为酒中国粹,值得发扬和传承。对黄酒高级醇的研究应从经验走向理论,从实验平台走向生产平台,应用现代高新技术,建立完善的黄酒发酵体系,这是实现黄酒技术升级和持续发展的关键,也是黄酒走向人文化,科技化、健康化的关键。
[1]甄会英. 葡萄酒中高级醇的测定方法与调控技术研究[D].保定:河北农业大学,2005.
[2]杜福强,任金艳,方雨辰. 啤酒中高级醇的影响因素及降低含量的措施[J]. 食品与药品,2007(11):46-49.
[3]芮鸿飞. 外源氨基酸对黄酒发酵的影响[D]. 杭州:浙江农林大学,2015.
[4]Arias-Gil M,Garde-Cerdán T,Ancín-Azpilicueta C. Influence of addition of ammonium and different amino acid concentrations on nitrogen metabolism in spontaneous must fermentation[J]. Food Chemistry,2007,103(4):1312-1318.
[5]苑振宇,王秉钦,邹海晏. 中国清酒中降低高级醇含量的研究[J]. 酿酒,2013(2):78-79.
[6]Hernández-Orte P,Ibarz M J,Cacho J,et al. Effect of the addition of ammonium and amino acids to musts of Airen variety on aromatic composition and sensory properties of the obtained wine[J]. Food Chemistry,2005,89(2):163-174.
[7]Losada M M,Andrés J,Cacho J,et al. Influence of some prefermentative treatments on aroma composition and sensory evaluation of white Godello wines[J]. Food Chemistry,2011,125(3):884-891.
[8]徐姗娜,王婷婷,陶树兴,等. 氮源种类及浓度对蜂蜜酒发酵和杂醇油含量的影响[J]. 食品工业科技,2010,31(7):158-161.
[9]Greenshields R N. Volatiles in home-brewed beers and wines[J]. Sci Fd Agric,1974(25):1307-1312.
[10]汪江波,郭建. 啤酒酿造过程中的高级醇[J]. 武汉:湖北工学院学报,2000,15(1):75-77.
[11]甄会英,王颉,李长文,等. 巨峰葡萄酒酿造过程中高级醇生成的研究[J]. 酿酒科技,2005(10):65-67.
[12]Torrea D,Varela C,Ugliano M,et al. Comparison of inorganic and organic nitrogen supplementation of grape juice-Effect on volatile composition and aroma profile of a Chardonnay wine fermented withSaccharomycescerevisiaeyeast[J]. Food Chemistry,2011,127(3):1072-1083.
[13]Martínez-Moreno R,Quirós M,Morales P,et al. New insights into the advantages of ammonium as a winemaking nutrient[J]. International Journal of Food Microbiology,2014,177:128-135.
[14]Vidal E E,de Morais Junior M A,François J M,et al. Biosynthesis of higher alcohol flavour compounds by the yeastSaccharomycescerevisiae:Impact of oxygen availability and responses to glucose pulse in minimal growth medium with leucine as sole nitrogen source.[J]. Yeast,2014(32):47-56.
[15]Clement T,Perez M,Mouret J R,et al. Metabolic responses ofSaccharomycescerevisiaeto valine and ammonium pulses during four-stage continuous wine fermentations[J]. Applied and Environmental Microbiology,2013,79(8):2749-2758.
[16]Vilanova M,Siebert T E,Varela C,et al. Effect of ammonium nitrogen supplementation of grape juice on wine volatiles and non-volatiles composition of the aromatic grape variety Albario[J]. Food Chemistry,2012,133(1):124-131.
[17]吕欣,段作营,毛忠贵. 氮源与无机盐对高浓度酒精发酵的影响[J]. 杨凌:西北农林科技大学学报:自然科学版,2003,31(4):159-162.
[18]杨士春. 氮源和无机盐对酵母菌发酵酒精浓度的影响[J]. 新能源及工艺,2012,7(4):50-54.
[19]陈双,罗涛,徐岩,等. 我国黄酒酵母和酿酒原料对黄酒中β-苯乙醇含量的影响[J]. 中国酿造,2009(4):23-26.
[20]Garde-Cerdán T,Ancín-Azpilicueta C. Effect of the addition of different quantities of amino acids to nitrogen-deficient must on the formation of esters,alcohols,and acids during wine alcoholic fermentation[J]. LWT-Food Science and Technology,2008,41(3):501-510.
[21]韩涛,肖冬光,李家飚.α-氨基氮对啤酒发酵过程中杂醇油生成的影响[J]. 酿酒,2003(6):55-57.
[22]Hernandez Orte P,Bely M,Cacho J,et al. Impact of ammonium additions on volatile acidity,ethanol,and aromatic compound production by differentSaccharomycescerevisiaestrains during fermentation in controlled synthetic media[J]. Australian Journal of Grape and Wine Research,2006,12(2):150-160.
[23]Torrea D,Varela C,Ugliano M,et al. Comparison of inorganic and organic nitrogen supplementation of grape juice-Effect on volatile composition and aroma profile of a Chardonnay wine fermented withSaccharomycescerevisiaeyeast[J]. Food Chemistry,2011,127(3):1072-1083.
[24]Vidal E E,de Billerbeck G M,Simões D A,et al. Influence of nitrogen supply on the production of higher alcohols/esters and expression of flavour-related genes in cachaça fermentation[J]. Food Chemistry,2013,138(1):701-708.
[25]林朴. 贵人香葡萄中的氨基氮含量及其对酵母发酵的影响[J]. 中外葡萄与葡萄酒,2013(5):17-21.

