流加补料技术在大观霉素发酵中的应用
,, ,小辉,
(浙江金华康恩贝生物制药有限公司,浙江 金华 321016)
大观霉素(Spectinomycin)是由壮观链霉菌(Streptomycesspectabilis)产生的一种氨基糖甙类抗生素,广泛应用于畜牧业.其硫酸盐是一种安全、高效、广谱新型兽药[1].2000年后国内陆续开展壮观链霉菌菌种选育工作,菌株生产能力获得大幅提高[2-4],例如夏云重等利用基因组重排技术和传统诱变技术,筛选到一株大观霉素高产菌株[5].目前大观霉素发酵生产采用间歇补加全料工艺,发酵单位5 000~6 000 U/mL,流加补料工艺国内未见相关报道.由于壮观链霉菌的生长期与生产期对所需营养及环境要求不同,间歇补加全料引起营养和环境的剧烈波动,导致发酵后期pH和氨基氮回升过快、菌丝早衰自溶、大观霉素合成速率降低,最终影响了发酵后期大观霉素发酵生产.
笔者针对大观霉素间歇补加全料发酵工艺存在的问题,通过发酵过程连续补料,均衡生长和生物合成的营养,将发酵液溶氧、温度、pH控制在大观霉素生物合成的最适范围内,结合发酵液待放方式,建立了发酵新工艺,较大幅度地提高了大观霉素发酵水平.
1 材料与方法
1.1 材 料
1.1.1 菌 种
菌种:壮观链霉菌(Streptomycesspectabilis)1012,浙江金华康恩贝生物制药有限公司研发中心保藏;检定菌:克雷伯氏肺炎杆菌,浙江金华康恩贝生物制药有限公司质量保证部保藏.
1.1.2 培养基
斜面培养基:可溶性淀粉20 g/L,酵母膏15 g/L,KNO31 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.5 g/L,NaCl 0.5 g/L,FeSO4·7H2O 0.01 g/L,琼脂20 g/L;pH自然,121 ℃灭菌30 min.
种子培养基:糊精20 g/L,葡萄糖10 g/L,豆粕粉30 g/L,酵母粉5 g/L,K2HPO42 g/L,CaCO32 g/L;pH自然,121 ℃灭菌30 min.
发酵培养基:糊精45 g/L,葡萄糖5 g/L,豆粕粉25 g/L,酵母粉5 g/L,K2HPO42 g/L,(NH4)2SO43 g/L,CaCO32 g/L,豆油3 g/L,PPE聚醚消泡剂0.1 g/L;pH 6.8~7.2,121 ℃灭菌30 min.
补料培养基:糊精400 g/L,(NH4)2SO415 g/L,分别121 ℃灭菌30 min;工业氨水调节发酵液pH(7.30±0.02).
1.2 方 法
1.2.1 摇瓶培养条件
1) 斜面培养条件:用壮观链霉菌1012冷冻孢子液,在空白斜面划线接种,28 ℃培养6 d.
2) 种子瓶培养条件:将成熟斜面挖块5×20 mm,接种到80 mL种子培养液中(750 mL圆底三角瓶),摇瓶机转速220 r/min,30 ℃培养48 h.
3) 发酵瓶培养条件:按8%接种量将种子液接种到80 mL种子培养液中(750 mL圆底三角瓶),摇瓶机转速220 r/min,32 ℃培养120 h.
1.2.2 50 L发酵罐培养条件
1) 种子罐培养条件:15 L发酵罐,装液量9 L,接种量0.2%,罐压0.05 MPa,搅拌转速350~400 r/min,30 ℃培养48 h.
2) 发酵罐培养条件:50 L发酵罐,装液量33 L,接种量8%,32 ℃培养(0~48 h),30 ℃培养(48~168 h),罐压0.05 MPa,搅拌转速300~500 r/min,空气量15~35 L/min,发酵周期168 h.
1.2.3 60 t发酵罐发酵条件
1) 一级种子罐培养条件:3.3 t发酵罐,装液量0.9 t,接种量0.2%,培养温度30 ℃,培养时间48 h,罐压0.05 MPa,空气量0.5~0.9 m3/min,搅拌转速150~220 r/min.
2) 二级种子罐培养条件:10 t发酵罐,装液量5 t,接种量10%,培养温度30 ℃,培养时间24 h,罐压0.05 MPa,空气量3~5 m3/min,搅拌转速120~180 r/min.
3) 发酵罐培养条件:60 t发酵罐,装液量40 t,接种量8%,32 ℃培养(0~48 h),30 ℃培养(48~168 h),培养时间168 h,罐压0.03 MPa,空气量15~48 m3/min,搅拌转速80~130 r/min.
1.2.4 补料方法
1) 间歇补料:发酵27 h后,每12 h间歇补料1 次,控制发酵液残糖浓度逐步降低.
2) 流加补料:发酵27 h后,流加40%糊精溶液,控制发酵液残糖质量浓度(15.0±0.5)g/L;流加15%硫酸铵溶液,控制铵态氮质量浓度为0.04~0.06 g/L;氨水控制pH为7.30±0.05.
1.2.4 相关参数测定
1) 大观霉素生物效价测定:管碟法[6].
2) 其他参数的测定:斐林试剂法测定总糖[6],甲醛法测定氨基氮[6].
3) 菌丝形态:美兰染色,光学显微镜观察法.
4) 生物量测定:10 mL发酵液,3 000 r/min离心15 min,倒出上清液,计算沉降物占发酵液的百分比.
5) 总产量计算方法:发酵产量(U)=放罐效价(U/mL)×放罐体积(m3)×106.
2 结果与分析
2.1 变温发酵对大观霉素生物合成影响
为确定壮观链霉菌1012生物合成大观霉素的最适温度,以1.1.2培养基配方,1.2.1培养条件,进行发酵实验.发酵周期0~48 h控制培养温度32 ℃,48~120 h分别考察培养温度28,30,32,34 ℃对发酵生物效价影响,结果见图1.各取培养温度30 ℃(120 h),32 ℃(120 h)的发酵液美兰染色,制备菌丝涂片,以1 500 倍光学显微镜观察菌丝生长情况,结果见图2.
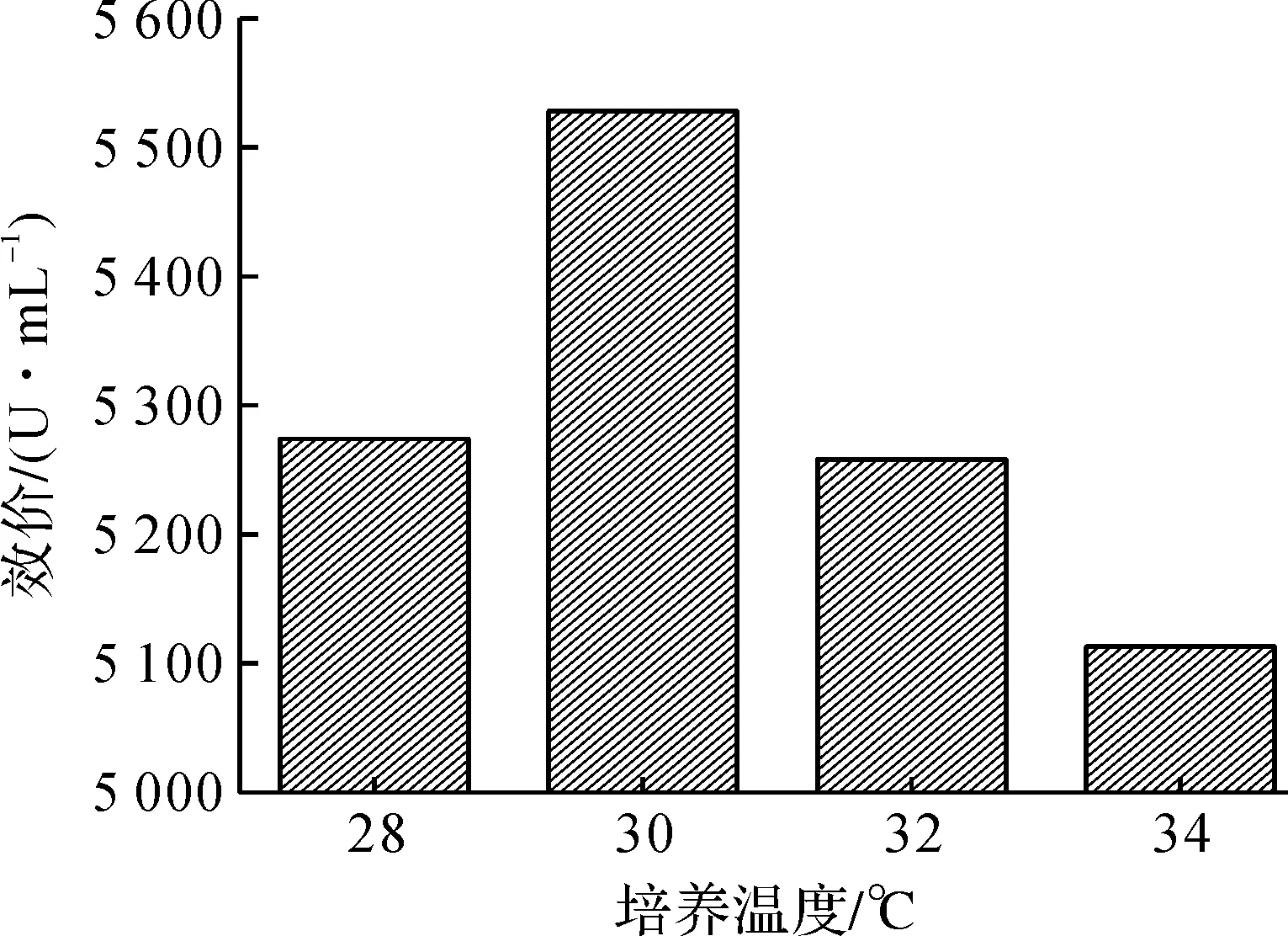
图1 温度对大观霉素生物合成的影响 Fig.1 Effect of temperature on biosynthesis of spectinomycin by Streptomyces spectabilis

图2 温度对壮观链霉菌菌体形态的影响(15×100)Fig.2 Effect of temperature on mycelia morphology of Streptomyces spectabilis(15×100)
由图1,2可知:发酵周期48~120 h,培养温度降至30 ℃,生物效价比32 ℃高5.1%;30 ℃培养120 h的发酵液菌丝比32 ℃更健壮.可见壮观链霉菌生物合成大观霉素的最适温度为30 ℃,发酵温度可采用前期32 ℃培养,有利于菌体生长,48 h后30 ℃培养,可减缓壮观链霉菌的衰老,利于生物效价的提高.
2.2 流加补料工艺对大观霉素合成的影响
将间歇补加全料的大观霉素发酵过程的工艺参数作图分析,结果见图3,4.

图3 间歇补料发酵过程参数曲线Fig.3 Profiles of parameters during batch feeding fermentation process
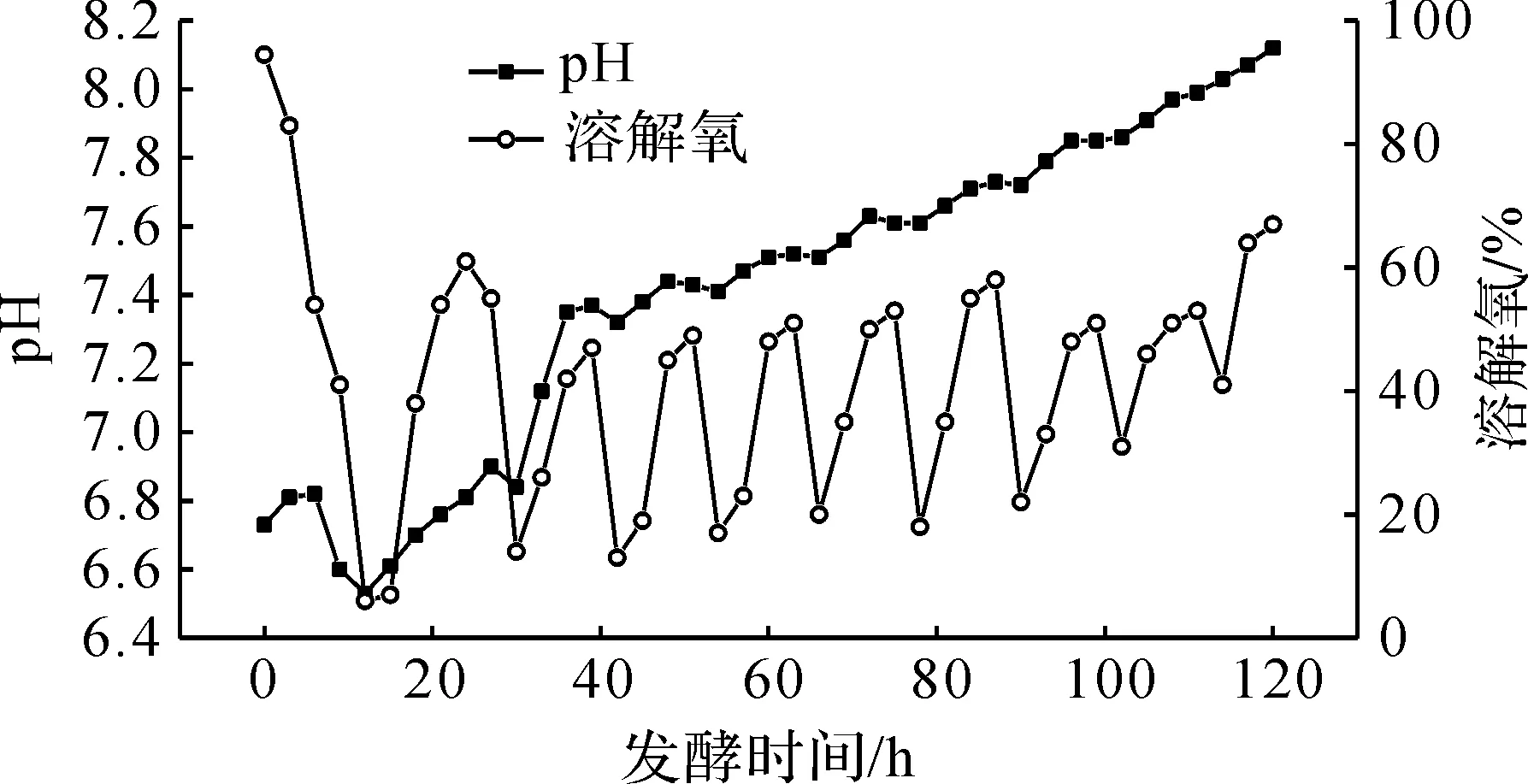
图4 间歇补料发酵过程pH、溶解氧浓度曲线 Fig.4 Profiles of dissolved oxygen concentration and pH during batch feeding fermentation process
分析图3,4可知:发酵过程27 h后,每12 h间歇补料后均导致溶氧浓度急剧变化,说明补入营养基质浓度过高,菌体呼吸强度增大,导致溶解氧浓度快速降低,造成生物合成环境剧烈波动;84 h后氨基氮和pH上升较快,120 h发酵液pH达8.12,氨基氮升至1.2 g/L,部分菌丝自溶,大观霉素生物合成速率由96 h的57 U/(mL·h),下降到120 h的23 U/(mL·h),说明发酵后期营养和工艺条件已不适合壮观链霉菌合成大观霉素.
采用50 L自控发酵罐,培养基装量体积33 L,以1.1.2配制培养基,通过蠕动泵流加糊精溶液,控制发酵液残糖质量浓度(15±0.5) g/L,流加硫酸铵溶液,控制铵态氮质量浓度0.04~0.06 g/L,工业氨水控制pH(7.3±0.05),发酵培养120 h,每12 h取样分析,按1.2.3进行相关参数测定.连续补料3 批研究结果见表1.
分别取间歇补全料和流加补料发酵培养120 h发酵液,美兰染色,制备菌丝涂片,1 500 倍光学显微镜观察菌丝生长,结果见图5.

表1 50 L发酵罐连续补料工艺对大观霉素合成的影响Table 1 Effect of continuous feeding process on biosynthesis of spectinomycin in 50 L fermentator

图5 流加补料发酵工艺对菌丝形态的影响(15×100)Fig.5 Effect of flow feeding fermentation process on speciation of Streptomyces spectabilis(15×100)
由图5可知:采用流加补料工艺与间歇补全料发酵液的菌丝形态有明显改变,菌丝分节变短,空泡增多,有利于提高大观霉素发酵水平.
取表1中效价最高的序号2发酵批次的发酵过程参数作曲线图,见图6.
由图6可知:采用流加补料技术,发酵周期36 h后,发酵液pH基本维持在7.3左右,溶解氧浓度波动幅度减小;发酵周期96~120 h间大观霉素合成速率仍保持60 U/(mL·h),与发酵周期72~96 h间大观霉素合成速率64 U/(mL·h)下降不显著,解决了原工艺后期大观霉素合成量减少的问题.
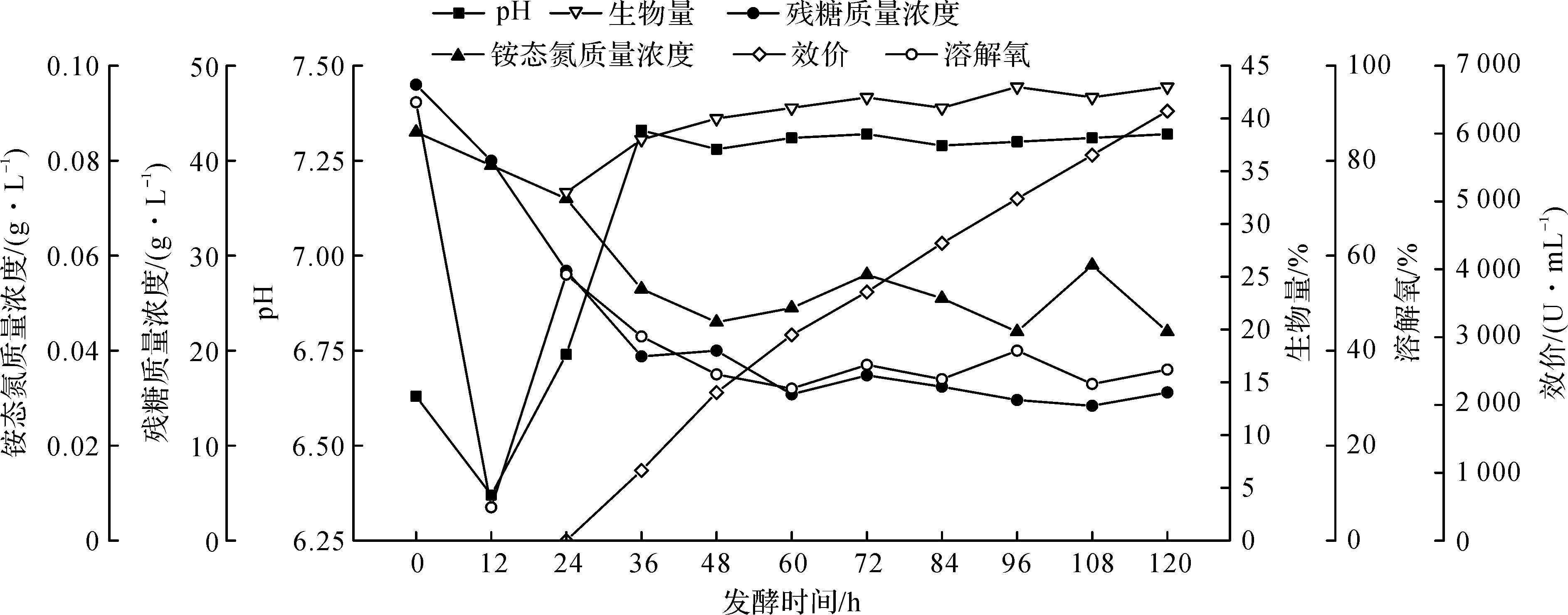
图6 流加补料发酵过程参数曲线Fig.6 Flow feed fermentation process parameters
2.3 延长发酵周期对对大观霉素合成的影响
通过2.2流加补料工艺研究发现:流加工艺较好地改善了发酵后期大观霉素合成单位增长缓慢的现状.为进一步提高发酵水平,将发酵周期由120 h延长到168 h,并在发酵96,120,144 h各放料1 次,放料体积为发酵液运行体积的8%,总产量为4次(放料体积×该发酵液效价)之和,3批发酵结果见表2.
由表2可知:通过延长发酵周期,平均发酵单位提高65%,产量提高112%,因144~168 h发酵单位合成速率开始明显下降,所以发酵周期确定为168 h.
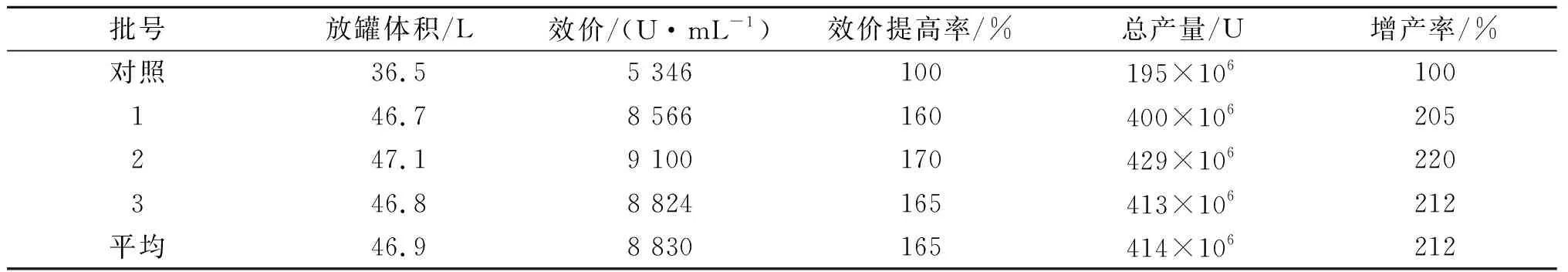
表2 50 L发酵罐发酵周期由120 h延长至168 h对大观霉素合成的影响Table 2 Effect of prolonger fermentation period 120 h to 160 h on synthesis of spectinomycin in 50 L fermentator
2.4 大观霉素补料新工艺生产罐的应用
新工艺在60 t发酵罐生产线推广应用,发酵培养基装量体积40 t,在发酵周期96,120,144 h各放料1 次,放料体积为发酵液运行体积的8%,总产量为4次(放料体积×该发酵液效价)之和,连续生产5批,结果如表3.
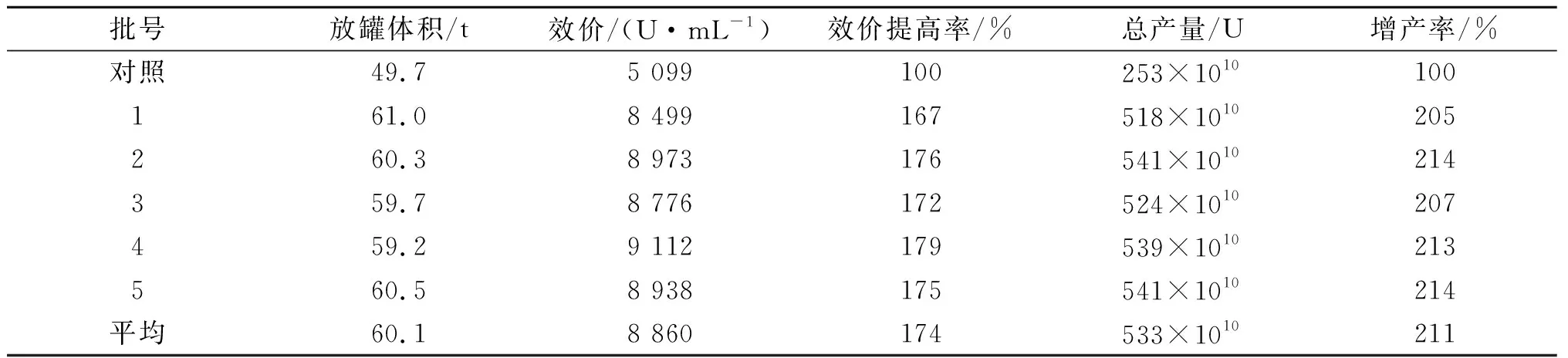
表3 60 t发酵罐流加补料工艺对大观霉素合成的影响Table 3 Effect of flow feeding process in 60 t fermenter on synthesis of spectinomycin
由表3可知:流加补料发酵工艺在60 t生产线上达到与50 L小试规模一样高的发酵水平和产量,发酵水平稳定,新工艺较原工艺发酵单位平均提高74%,产量提高111%.
3 结 论
中国专利[7]报道的一种大观霉素生产方法,发酵过程补糖、水,通过NaOH和(NH4)2SO4控制发酵液pH,最高发酵单位8 236 U/mL,未见其发酵放罐体积情况,无法比较发酵生产指数,其原料蚯蚓粉价格较高采购不易;壮观链霉菌1012生物合成大观霉素最适温度为30 ℃,发酵前期32 ℃培养有利于菌体生长,48 h后30 ℃培养延缓菌丝衰老,利于大观霉素生物合成;12 h一次间歇补加全料导致发酵液溶氧浓度急剧变化,造成生物合成大观霉素的发酵环境剧烈波动;50 L自控发酵罐流加补料实验,发酵过程用质量浓度为40%的糊精溶液控制残糖浓度,质量浓度为15%的硫酸铵溶液控制铵态氮浓度,工业氨水控制pH,延长发酵培养周期至168 h,发酵过程发酵液放料3 次,平均发酵单位提高65%,产量提高112%;流加补料新工艺在60 t发酵罐放大生产,大观霉素发酵单位平均提高74%,产量平均提高111%,研究结果取得较好的经济效益.
参考文献:
[1] 吴根福.大观霉素的研究进展及其在畜牧业中的应用[J].中国兽药杂志,2005,39(9):29-32
[2] 韩香玲,曲音波,孙树申,等.大观霉素高产菌株的选育[J].华中农业大学学报,2005,24(5):474-476
[3] 王荣学,杜力华.大观霉素高产菌的诱变选育和发酵条件研究[J].河北化工,2005,28(5):37-39
[4] 张金龙,李芳.高产安丝菌素的珍贵束丝放线菌菌种选育[J].发酵科技通讯,2015,44(4):43-47
[5] 夏云重,张正波,辛波波,等.基因组重排与传统育种相结合选育大观霉素高产菌株[J].工业微生物,2011,41(1):36-40
[6] 陈钧鸿.抗生素工业分析[M].北京:中国医药科技出版社,1991.
[7] 任勇,王义,奇乃.一种壮观链霉菌发酵生产大观霉素的培养基及发酵方法:CN103484509B[P].2015-06-17.

