PD⁃L1在食管鳞癌中的表达及其与食管鳞癌预后的关系*
杜国波,谢晓翠,周晶(.川北医学院附属医院肿瘤科,四川南充637000;.医学影像四川省重点实验室,四川南充637400)
食管癌已成为全球癌症相关死亡的第五大因素,我国食管癌发生率和死亡率位居第4位,尽管其发病率与死亡率呈下降趋势,但依然对人类健康和生命存在极大威胁[1-2]。食管癌目前主要治疗手段为传统的手术结合放化疗,但总体5年生存率目前仍徘徊在30%左右,如何寻找与临床疗效相关的分子标记物及这些分子标记是否可以作为新的治疗靶点是近年来各大肿瘤研究领域的热点问题。
程序性死亡分子1配体(PD-L1)属于B7家族的一个共刺激信号分子。PD-L1作为程序性死亡受体1(PD-1)阻断T细胞活化及介导肿瘤免疫抑制的主要配体,其在多种细胞(T细胞、B细胞、单核-巨噬细胞和全称树突状细胞等)上表达[3]。近几年,针对PD-1/PD-L1通路的单克隆抗体治疗是肿瘤免疫治疗的一个重大突破,其在恶性黑色素瘤、非小细胞肺癌、肾癌、膀胱癌等癌症治疗中表现出令人振奋的疗效[4]。但其在食管鳞癌(ESCC)中的研究报道较少,PD-1/PD-L1的表达和ESCC预后之间的关系存在争议,其作用机制也有待进一步研究。本研究拟探讨ESCC组织中PD-L1的表达情况及其与ESCC预后的关系。
1 资料与方法
1.1一般资料选取2012年5月至2015年12月就诊于川北医学院附属医院并经过术后病理确诊为ESCC的108例患者,其中男75例,女33例;年龄(63.5±5.3)岁,未进行术前放、化疗,有完整的临床病理及随访资料。取108例患者的ESCC组织、60例癌旁食管组织。
1.2方法
1.2.1PD-L1表达检测方法采用免疫组织化学(免疫组化)法。蜡块切片4~5µm,置于二甲苯Ⅰ、Ⅱ中脱蜡10 min,放切片于梯度酒精脱水,切片浸入枸橼酸钠缓冲液中并加热,沸腾20 min进行抗原修复。然后封闭抗原,加入一抗,湿盒中4℃孵育过夜,滴加二抗,室温孵育盒中孵育30 min,然后二氨基联苯胺法(DAB)显色,洗涤封片后光镜下观察拍照。免疫组化结果采用Fromowitz半定量分级法分析,以肿瘤细胞染色强度和阳性细胞比例进行计分。计分标准:无着色(0分),淡黄色(1分),棕黄色(2分),棕褐色(3分)。阳性细胞比例计分是在光学显微镜下随机选择5个高倍镜视野(400×),计算呈现染色阳性的肿瘤细胞占视野内所有肿瘤细胞的百分比,以各视野的均值作为阳性细胞百分比,计分标准:<10%肿瘤细胞着色(0分),10%~30%肿瘤细胞着色(1分),>30%~60%肿瘤细胞着色(2分),>60%肿瘤细胞着色(3分)。以染色强度评分与阳性细胞比例评分的乘积为最终分值。最终分值0~3分定义为阴性,4~9分定义为阳性。
1.2.2随访随访方式为电话、门诊及复诊病例资料随访,随访结束时间为患者死亡,末次随访时间为2017年6月16日。随访率为95.4%。随访到截止时间,108例患者共有62例死亡,其中3例死于非肿瘤(感染、放射性肺炎、心肺意外),存活41例,失访5例。
1.3统计学处理采用SPSS17.0统计软件进行数据处理,计数资料以率表示,组间比较采用χ2检验;生存资料采用中位数表示,组间比较采用Kaplan-Meier法和Log-Rank法进行生存率分析;采用Cox比例风险模型进行多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1PD-L1在ESCC中的表达情况PD-L1免疫组化染色主要定位于细胞膜或细胞质,呈棕黄色颗粒,见图1。在癌组织、癌旁组织中PD-L1阳性表达率分别为54.6%(59/108)、16.7%(10/60),癌组织 PD-L1阳性表达率显著高于癌旁组织,差异有统计学意义(χ2=22.968,P<0.01)。
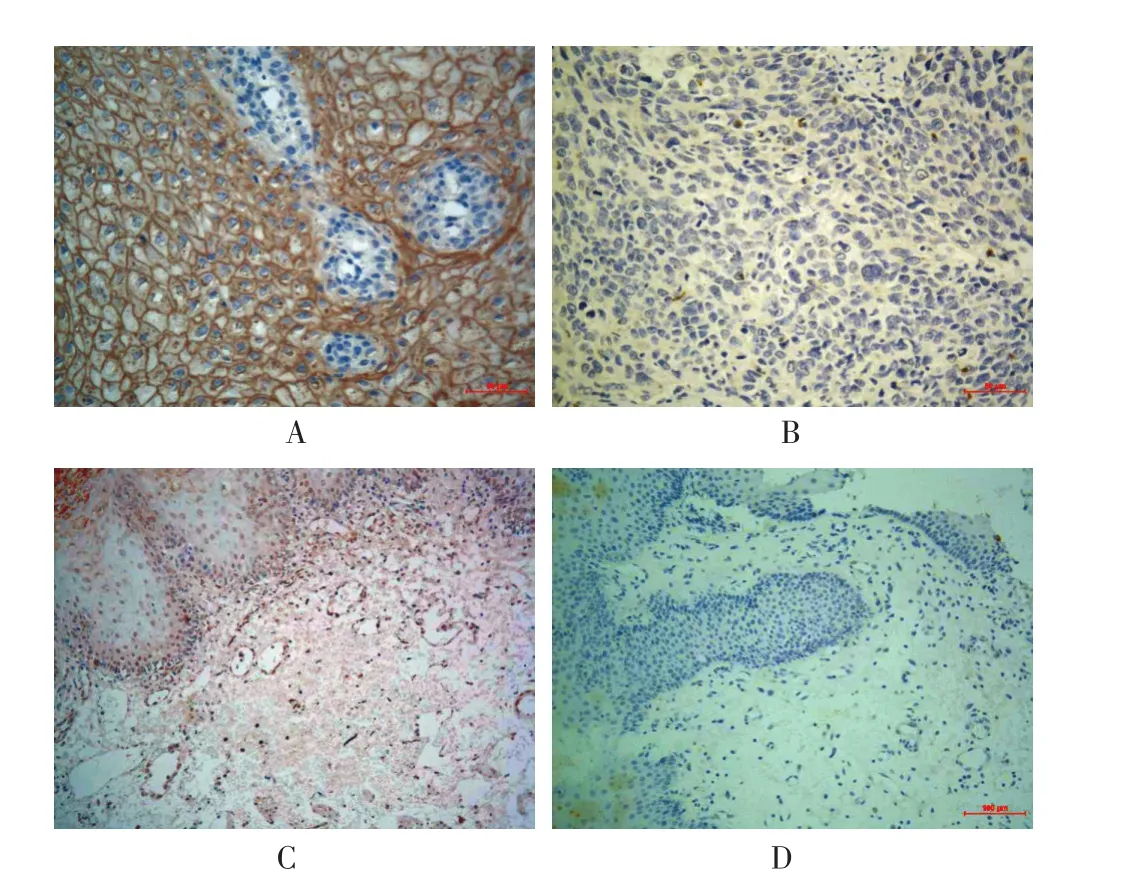
图1 PD-L1免疫组化染色情况
2.2PD-L1与ESCC临床病理参数的关系PD-L1表达水平与ESCC淋巴结转移有关(P<0.05),而与患者的年龄、性别、病变部位、病变长度、肿瘤浸润深度、临床分期无显著相关性(P>0.05),见表1。

表1 PD-L1表达和ESCC临床病理参数的关系(n)
2.3PD-1表达与ESCC患者预后的关系经Kaplan-Meier法计算得PD-L1表达阳性组中位生存时间为18个月,表达阴性组为25个月,PD-L1表达阳性组3年总生存率为25.2%,表达阴性组3年总生存率为47.9%,PD-L1表达阳、阴性组中位生存时间、总生存率比较,差异均有统计学意义(P<0.05)。单因素分析及Cox回归模型进行多因素分析,结果显示,T分期和PD-L1为独立预后因素。见图2。

图2 Kaplan-Meier法对108例ESCC患者的总生存期的分析结果
3 讨 论
食管癌在全球范围内呈现明显的地区分布差异,不同地区的发病率和病死率有明显差异[5]。据2015年发布的中国最新癌症登记年报,中国西南部食管癌的新发病例数及死亡数占据年报所示国内7个大区的第1位,川东北地区长久以来被认为是全国的第2个食管癌高发现场[2],防控形势极为严峻。食管癌中约90%为鳞状细胞癌。研究显示,食管癌病因与遗传因素和饮食习惯有明显关系,但确切发病机制不详[6-7]。
PD-L1是近年来新发现的B7家族成员之一,对调节T细胞或B细胞的免疫功能具有明显的效应[8]。研究发现,当PD-L1与受体PD-1结合后可促进效应T细胞凋亡,降低效应T细胞对肿瘤细胞的杀伤力,促进肿瘤的发生[9]。近年来,大量研究关于PD-L1在恶性肿瘤中表达与临床病理特征、预后的相关性,但关于PD-L1表达与ESCC患者临床病理参数和预后关系的文献报道研究较少。因此,本研究检测了ESCC组织中PD-L1的表达情况,并分析其与患者预后的关系。结果显示,癌组织PD-L1表达水平显著高于癌旁组织(54.6%vs.16.7%),PD-L1阳性表达患者淋巴结转移率更高(64.9%vs.35.1%),PD-L1阳性表达与年龄、性别、病变部位、病变长度、肿瘤浸润深度、临床分期无显著相关性(P>0.05),与 LENG等[10]的结论一致。本研究结果还显示,PD-L1阳性者较阴性者的中位生存时间更低(18个月vs.25个月),3年总生存率更差(25.2%vs.47.9%),与张锋等[11]的研究结果一致。PD-L1可能作为预测食管癌疾病进展和预后的一个新的指标。WU等[12]的meta分析显示,实体瘤PD-L1阳性表达的预后更差,其中PD-L1阳性表达的食管癌患者的3年生存率更差。最近TSUTSUMI等[13]的研究也显示,PD-L1阳性表达的食管癌患者预后更差,与JIANG等[14]的研究结论和QU等[15]的meta分析一致。而ZHANG等[16]研究结果显示,食管癌肿瘤细胞PD-L1阳性表达者5年总生存率和无病生存率与阴性表达者无显著差异,而食管癌组织中肿瘤浸润免疫细胞的PD-L1阳性表达者5年总生存率高于阴性表达者者(37.6%vs.20.5%),无病生存率也明显高于阴性组(37.6%vs.18.9%),提示PD-L1在肿瘤浸润免疫细胞的表达而不是肿瘤细胞的表达与食管癌预后有关。而CHEN等[17]的报道结果相反,PD-L1阳性表达降低了ESCC疾病复发风险,中位无病生存率更高,但总生存率无统计学差异,研究结果与大多数研究结论不一致。作者认为,虽然研究显示PD-L1与受体PD-1结合后导致肿瘤细胞的免疫抵抗,但过高的PD-L1的表达可能促进PD-L1与PD-1之外的其他未知受体结合,导致T细胞增殖、某些细胞因子如白细胞介素10、γ-干扰素等的分泌增加,使机体抗肿瘤作用增强,促进免疫应答[18],但这种推断需要进一步研究证实。CHEN等[19]在机制方面进行了探讨,研究显示PD-L1的表达能够促进食管癌细胞的增殖、侵袭和上皮间质转化。
总之,多数研究显示PD-L1阳性表达的食管癌患者预后更差,PD-L1是否可作为预测食管癌疾病进展和预后的新指标,以及PD-L1参与食管癌及其他实体恶性肿瘤发生、发展过程的确切分子机制都需要进一步研究。

