不同植物修复锰矿渣模式中根际菌群的特性及多样性研究
张 爽,冯冲凌,欧阳林男,李刘刚,吴晓芙
(中南林业科技大学 环境科学与工程学院,湖南 长沙 410004)
土壤、植物和微生物之间的相互作用被认为是生态系统功能的主要驱动力[1],其中微生物能对任何植被或土壤性质的改变做出快速响应[2-3]。矿区生态修复进程中细菌群落的多样性和丰富性对于保持矿区植被土壤质量,维持生产力和生态平衡至关重要。有机菌肥作为一种无二次污染、高效率的改良剂,兼具改善土壤养分条件和降低重金属等污染物生物有效性的双重功能[4],它的应用在一定程度上能加快矿区植被的恢复进程,但这又会反过来对土壤理化性质产生影响[5]。有研究表明,基于土壤重金属浓度的不同与土壤相关的功能菌群如固氮细菌、氨氧化细菌、甲烷营养菌和反硝化细菌等也会出现显著变化[6-9]。了解不同植物群落修复模式对土壤微生物群落结构和组成的影响对开发更好的矿山生态修复技术具有重要意义[10]。
课题组前期以湘潭锰矿尾矿区矿渣为基质、专用有机菌肥为改良剂,开展了植物-有机菌肥联合修复中试试验。结果显示有机菌肥能明显提高植物的重金属转运能力,增大植物生物量、株高和重金属积累量,其中复合植物-有机菌肥处理的生态修复效果最好,形成的草-灌-乔空间结构具有保水性强,植物多样性丰富和重金属扩散率低等综合特点[11]。本研究以中试试验装置内的植物根际土壤为研究对象,结合高通量测序分析细菌群落的结构与多样性,为进一步探究在有机菌肥改良下植物-微生物联合修复的机理提供依据和参考数据。
1 材料与方法
1.1 中试系统试验处理
以专用有机菌肥作为改良剂,根据课题组前期盆栽试验结果,选择栾树、泡桐、夹竹桃、小叶女贞以及本土先锋植物商陆等重金属积累量大、生长速度快的植物开展中试系统试验[11],试验处理见表1。试验装置储量360 kg,设计3个重复,供试植物由湖南省林业科学院提供且均为同批1年生实生苗,其中商陆为矿渣自然萌生植物。试验用矿渣基本理化性质见表2;基于课题组前期研究[12],试验用有机菌肥的配置情况见表3。

表 1 不同植物模式处理Table 1 Treatment of manganese tailing and plant community in pilot scale simulation test
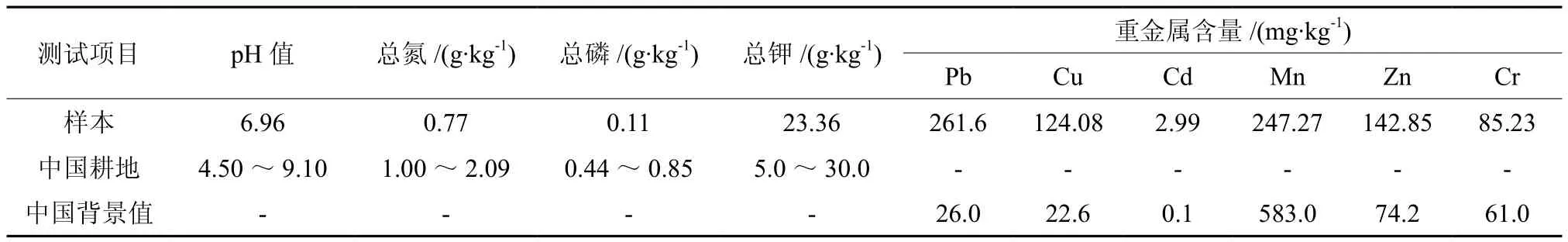
表 2 锰矿渣重金属元素含量和养分状况Table 2 Nutrient and heavy metal content of the manganese tailing

表 3 有机菌肥配置Table 3 Composition of the organic bacterial manure
1.2 土样采集与测定
抖落各装置每种植物的根际土壤,标记为该植物根际土,每种植物需200 g鲜土;按装置取50 g左右各植物根际鲜土混合,组成根际混合土,4个装置即有4个根际混合土;每份土壤样本一分为二,一份自然风干,一份置于-80 ℃下冷冻保存,用于分析土壤微生物数据。
土壤重金属含量:称取0.5 g(过100目)土壤样品置于150 mL三角瓶中,用少量超纯水润湿样品,盖上弯颈漏斗,打开通风厨,在厨内向三角瓶均加入10 mL王水(盐酸∶硝酸=3∶1),轻轻摇匀,静置过夜。次日,置于电热板上,从160 ℃开始每半小时升温5 ℃,溶液块干时,取下冷却。加入3 mL高氯酸,从200 ℃开始加热每半小时升温5 ℃,至三角瓶中呈灰白色糊状取下冷却。用超纯水过滤至50 mL容量瓶,定容,用原子吸收测定土壤样品中Mn、Pb、Cd、Cu、Zn的含量。
土壤pH值:采用电位法测定土壤pH值。
土壤阳离子交换量:氯化钡-硫酸强迫交换法[13]。
1.3 土壤DNA提取、PCR扩增及高通量测序
土壤DNA提取、PCR扩增及高通量测序由上海美吉生物医药科技有限公司完成。4个装置土壤每份由4个平行组成,共16个土壤样本的具体操作步骤如下:将适量的土壤以10 000 r/min 离 心 5 min,使 用 E.Z.N.A.®DNA试剂盒提取基因组DNA。提取的基因组DNA通过1%琼脂糖凝胶电泳检查,然后使用引物338F(5-ACTCCTACGGGAGGCAGCAG-3) 和 806R(5-ACTCCTACGGGAGGCAGCAG-3)进行PCR 扩 增[14]。 用 TransGen AP221-02:TransStart Fastpfu DNA聚合酶进行PCR扩增。将每个样品的PCR产物纯化后在Illumina Miseq PE250平台上测序。
2 结果与分析
2.1 土壤重金属含量和理化性质
从不同植物模式的土壤理化性质(见表4)来看,有一定差异,如pH值和阳离子交换量,在1号装置的土壤pH值与阳离子交换量均稍低于4号系统,表明复合植物模式会对系统土壤产生一定的酸化作用,这可能与植物根际分泌的有机酸相关[15]。2号和3号装置土壤的pH值与阳离子相差最大,说明植物群落组成对土壤理化性质的影响要强于有机菌肥。
各装置试验结束时土壤重金属的总含量见表5,4个装置土壤基质的Mn、Cd、Pb、Cu、Zn总量均远超湖南省背景值和中国背景值,说明装置土壤重金属浓度高且属复合型重金属污染。其中2号和3号系统土壤的各元素重金属总量均显著小于1号和4号系统,这是由于有机菌肥中的有机物质是有效的重金属络合剂,其可通过形成不溶性金属-有机复合物、增加土壤阳离子交换量(CEC)、降低土壤中重金属的水溶态及可交换态组分,从而降低土壤中重金属的生物有效性[16]。另一方面也可能由于2号和3号系统基质中添加了一定比例的有机菌肥改良剂,从而稀释了土壤重金属总量。土壤理化性质和重金属含量的这些变化也可能会影响细菌群落的组成和丰度,这将通过高通量测序技术做进一步检验。

表 4 各装置土壤 pH 值和阳离子交换量Table 4 Soil pH value and CEC of rooting soil in pilot scale simulation test
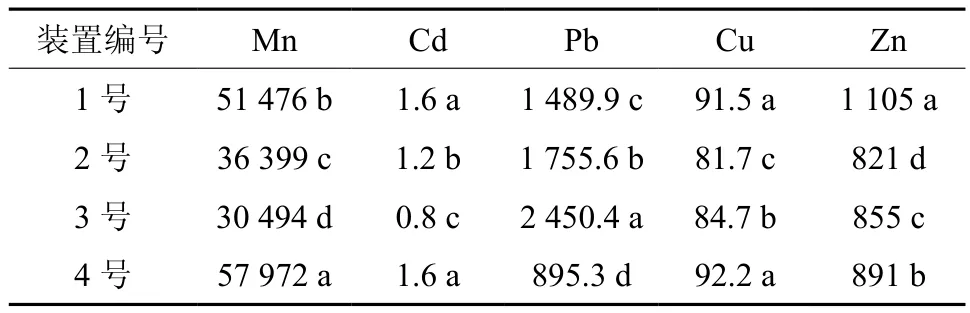
表 5 各装置土壤重金属总含量†Table 5 Soil heavy metal content in pilot scale simulation test (mg·kg-1)
2.2 细菌群落结构与多样性
2.2.1样本测序结果及取样深度验证
对1号、2号、3号、4号装置的16个土壤样本细菌16S rRNA基因进行高通量测序,结果表明:共获得有效序列150 703个,97%相似水平下4个处理的测序覆盖率都接近0.98,说明目前的序列阅读数足以表达这些土壤中的细菌的多样性。97%相似水平下的OTU共789个,其中3号OTU数目最多,1号最少(见表6)。采用sobs指数(实际观测到的物种数目)构建的稀释曲线(如图1)所示,16个样本的稀释曲线最终均趋向于平缓,说明测序数据量合理,更多的数据量只会产生少量新的物种,测序数据量足够反映样本中绝大多数的微生物多样性信息,可以满足分析要求[17]。
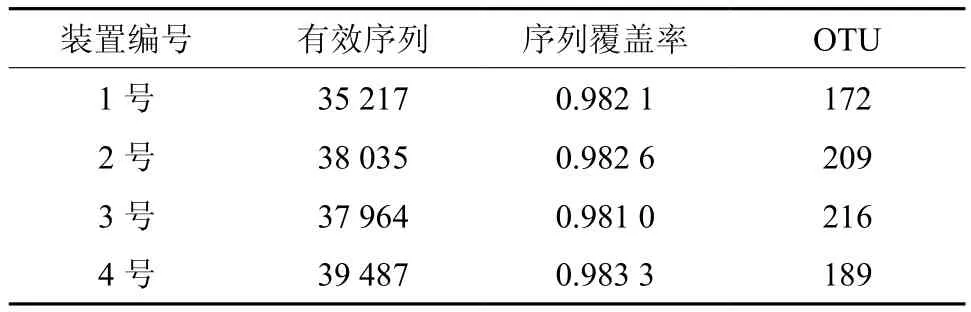
表 6 各样本的有效序列数、序列覆盖率及OTUs数Table 6 Reads, coverage and OTUs numbers of bacteria sequences in different samples
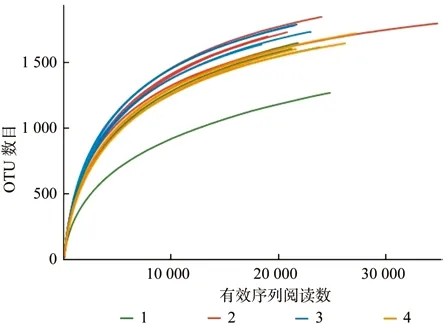
图1 各样本的稀释曲线Fig. 1 Rarefaction curves of different samples
2.2.2细菌群落多样性和丰富度分析
以α多样性分析反映装置土壤中细菌群落的多样性与丰富度,以Simpson指数和Shannon指数描述样品的多样性,以Ace指数和Chao指数描述细菌群落丰富度[18-20]。如表7所示,样本间的丰富度指数差异显著(P<0.05),2号和3号的Shannon指数、Simpson指数、Ace指数和Chao指数均显著高于1号和4号,表明有机菌肥能显著提高土壤细菌的物种丰富度和多样性,而这4种指数在2号与3号之间的差异并不明显,表明植物群落组成对土壤细菌的影响较小。

表 7 各装置的细菌丰富度及多样性指数Table 7 Richness and diversity indexes of bacteria in all treatments
2.2.3细菌群落组成
在门分类水平上,4装置土壤的细菌群落分布在34个细菌门。其中相对丰度较大的为以下10个门类:变形菌门Proteobacteria、酸杆菌门Acidobacteria、绿弯菌门Chloroflexi、芽单胞菌门Gemmatimonadetes、Acitnobacteria门、拟杆菌门Bacteroidetes、Saccharibacteria门、Parcubacteria门、蓝藻门Cyanobacteria、Latescibacteria门、硝化螺旋菌门Nitrospirae和Microgenomates门,它们的相对丰度之和在1号、2号、3号和4号装置的土壤中分别占据细菌总量的98.2%、98.4%、99.7和98.7%。Parcubacteria门、蓝藻门Cyanobacteria、Latescibacteria门、硝化螺旋菌门Nitrospirae和Microgenomates门等其它27个细菌门在各装置土壤中的组成分布有所差异,但其相对丰度极小,在6.1%至9.0%范围内。由图2可知,各装置土壤中的优势门均为变形菌门,相对丰度分别达到了32.4%、38.5%、34.9%和34.3%。其次是酸杆菌门,相对丰度分别为11.7%、13.8%、20.4%和8.5%。在未施加有机菌肥的1号和4号装置中各菌门的相对丰度差异较小,而对比1号和2号可以发现有机菌肥增加了变形菌门、酸杆菌门、Acitnobacteria门、Parcubacteria门和硝化螺旋菌门的相对丰度,增幅在0.4%~6.1%范围内。在施加了有机菌肥的2号和3号装置中变形菌门、酸酐菌门和Saccharibacteria门的相对丰度差异最为显著,其中单一植物群落下的酸酐菌门和Saccharibacteria门的相对丰度得到了增加,分别增加了6.6%和4.3%,而变形菌门的相对丰度则降低了6.3%。
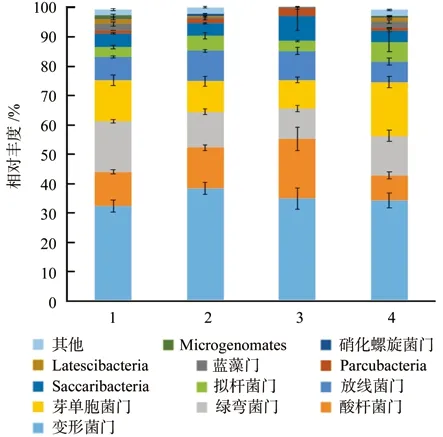
图2 各装置细菌类群在门分类水平上的比较Fig. 2 Comparison of bacteria community in all treatments at phylum level
在纲分类水平上,各装置土壤的细菌群落共分布在81个细菌纲。图3显示了4装置土壤中相对丰度最大的9个已知纲类,分别为:变形菌纲Alphaproteobacteria、酸酐菌纲Acidobaceria、 芽单胞菌纲Gemmatimonadetes、β-变形菌纲Betaproteobacteria、 放线菌纲Actinobacteria、 厌氧绳菌纲 Anaerolineae、γ-变形菌纲Gammaproteobacteria、Δ-变 形 菌 纲Deltaproteovbacteria和鞘脂杆菌纲Sphingobacteriia。在这9个菌纲中β-变形菌纲、放线菌纲、Δ-变形菌纲和鞘脂杆菌纲之间的相对丰度并没有显著的差异(P>0.05),而变形菌纲、酸酐菌纲、芽单胞菌纲、厌氧绳菌纲和γ-变形菌纲之间的相对丰度则差异显著(P<0.05)。值得注意的是不同类别的变形菌纲均会对是否施加有机菌肥以及不同的植物群落做出不同的响应。在未施加有机菌肥的1号和4号装置土壤中芽单胞菌纲、β-变形菌纲和厌氧绳菌纲的相对丰度均高于施加了有机菌肥的3号和4号(图3 C、D和F)。虽然1号装置与4号装置土壤中各纲类的相对丰度差异不大,但酸酐菌纲、放线菌纲、厌氧绳菌纲、γ-变形菌纲和鞘脂杆菌纲的相对丰度仍在复合植物群落处理中(1号)得到了提高,增幅在0.27%~2.58%(图3 B、E、F、G和I)。在有机菌肥处理的2号和3号装置中变形菌纲、酸酐菌纲、放线菌纲和鞘脂杆菌纲的相对丰度均得到了显著提高(图3 A、B、E和I)。此外对比1号和2号不难发现有机菌肥的添加能提高变形菌纲、酸酐菌纲、放线菌纲、Δ-变形菌纲和鞘脂杆菌纲的相对丰度,其中变形菌纲的相对丰度得到了大幅增加,增加了8.04%(图3 A、B、E、H和I)。在施加了有机菌肥的2号和3号装置中变形菌纲、酸酐菌纲、β-变形菌纲和γ-变形菌纲的相对丰度差异最为显著,其中单一植物群落下的酸酐菌纲和β-变形菌纲的相对丰度得到了增加分别增加了6.6%和2.3%,而变形菌纲和γ-变形菌纲的相对丰度则分别降低了4.5%和1.3%(图3 A、B、D和G)。
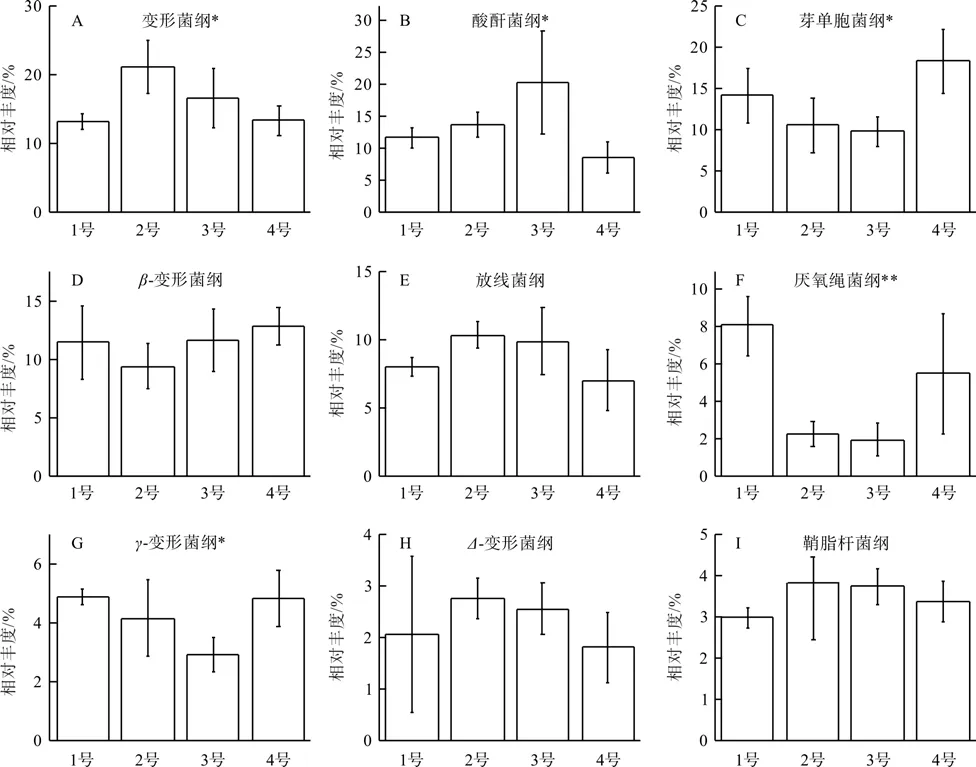
图3 各装置细菌类群在纲分类水平上的比较Fig. 3 Comparison of bacteria community in all treatments at class level
2.2.4各样本细菌群落间的关系
如图4所示,样本通过降维分析后,在主成分上有相对坐标点,各个样本点的距离代表了样本的距离,平面上同一区域的样本表明其具有相似性。在纲水平上PCA分析表明不同处理中细菌群落明显分离,代表各装置微生物相关的主成分1(PC1)、主成分2(PC2)可分别解释变量方差的46.32%和28.82%,有机菌肥处理下的2号与3号细菌群落最相似,而未施加有机菌肥的1号与4号细菌群落最相似。
2.2.5细菌群落与环境因子的关系
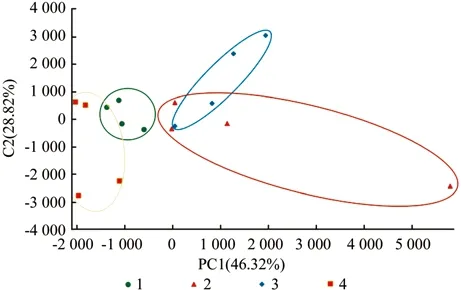
图4 基于纲水平的PCA分析结果展示Fig. 4 Principal component analysis of in all treatments at class level
各装置细菌群落与环境因子在纲水平上的RDA分析结果见表8和图5。由表8知:在排序图中,前两轴累计解释了86.02%的物种-环境关系信息和64.03%的物种变化信息,所选的环境因子共解释了76.1%的物种变化信息;轴Ⅰ和轴Ⅱ的特征值分别为0.562 5、0.077 8。利用Monte Carlo置换检验,向前引入法对环境因子进行逐步筛选,结果见图5。由图5可知,土壤锰离子浓度是造成细菌群落产生变化的主要因素。各环境因子对细菌群落结构影响的排序为:Mn2+> Cd2+> Cu2+>Pb2+> pH 值 > Zn+> CEC。

表 8 各装置细菌群落纲类RDA统计结果Table 8 Summary of redundancy analysis (RDA) of bacterial community for the first two axes
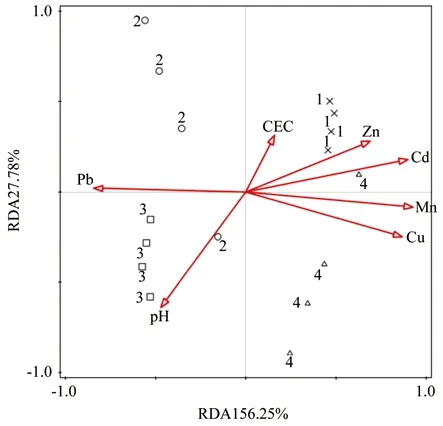
图5 细菌群落纲类、土壤重金属浓度、pH值与阳离子交换量的冗余分析Fig. 5 RDA analysis between bacterial classes, heavy metal content, pH value and CEC
3 讨论与结论
有机菌肥作为一种微生物肥料不仅具备有机肥效应,还是一种良好的土壤改良剂[21]。本研究结果显示,施用了有机菌肥的2号(复合植物-有机菌肥)与3号(单一植物-有机菌肥)装置土壤各元素的重金属总量均显著下降(见表5)。研究表明,有机菌肥中的吸附介质和有机物料本身就是一种良好的土壤缓释剂,这些物质能活化或钝化土壤重金属,缓解土壤重金属毒性。如有机物料中的大分子腐殖质和水溶性有机物能与土壤胶体或土壤溶液的重金属形成稳定络合物,进而降低了重金属元素的络合性,钝化土壤重金属[22]。而有机菌肥中的抗性菌株虽不能直接引起土壤重金属和理化性质的改变,但其能与植物产生协同作用。如抗性芽孢杆菌能刺激植物根系分泌H+,降低土壤pH值,置换土壤颗粒表面吸附的金属离子[23];胶质芽孢杆菌分泌的小分子有机酸可溶解土壤中沉淀的重金属化合物[24]。
土壤的高度异质性使之成为地球上最为多样化的微生物栖息地之一[25-26]。有机菌肥对土壤的可利用性、土壤pH值、水分、养分等的影响可能会增加土壤微粒之间的差异,使土壤均质化,从而提升根际微生物群落的丰富度[27]。有机菌肥所引起的根际细菌群落的变化已被多次报道[28-29]。在本研究中,施用有机菌肥后显著提高了2号和3号植物根际区域的细菌多样性(表7)。根际细菌多样性的提高是有机菌肥引入了一定数量细菌的结果。有机菌肥中的土著抗性菌株主要由细菌组成,菌肥施用后其中的有机肥原料也会吸引大量异养细菌于土壤中定殖[30]。另一方面,细菌的生长速率和生物量也会受金属离子浓度的影响[31]。
一般来说,重金属毒性会作用于一部分抗性较低的微生物,减少它们的丰度[28],如变形菌门和酸杆菌门,有研究报道它们的丰度与重金属浓度呈负相关[32]。另一方面,重金属也会增加一些金属抗性细菌的丰度,如本研究中所发现的放线菌纲和变形菌纲的一些细菌(图3)。这些细菌已被鉴定为重金属污染土壤中的优势菌,在其中发挥某些特定作用[33-34]。放线菌纲是高浓度重金属污染水平下植物群落根际最为重要的差异菌门。它在之前的研究中已被认定为定殖在植物根际的最为重要的一类微生物[35]。放线菌纲的很多成员可以产生IAA以促进植物生长、分泌铁载体与Mn形成稳定的配合物、帮助植物抵御病原性真菌等[36]。与之不同的是,变形门作为有机施肥后的优势菌种,有研究报道它的丰度与土壤中重金属的含量、植物生物量和重金属积累量均呈显著正相关[37]。虽然这里并没有直接的方法证明,但我们推测它很可能在污染土壤重金属的植物提取效率的提高中发挥重要作用。进一步鉴定和研究这种特异细菌种属以及其他一些在超积累型根际发现的重要菌群,揭示其功能和相关机制,将有助于重金属污染土壤生物修复技术的优化。
本研究主要的结论如下:
有机菌肥能显著地降低土壤重金属浓度,缓解土壤重金属毒性;
施用有机菌肥引入了一定数量的细菌,单一和复合植物模式根际细菌的多样性和丰富度得到了显著提升。根际的优势细菌门为变形菌门,优势细菌纲为变形菌纲、酸酐菌纲;
土壤重金属毒性、土壤pH值、阳离子交换量等均能引起根际细菌群落结构发生改变,其中土壤锰离子浓度对细菌群落结构的影响最大。

