围产期蒙古牛外周中性粒细胞凋亡相关基因的表达分析
刘 阳,张新颖,耿万友,毛景东,杜立银*
(1.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010010; 2.内蒙古民族大学 动物科学技术学院,内蒙古 通辽 028042)
蒙古牛是我国畜禽遗传资源保护的地方黄牛,是我国北方地区黄牛改良的主要母系之一,属于国家战略性生物资源。但由于围产期免疫抑制疾病如奶牛产后子宫炎、乳房炎等导致农牧区蒙古牛存栏量锐减,个别地区甚至出现种群消失的现象[1]。而作为机体免疫的第一道防线的中性粒细胞(Polymorphonuclear neutrophils,PMNs),其数量、功能的改变均会对动物机体的免疫功能起到至关重要的作用。细胞凋亡又称程序性细胞死亡,被广泛认为是调控围产期 PMNs数量的一种重要途径。参与调控细胞凋亡的基因主要有促细胞凋亡基因(主要包括Bax、P53、Cyt-c、caspases)和抗细胞凋亡基因,如Bcl-2。细胞凋亡通过上调或下调Bax、Cyt-c、P53和Bcl-2等基因的表达,从而调节PMNs数量,以达到维持机体免疫状态的目的。其中,Bcl-2与Bax表达量的比值对细胞凋亡具有决定作用[2]。Bcl-2基因可通过稳定线粒体结构而阻止线粒体释放Cyt-c,Bax基因则会破坏线粒体膜的稳定性。P53基因可通过激活其他促凋亡基因转录的方式来启动细胞凋亡,其表达量与细胞凋亡率呈正相关[3]。研究证实,细胞内凋亡信号能够直接促进或抑制细胞因子Fas(Fatty acid synthase)触发PMNs凋亡[4],而Cyt-c基因在触发PMNs凋亡和驱动PMNs老化的信号转导中有显著作用[5]。此外,围产期免疫抑制的发生与体内雌二醇(主要为17β-雌二醇,E2)、糖皮质激素(Glucocorticoid,GC)和孕酮(Progesterone,P4)浓度及其受体活性的改变密切相关,显著影响PMNs等免疫细胞的分布及功能变化。蒙古牛为古老地方黄牛品种,目前,关于其围产期外周PMNs凋亡相关基因的研究尚无报道。为此,研究围产期蒙古牛外周PMNs凋亡基因的表达情况,以揭示蒙古牛围产期免疫抑制下外周PMNs的免疫状态,从而为评价PMNs免疫抑制特征及机制提供理论参考。
1 材料和方法
1.1 试验材料
主要试剂有Percoll细胞分离液(Pharmacia公司),Trizol试剂(Invitrogen公司),AMV反转录试剂盒、TaqDNA聚合酶(KR公司),Bradford蛋白质定量试剂盒(北京天根生物科技公司),Tubulin抗体、辣根过氧化物酶(HRP)标记羊抗兔IgG(北京中杉金桥生物技术公司),Bcl-2抗体、Bax抗体、Cyt-c抗体(武汉博士德生物工程公司),P53抗体(碧云天生物科技研究所),DL2000 DNA Marker、蛋白质预染Marker(北京天根生物科技公司),RIPA裂解液、DAB辣根过氧化物酶显色试剂盒(碧云天生物科技研究所)。
主要仪器有Gene AMP PCR System 2700(Applied Bio system公司),TG16-WS台式高速离心机(湖南湘仪离心机仪器有限公司),TGL-16M台式高速冷冻离心机(湖南湘仪离心机仪器有限公司), JY-92-2D型超声波细胞粉碎机(宁波新芝生物科技股份有限公司),W-CJ-2FD洁净工作台(苏州安泰空气技术有限公司),DYY-12C型电泳仪、DYY-7C型电泳仪(北京六一公司),UV-3C紫外透射分析仪、凝胶成像分析系统(珠海黑马医学仪器公司),MDF-U2086S超低温冰箱(SANYO公司),核酸-蛋白测定仪(Biophotometer)(德国Eppendorf公司),YS100显微镜(Nikon公司),M200酶标仪(TECAN公司)。
选择3头2~3胎次妊娠蒙古牛,分别于分娩前22、18、14、10、8、6、4、2 d,分娩当天和产后2、4、6、8、10、14 d颈静脉采血50 mL,用于PMNs分离。分娩前采血时间标记“-”,分娩当天记作“0”。
1.2 试验方法
1.2.1 PMNs的分离、计数 采用Bhatnagar等[6]、Stillie等[7]报道的Percoll分离液法。Percoll分离液质量浓度为1.084 g/mL,按上述分离方法,得到红细胞与PMNs混合沉淀层,再用RIPA裂解液裂解细胞2~3次,即可分离出PMNs白色沉淀,加入适量RPMI 1640细胞培养液,尽量洗尽残留的红色液体。采用台盼蓝拒染法鉴定细胞活力,经检验细胞活力若达97%以上,则可以进行计数板计数。将PMNs沉淀按每管6×106~8×106个细胞分装冻存于-80 ℃。
1.2.2 血清中类固醇激素浓度的检测 试验采用放射免疫法(Radioimmunoassay,RIA)分析外周血血清中GC、E2和P4浓度变化。具体操作步骤如下:首先,稀释GC、E2 和P4标准品,溶解15 min摇匀后方可使用。溶解兔抗GC、E2 和P4抗体,其他组成成分充分混匀后可直接使用。然后取圆底聚苯乙烯试管若干,将待测样品管编号,用微量加样器加样,充分摇匀后,室温放置15 min,1 500×g离心15 min,弃上清,测各沉淀管的放射性计数(cpm),计算结果并进行统计分析。
1.2.3 外周血各型白细胞动态变化检测 将外周抗凝血轻轻上下颠倒混匀,取1 mL利用全自动动物血液细胞分析仪检测不同时间外周血PMNs、单核细胞(Mononuclear cell,MC)数和淋巴细胞数的变化。
1.2.4 RT-PCR检测PMNs凋亡相关基因mRNA表达量 将PMNs冻存样品在室温进行融化,而后在小型振荡器上振荡30 s,直到完全解离出PMNs核蛋白复合物。然后依照Sigma RNA提取试剂盒说明书进行总RNA 的提取。吸取3 μL RNA溶液,利用核酸浓度微量测定仪,检测RNA浓度及其OD值,OD260/OD280≥1.9、OD260/OD230≥2.0 的RNA,纯度符合要求,可用于反转录。
根据GenBank中牛源凋亡相关基因(Bax、P53、Cyt-c、Bcl-2)序列,运用Primer 5.0软件设计引物,引物序列见表1。合成cDNA第一条链后进行PCR反应,反应体系:10×PCR Buffer 2.0 μL,cDNA 1 μL,dNTP 0.5 μL,上、下游引物各0.5 μL,TaqDNA聚合酶0.2 μL,加ddH2O至20 μL。PCR反应条件:94 ℃预变性5 min;94 ℃ 30 s,合适温度退火30 s,72 ℃ 30 s,30个循环;72 ℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳,用Quantity One对凋亡相关基因mRNA和内参基因Tubulin条带进行灰度扫描,计算相对表达量。

表1 牛源凋亡基因的PCR引物信息
1.2.5 Western blotting检测PMNs凋亡相关蛋白表达量 在4 ℃条件下,解冻PMNs,14 000 ×g离心2 min弃上清,加入RIPA裂解液,充分振荡,14 000×g离心10 min,取上清用Bradford法测定蛋白质浓度;然后用2×SDS样品缓冲液按1∶1混合煮沸变性,10% SDS-PAGE凝胶电泳;转移至聚偏二氟乙烯(PVDF)膜上,TBST缓冲液漂洗3 次,每次5~10 min,将PVDF膜置5%脱脂奶中室温封闭3 h后取出,TBST漂洗3次,每次10 min,与P53、Bax、Cyt-c、Bcl-2和Tubulin(对照)蛋白一抗孵育(1∶500)(4 ℃过夜),PVDF膜经TBST漂洗3次,每次10 min;与HRP标记的IgG(1∶1 000)室温孵育2 h,经TBST漂洗、DAB显色,观察拍照,用Glyko Bandcan 5.0软件分析。
1.3 数据处理
采用SPSS 19.0统计软件对数据进行分析处理,利用单因素方差分析(One-way ANOVA)、LSD法比较差异显著性。
2 结果与分析
2.1 围产期蒙古牛外周PMNs的分离鉴定
外周血轻轻置于分离液液面上,离心后取出白色层即下数第3层,经瑞氏染色镜检鉴定为PMNs,核呈深染的弯曲杆状(马蹄铁形)或分叶状,叶间有纤细的缩窄部相连。
2.2 围产期蒙古牛血液PMNs数量和血清类固醇激素浓度的变化
2.2.1 PMNs和MC总数 由图1可知,蒙古牛分娩前22~10 d PMNs和MC总数逐渐升高,分娩前10 d达到峰值,分娩前10~0 d逐渐下降,分娩后又逐渐升高。这说明伴随分娩临近,PMNs和MC免疫抑制作用逐渐减弱,分娩当天细胞数量降至最低,免疫抑制作用最弱,分娩后又逐渐增强。

图1 围产期蒙古牛外周血中PMNs和MC总数
2.2.2 淋巴细胞总数 由图2可知,蒙古牛分娩前8~0 d淋巴细胞总数逐渐下降,0 d降至最低,分娩后2 d明显升高,分娩前22~8 d、分娩后2~14 d变化不明显。这说明随着分娩临近,淋巴细胞免疫抑制作用显著减弱,0 d达到最低,产后淋巴细胞数量逐渐增多,机体免疫作用增强。

图2 围产期蒙古牛外周血中淋巴细胞总数
2.2.3 E2质量浓度 由图3可知,蒙古牛分娩前22~2 d E2质量浓度明显升高,并在分娩前2 d达到峰值,分娩前2~0 d明显下降,分娩后2~14 d变化趋势相对平缓。这表明随着分娩逐渐临近,E2活性明显升高,而分娩时活性明显下降,分娩后2 d活性降至基础水平,之后无明显变化。

图3 围产期蒙古牛外周血清中E2质量浓度
2.2.4 P4质量浓度 由图4可知,蒙古牛分娩前22 d至分娩后2 d P4质量浓度逐渐下降,分娩后2~14 d无明显变化。这表明,随着分娩临近,P4活性逐渐下降,分娩当天活性降低最明显,分娩后2 d达到正常生理活性,之后无明显变化。
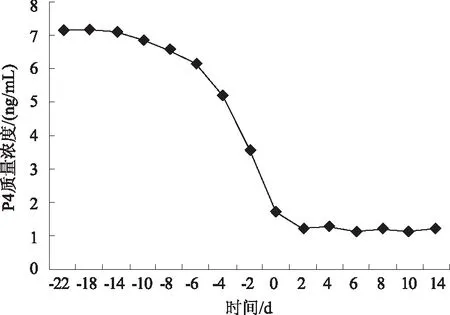
图4 围产期蒙古牛外周血清中P4质量浓度
2.2.5 GC质量浓度 由图5可知,蒙古牛分娩前8~0 d GC质量浓度逐渐升高,0 d达到峰值,分娩后0~2 d迅速下降,分娩后2 d之后无明显变化。这表明随着分娩临近,GC活性逐渐升高,分娩当天活性最强,分娩后2 d降低至正常生理水平,之后变化不明显。

图5 围产期蒙古牛外周血清中GC质量浓度
2.3 PMNs凋亡相关基因mRNA表达水平
2.3.1Bax基因 由图6可知,蒙古牛分娩前22~0 dBax基因mRNA表达量逐渐下降,分娩当天降至最低,分娩后0~14 d逐渐升高。这表明随着分娩临近,Bax基因表达抑制作用显著增强,分娩当天最明显,产后表达量逐渐升高。
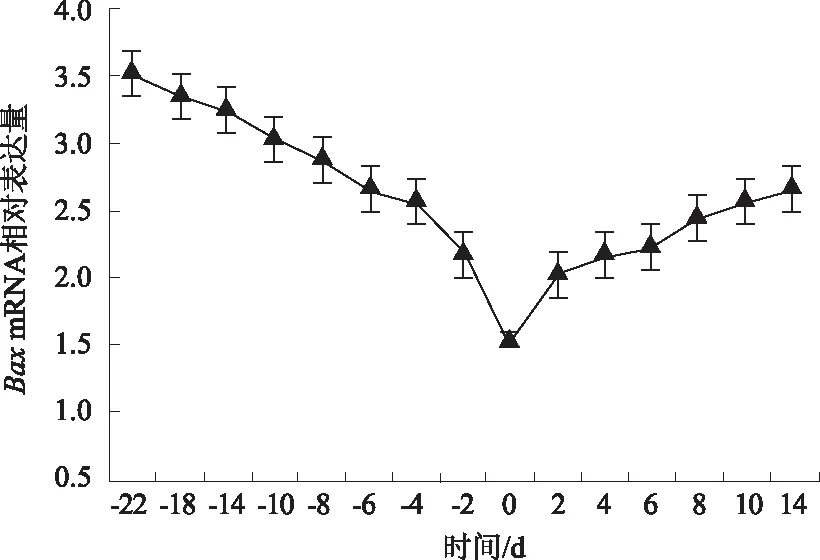
图6 Bax基因相对表达量
2.3.2Bcl-2基因 由图7可知,蒙古牛分娩前22~0 dBcl-2 mRNA表达量逐渐上升,分娩当天升至最高,分娩后0~14 d逐渐降低。这表明,随着分娩的临近,Bcl-2基因表达抑制作用逐渐减弱,分娩当天作用最明显,分娩后抑制作用逐渐增强,表达量逐渐下降。

图7 Bcl-2基因相对表达量
2.3.3P53基因P53 mRNA表达量总体的变化趋势如图8,蒙古牛分娩前22~0 dP53 mRNA表达量逐渐下降,分娩当天降至最低,分娩后0~14 d逐渐升高。其中,分娩后0~8 dP53 mRNA表达量逐渐升高,8~14 d升高趋势相对平缓,无明显差异;与分娩后8、10、14 d相比,分娩前22、18、14、10 dP53表达量较高,即产前表达量明显高于产后。这说明随着分娩临近,P53基因表达抑制作用逐渐增强,分娩时最明显,产后抑制作用逐渐消除,表达量逐渐升高。
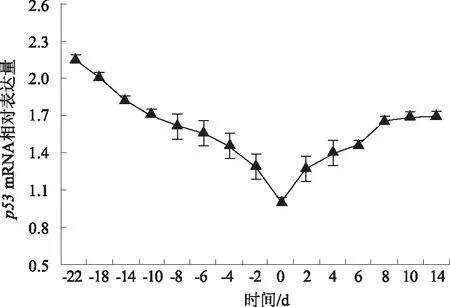
图8 P53基因相对表达量
2.3.4Cyt-c基因 由图9可知,蒙古牛分娩前22~0 dCyt-cmRNA表达量逐渐下降,并呈现一定的时间依赖性,分娩当天降至最低,分娩后0~14 d逐渐升高。这表明随着分娩临近,Cyt-c基因表达抑制作用明显增强,分娩当天最明显,分娩后表达抑制作用逐渐解除,表达量逐渐升高。
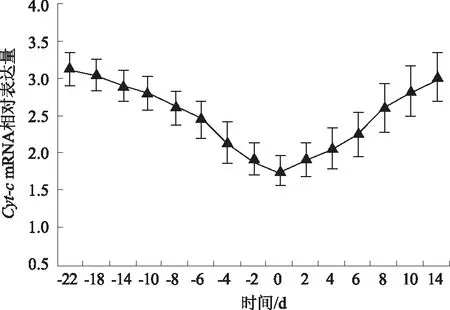
图9 Cyt-c基因相对表达量
2.4 PMNs凋亡相关蛋白的表达水平
PMNs凋亡相关蛋白P53、Bax、Cyt-c、Bcl-2的相对表达量及变化趋势如图10。对目的条带进行灰度分析,结果如图11—14。由图10和11可知,Bax蛋白表达趋势与BaxmRNA基本一致。分娩前Bax蛋白表达量呈现下降趋势,分娩后明显升高。这表明随着分娩的临近,机体启动分娩过程,明显抑制了Bax蛋白的表达,分娩当天抑制作用最明显,分娩后随着抑制作用的解除表达量逐渐升高。
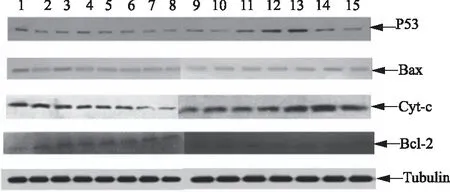
1—15:妊娠蒙古牛分娩前22、18、14、10、8、6、4、2 d及分娩当天及产后2、4、6、8、10、14 d图10 PMNs凋亡相关蛋白的Western blot 检测结果
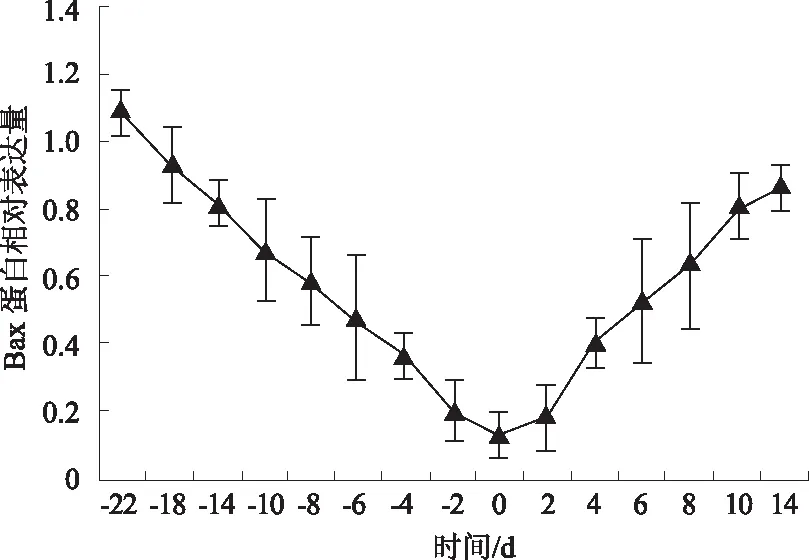
图11 Bax蛋白相对表达量
由图10和12可知,Bcl-2蛋白表达变化趋势与Bcl-2 mRNA基本一致。分娩前Bcl-2蛋白表达量明显上升,分娩后呈现下降趋势。这说明随着分娩临近,Bcl-2蛋白表达抑制作用逐渐解除,分娩当天最明显,分娩后抑制作用逐渐增强,表达量下降。
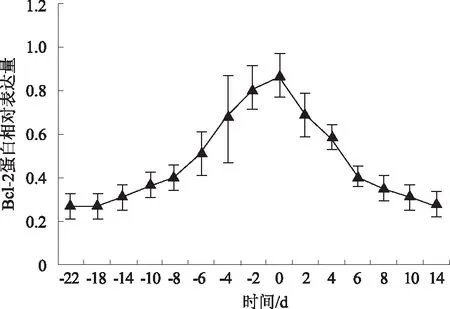
图12 Bcl-2蛋白相对表达量
由图10和13可知,Cyt-c蛋白表达变化趋势与Cyt-cmRNA基本一致。分娩前6~0 d Cyt-c蛋白表达量较分娩前22~6 d明显下降,分娩后0~6 d较6~14 d明显上升。这表明随着分娩临近,Cyt-c蛋白表达抑制作用逐渐增强,分娩当天最明显,产后随着抑制作用的逐渐解除,表达量逐渐升高。

图13 Cyt-c蛋白相对表达量
由图10和14可知, P53蛋白表达变化趋势与P53 mRNA基本一致。分娩前P53蛋白表达量呈下调趋势,分娩后表达抑制作用解除,表达量逐渐升高。

图14 P53蛋白相对表达量
3 结论与讨论
围产期是牛繁殖障碍性疾病的高发期,其免疫抑制主要表现为外周血免疫细胞分布、数量及功能的改变,尤其是PMNs的显著增加及其功能性基因表达的上调或下调,从而诱发多种疾病[8]。外周血中PMNs的生命周期一般为6~8 h,随即发生细胞凋亡或迁移至组织、器官参与炎性反应,但是当到达炎症部位参与炎症反应时,PMNs的生命周期将延长2~4倍[9]。因此,认为外周血PMNs的分布和功能变化与细胞凋亡密切相关,即促进细胞凋亡利于维持免疫系统稳定,反之抑制细胞凋亡可致免疫抑制[1]。Bax、P53、Cyt-c等促细胞凋亡基因以及Bcl-2等抗细胞凋亡基因是参与细胞凋亡调控的两大类主要基因。本试验结果表明,围产期蒙古牛外周PMNs的Bcl-2 mRNA和蛋白表达量均以分娩当天为拐点先升后降,分娩前22 d和分娩后14 d明显低于0 d;Bax、P53和Cyt-cmRNA和蛋白表达趋势与Bcl-2相反。表明整个围产期外周PMNs免疫活性经历了以分娩为节点的抑制加剧与减缓过程。
此外,大量试验证实了围产期免疫抑制、细胞功能与外周血主要类固醇激素P4、E2和GC质量浓度的变化密切相关[10-12]。本研究结果表明,外周血血清E2质量浓度于分娩前22 d逐渐升高,分娩前2 d升至最高;P4质量浓度于分娩前22 d开始逐渐下降,分娩当天迅速下降;GC质量浓度于分娩前22 d逐渐升高,分娩当天升至最高。GC刺激T细胞和B细胞的增殖、抑制相关因子的产生[11],使产后牛外周PMNs的氧化状态发生改变;E2通过Bcl-2家族成员诱发外周淋巴细胞凋亡、促进巨噬细胞炎性介导因子和细胞因子的产生;而P4能够直接抑制T淋巴细胞促炎性因子的产生[6,12-14]。同时,E2、P4和GC依赖其特异性受体双向调节PMNs活性,即低浓度时增强细胞活性而高浓度则抑制细胞活性。外周血PMNs和MC总数从分娩前22 d开始逐渐增多,分娩前10 d达最大值,而淋巴细胞数量在此期间并未出现明显变化,这可能提示了PMNs的增多明显抑制了淋巴细胞的增殖分化,致使机体出现免疫抑制,导致免疫应答反应相关分子表达发生明显变化。同时,围产期类固醇激素及激素间相互作用,共同调控凋亡相关基因的表达,例如P4可抑制Bax表达,上调Bcl-2表达;GC降低BaxmRNA丰度[10]。本试验中促/抗细胞凋亡基因Bax/Bcl-2下调/上调趋势与类固醇激素质量浓度变化趋势基本一致。
本试验探究了类固醇激素水平和凋亡因子表达的动态变化特征,以及PMNs凋亡相关基因表达调控之间的关系,对临床应用及科学研究具有一定的指导意义。需要指出的,为了进一步阐明围产蒙古牛外周类固醇激素-受体表达与PMNs动态变化及相关分子表达的关系,本课题组正在开展PMNs类固醇激素核/膜受体及CD11b等信号分子表达研究,找到直接证据以支持本研究结果,也为阐明围产牛机体免疫状态及相关分子表达信号通路提供依据。

