肉鸡鸡胚十二指肠上皮细胞的体外分离、鉴定及其原代培养吸收模型的构建与评估
张树敏 廖秀冬 吕 林 张丽阳 罗绪刚
(中国农业科学院北京畜牧兽医研究所,矿物元素营养研究室,北京 100193)
小肠是动物重要的消化器官,是营养物质主要的消化与吸收的场所。而小肠上皮细胞(intestinal epithelial cells,IEC)作为体内更新最快的一类细胞,是肠道内外环境的媒介,又是机体免疫屏障的重要组成部分,具有消化、吸收、分泌、免疫等重要的生理功能[1]。小肠上皮细胞在一定条件下可进行体外分离和培养。体外分离培养小肠上皮细胞对于研究肠道生物学功能、营养物质吸收机制及其调控以及小肠上皮细胞增殖和分化提供了简单、快速的手段,并为研究营养素及其他外界因素对肠上皮的作用提供了理想的体外模型[2]。一般而言,体外培养胚胎组织比成体组织更易生存和生长,因而其细胞分离后容易培养成功。而成体组织中大部分是非繁殖的分化细胞,当细胞分化时生长受到严重抑制或完全停止,并且成体组织的年龄越大,体外培养的成功率越低,这可能与胚胎干细胞的分化水平有关,故成体来源组织培养细胞增殖极为困难,且培养周期缩短[3]。李艳等[4]选取9胚龄鸡胚,Guo等[5]选取17胚龄鸡胚,马玉龙等[6]和古少鹏等[7]选取18胚龄鸡胚,Derache等[8]选用大于18胚龄的将出壳鸡胚,贾国东等[9]选取20胚龄鸡胚进行小肠上皮细胞原代培养,均已成功构建小肠上皮细胞体外原代培养模型。以上文献中选取的鸡胚多集中在18胚龄左右,故本试验选用18胚龄鸡胚十二指肠上皮细胞进行原代培养。但是关于原代培养肠上皮细胞用于物质吸收试验未见报道,有诸多研究用Caco-2细胞进行培养作为物质吸收模型[10-13],并进行其单层模型细胞紧密连接性的评估[14-15]。本实验室前期Liu等[16]用半体内半体外的原位结扎灌注肠段法研究发现,磷在肉鸡原位结扎灌注肠段中的主要吸收肠段是十二指肠,胡义信[17]用自然饲喂法进一步深入研究证实磷在肉鸡自然饲喂过程中的主要吸收肠段是十二指肠,与Liu等[16]研究结果一致。在以上2个试验的基础上,用体外原代培养十二指肠上皮细胞的方法,可进一步证实磷在肉鸡鸡胚原代培养十二指肠上皮细胞中的转运吸收规律及其分子机制。因此,本研究采用Caco-2细胞评估其单层模型细胞连接紧密性的方法,来评估十二指肠上皮细胞不同接种密度在不同培养时间下对细胞连接紧密性及细胞活力的影响,为建立肉鸡鸡胚体外原代培养十二指肠上皮细胞吸收模型选择最佳的细胞接种密度,并最终构建十二指肠上皮细胞原代培养的物质吸收模型。
1 材料与方法
1.1 试验设计
试验采用单因子完全随机试验设计,共设3个组,Ⅰ组、Ⅱ组、Ⅲ组十二指肠上皮细胞接种密度分别为2.90×106、6.25×106、8.75×106个/mL,每个组6个重复,每个重复包含2个培养孔。
1.2 试验动物
18胚龄的爱拔益加(AA)肉鸡鸡胚,由河北滦平华都肉鸡公司提供。
1.3 主要试剂和仪器
主要试剂:杜氏磷酸盐缓冲液(D-PBS)、DMEM/F12培养基、胎牛血清、台盼蓝、胶原酶Ⅰ,购于Gibco公司;青-链霉素、肝素钠,购于Sigma公司;表皮细胞生长因子、噻唑蓝(MTT)试剂盒,购于上海凡歌生物化工公司;5-溴-4-氯-3-吲哚-磷酸盐/四唑硝基蓝(BCIP/NBT)碱性磷酸酯酶显色试剂盒,购于碧云天生物技术研究所;链霉亲和素-生物素复合物(SABC)免疫组化试剂盒、二氨基联苯胺(DAB)显色试剂盒、4%多聚甲醛,购于武汉博士德生物工程有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒,购于南京建成生物工程研究所;细胞角蛋白18抗体,购于博奥森公司;胰岛素,购于迈晨科技(北京)有限公司;其他试剂均为国产分析纯。
主要仪器:150、500目细胞过滤筛(北京索莱宝科技有限公司),超纯水净化装置(Milli-Q,美国Biocell公司),自动灭菌锅(TOMY SS-325),台式离心机(Eppendorf),0.22 μm滤器(美国Millipore公司),CO2培养箱(美国Thermo公司),相差倒置显微镜(日本Olympus公司),超净工作台(YJ-1450型医用净化工作台,苏州长桥净化设备厂),Millicell-ERS电阻仪(美国Millipore公司),50 mL离心管、60 mm细胞培养皿、6孔细胞培养板、96孔细胞培养板(美国Corning公司),全波长酶标仪(美国Biotek公司)。
1.4 AA肉鸡鸡胚十二指肠上皮细胞的消化、分离
参考Guo等[5]和Qin等[18]的消化分离细胞的方法,取18胚龄AA肉鸡鸡胚,用75%酒精擦其外壳,晾干后在无菌条件下取出十二指肠,用解剖器械取出肠组织,置于盛有预冷的含2%青-链霉素的D-PBS中,用镊子剔除十二指肠中夹带的胰脏及其筋膜,用含2%青-链霉素的D-PBS反复清洗2~3次。用剪刀将十二指肠组织剪成0.5 cm长的小段,转移至盛有30 mL DMEM/F12培养基的50 mL离心管中,剧烈振荡数次,将清洗液吸出,重复2~3次。然后将肠段剪成小于1 mm3的组织块碎片,静置数分钟自行沉淀,用DMEM/F12肠段清洗液冲洗3~4次至上清液澄清,吸弃洗液。
向沉淀中加入10倍体积的1 mg/mL胶原酶Ⅰ消化液消化,在37 ℃水浴箱中慢速(80循环/min)振荡消化50 min,消化完毕后,于1 000×g离心8 min,弃上清去除酶消化液。继续向沉淀中加入10 mL DMEM/F12肠段清洗液悬浮沉淀,轻轻吹打混匀,于1 000×g离心8 min,弃上清,重复该洗涤操作1~2次。加入10 mL DMEM/F12贴壁培养液悬浮沉淀,反复轻柔吹打5~10次,用150和500目的细胞筛连续过滤悬液以去除组织块和成纤维细胞,留在500目筛上的细胞团用DMEM/F12贴壁培养液冲洗下来,制成细胞悬液,用台盼蓝染色法进行十二指肠上皮细胞活细胞率的检测。
1.5 AA肉鸡鸡胚十二指肠上皮细胞活细胞率的检测
用彭彬等[19]使用的台盼蓝染色法进行十二指肠上皮细胞活细胞率检测。主要步骤为:取200 μL细胞悬液,加入等量0.4%的台盼蓝溶液,混匀后取1滴于细胞计数板上,轻轻盖上盖玻片,于相差倒置显微镜下观察。分别计数未染色的细胞数(活细胞)和染色的细胞数(死细胞)。活细胞率计算:
活细胞率(%)=100×活细胞数/(活细胞数+死细胞数)。
当活细胞率达到95%以上时,可用于以下的十二指肠上皮细胞培养。
1.6 AA肉鸡鸡胚十二指肠上皮细胞的培养
采用DMEM/F12培养基作为基础培养基,另外添加胎牛血清浓度为3%,用制成的DMEM/F12贴壁培养液将获得的十二指肠上皮细胞团进行悬浮,制成细胞悬液,当活细胞率达到95%以上且按照以上试验设计调整细胞密度,随即取1.5 mL细胞悬液接种于Transwell 6孔细胞培养板的上槽中,另取没有细胞的DMEM/F12培养基2.6 mL于Transwell 6孔细胞培养板的下槽中,于37 ℃、5% CO2培养箱中培养,共培养4 d。
1.7 AA肉鸡鸡胚十二指肠上皮细胞碱性磷酸酶染色鉴定
采用洪智敏等[2]的方法进行鸡胚十二指肠上皮细胞碱性磷酸酶染色鉴定。原代培养的十二指肠上皮细胞贴壁生长48 h后,选取已接种培养细胞的1块6孔细胞培养板,吸出6个培养孔中培养液并以磷酸盐缓冲液(PBS)清洗2次,洗去未贴壁细胞及碎片杂质,并加入4%多聚甲醛固定液固定30 min。随后以PBS洗涤2次去除固定液,即可用于鉴定。其中3个培养孔作为阳性试验组,3个培养孔作为阴性对照组。具体操作步骤按照BCIP/NBT碱性磷酸酯酶显色试剂盒说明进行。
1.8 样品采集与制备
在细胞培养的第24、48、72、96 h,立即收集培养孔上槽中细胞培养液0.5 mL于灭菌的1.5 mL离心管中,将2个培养孔的细胞培养液收集合为1个重复,共收集6个重复,于3 500 r/min、4 ℃条件下离心10 min,取上清置于-20 ℃冰箱中保存,以备测定细胞培养液中LDH活力;随即弃去Transwell 6孔细胞培养板上、下槽中剩余细胞培养液,用含酚红培养基和无酚红培养基测定细胞酚红透过率,细胞样品收集于灭菌的1.5 mL离心管中,置于-20 ℃冰箱中保存以备测定其酚红透过率;用Millcell-ERS电阻仪测量每个培养孔的跨膜电阻(transepithelial electrical resistance,TEER)值。连续测定收集4 d。
1.9 样品分析
分别于细胞培养24、48、72、96 h后,取上、下槽培养液0.5 mL于具塞试管中,分别加入1 mol/L NaOH溶液5 mL显色,摇匀后以1 mol/L NaOH溶液为空白,在560 nm下测定吸光度(OD)。按以下公式计算细胞酚红透过率:
酚红透过率(%)=100×OD下层/(OD上层+OD下层)。
细胞生长孔TEER值计算:
TEER值(Ω·cm2)=(细胞生长孔值-空白孔值)×微孔面积。
式中:微孔面积为Transwell 6孔细胞培养板插入槽的面积,为4.67 cm2。
将每天收集的6个重复的细胞培养液解冻,参照南京建成生物工程研究所试剂盒说明书步骤进行LDH活力测定。
1.10 数据统计分析
用SAS 9.0[20]软件中一般线性模型(general linear model,GLM)程序对所得数据进行单因素方差分析,以每个重复分析样本作为1个试验单元。方差分析差异显著者,以最小显著差数法(least significant difference,LSD)比较平均值间的差异显著性。以P<0.05作为数据差异显著性检验标准。
2 结 果
2.1 体外原代培养AA肉鸡鸡胚十二指肠上皮细胞分离观察结果
镜下观察发现,可获得大量的十二指肠上皮细胞团和极少量的单个肠上皮细胞,刚分离的十二指肠上皮细胞团呈球形,且细胞团的大小均一,悬浮于培养液中(图1-A)。Ⅰ组细胞团之间空隙较大,Ⅱ组细胞团之间仍有较多空隙,Ⅲ组细胞团之间的空隙明显变小,经台盼蓝染色鉴定,3个组细胞活率均在95%以上,以上结果表明,此次分离获得的十二指肠上皮细胞适用于原代细胞培养模型的构建。
2.2 体外原代培养AA肉鸡鸡胚十二指肠上皮细胞形态学观察结果
在倒置生物显微镜下每隔24 h观察各处理细胞生长状态、形态特征。在细胞培养的24 h,十二指肠上皮细胞团沉于培养板底部,已经开始贴壁,贴壁的细胞团开始向外伸展,逐渐铺成片;Ⅰ组的细胞团贴壁伸展较好,贴壁后的细胞表面较为平整;Ⅱ组仍可见部分未完全伸展开的细胞团;Ⅲ组可见大量未伸展开的细胞团(图1-B)。在细胞培养的48 h,Ⅰ组和Ⅱ组的已贴壁细胞之间界限清晰,排列紧密,细胞呈单层分布,多呈卵石状、椭圆状,排列紧密,细胞呈“铺路石样”生长;Ⅲ组细胞间界限模糊,有较多未贴壁的死亡细胞团依附在上面(图1-C)。在细胞培养的72 h,Ⅰ组和Ⅱ组的细胞界限依然较为清晰,排列紧密,细胞呈单层分布,依然可见“铺路石样”生长的细胞;Ⅲ组细胞模糊不清,细胞脱落明显(图1-D)。在细胞培养的96 h,3个组的细胞都开始有部分脱落,细胞形状开始变得模糊不清,此时细胞基本上不再增殖;Ⅰ组和Ⅱ组已贴壁的十二指肠上皮细胞之间界限变得模糊不清,开始有部分脱落;Ⅲ组细胞脱落后留下许多空泡,细胞脱落明显(图1-E)。以上结果表明,Ⅰ组和Ⅱ组细胞在培养的48和72 h,细胞之间界限清晰、生长状态良好、贴壁均匀,具备了做试验处理的条件。
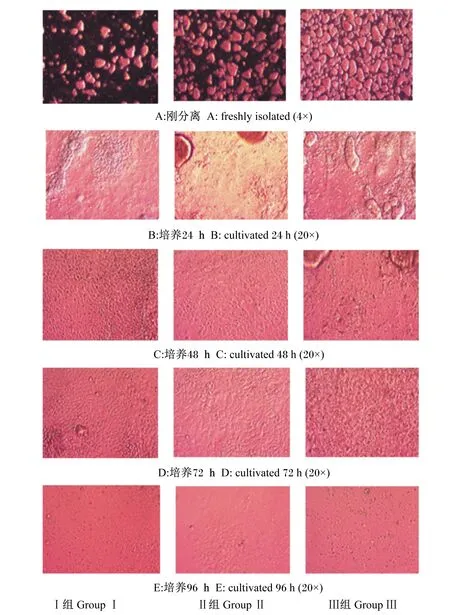
图1 原代培养不同时间肉鸡鸡胚十二指肠上皮细胞形态变化Fig.1 Morphological change of primary cultured duodenal epithelial cells of broiler embryos under different cultivated time
2.3 AA肉鸡鸡胚十二指肠上皮细胞碱性磷酸酶染色鉴定结果
在原代培养的十二指肠上皮细胞贴壁生长48 h后,以Ⅰ组的细胞为例,采用洪智敏等[2]的方法进行十二指肠上皮细胞碱性磷酸酶染色鉴定,结果见图2。阳性试验组的十二指肠上皮细胞胞浆被染成了蓝黑色(染色率在95%以上),成纤维细胞或血细胞等杂细胞不着色,另外,阴性对照组的十二指肠上皮细胞未被染色。以上结果表明,本试验所获得的细胞是分化完全、功能健全的十二指肠上皮细胞。

图2 原代培养48 h肉鸡鸡胚十二指肠上皮细胞碱性磷酸酶染色情况Fig.2 Alkaline phosphatase staining of primary cultured duodenal epithelial cells of broiler embryos after 48 h cultivations
2.4 十二指肠上皮细胞TEER值测定结果
在细胞培养的24、48、72、96 h,对已贴壁的十二指肠上皮细胞测定其TEER值,见图3。从相同细胞密度不同培养时间角度看,3个组细胞的TEER值均随着细胞培养时间的变化有显著差异(P<0.05),Ⅰ组和Ⅱ组细胞的TEER值的变化趋势相似,Ⅰ组细胞的TEER值在细胞培养的48和72 h均显著高于24和96 h(P<0.05),并且在48和72 h,细胞的TEER值维持恒定不变(P>0.05);Ⅱ组细胞的TEER值在细胞培养的48 h显著高于24和96 h(P<0.05);Ⅲ组细胞的TEER值在细胞培养的24 h时最高,在48、72和96 h均显著降低(P<0.05)。
从相同培养时间不同细胞密度角度看,在细胞培养的24 h,Ⅰ组细胞的TEER值显著低于Ⅱ组和Ⅲ组(P<0.05);在细胞培养的48、72和96 h,Ⅰ组细胞的TEER值显著高于Ⅱ组(P<0.05),Ⅱ组细胞的TEER值显著高于Ⅲ组(P<0.005)。从数值上看,Ⅰ组和Ⅱ组细胞的TEER值在48 h均达到最高状态并持续到72 h,且Ⅰ组细胞的TEER值均大于Ⅱ组。
2.5 十二指肠上皮细胞酚红透过率测定结果
在细胞培养的24、48、72、96 h,对已贴壁的十二指肠上皮细胞测定其酚红透过率,见图4。从相同细胞密度不同培养时间角度看,Ⅰ组、Ⅱ组和Ⅲ组细胞的酚红透过率均随着细胞培养时间的变化有显著差异(P<0.05),Ⅰ组和Ⅱ组细胞的酚红透过率的变化趋势相似,在细胞培养的24、48和72 h,细胞的酚红透过率随细胞培养时间的推移而显著降低(P<0.05),在细胞培养的96 h,细胞的酚红透过率显著增加(P<0.05);Ⅲ组细胞的酚红透过率在细胞培养的24和48 h时均较低,在细胞培养的72和96 h均显著增高(P<0.05)。
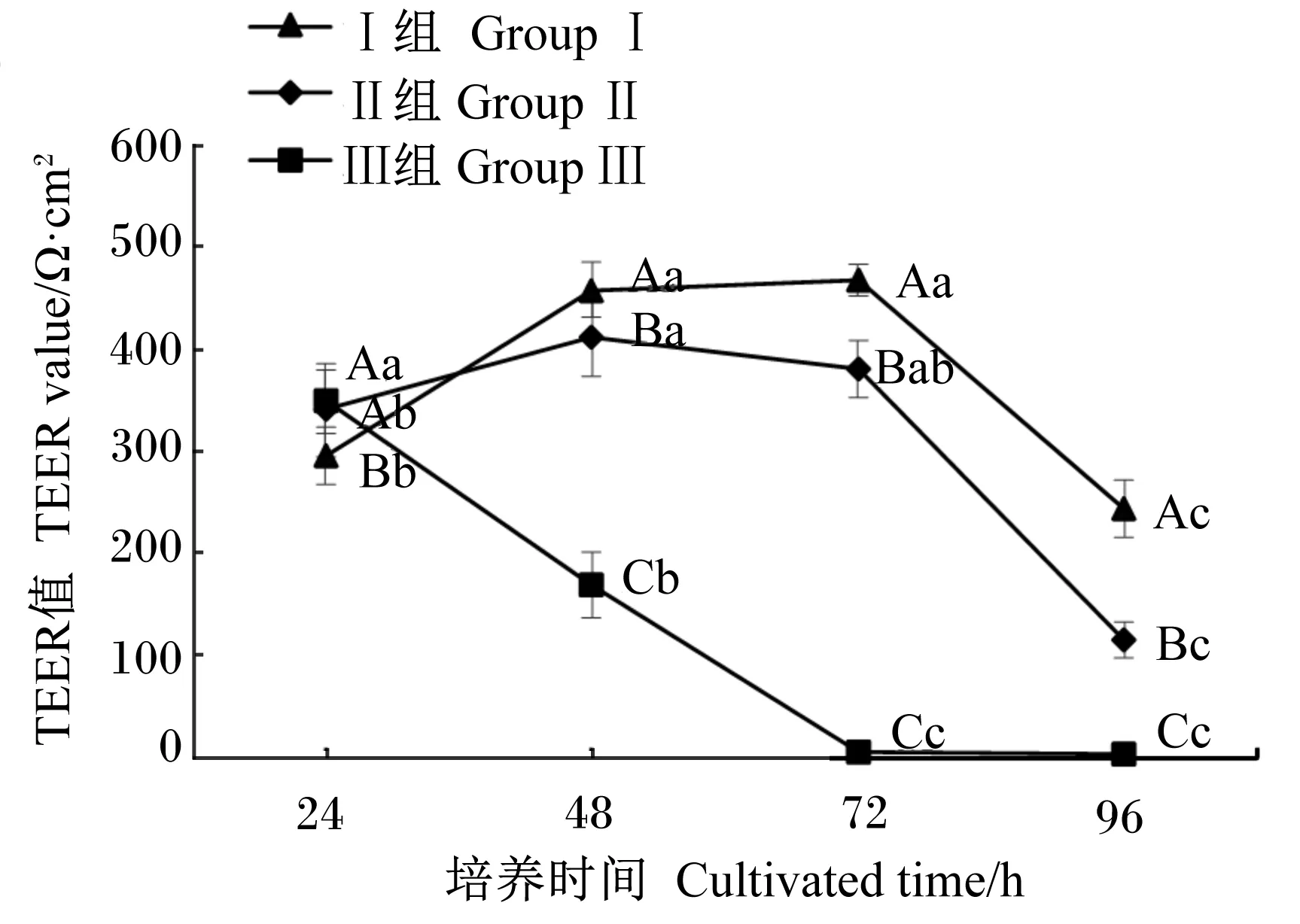
数据点不同小写字母表示相同细胞密度不同培养时间之间差异显著(P<0.05),不同大写字母表示相同培养时间不同细胞密度之间差异显著(P<0.05)。下图同。
Value datapoints with different small letters mean significant difference in the same cell density at different culture time (P<0.05), and with different capital letters mean significant difference at the same culture time in different cell density (P<0.05). The same as below.
图3原代培养肉鸡鸡胚十二指肠上皮细胞的TEER值
Fig.3 TEER values of primary cultured duodenal epithelial cells of broiler embryos (n=6)
从相同培养时间不同细胞密度角度看,在细胞培养的48、72和96 h,Ⅰ组和Ⅱ组的细胞酚红透过率均显著低于Ⅲ组(P<0.05)。
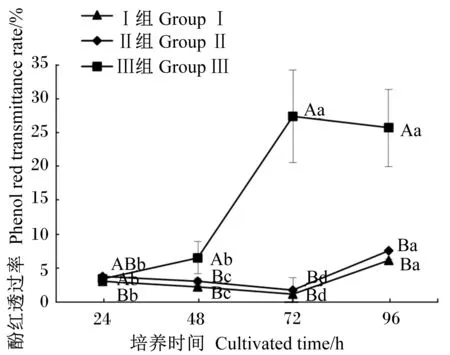
图4 原代培养肉鸡鸡胚十二指肠上皮细胞的酚红透过率Fig.4 Phenol red transmittance rate of primary cultured duodenal epithelial cells of broiler embryos (n=6)
2.6 十二指肠上皮细胞培养液中LDH活力测定结果
在细胞培养的24、48、72、96 h,测定细胞培养液中的LDH活力,见图5。从相同细胞密度不同培养时间角度看,Ⅰ组、Ⅱ组和Ⅲ组细胞培养液中的LDH活力均随着细胞培养时间的变化有显著差异(P<0.05),Ⅰ组细胞培养液中的LDH活力在细胞培养的24、48和72 h没有显著变化(P>0.05),在细胞培养的96 h显著增加(P<0.05);Ⅱ组细胞培养液中的LDH活力在细胞培养的24、48 h均在较低水平,在细胞培养的72、96 h显著增高(P<0.05);Ⅲ组细胞培养液中的LDH活力在细胞培养的24、48和72 h随细胞培养时间的推移而显著增高(P<0.05),在细胞培养的96 h显著降低(P<0.05)。
从相同培养时间不同细胞密度角度看,Ⅰ组、Ⅱ组和Ⅲ组细胞培养液中的LDH活力在24、48、72 h均有显著差异(P<0.05),在细胞培养的24和48 h,Ⅰ组细胞培养液中的LDH活力显著低于Ⅱ组(P<0.05),Ⅱ组细胞培养液中的LDH活力显著低于Ⅲ组(P<0.05);在细胞培养的72 h,Ⅰ组细胞培养液中的LDH活力显著低于Ⅲ组(P<0.05),Ⅲ组细胞培养液中的LDH活力显著低于Ⅱ组(P<0.05);在细胞培养的96 h,Ⅰ组和Ⅱ组细胞培养液中的LDH活力均显著高于Ⅲ组(P<0.05)。从数值上看,Ⅰ组细胞培养液中的LDH活力在细胞培养的24、48、72 h均维持在较低的水平,在细胞培养的96 h开始明显升高。
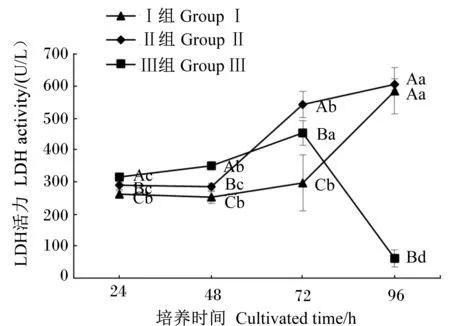
图5 原代培养肉鸡鸡胚十二指肠上皮细胞培养液中的LDH活力Fig.5 LDH activity of primary cultured duodenal epithelial cells medium of broiler embryos (n=6)
3 讨 论
常用的细胞纯化的方法主要有差速贴壁法、机械刮除法和用细胞筛筛选等方法。差速贴壁法主要利用成纤维细胞比肠道上皮细胞贴壁速度快的特点,大部分成纤维细胞能在短时间内(1~2 h)完成附着过程,而大部分肠上皮细胞在短时间内不能附着或附着不稳定,稍加振荡即浮起,此时收集未贴壁的含大量肠上皮细胞团的细胞悬液,重新接种于新的培养板中,利用此差别可以纯化细胞,从而获得较多的肠上皮细胞团。许多研究利用差速贴壁法去除成纤维细胞等杂细胞,从而获得肠上皮细胞团[4-5,9]。但用这种方法进行操作,会损失掉一部分已贴壁的肠上皮细胞团,使细胞悬液中肠上皮细胞团的密度降低,且成纤维细胞无法去除干净。在原代培养时,上皮细胞和成纤维细胞往往会分区成片混杂生长,每种细胞都以小片或成区域的分布方式生长在瓶壁上,采用机械刮除的方法去除不需要的成纤维细胞区域而保留需要的上皮细胞区域,用这种方法往往容易造成污染、细胞在培养孔孔底分布不均匀等情况。用150~500目的细胞筛连续过滤细胞悬液,先用150目细胞筛来筛除未被消化的较大组织块,然后用500目筛筛除直径较小的血细胞、成纤维细胞和单个肠上皮细胞,而直径相对较大的肠上皮细胞团无法经过500目筛,留在500目筛上的细胞团用细胞培养液冲洗下来,制成细胞悬液,接种于培养板中就可进行细胞培养[21-22]。用这种方法可以很有效地去除大量成纤维细胞和难以贴壁增殖的单个肠上皮细胞,最终留在细胞悬液中大部分为肠上皮细胞团。本研究采用了150~500目细胞筛连续过滤的方法进行去除成纤维细胞,获得大量十二指肠上皮细胞团,并经形态学观察及碱性磷酸酶染色鉴定,很少有成纤维细胞、血细胞等杂细胞污染,细胞纯化较为彻底。
目前,鉴定小肠上皮细胞的常用方法有形态学鉴定、碱性磷酸酶染色法、免疫细胞化学法等[23-25]。本试验的十二指肠上皮细胞增殖迅速,在培养的2~3 d数量显著增多,形成集落,呈单层“铺路石样”生长,边界清晰,互不重叠,多呈扁平多角状、卵石状、椭圆状,符合原代培养肠上皮细胞的形态特征。然而,仅凭在显微镜下观察具有肠上皮细胞特征的细胞不能确定为小肠上皮细胞,只能确定为类肠上皮细胞,还需要进一步鉴定。碱性磷酸酶是小肠上皮细胞微绒毛上的标志性酶[2,24],该酶凝集于肠细胞表面,参与细胞内消化及上皮细胞脱落到肠腔内的细胞外消化过程,能被成功染色的细胞即为十二指肠上皮细胞。洪智敏等[2]、杨文平等[26]和贾国东等[9]均采用碱性磷酸酶染色鉴定法成功鉴定十二指肠上皮细胞。
Caco-2细胞单层的紧密连接性一般用细胞TEER值和标志物的表观通透系数来评价。其中TEER值测定是目前公认的一种简单而权威性的评价方法,细胞层的紧密连接与TEER值具有密切相关,当TEER值增长到一定水平(通常为大于300 Ω·cm2)后即表明细胞单层的紧密连接性好[27]。TEER值越大,说明细胞紧密连接越强[28-31]。酚红为水溶性小分子物质,不易被肠黏膜代谢且不会通过细胞膜转运,可以间接反映单层细胞之间连接处的通透量,作为细胞单层连接紧密性的标示物。因此,本试验采用酚红作为探针评价在Transwell 6孔细胞培养板的插槽内培养的十二指肠上皮细胞间连接的紧密性,酚红透过率小于5%作为细胞单层形成的标志[30]。在本试验中细胞培养的24、48和72 h,Ⅰ组和Ⅱ组细胞的TEER值均满足大于300 Ω·cm2的试验要求,酚红透过率均满足小于5%的试验要求,并且2组细胞的TEER值在48 h均达到最高状态并持续到72 h,另外,Ⅰ组细胞的TEER值均大于Ⅱ组,细胞酚红透过率均小于Ⅱ组,说明Ⅰ组已贴壁的十二指肠上皮细胞间紧密连接性更强。由此可见,细胞TEER值、酚红透过率也可以作为评估原代培养十二指肠上皮细胞紧密连接性的指标。
LDH是机体细胞内一种稳定存在的酶,当细胞膜受到损害时,它就会通过细胞膜从细胞内漏出到细胞外,因此,细胞培养液中LDH活力的高低在一定程度上反映了细胞的损伤程度[32-34]。Qin等[18]通过测定原代培养心肌细胞培养液中的LDH活力,来作为判断热应激心肌细胞损伤的标志。所以,本试验通过测定十二指肠上皮细胞培养液中LDH活力来间接反映十二指肠上皮细胞膜的完整性及细胞活力。本试验中Ⅰ组细胞培养液中的LDH活力在细胞培养的24、48、72 h均维持在较低的水平,在细胞培养的96 h开始显著升高,而其他2组细胞培养液中的LDH活力在72 h就已经明显升高,表明Ⅰ组已贴壁的十二指肠上皮细胞在细胞培养的24、48和72 h生长状态最好、活力最佳。
4 结 论
综合以上细胞形态学、TEER值、酚红透过率、细胞培养液中的LDH活力4项指标得出,在细胞培养的48 h,2.90×106个/mL细胞密度组细胞生长状态良好,细胞之间界限清晰、紧密连接性强,细胞活力最佳,因此,原代培养肉鸡鸡胚十二指肠上皮细胞的物质吸收模型构建成功,并且该组细胞所用的接种密度(2.90×106个/mL)可以作为后续十二指肠上皮细胞的吸收规律及其分子机制的研究试验中所用的细胞接种密度。

