人乳头瘤病毒的p53蛋白表达与外阴上皮内瘤变的相关性
薛雯娟 崔 旭 杨 宁 张亚萍 王丽娟
外阴上皮内瘤变(vulvar intraepithelial neoplasia,VIN)是一组外阴病变,具有发病率高、病死率高、普查率低等特点,是外阴癌的前期病变。流行病学调查显示全球每年约有500万的外阴上皮内瘤变新发病例,其中外阴癌占10%左右,在我国的国内发病率呈现上升的趋势[1]。不过外阴上皮内瘤变具有较长的、可逆转的癌前病变期,由外阴上皮内瘤变逐渐发展到外阴癌的过程比较长,早期诊治能取得比较好的效果[2]。人乳头瘤病毒(human papilloma virus,HPV)是一种无包膜的小DNA病毒,高危型HPV(HR-HPV)感染与外阴上皮内瘤变紧密相关[3]。有报道显示HPV的持续感染与外阴上皮内瘤变相关,故将HPV感染作为筛查外阴上皮内瘤变的一种手段[4]。近年来,随着分子遗传学的研究与不断发展,现代研究已表明外阴上皮内瘤变的发生与发展癌基因的异常激活和编码蛋白的过度表达以及抑癌基因的缺失、突变失活有明显相关性[5]。p53基因是一种分子量为53 kDa的蛋白质,也为人体抑癌基因,p53基因的失活对宫颈癌形成起重要作用[6]。本文具体探讨了人乳头瘤病毒的p53蛋白表达与外阴上皮内瘤变的关系,报告如下。
1 资料与方法
1.1 一般资料
选择2014年2月至2017年2月96例在我院进行宫颈分泌物HPV感染筛查的患者。纳入标准:临床表现不规则阴道流血、白带增多;患者知情同意本研究;有性生活经验史;年龄18~80岁;研究得到医院伦理委员会的批准。排除标准:既往有其他肿瘤病史及具有肿瘤家族史者;病例资料不全或缺失者;精神疾病患者。96例患者年龄在19~79岁之间,平均年龄是(41.11±8.56)岁;平均体重指数是(23.11±1.48)kg/m2;平均初潮年龄为(15.92±2.52)岁;平均怀孕次数为(2.61±0.44)次;平均分娩次数为(1.62±0.33)次。
1.2 HPV检测
所有患者都给予HPV基因分型检测,包括15种高危型:HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV59、HPV68、HPV73、HPV82;3种疑似高危型:HPV26、HPV53、HPV66;10种低危型:HPV、HPV83、HPV81、HPV61、HPV54、HPV44、HPV43、HPV42、HPV40、HPV11、HPV6。标本采集前3天停止使用任何妇科外用药物,患者取截石位,使用窥阴器暴露宫颈,将HPV采集器放入宫颈内部,旋转3周后停止,停留10 s左右后将采集器取出,放入盛有细胞保存液的瓶内,盖好瓶盖,填写患者资料并编号,并将其送往检验科集中检测。检测使用PCR反向点杂交法,通过膜条上的特异性探针与PCR产物的杂交,洗膜,特异性探针与靶标中的特异性片段结合,最后显色分析,从而得知HPV感染阳性基因分型。
1.3 p53蛋白表达检测
所有患者的外阴病变处取小块活检组织标本,通过脱水、切片、浸蜡、透明、包埋、切片,制作成防脱胶片。再通过恒温箱过夜后脱蜡,再进行组化染色,封片,镜检判读。
1.4 统计方法
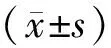
2 结果
2.1 外阴上皮内瘤变分级情况
在96例患者中,外阴上皮内瘤变Ⅰ级72例,表现为上皮过度增生和异型细胞的改变,局限于上皮的下1/3;外阴上皮内瘤变Ⅱ级16例,表现为上皮层上述变化发生于上皮的下2/3;外阴上皮瘤变Ⅲ级8例,表现为上皮层的变化超过2/3,不典型增生累及整个上皮层,但未穿透基膜。
2.2 高危型HPV阳性情况对比
外阴上皮内瘤变Ⅰ级、Ⅱ级与Ⅲ级患者的高危型HPV阳性率分别为37.5%(27/72)、75.0 %(12/16)和87.5 %(7/8),对比差异有统计学意义(F=8.194,P<0.05)。
2.3 p53蛋白表达情况对比
Ⅰ级、Ⅱ级与Ⅲ级患者的p53蛋白相对表达量分别为(12.76±1.12)、(6.22±0.84)、(1.33±1.21),两两对比差异明显(F=18.472,P<0.05)。
2.4 相关性分析
直线相关分析显示观察组高危型HPV阳性率与p53蛋白相对表达量呈现明显负相关性(γ=-0.544,P<0.05)。多因素非条件logistic回归分析显示高危型HPV阳性、p53蛋白相对表达量都为导致外阴上皮瘤变的主要独立危险因素(P<0.05)。见表1。

表1 导致外阴上皮瘤变的主要独立危险因素(n=296)
3 讨论
外阴上皮内瘤变是临床上比较常见的妇科肿瘤,一旦发病,对患者的身心都会造成严重的损害。HPV病毒只针对人类进行侵犯,对其它动物并没有致病性,人体可通过正规系统的治疗将该病毒清除掉[7]。大部分HPV感染表现为一过性,大部分感染该病毒的女性并没有明显的临床症状,只有少数发展为HPV持续感染,进一步发展为外阴癌。一般情况下,外阴上皮内瘤变病变级别上升,HPV感染率也会随之增加[8]。但也存在低危型HPV病毒,不会引起外阴上皮内瘤变,但可引起人体其他良性肿瘤或疣,需进行临床确诊才可判别[9]。本研究显示在96例患者中,外阴上皮内瘤变Ⅰ级72例,外阴上皮内瘤变Ⅱ级16例,外阴上皮瘤变Ⅲ级8例。
外阴上皮内瘤变具有明确的致病因素和较长的可逆转的癌前病变期,高危型HPV病毒的持续感染将会导致外阴上皮内瘤变的发生,95%以上的外阴上皮内瘤变由高危型HPV感染引起。HPV病毒为双链DNA病毒,绝大多数的HPV感染可在2年内感染消退,不会发展为外阴癌[10]。本研究显示外阴上皮内瘤变Ⅰ级、Ⅱ级与Ⅲ级患者的高危型HPV阳性率分别为37.5%、75.0%和87.5%,对比差异有统计学意义(P<0.05)。在一定程度上说明高危型HPV阳性可促进外阴上皮内瘤变的发生和发展,二者存在一定的关系。
癌基因激活和抑癌基因失活均可导致正常组织发生癌变,通过单个抑癌基因或癌基因的检测分析等有助于分析肿瘤的发生与发展[11]。p53是比较常见的抑癌基因,在各种肿瘤中被广泛检测,通过检测p53抑癌基因可以有效地检测出遗传性癌症相关的致病突变,从而预知特定恶性肿瘤发生的风险。本研究显示Ⅰ级、Ⅱ级与Ⅲ级患者的p53蛋白相对表达量分别为(12.76±1.12)、(6.22±0.84)、(1.33±1.21),两两对比差异明显(P<0.05),表明随着外阴上皮内瘤变的恶化,p53蛋白相对表达量越来越降低。有研究表明p53能够促进细胞凋亡,促进染色体稳定,抑制上皮细胞永生化的恶性发展[12]。分子生物学研究表明HPV E6通过E6相关蛋白与p53结合,促进泛素介导的p53降解,引起细胞过度增殖[13]。
本研究直线相关分析显示观察组的高危型HPV阳性率与p53蛋白相对表达量呈现明显负相关性(γ=-0.544,P<0.05)。多因素非条件logistic回归分析显示高危型HPV阳性、p53蛋白相对表达量都为导致外阴上皮瘤变的主要独立危险因素(P<0.05)。外阴上皮内瘤变的程度与HPV DNA含量成正相关性,随外阴上皮内瘤变病情的加重,高危型HPV感染率随之升高。p53蛋白缺失可使黏附复合体中β-actin释放至胞质,激活核内Wnt通路,诱导上皮细胞-间质转化,诱发上皮性癌发生转移复发。
总之,外阴上皮内瘤变患者伴随有高危型HPV阳性率增加与p53蛋白表达下降,高危型HPV阳性率与p53蛋白相对表达有明显相关性。

